A型主动脉夹层病死率极高,约50 %的确诊患者在发病48 h内死亡,多数A型主动脉夹层患者需要在术中行体外循环(cardiopulmonary bypass,CPB)。深低温停循环技术(deep hypothermia circulatory arrest, DHCA),对患者器官会产生短期和长期影响,动物DHCA模型建立使针对DHCA的研究成为可能[1]。
动物DHCA模型通常被用于研究围DHCA阶段的治疗手段与DHCA过程中的分子机制[1]。近年来,建立大鼠DHCA模型正受到越来越多研究者的关注[2-8]。因为狗、羊、猪等大动物DHCA模型存在价格高昂,缺乏神经行为学评价方法等缺点[2, 7, 9],而大鼠因取材便利,与人类相似的心血管系统解剖,使其成为了重要的备选动物。由于大鼠体型小,微型化CPB就成为建立DHCA大鼠模型的关键。但是当前大鼠DHCA模型存活率不明确,且DHCA时间各异[3, 5]。通过相关资料的整合以及结合自己的临床经验,笔者建立了一个具有高存活率的周围CPB大鼠40 min DHCA模型。现就该模型建立的难点和一些经验展开讨论。
1 材料与方法 1.1 实验动物与分组选取20只体质量350~450 g的Sprague-Dawley大鼠,通过随机数字表将其随机分为实验组(n=10)和对照组(n=10)。本动物实验由浙江大学医学院附属第二医院动物实验中心批准, 符合实验动物伦理。
1.2 术前准备 1.2.1 麻醉准备大鼠固定后,用16 G导管进行气管插管,连接小动物呼吸机(美国Harvard Apparatus公司)及麻醉挥发罐(美国Datex Ohmeda公司),机械通气气体为99%氧气、1%二氧化碳及3%的异氟烷。呼吸频率维持在60~70次/min,呼吸容量控制在及8~10 ml·kg-1 ·min-1,实验过程中根据血气分析结果调整相关参数。
1.2.2 温度管理将脑温监测探针置入大鼠右侧颞肌来监测实验过程中大鼠脑温。实验过程中采用变温毯(德国Stockert公司)、热交换器(西安,西京医疗器械有限公司)实现变温过程。
1.2.3 外科准备消毒术野,解剖分离暴露出尾动脉、右颈静脉及左股浅动脉分别作为CPB灌注、引流、监测血管。大鼠尾动脉用20 G(美国Becton Dickinson公司)穿刺针置管。右颈静脉经多孔的静脉导管(改制于22 G静脉输血器,外径大约2 mm,内经大约1.6 mm,长约50 cm)置入大鼠右心房引流。左侧股浅动脉由24 G穿刺针(美国Becton Dickinson公司)置管,大鼠实验过程中生命体征由多导生理监护仪(美国NOVA Biomedical公司)监测。
1.3 CPB与手术过程 1.3.1 CPB回路本研究CPB回路如图 1所示,由储血池(5 mL针筒,上海碧迪医疗有限公司),单头滚压泵(德国Stockert公司),特制动物膜肺(深圳,科威医疗器械有限公司)(预充量 < 4 mL),热交换器(预充量 < 3 mL),CPB管道(外径4 mm,内径3 mm)和变温水箱组成,该回路用羟乙基淀粉(万汶,130/04,北京费森尤斯卡比医药有限公司)和125单位肝素(肝素钠,常州千红生化制药有限公司)预充,垂直重力引流35 cm。同时采用变温毯(美国ATC1000公司)置于大鼠操作板上以保持大鼠体温。
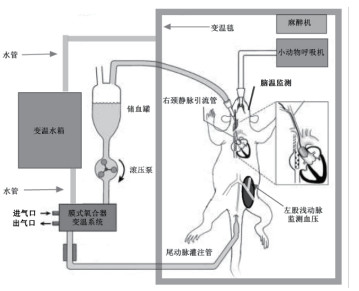
|
| 脑温监测由探针置入大鼠右侧颞肌进行 图 1 体外循环回路 Fig 1 Cardiopulmonary bypass circuit |
|
|
大鼠CPB开始前推注0.5 ml(250 U/ml)肝素使大鼠全身肝素化。实验组CPB开始后,流量维持在100~120 ml·min-1·kg-1,降温30 min后,脑温降至18℃,停循环,引发心脏停搏(可由生理监测仪看到心率为零证实)。确保整个停搏过程中大鼠脑温维持在18~20℃。DHCA过程中停止机械通气,DHCA结束后恢复机械通气。DHCA 40 min后,逐渐恢复流量100~120 mL·min-1·kg-1,保证复温时间大于40 min,复温至34℃时,停止体外循环,见图 2。
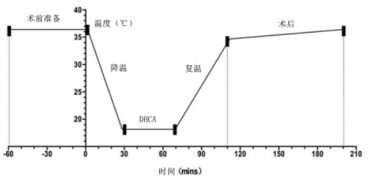
|
| DHCA:深低温停循环。大鼠术前体温维持在37℃,体外循环开始后降温,30 min后降温至18℃,DHCA 40 min,其后复温40 min至34℃停止体外循环。其后90 min持续通过水毯复温至37℃ 图 2 体温变化曲线 Fig 2 Temperature curve |
|
|
实验组非DHCA阶段,维持大鼠血压大于50 mmHg,不使用血管活性药物,通过输注机血升压,在CPB停止后用2%异氟烷维持麻醉1.5 h,期间用变温毯保温、对照组只进行插管不进行DHCA,常规监测其生命体征。通过减少异氟烷的浓度,使两组大鼠的自主呼吸功能恢复,当大鼠自主呼吸功能稳定后拔除气管插管,将大鼠放置于富氧环境中复苏1 h,之后将大鼠放置于大鼠笼子里,自由进食和饮水。
1.3.3 标本处理术后通过随机数字法在两组各随机选取了5只大鼠行后续评估,其余大鼠均处死。
1.4 数据采集与统计学方法整个实验过程记录5个点的血流动力学与血气分析(血气分析仪,美国NOVA Biomedical公司)参数。实验组分别是CPB前(T1),降温15 min(T2),复温10 min(T3),复温40 min(T4),停机后30 min(T5)。对照组按照实验组时间点进行记录(表 1)。所有实验数据采用SPSS 19.0(SPSS Inc., Chicago, IL, USA)统计和分析,对术中各时间点血气分析的组间差异采用Mann-Whitney U检验,以P < 0.05为差异有统计学意义。
2 结果 2.1 大鼠术后存活率实验组中1只大鼠DHCA术后死亡,原因是复温过程中血压无法维持,其余9只均术后存活。对照组10只大鼠均术后存活。术后通过随机数字法在两组各选取了5只大鼠行后续评估,两组共10只大鼠均存活至术后14 d。
2.2 血流动力学及血气结果两组大鼠血流动力学及血气比较见表 1。从数据中可以看出,CPB开始后,实验组红细胞压积(Hct)快速下降到22%左右,显著低于对照组(P<0.05),但符合CPB血液稀释要求(Hct>20%)。术中两组大鼠生命体征总体平稳。实验组在复温10 min(T3)时,乳酸水平显著增高(P<0.05)。符合临床经验。
| 指标 | T1 | T2 | T3 | T4 | T5 |
| 体质量(g) | |||||
| 对照组 | 401.67±19.02 | ||||
| DHCA组 | 406.89±20.77 | ||||
| 平均动脉压(mmHg) | |||||
| 对照组 | 96.34±11.27 | 95.20±11.02 | 96.20±10.36 | 97.02±11.25 | 96.58±11.20 |
| DHCA组 | 96.34±11.27 | 82.47±18.02 | 47.96±18.51 | 75.02±15.64 | 75.81±8, 96 |
| 心率(次/min) | |||||
| 对照组 | 346.27±11.74 | 336.67±15.20 | 317.86±17.56 | 351.29±18.34 | 355.32±12.23 |
| DHCA组 | 346.27±11.74 | 161.10±24.38 | 125.26±23.82 | 343.15±23.70 | 333.27±17.61 |
| pH | |||||
| 对照组 | 7.43±0.60 | 7.44±0.60 | 7.44±0.60 | 7.44±0.61 | 7.44±0.62 |
| DHCA组 | 7.37±0.36 | 7.38±0.62 | 7.39±0.88 | 7.45±0.10 | 7.39±0.84 |
| 乳酸(mmol/L) | |||||
| 对照组 | 1.98±0.65 | 1.97±0.50 | 1.93±0.59 | 1.90±0.30 | 1.98±0.42 |
| DHCA组 | 1.61±0.43 | 1.88±0.45 | 7.84±1.38 | 4.69±2.50 | 3.08±1.16 |
| Hct(%) | |||||
| 对照组 | 42.50±1.87 | 41.00±1.67 | 40.17±1.94 | 40.17±2.32 | 38.5±1.50 |
| DHCA组 | 42.00±4.07 | 22.33±2.24 | 21.50±1.97 | 21.11±2.10 | 22.88±2.07 |
| 注:Hct:红细胞比容 | |||||
当前,有研究表明DHCA术中器官损伤与保护的分子机制可能和信号通路、microRNAs等相关[1, 10-13]。而这些研究成果都基于DHCA术后动物模型的长期存活。但是当前文献报道的DHCA大鼠模型仍具有诸多争议。首先,DHCA大鼠的存活率不明确,这是否说明这些大鼠DHCA模型可操作性值得怀疑。其次,DHCA大鼠模型的停循环时间没有一致性。DHCA时间从15 min到105 min[3, 7]均有。研究表明,DHCA时间与大鼠存活率相关[3],因此研究者须在找到最佳DHCA时间以保证大鼠存活率。
3.1 本研究DHCA大鼠模型成功建立的要素在开展大鼠DHCA模型建立之初,尝试了多种CPB下的DHCA模型,最后通过比较长期存活率指标,发现了一些明显影响长期生存率的因素,这些因素主要包括以下5点:①CPB的方式;②CPB流量;③DHCA时间;④转流中Hct的水平;⑤温度管理和停循环后的生命支持。现讨论如下。
3.1.1 周围CPB方法在预实验阶段发现开胸建立CPB下的DHCA模型,病死率极高。因其胸腔结构的破坏以及心脏和大血管的某些损伤使大鼠很难在术后康复。因此,选择创伤最小的周围CPB就能大幅提高大鼠术后的长期存活率。但是采用周围CPB的难点在于,静脉置管很难保证一次就插到右心房。这时如果采用闭式CPB就容易出现负压过大,心脏吸瘪,心脏停搏,转流失败;或者插管不到位,引流不好,流量不能保证,同样实验失败。为此,本研究采用开放式CPB,静脉垂直重力引流达35 cm。转流开始后,再不断调整静脉插管的深度,以期达到达到充分的血液引流。
3.1.2 CPB的插管与流量大鼠的心输出量在170 ~180 mL·min-1·kg-1,有学者采用颈外静脉联合股静脉插管引流,股动脉灌注的方法进行CPB以达到大鼠心排量水平的流量,但该插管方式可能会引起大鼠下肢缺血,导致大鼠术后下肢活动障碍、甚至坏死,不利于术后大鼠的康复。由于尾动脉血供丰富,术后对尾部活动影响小,我们采用经右侧颈静脉插管进入右心房引流静脉血,尾动脉灌注的方式进行插管,可使流量维持在100~120 mL·min-1·kg-1,约为心排量的70%。该流量在既往研究中被证实已足够[7],且本实验结果表明,此流量能够保证大鼠降温与复温的需求。我们在监测血流动力学方面采用左侧股浅动脉监测大鼠血压,这种监测方式较一些文献报道的,采用右侧腹壁浅动脉插管监测血流动力学[6],提高了插管的成功率,且不影响大鼠左大腿的功能。
3.1.3 DHCA的时间选择Jungwirth等[3]研究表明,大鼠深低温停循环时间大于75 min时,会出现外周器官损伤和严重的脑损害,因此,为保证大鼠仅出现中枢神性系统损害并保证较高的存活率,该研究认为,理想的DHCA时间应在60 min或更短,这样不仅能够使器官组织得到足够的损伤,且对长期的存活率影响不大。杜克大学的研究团队将60 min定为大鼠的DHCA时间[3, 14]。曾庆东等[15]建立了30 min DHCA大鼠模型,其生存率较高,但30 min较其他研究大鼠的DHCA时间短。当DHCA超过40 min时,大鼠的长期存活率会显著下降,虽然努力改善转流方式与围术期的生命支持,但很难达到DHCA 60 min仍保持较高长期生存率。因此本研究选择40 min为DHCA时间。
3.1.4 转流中Hct的水平在预实验中发现,当Hct > 20%时,大鼠DHCA术后的长期存活率显著提升。为了提高实验组大鼠转中的Hct,将CPB管道的预充量减少至10~12 mL,当术中红细胞压积因出血等原因降低时,则通过术中输血,使红细胞压积大于20%,以提高大鼠术后存活率。
3.1.5 温度管理和停循环后的生命支持监测大鼠肛温,是目前基本的温度监测方式。然而若只监测肛温,并不能精确反映大鼠大脑的温度。因此,我们采用探针置入大鼠右侧颞肌来监测实验过程中大鼠脑温。这种方法比监测肛温更能精确的反映大鼠脑温,更贴近临床。
DHCA后的复温过程,易导致缺血-再灌注损伤,可能会发生急性心功能衰竭和外周血管舒张,导致一过性的血压下降,影响术后的康复,有研究表明,快速复温可引起大脑的氧耗大于氧供[16],造成DHCA大鼠显著的组织学损害与NF-κB升高[17]。因此,将复温过程保持在40 min以上,在保证大鼠均匀复温的同时,提高心脏和血管功能的稳定性,利于大鼠的术后康复。
在生命支持方面,停机后呼吸机维持时间应至少1 h[6]。本实验中采用1.5 h辅助呼吸以提高生存率。
3.2 本研究的不足在大鼠脑温降至18℃时,将其所有血液由右颈静脉引流储血池,使心脏即使跳动[7]也没有有效搏出。但不能保证大鼠心脏的绝对静止,因为没有主动脉阻断和心脏停跳过程。Günzinger等[18],Drabek等[19],和deLange等[4]曾尝试将大鼠心脏停搏,但他们的方法并不能达到心脏停搏完全,远期生存率高,可操作性强的目标。未来是否能够采取更简便有效的方法将DHCA大鼠模型进行主动脉阻断,心脏停跳,使大鼠模型更贴近临床工作是需要研究的课题。此外,如何在不降低大鼠远期生存率的同时,增加该模型DHCA时间也是未来的研究方向之一。
总之,本研究建立的40 min深低温停循环大鼠模型具有存活率高,麻醉、温度可控性强等特点,可为研究DHCA导致的器官损害研究提供一个可靠的实验平台。
| [1] | Yu L, Gu T, Liu Y, et al. Cold-inducible ribonucleic acid-binding protein attenuates acute kidney injuries after deep hypothermic circulatory arrest in rats[J]. Interact Cardiovasc Thorac Surg, 2018, 26(1): 124-130. DOI:10.1093/icvts/ivx262 |
| [2] | Jungwirth B, de Lange F. Animal models of cardiopulmonary bypass:development, applications, and impact[J]. Semin Cardiothorac Vasc Anesth, 2010, 14(2): 136-140. DOI:10.1177/1089253210370491 |
| [3] | Jungwirth B, Mackensen GB, Blobner M, et al. Neurologic outcome after cardiopulmonary bypass with deep hypothermic circulatory arrest in rats:description of a new model[J]. J Thorac Cardiovasc Surg, 2006, 131(4): 805-812. DOI:10.1016/j.jtcvs2005.11.017 |
| [4] | de Lange F, Yoshitani K, Podgoreanu MV, et al. A novel survival model of cardioplegic arrest and cardiopulmonary bypass in rats:a methodology paper[J]. J Cardiothorac Surg, 2008, 3: 51. DOI:10.1186/1749-8090-3-51 |
| [5] | Ma S, Zhu B. The cardiopulmonary bypass model in rats[J]. J Thorac Cardiovasc Surg, 2012, 144(1): 286-287. DOI:10.1016/j.jtcvs2012.03.055 |
| [6] | Shim JK, Ma Q, Zhang Z, et al. Effect of pregabalin on cerebral outcome after cardiopulmonary bypass with deep hypothermic circulatory arrest in rats[J]. J Thorac Cardiovasc Surg, 2014, 148(1): 298-303. DOI:10.1016/j.jtcvs2014.02.076 |
| [7] | Waterbury T, Clark TJ, Niles S, et al. Rat model of cardiopulmonary bypass for deep hypothermic circulatory arrest[J]. J Thorac Cardiovasc Surg, 2011, 141(6): 1549-1551. DOI:10.1016/j.jtcvs2011.01.062 |
| [8] | Yuan L, Su D, Liu X, et al. Cerebral blood flow changes during rat cardiopulmonary bypass and deep hypothermic circulatory arrest model:a preliminary study[J]. Conf Proc IEEE Eng Med Biol Soc, 2013: 1807-1810. DOI:10.1109/EMBC.2013.6609873 |
| [9] | Jonsson O, Morell A, Zemgulis V, et al. Minimal safe arterial blood flow during selective antegrade cerebral perfusion at 20 degrees centigrade[J]. Ann Thorac Surg, 2011, 91(4): 1198-1205. DOI:10.1016/j.athoracsur.2010.12.066 |
| [10] | Yu L, Gu T, Shi E, et al. Dysregulation of renal microRNA expression after deep hypothermic circulatory arrest in rats[J]. Eur J Cardiothorac Surg, 2016, 49(6): 1725-1731. DOI:10.1093/ejcts/ezv460 |
| [11] | Steinbrenner H, Bilgic E, Pinto A, et al. Selenium pretreatment for mitigation of ischemia/reperfusion injury in cardiovascular surgery:influence on acute organ damage and inflammatory response[J]. inflammation, 2016, 39(4): 1363-1376. DOI:10.1007/s10753-016-0368-5 |
| [12] | Zhang X, Xue X, Zhao J, et al. Diosgenin attenuates the brain injury induced by transient focal cerebral ischemia-reperfusion in rats[J]. Steroids, 2016, 113: 103-112. DOI:10.1016/j.steroids.2016.07.006 |
| [13] | Zahedi M, Hojjati MR, Fathpour H, et al. Effect of rheum ribes hydro-alcoholic extract on memory impairments in rat model of alzheimer' s disease[J]. Iran J Pharm Res, 2015, 14(4): 1197-1206. |
| [14] | Li P, Gu T, Wang C, et al. Neuregulin 1 attenuates neuronal apoptosis induced by deep hypothermic circulatory arrest through erbB4 signaling in rats[J]. J Cardiovasc Pharmacol, 2015, 66(6): 551-557. DOI:10.1097/FJC.0000000000000303 |
| [15] | 曾庆东, 李勇男, 周玉姣, 等. 新型无血预充大鼠深低温停循环模型的建立[J]. 中国体外循环杂志, 2016, 14: 120-124. DOI:10.13498/j.cnki.chin.j.ecc.2016.02.15 |
| [16] | Enomoto S, Hindman BJ, Dexter F, et al. Rapid rewarming causes an increase in the cerebral metabolic rate for oxygen that is temporarily unmatched by cerebral blood flow.A study during cardiopulmonary bypass in rabbits[J]. Anesthesiology, 1996, 84(6): 1392-1400. DOI:10.1097/00000542-199606000-00016 |
| [17] | Gordan ML, Kellermann K, Blobner M, et al. Fast rewarming after deep hypothermic circulatory arrest in rats impairs histologic outcome and increases NF kappa B expression in the brain[J]. Perfusion, 2010, 25(5): 349-354. DOI:10.1177/0267659110377946 |
| [18] | Günzinger R, Wildhirt SM, Schad H, et al. A rat model of cardiopulmonary bypass with cardioplegic arrest and hemodynamic assessment by conductance catheter technique[J]. Basic Res Cardiol, 2007, 102(6): 508-517. DOI:10.1007/s00395-007-0668-x |
| [19] | Drabek T, Fisk JA, Dixon CE, et al. Prolonged deep hypothermic circulatory arrest in rats can be achieved without cognitive deficits[J]. Life Sci, 2007, 81(7): 543-552. DOI:10.1016/j.lfs.2007.06.015 |
| [20] | 薛渊, 肖子亚, 顾国嵘, 等. D-二聚体对急性主动脉夹层诊断及预后判断价值[J]. 中华急诊医学杂志, 2017, 26(8): 935-938. DOI:10.3760/cma.j.issn.1671-0282.2017.08.021 |
| [21] | 宋剑平, 胡新宇, 金静芬, 等. 急性Stanford A型主动脉夹层术后短期死亡影响因素分析[J]. 中华急诊医学杂志, 2017, 26(6): 706-709. DOI:10.3760/cma.j.issn.1671-0282.2017.06.022 |
 2019, Vol. 28
2019, Vol. 28




