根据脓毒症和脓毒性休克的第三版国际共识(Sepsis-3),脓毒症定义为宿主对感染的反应失调所引起的器官功能障碍[1]。根据最新的指南以及专家共识,器官功能障碍成为诊断脓毒症不可或缺的一部分。目前临床使用多种评估体系来诊断脓毒症,而已有研究肯定了序贯器官衰竭评估(sequential organ faliure assessment,SOFA)评分在评估脓毒症器官功能障碍方面的重要性[2]。
尽管脓毒症发生发展的具体机制仍未完全阐明,越来越多的研究认为线粒体功能障碍参与了脓毒症发生发展的进程[3-4]。循环中的线粒体DNA(mitochondrial DNA, mtDNA)可作为一种损伤相关的分子模式,引起机体产生固有免疫应答,最终导致炎症反应级联扩增[5-6]。多项研究表明,脓毒症患者血浆中游离mtDNA拷贝数表达升高[7-10],但仍有研究认为脓毒症患者血浆游离mtDNA水平与器官功能障碍呈负相关,并且在脓毒症队列与健康对照队列之间差异无统计学意义[11]。造成上述争议的原因,可能与既往的脓毒症诊断标准相对宽泛,尤其未将脓毒症相关脏器损伤作为诊断的必要条件有关,而在存在严重脏器损害的情况下,细胞内线粒体的大量损耗同样可能导致血浆中游离mtDNA拷贝数的减少。
本研究基于Sepsis-3脓毒症诊断标准,探讨在明确存在器官功能障碍的情况下,血浆游离mtDNA拷贝数与脓毒症患者器官功能损伤程度的关系。
1 资料与方法 1.1 一般资料回顾性纳入2013年10月至2014年5月就诊于浙江大学医学院附属第一医院重症监护室(intensive care unit, ICU)的脓毒症患者样本库中,符合Sepsis-3诊断标准的440例作为研究队列。收集所有研究对象的年龄、性别、合并症、实验室检验数据、初始感染部位及预后。计算所有研究对象的SOFA评分。排除标准:年龄 < 18岁;近期重大手术及外伤;伴有肿瘤及严重血液病。该研究已经通过本院伦理委员会审批(审核编号:2017706),所有纳入研究的对象均获得充分告知并签署知情同意书。
1.2 试剂与仪器德国Eppendorf离心机;美国BIO-RAD CFX96TM荧光定量PCR仪;美国Thermo Scientific NANODROP 2000超微量分光光度计。实时荧光定量聚合酶链反应(PCR)试剂盒购自日本Takara公司,AxyPrep血基因组DNA小量制备试剂盒购自康宁生命科学有限公司,引物购自杭州擎科梓熙生物技术有限公司。
1.3 方法 1.3.1 标本处理及DNA提取采取所有研究对象于ICU入组时的EDTA抗凝的静脉血3 mL。收集到的标本首先通过2 000 g/min离心10 min,留取上清液。然后通过0.22 μm过滤器过滤上清液,以除去与mtDNA结合的颗粒、血小板和细胞碎片。取上清液200 μL,利用AxyPrep血基因组DNA小量制备试剂盒提取血浆中的基因组DNA。
1.3.2 血浆游离mtDNA拷贝数检测本实验血浆mtDNA拷贝数以mtDNA / nDNA来表示,线粒体NADH脱氢酶1(mitochondrial NADH dehydrogenase subunit l, MT-ND1)基因和β肌动蛋白(β-actin)基因分别用来扩增代表mtDNA和核DNA(nuclear DNA,nDNA)的基因片段,引物序列分别为:MT-ND1正向引物5’-ACACTAGCAGAGACCAACCG-3’,反向引物5’-GAAGAATAGGGCGAAGGGGC-3’;β-actin正向引物5’-TAAAGCGGCCTTGGAGTGTG-3’,反向引物5’-GAACACGGCTAAGTGTGCTG-3’。PCR扩增反应条件为20 μL反应体系,95℃预变性5 min,随后95℃变性30 s、55℃复性30 s、72℃延伸30 s,共40个循环。将标准品DNA连续稀释绘制标准曲线,计算mtDNA和nDNA的绝对定量,mtDNA拷贝数以mtDNA/nDNA来表示。
1.4 统计学方法采用SPSS 23.0统计软件分析数据,计量资料以均值±标准差(Mean±SD)或中位数(四分位数)[M(P25, P75)]表示,组间比较采用独立样本t检验;计数资料采用百分数表示,组间比较采用χ2检验。利用多因素Logistic回归分析自变量与因变量之间的关系,SOFA评分预测住院患者28 d死亡采用受试者工作者特征(receiver operating characteristic, ROC)曲线。以P < 0.05为差异有统计学意义。
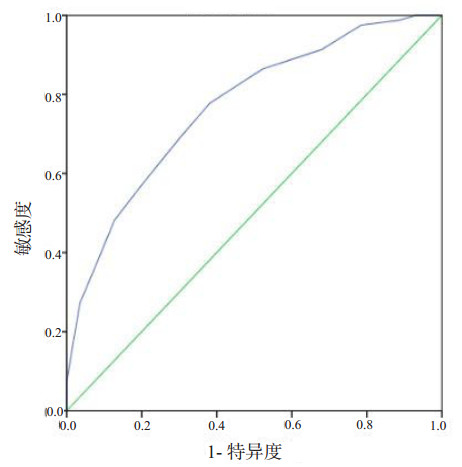
2 结果 2.1 研究对象的分组利用ROC曲线分析本研究队列SOFA评分与28 d预后之间的关系,并选取截断点作为该队列分组的依据。ROC曲线下面积为0.77,计算截断点为5.5分(图 1)。根据截断点取值,将研究队列分为两组,高SOFA评分组(SOFA评分≥5.5分)和低SOFA评分组(SOFA评分 < 5.5分)。
|
| 曲线下面积为0.77,截断点为5.5分 图 1 SOFA评分预测住院死亡的ROC曲线 |
|
|
两组研究对象的年龄、性别、入住ICU天数、住院天数、C反应蛋白均差异无统计学意义(P > 0.05)。两组在合并高血压、糖尿病、慢性肾脏病的比例、白细胞计数、血红蛋白、血小板计数、谷丙转氨酶、谷草转氨酶、总胆红素、肌酐、尿素氮、乳酸水平均存在差异,差异有统计学意义(P < 0.05),见表 1。
| 指标 | 高SOFA评分组(n=240) | 低SOFA评分组(n=200) | P值 |
| 年龄(岁) | 58.98±15.92 | 60.99±16.73 | 0.197 |
| 男性(例,%) | 158(65.83) | 118(59.00) | 0.141 |
| 合并症(例,%) | |||
| 高血压 | 66(27.50) | 80(40.00) | 0.005 |
| 糖尿病 | 24(10.00) | 38(19.00) | 0.007 |
| 心脏病 | 40(16.67) | 34(17.00) | 0.926 |
| 慢性肾脏病 | 16(6.67) | 2(1.00) | 0.003 |
| 初始感染部位(例,%) | |||
| 肺部 | 182(75.83) | 124(62.00) | 0.002 |
| 腹腔 | 30(12.50) | 32(16.00) | 0.299 |
| 泌尿系统 | 12(5.00) | 6(3.00) | 0.299 |
| 其他 | 30(12.50) | 32(16.00) | 0.282 |
| 实验室检验结果 | |||
| 白细胞计数(×109/L) | 15.31±10.86 | 12.95±5.80 | 0.006 |
| 血红蛋白(g/L) | 104.78±27.19 | 113.31±23.99 | 0.001 |
| 血小板计数(×109/L) | 160.46±107.33 | 226.81±83.48 | < 0.01 |
| 乳酸(mmol/L) | 3.00±2.50 | 1.82±1.48 | < 0.01 |
| 谷丙转氨酶(U/L) | 31.00 (14.00, 88.75) | 23.00 (12.00, 46.00) | < 0.01 |
| 谷草转氨酶(U/L) | 49.00 (28.25, 104.00) | 29.00 (19.00, 57.00) | < 0.01 |
| 总胆红素(μmol/L) | 21.00 (13.00, 41.25) | 13.00 (9.00, 20.00) | < 0.01 |
| C反应蛋白(mg/L) | 50.65 (15.10, 112.83) | 59.30 (19.90, 130.10) | 0.110 |
| 肌酐(μmol/L) | 82.00 (59.00, 161.25) | 67.00 (54.00, 94.00) | < 0.01 |
| 尿素氮(mmol/L) | 9.35 (6.18, 15.43) | 6.10 (4.60, 9.20) | < 0.01 |
| 入住ICU时间(d) | 9.66±11.17 | 8.60±10.30 | 0.305 |
| 住院时间(d) | 21.82±17.60 | 21.60±15.47 | 0.892 |
| 28 d病死率(%) | 45.00 | 16.00 | < 0.01 |
| 血浆游离mtDNA拷贝数 | 185.65 (75.67, 514.75) | 632.09 (220.11, 1 303.53) | < 0.01 |
| 注:SOFA评分以5.5分为分界,将评分≥5.5分定义为高SOFA评分组,评分 < 5.5分定义为低SOFA评分组 | |||
经正态性检验,数据呈非正态分布,采用中位数(四分位数)进行统计描述。结果显示,高SOFA评分组患者血浆游离mtDNA拷贝数显著低于低SOFA评分组[185.65(75.67,514.75) vs 632.09(220.11,1 303.53)],差异有统计学意义(P < 0.01)。
2.4 高拷贝数与低拷贝数组临床资料的比较以研究队列总的血浆mtDNA拷贝数的中位数作为分界值,拷贝数≥368.51定义为高拷贝数组,拷贝数 < 368.51定义为低拷贝数组。两组一般资料比较结果显示,两组研究对象的年龄、性别、入住ICU天数、住院天数、28 d病死率均差异无统计学意义(P > 0.05)。高拷贝数组患者合并高血压比例、血红蛋白、血小板计数均高于低拷贝数组,而其SOFA评分、乳酸水平均低于低拷贝数组,差异均有统计学意义(P < 0.05)。见表 2。
| 指标 | 高拷贝数组(n=220) | 低拷贝数组(n=220) | P值 |
| 年龄(岁) | 59.50±16.35 | 60.28±16.29 | 0.616 |
| 男性(例,%) | 84(38.18) | 136(61.82) | 0.693 |
| 合并症(例,%) | |||
| 高血压 | 92(41.82) | 54(24.55) | < 0.01 |
| 糖尿病 | 36(16.36) | 26(11.82) | 0.171 |
| 心脏病 | 34(15.45) | 40(18.18) | 0.444 |
| 慢性肾脏病 | 6(2.73) | 12(5.45) | 0.149 |
| 实验室检验结果 | |||
| 白细胞计数(×109/L) | 13.62±6.48 | 14.85±10.92 | 0.154 |
| 血红蛋白(g/L) | 112.41±24.11 | 104.90±27.49 | 0.002 |
| 血小板计数(×109/L) | 210.88±112.45 | 172.40±90.83 | < 0.01 |
| 乳酸(mmol/L) | 2.02±1.92 | 2.90±2.33 | < 0.01 |
| 谷丙转氨酶(U/L) | 25.00 (13.00, 49.00) | 25.50 (12.25, 72.50) | 0.407 |
| 谷草转氨酶(U/L) | 37.00 (20.00, 63.00) | 40.50 (22.00, 102.75) | 0.618 |
| 总胆红素(μmol/L) | 16.00 (10.00, 24.75) | 16.00 (11.00, 30.75) | 0.147 |
| C反应蛋白(mg/L) | 48.65 (15.83, 121.48) | 50.65 (15.83, 122.38) | 0.952 |
| 肌酐(μmol/L) | 70.00 (54.00, 105.75) | 77.00 (57.00, 118.00) | 0.991 |
| 尿素氮(mmol/L) | 7.25 (4.83, 11.38) | 7.75 (5.40, 11.98) | 0.965 |
| 入住ICU时间(d) | 8.99±10.39 | 9.36±11.13 | 0.717 |
| 住院时间(d) | 20.62±16.03 | 22.82±17.14 | 0.165 |
| SOFA评分 | 6.69±3.32 | 7.57±3.52 | 0.019 |
| 28 d病死率(%) | 28.18 | 35.45 | 0.101 |
| 注:mtDNA拷贝数以中位数368.51为分界,拷贝数≥368.51定义为高拷贝数组,拷贝数 < 368.51定义为低拷贝数组 | |||
选取单因素分析中P < 0.2的变量作为自变量,SOFA评分作为因变量,采用多因素Logistic回归分析,结果显示,低血浆游离mtDNA拷贝数是SOFA评分增高的独立预测因子(OR=4.16, 95%CI:2.73~6.35,P < 0.01)。另外,肺部感染也是SOFA评分的独立预测因子(OR=1.83, 95%CI:1.16~2.88,P < 0.05),见表 3。
| 因素 | B值 | S.E.值 | Wald值 | OR值(95%CI) | P值 |
| 年龄 | 0.153 | 0.228 | 0.448 | 1.17 (0.75~1.82) | 0.503 |
| 男性 | 0.296 | 0.223 | 1.754 | 1.34 (0.87~2.08) | 0.185 |
| 高血压 | -0.338 | 0.247 | 1.864 | 1.40 (0.86~2.28) | 0.172 |
| 糖尿病 | 0.623 | 0.332 | 3.535 | 1.87 (0.97~3.57) | 0.060 |
| 慢性肾脏病 | -2.121 | 0.814 | 6.782 | 8.33 (1.69~41.67) | 0.009 |
| 肺部感染 | -0.601 | 0.233 | 6.640 | 1.83 (1.16~2.88) | 0.010 |
| 血浆游离mtDNA拷贝数 | 1.426 | 0.216 | 43.654 | 4.16 (2.73~6.35) | < 0.01 |
脓毒症是临床常见且难治的危重症之一[12],多项研究表明线粒体在感染相关疾病的发生发展中起到了重要作用[13-14]。尽管线粒体参与脓毒症发生的具体机制尚不完全明确,但已有研究证实线粒体对疾病的影响在有或无器官功能障碍的临床情况之间存在很大差异[15]。因此本研究基于Sepsis-3诊断标准,选择存在明确器官功能障碍的脓毒症患者作为研究对象,结果显示,高SOFA评分组患者血浆游离mtDNA拷贝数显著低于低SOFA评分组。
近年来有研究发现,脓毒症患者血浆游离mtDNA拷贝数明显高于健康对照组。其中,Yamanouchi等[9]研究发现严重脓毒症患者血浆游离mtDNA拷贝数与预后并无明显相关性,但其研究队列纳入例数较少,且仅有3例患者发生死亡。另有研究发现血浆mtDNA水平升高与ICU重症患者的病死率相关,但该队列包括一定数目的创伤患者,而这些患者可能影响外周血的mtDNA水平[8, 16]。更为重要的是在既往研究中,由于采用的脓毒症诊断标准没有将器官损害作为必要诊断条件,因此纳入研究的脓毒症患者,其病程及疾病的严重程度存在比较大的异质性,而从病理生理机制上看,线粒体在有无合并器官损害的情况下,其生物学功能存在很大差异[15]。因此本研究采用Sepsis-3作为入组诊断标准,在一定程度上减少了入组队列的上述异质性。
研究表明,线粒体消耗参与了脓毒症相关器官损伤的发生过程,脓毒症发生时,可激活与线粒体相关的一系列病理途径,包括低灌注、氧化应激和炎症反应[15],而这些途径可导致线粒体氧化呼吸链产生大量的活性氧自由基,同时可降低线粒体抗氧化能力,进而破坏线粒体的完整性[17-18]。因此,随着疾病进展,在存在器官功能损害的情况下,细胞内线粒体减少逐渐成为线粒体参与病理进程的主要形式。本研究中定义的血浆游离mtDNA拷贝数,是经过核DNA拷贝数校正的相对值,因此在更大程度上反映的是细胞破坏裂解前细胞内mtDNA拷贝数的含量。本研究结果提示当脓毒症脏器功能损害发生时,细胞内mtDNA拷贝数下降,线粒体消耗的程度与脏器损害的程度呈正相关关系。
本研究选取ICU脓毒症患者作为研究对象,通过收集其一般资料,计算SOFA评分,测定经过核DNA校正的血浆游离mtDNA拷贝数,根据SOFA评分预测该队列病死率的截断点作为分组依据,结果显示,在脓毒症高SOFA评分组,其血浆mtDNA拷贝数明显下降。因此,本研究提示,mtDNA拷贝数的下降实际上反映了机体细胞内功能线粒体数目的减少,进而加重了脓毒症患者能量代谢障碍,最终引起器官功能障碍的进展。因本研究属于关联性研究,提示mtDNA拷贝数作为脓毒症预后或脏器损伤严重程度生物标志物的可能性,而探索mtDNA或者线粒体参与脓毒症器官功能障碍的详细机制还需纵向机制研究及相应动物实验。本研究队列的总体病死率较低,在预后更差的研究队列中结果可能会有所不同,有待扩大病例数做更深入的分层研究。
综上所述,本研究发现高SOFA评分的脓毒症患者血浆游离mtDNA拷贝数较低,提示在存在明确脏器功能损害时,循环中mtDNA可能并不是通过其促炎作用参与脓毒症发生发展的病理过程,而在更大程度上反映了细胞内线粒体的病理性损耗。
| [1] | Singer M, Deutschman CS, Seymour CW, et al. The Third International Consensus Definitions for Sepsis and Septic Shock (Sepsis-3)[J]. JAMA, 2016, 315(8): 801-810. DOI:10.1001/jama.2016.0287 |
| [2] | Seymour CW, Liu VX, Iwashyna TJ, et al. Assessment of Clinical Criteria for Sepsis:For the Third International Consensus Definitions for Sepsis and Septic Shock (Sepsis-3)[J]. JAMA, 2016, 315(8): 762-774. DOI:10.1001/jama.2016.0288 |
| [3] | Singer M. Mitochondrial function in sepsis:acute phase versus multiple organ failure[J]. Crit Care Med, 2007, 35: S441-448. DOI:10.1097/01.ccm.0000278049.48333.78 |
| [4] | Fink MP. Bench-to-bedside review:Cytopathic hypoxia[J]. Crit Care, 2002, 6(6): 491-499. DOI:10.1186/cc1824 |
| [5] | Zhang Q, Raoof M, Chen Y, et al. Circulating mitochondrial DAMPs cause inflammatory responses to injury[J]. Nature, 2010, 464(7285): 104-107. DOI:10.1038/nature08780 |
| [6] | Boyapati RK, Rossi AG, Satsangi J, et al. Gut mucosal DAMPs in IBD:from mechanisms to therapeutic implications[J]. Mucosal Immunol, 2016, 9(3): 567-582. DOI:10.1038/mi.2016.14 |
| [7] | Kung CT, Hsiao SY, Tsai TC, et al. Plasma nuclear and mitochondrial DNA levels as predictors of outcome in severe sepsis patients in the emergency room[J]. J Transl Med, 2012, 10: 130. DOI:10.1186/1479-5876-10-130 |
| [8] | Nakahira K, Kyung SY, Rogers AJ, et al. Circulating mitochondrial DNA in patients in the ICU as a marker of mortality:derivation and validation[J]. PLoS Med, 2013, 10(12): e1001577. DOI:10.1371/journal.pmed.1001577 |
| [9] | Yamanouchi S, Kudo D, Yamada M, et al. Plasma mitochondrial DNA levels in patients with trauma and severe sepsis:time course and the association with clinical status[J]. J Crit Care, 2013, 28(6): 1027-1031. DOI:10.1016/j.jcrc.2013.05.006 |
| [10] | Timmermans K, Kox M, Scheffer GJ, et al. Plasma nuclear and mitochondrial dna levels, and markers of inflammation, shock, and organ damage in patients with septic shock[J]. Shock, 2016, 45(6): 607-612. DOI:10.1097/shk.0000000000000549 |
| [11] | Puskarich MA, Shapiro NI, Trzeciak S, et al. Plasma levels of mitochondrial DNA in patients presenting to the emergency department with sepsis[J]. Shock, 2012, 38(4): 337-340. DOI:10.1097/SHK.0b013e318266a169 |
| [12] | Chen K, Zhou QX, Shan HW, et al. Prognostic value of CD4(+)CD25(+) Tregs as a valuable biomarker for patients with sepsis in ICU[J]. World J Emerg Med, 2015, 6(1): 40-43. DOI:10.5847/wjem.j.1920-8642.2015.01.007 |
| [13] | Karlsson M, Hara N, Morata S, et al. Diverse and tissue-specific mitochondrial respiratory response in a mouse model of sepsis-induced multiple organ failure[J]. Shock, 2016, 45(4): 404-410. DOI:10.1097/shk.0000000000000525 |
| [14] | Hinkelbein J, Bohm L, Braunecker S, et al. Decreased tissue COX5B expression and mitochondrial dysfunction during sepsis-induced kidney injury in rats[J]. Oxid Med Cell Longev, 2017, 2017: 8498510. DOI:10.1155/2017/8498510 |
| [15] | Hu Q, Ren J, Ren H, et al. Urinary mitochondrial DNA identifies renal dysfunction and mitochondrial damage in sepsis-induced acute kidney injury[J]. Oxid Med Cell Longev, 2018, 2018: 8074936. DOI:10.1155/2018/8074936 |
| [16] | Lam NY, Rainer TH, Chiu RW, et al. Plasma mitochondrial DNA concentrations after trauma[J]. Clin Chem, 2004, 50(1): 213-216. DOI:10.1373/clinchem.2003.025783 |
| [17] | Kolls JK. Oxidative stress in sepsis:a redox redux[J]. J Clin Invest, 2006, 116(4): 860-863. DOI:10.1172/jci28111 |
| [18] | Shadel GS, Horvath TL. Mitochondrial ROS signaling in organismal homeostasis[J]. Cell, 2015, 163(3): 560-569. DOI:10.1016/j.cell.2015.10.001 |
 2019, Vol. 28
2019, Vol. 28




