神经重症患者的机体功能状态受创,呈现明显异常的状态,往往出现较多的并发症,比如感染、应激性溃疡、凝血功能异常等,其中许多患者无法开放饮食,只能依靠肠外营养(parenteral nutrition, PN)和肠内营养(enteral nutrition, EN)提供支持,因此神经重症患者的营养支持一直是神经外科临床工作重点。营养支持作为对重症患者生存状态影响较大的方面,在神经重症患者中具有极高的应用率,而肠内营养支持与肠外营养支持的应用价值比较也是研究争议极大的方面。有研究认为,肠外营养支持更适用于神经重症患者,可较大程度地降低肠内营养导致的胃肠道负担,因此在患者术后的康复促进方面意义较大[1]; 但是肠内营养支持则对患者的机体生理功能刺激与维持有较好作用,在促进消化液分泌方面作用较好,对于各项生理功能改善与增强体质具有更高的临床价值。
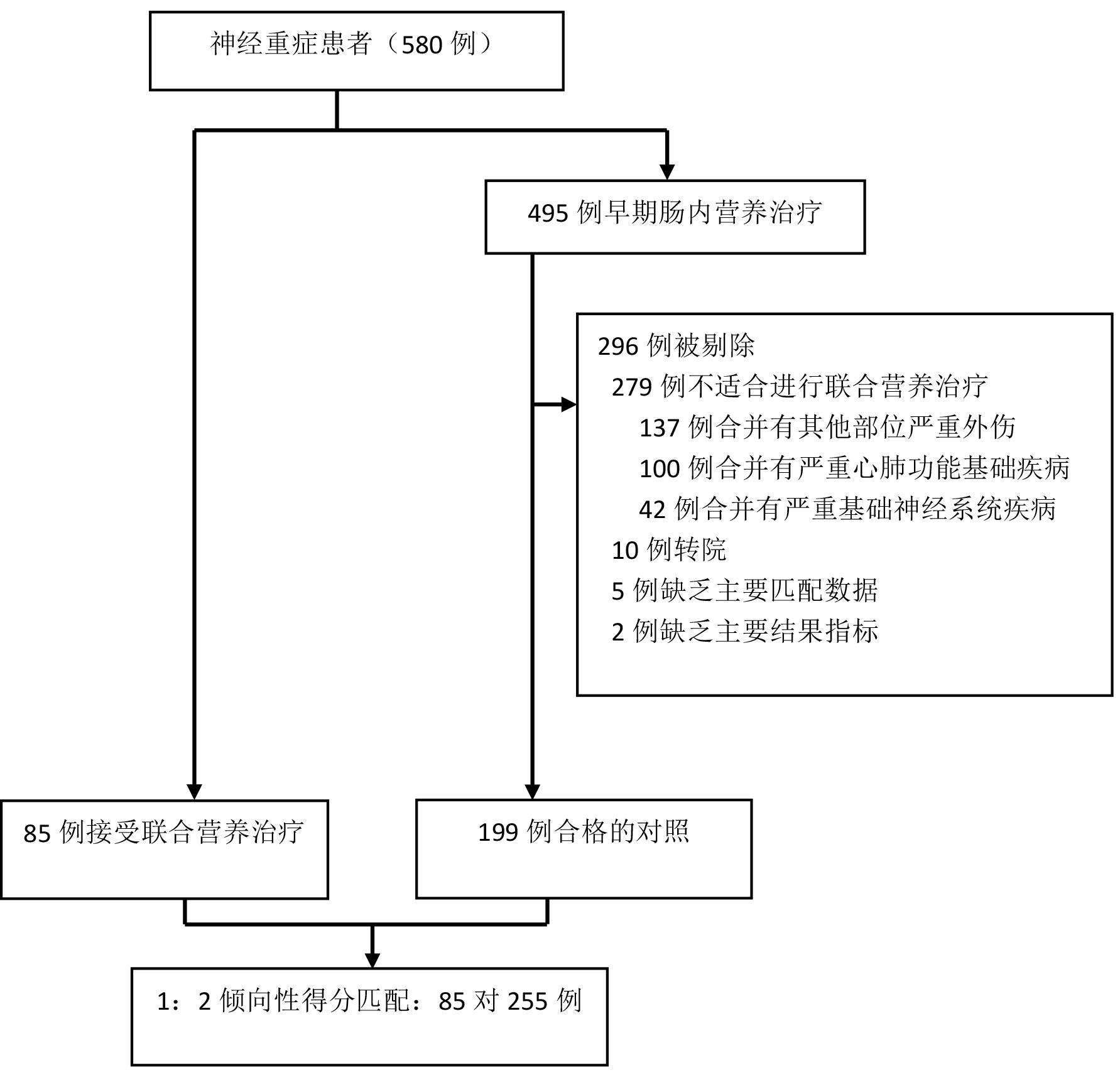
1 资料与方法 1.1 一般资料本研究纳入2018年1月1日至2018年8月31日入住上海市第十人民医院神经外科的神经重症患者。入组标准:因神经重症入住神经外科重症监护室(NICU),入院时无肝肾功能异常及心功能不全,无其他部位严重多发伤,无严重基础神经系统疾病。排除标准:不适合进行联合营养治疗; 合并有其他部位严重外伤; 合并有严重心肺功能基础疾病; 合并有严重基础神经系统疾病; 中途转院者; 缺乏主要匹配数据者; 缺乏主要结果指标者。
1.2 研究方案采用回顾性队列研究的方法,将神经重症患者作为研究对象,按住院期间的营养方式作为暴露因素,将出院后格拉斯哥预后评分(GOS评分)≥4分的占比作为主要终点指标,将个体不良反应发生率、日均肠内营养量、人血白蛋白补充量、日均补液量、肺部感染率和感染时间、住院期间白蛋白水平变化的差异,以及联合肠内营养时间及营养量与肺部感染、血清白蛋白水平之间的关系作为次要终点指标。收集两组对象的相关临床资料,包括性别、年龄、地区分布、疾病诊断、手术率、入院时意识水平、急性期插管率、胃肠减压率、血清白蛋白水平,住院天数。研究经本院伦理委员会审查批准。两组患者家属对营养治疗均知情同意。
患者按营养方式分为早期肠外联合肠内营养治疗组(实验组)和传统肠内营养组(对照组)。选用北京灵泽佰通胃管或鼻肠管,喂养时使用北京灵泽佰通生产的胃肠营养泵和EN滴注管。肠外营养液为德国费森尤斯卡比华瑞公司生产的复方氨基酸注射液(18AA)500 mL/瓶; 肠内营养液为德国费森尤斯卡比华瑞公司生产的瑞代肠内营养乳剂(TPF-D)500 mL/瓶、瑞能肠内营养乳剂(TPF-T)200 mL/瓶。对照组均于入院后24~48 h内进行,在评估无喂养禁忌证(如应激性溃疡或者血流动力学不稳定等)通常入院24 h后开始,经胃管入内,每天持续肠内营养20 h,停止喂养4 h便于肠道休息。实验组患者均在入院后至72 h内给予肠外营养,通常72 h后评估无喂养禁忌证(如应激性溃疡或者血流动力学不稳定等)后,给予肠内营养,经胃管入内,每天持续肠内营养约20 h,停止喂养4 h便于肠道休息。若出现腹泻、呕吐、消化功能障碍或心肺功能异常等情况,按相应措施处理并做相应记录。
肠内营养监测指标应用sySmeX公司XE-2100全自动分析仪和sySmeX XS-500i全自动分析仪动态测定白蛋白。样本的检测均由同一名技师完成。
1.3 统计学方法采用R 3.4.3软件进行统计分析,计量资料采用t检验或秩和检验。计数资料采用χ2检验,两组患者的基线资料采用1:2倾向性得分匹配法进行筛选。白蛋白水平变化采用广义估计方程模型和广义随机效应混合模型进行分析,主要终点指标采用二分类Logistic方程模型,次要终点指标采用多分类Logistic方程模型或广义线性模型(高斯分布)来进行评估。由于模型稳定性和过度离散等因素的影响,本研究未采用泊松分布模型。GOS得分预测模型分别采用决策树、随机森林、最邻近法、自适应助推法及自主整合模型进行拟合,并对其误判率进行五折交叉验证,其中训练集和测试集的结果以平均误判率表示,模型的预测结果以预测集来表示。以P < 0.05为差异有统计学意义。
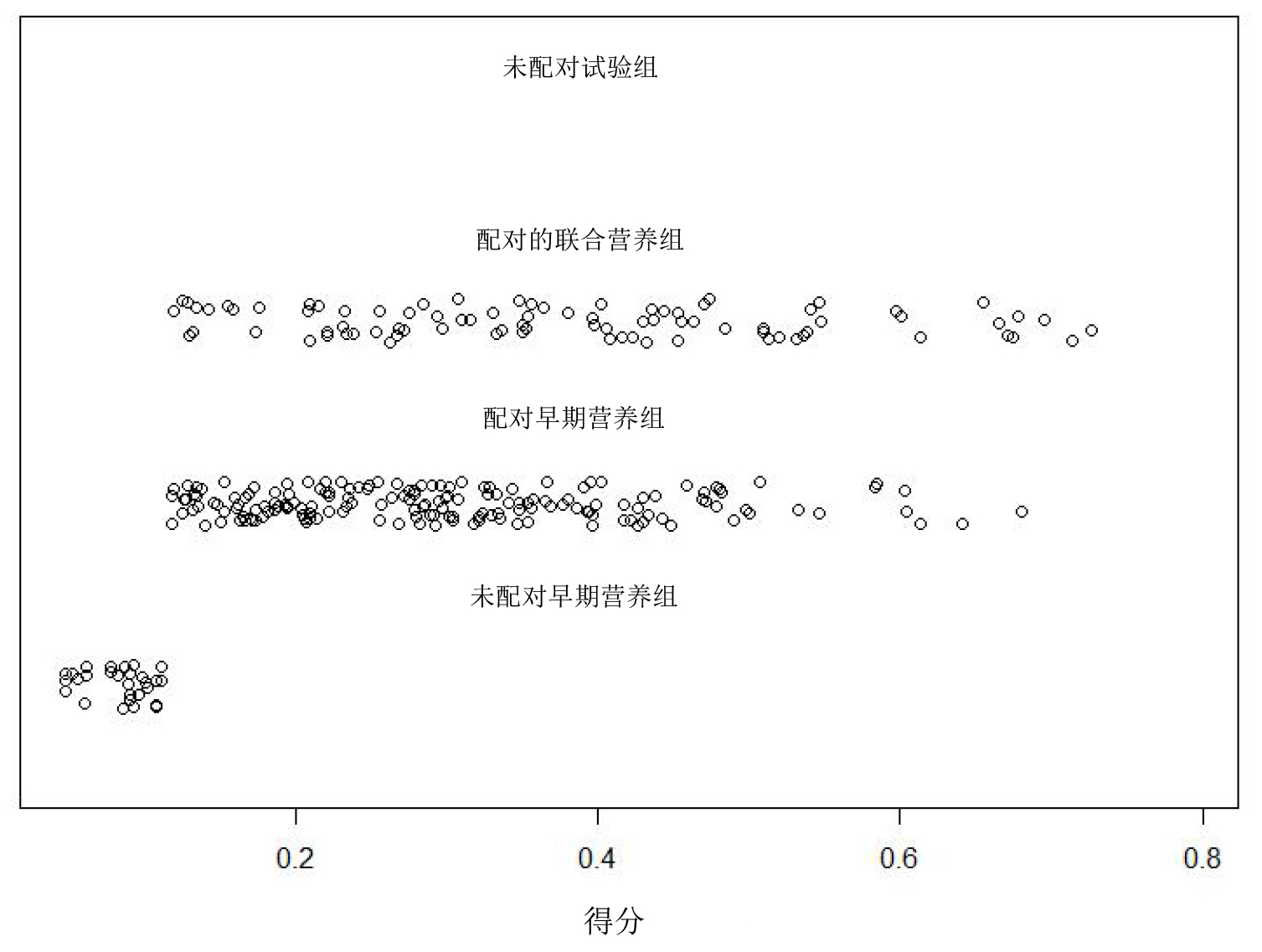
2 结果 2.1 一般资料汇总本研究初筛患者580例,其中85例接收联合营养治疗,经过筛选和倾向性得分匹配,共有85对255例纳入研究,其中实验组85例,对照组170例(图 1)。图 2所示,经Logistic模型按最临近匹配原则分析,联合营养组中每例患者得分与早期营养组中每2例患者得分基本一致,未被匹配的病例得分与实验组总体得分差别较大。经过匹配的资料基线指标差异无统计学意义(表 1)。
|
| 图 1 研究数据筛选和匹配流程图 Fig 1 Flow chart of research data screening and matching |
|
|
|
| 图 2 倾向得分的分布 Fig 2 Score distribution |
|
|
| 指标 | 匹配情况 | 实验组 | 对照组 | 统计量 | P值 |
| 病例数 | 未匹配 | 85 | 199 | ||
| 匹配后 | 170 | ||||
| 男性(例,%) | 未匹配 | 47(55.3) | 139(70.0) | 4.96 | 0.026 |
| 匹配后 | 113(66.5) | 2.56 | 0.109 | ||
| ≥65岁(例,%) | 未匹配 | 22(25.9) | 63(31.7) | 0.69 | 0.405 |
| 匹配后 | 51(30.0) | 0.29 | 0.590 | ||
| 地区分布(例,%) | 未匹配 | 7.69 | 0.104 | ||
| 匹配后 | 8.46 | 0.076 | |||
| 华东地区 | 未匹配 | 73(85.9) | 148(81.2) | ||
| 匹配后 | 125(73.5) | ||||
| 华北地区 | 未匹配 | 2(2.4) | 4(2.0) | ||
| 匹配后 | 3(1.8) | ||||
| 华中地区 | 未匹配 | 4(4.7) | 7(3.5) | ||
| 匹配后 | 6(3.5) | ||||
| 华南地区 | 未匹配 | 6(7.1) | 38(19.1) | ||
| 匹配后 | 34(20.0) | ||||
| 华西地区 | 未匹配 | 0(0.0) | 2(1.0) | ||
| 匹配后 | 2(1.2) | ||||
| 疾病诊断(例,%) | |||||
| 脑外伤 | 未匹配 | 16(18.8) | 57(28.6) | 2.52 | 0.113 |
| 匹配后 | 43(25.3) | 1.00 | 0.319 | ||
| 脑出血 | 未匹配 | 37(43.5) | 100(50.2) | 0.83 | 0.364 |
| 匹配后 | 83(48.8) | 0.44 | 0.506 | ||
| 脑梗死 | 未匹配 | 10(11.8) | 23(11.6) | 0.00 | 1.000 |
| 匹配后 | 20(11.8) | 0.00 | 1.000 | ||
| 脑肿瘤 | 未匹配 | 23(27.1) | 38(19.1) | 1.79 | 0.181 |
| 匹配后 | 35(20.6) | 1.01 | 0.316 | ||
| 颅内感染 | 未匹配 | 4(4.7) | 27(13.6) | 3.94 | 0.047 |
| 匹配后 | 22(12.9) | 3.35 | 0.067 | ||
| 脑积水 | 未匹配 | 13(15.3) | 21(10.6) | 0.86 | 0.354 |
| 匹配后 | 20(11.8) | 0.35 | 0.553 | ||
| 进行手术(例,%) | 未匹配 | 73(85.9) | 148(74.4) | 3.93 | 0.047 |
| 匹配后 | 136(80.0) | 0.96 | 0.328 | ||
| 入院时意识水平(例,%) | 未匹配 | 2.36 | 0.307 | ||
| 匹配后 | 0.81 | 0.666 | |||
| 清楚 | 未匹配 | 38(44.7) | 72(36.2) | ||
| 匹配后 | 66(38.8) | ||||
| 嗜睡和昏睡 | 未匹配 | 17(20.0) | 54(27.1) | ||
| 匹配后 | 38(22.4) | ||||
| 昏迷 | 未匹配 | 30(35.3) | 73(36.7) | ||
| 匹配后 | 66(38.8) | ||||
| 入院时GCS(例,%) | 未匹配 | 2.83 | 0.418 | ||
| 匹配后 | 2.43 | 0.487 | |||
| 13~15分 | 未匹配 | 35(41.2) | 62(31.2) | ||
| 匹配后 | 56(32.9) | ||||
| 9~12分 | 未匹配 | 19(22.4) | 50(25.1) | ||
| 匹配后 | 37(21.8) | ||||
| 6~8分 | 未匹配 | 18(21.2) | 47(23.6) | ||
| 匹配后 | 40(23.5) | ||||
| 3~5分 | 未匹配 | 13(15.3) | 40(20.1) | ||
| 匹配后 | 37(21.8) | ||||
| 术后保留气管插管(例,%) | 未匹配 | 55(64.7) | 143(71.9) | 1.12 | 0.289 |
| 匹配后 | 117(70.0) | 0.51 | 0.476 | ||
| 术后胃肠减压(例,%) | 未匹配 | 37(43.5) | 116(58.3) | 4.65 | 0.031 |
| 匹配后 | 89(52.4) | 1.43 | 0.232 | ||
| 血清白蛋白[g/L,Mean±SD(范围)] | 未匹配 | 35.22±6.60(22~67) | 35.96±7.97(22~73) | 0.81 | 0.451 |
| 匹配后 | 35.56±7.19(14~67) | 0.38 | 0.714 | ||
| 住院天数≥14 d(例,%) | 未匹配 | 63(74.1) | 108(54.3) | 8.98 | 0.003 |
| 匹配后 | 105(61.8) | 3.32 | 0.069 |
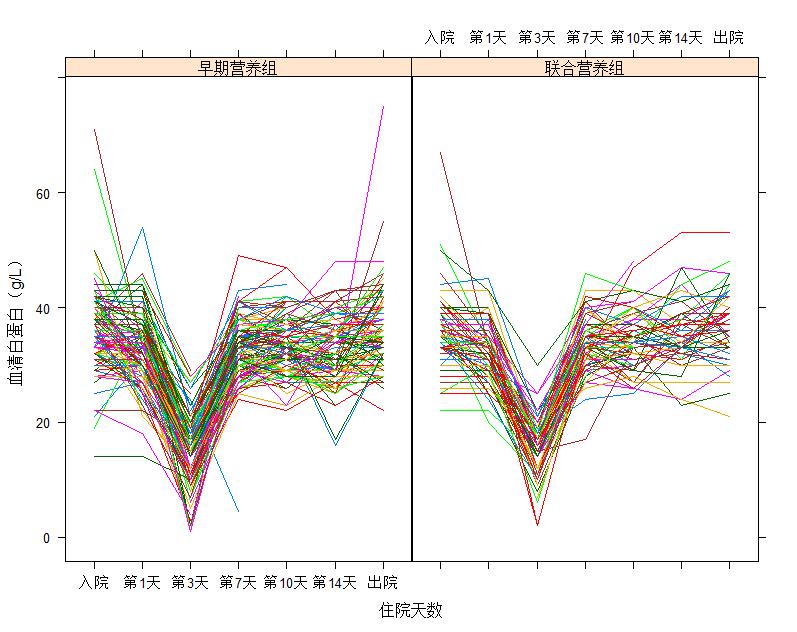
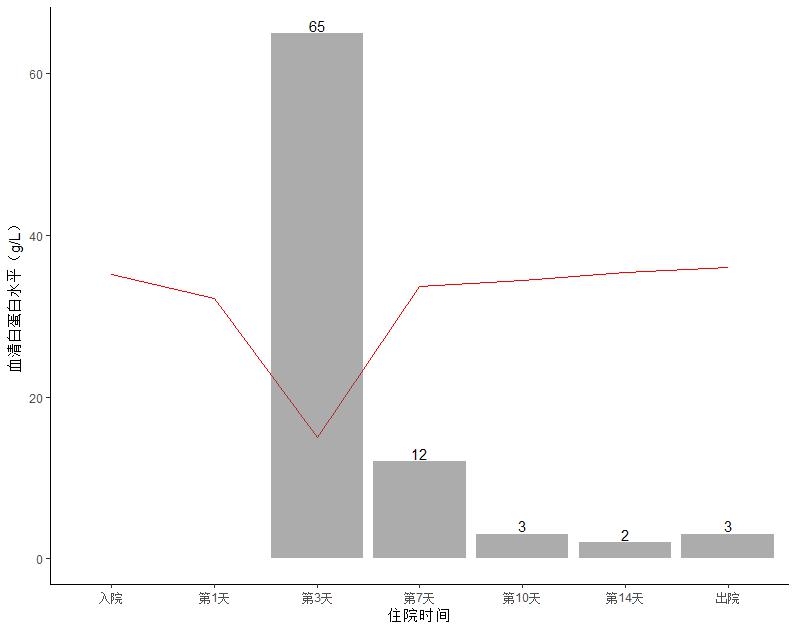
两组患者住院期间血清白蛋白水平变化差异无统计学意义,均在入院第3天出现一过性低谷,平均值为15.0 g/L。经过临床治疗,各组患者各时间点白蛋白水平基本处在相对正常水平以上(> 30 g/L)(图 3),经过广义估计方程和广义随机混合效应模型分析发现,白蛋白水平与营养方案的选择无关,但与入院意识水平和患者入院前基本白蛋白水平相关(表 2),两种模型结果基本一致,模型稳定性好。图 4表明,实验组中有65例(76.5%)患者在入院后第2~3天开始肠内营养治疗,这与住院期间患者白蛋白水平平均变化相一致。
|
| 图 3 血清白蛋白水平变化趋势 Fig 3 The change trend of serum albumin level |
|
|
| 因素 | 广义估计方程 | 混合效应方程 | ||||
| 系数 | 标准误 | 系数 | 标准误 | P值 | ||
| 营养方案 | 0.238 | 1.470 | 0.238 | 0.594 | 0.689 | |
| 入院意识为嗜睡或昏睡 | 1.409 | 0.707 | 1.409 | 0.692 | 0.042 | |
| 截距 | 28.167 | 1.470 | 28.170 | 1.479 | 0.000 | |
|
| 图 4 实验组肠内营养的开始时间的病例数与血清白蛋白平均水平的相关关系 Fig 4 Correlation between the start time of enteral nutrition and the average level of serum albumin in the experiment group |
|
|
两组患者出院后GOS得分的分布大致一致,有序多分类Logistic回归表明,OR=1.280(95%CI:0.771~2.125),P=0.339,但实验组GOS≥4分的人数比例高于对照组,而对照组GOS 3分的人数高于实验组(表 3)。
| 组别 | GOS得分(分) | ||||
| 1 | 2 | 3 | 4 | 5 | |
| 实验组 | 5(5.9) | 12(14.1) | 32(37.6) | 26(30.6) | 10(11.8) |
| 对照组 | 4(2.4) | 26(15.3) | 91(53.5) | 40(23.5) | 9(5.3) |
结果分析结果,实验组GOS≥4分人数比例在年龄、性别、入院诊断等基线指标校准的情况下高于对照组,OR=1.853(95%CI:1.018~3.385),P=0.043,差异有统计学意义。出院后意识水平的差异也支持了这一点,然而,实验组与对照组的病死率差异无统计学意义,实验组发生的不良反应种类甚至高于对照组,更容易发生肺部感染。实验组治疗过程中需要更少的日均补液量,但是肠内营养量及补充人血白蛋白的患者比例相对较多(表 4)。亚组分析表明,单纯各基线指标对主要终点指标的危险比均差异无统计学意义(图 5)。
| 结局 | 实验组 (n=85) |
对照组 (n=170) |
未校准分析 | 校准后分析 | |||
| OR(95%CI) | P值 | OR或系数(95%CI) | P值 | ||||
| 主要终点指标 | |||||||
| GOS 4~5分(例,%) | 36(42.4) | 49(28.8) | 1.814(1.052~3.127) | 0.032 | 1.853(1.018~3.385) | 0.043 | |
| 次要终点指标 | |||||||
| 出院时意识水平(例,%) | |||||||
| 清楚和烦躁 | 48(56.5) | 57(33.5) | 1.851(1.113~3.081) | 0.018 | 1.786(1.054~3.025) | 0.031 | |
| 嗜睡和昏睡 | 17(20.0) | 77(45.3) | |||||
| 昏迷和死亡 | 20(23.5) | 36(21.2) | |||||
| 死亡人数(例,%) | 5(5.9) | 4(2.4) | 2.594(0.669~10.726) | 0.164 | 3.078(0.711~14.194) | 0.130 | |
| 个体不良反应发生种类(例,%) | |||||||
| 1种 | 18(21.2) | 71(41.8) | 2.212(1.283~3.816) | 0.004 | 2.183(1.257~3.792) | 0.006 | |
| 2种 | 63(74.1) | 90(52.9) | |||||
| 3种 | 4(4.7) | 9(5.3) | |||||
| 日均肠内营养量 [mL,Mean±SD(范围)] |
1 153.53±337.87 (400~1 600) |
958.82±372.40 (150~2 000) |
194.706 (100.097~289.315) |
< 0.01 | 193.075(97.274~288.875) |
< 0.01 | |
| 人血白蛋白补充人数(例,%) | 80(94.1) | 136(80.0) | 4.000(1.633~12.033) | 0.005 | 4.041(1.633~12.252) | 0.006 | |
| 白蛋白补充量 [mL,Mean±SD(范围)] |
196±160.88 (50~1 090) |
219.96±182.34 (10~1 050) |
-23.963 (-72.215~24.288) |
0.331 | -24.406(-73.204~24.391) | 0.328 | |
| 日均补液量 [mL,Mean±SD(范围)] |
2 174.12±875.62 (1 000~4 800) |
2 984.12±790.5 8(1 000~7 300) |
-810.000 (-1 023.446~ -596.555) |
< 0.01 | -774.683 (-988.643~ -560.724) |
< 0.01 | |
| 肺部感染(例,%) | 67(78.9) | 93(54.7) | 3.082(1.717-5.750) | 0.000 2 | 2.939(1.626~5.514) | 0.000 5 | |
| 院内肺部感染时间 [d,Mean±SD(范围)] |
3.01±2.48(1~11) | 4.13±3.79(1~19) | -1.114(-2.152~ -0.076) | 0.037 | -1.265(-2.260~ -0.271) | 0.014 | |
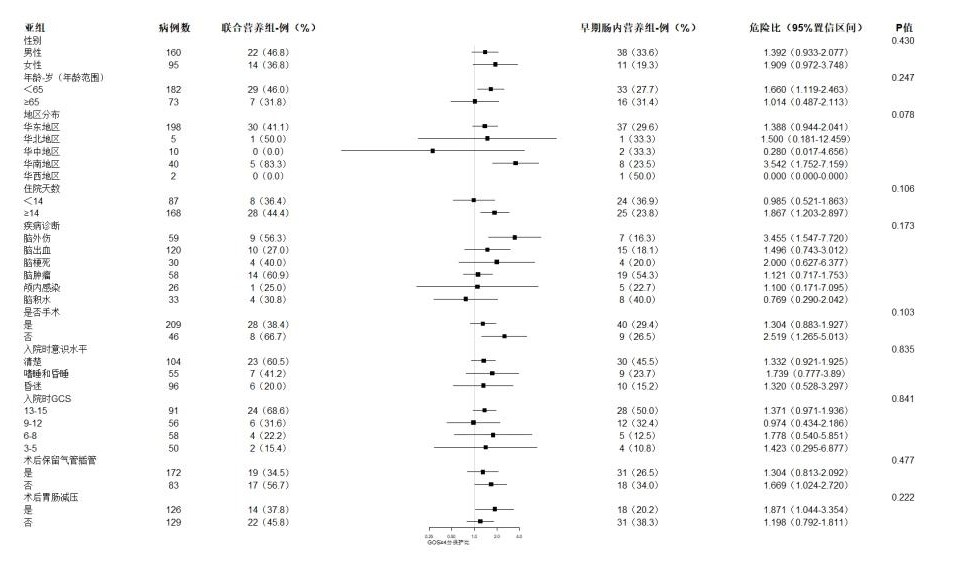
|
| 图 5 GOS各影响因素未校准危险比的树状图 Fig 5 Tree chart of the uncalibrated hazard ratio of each influencing factor of GOS |
|
|
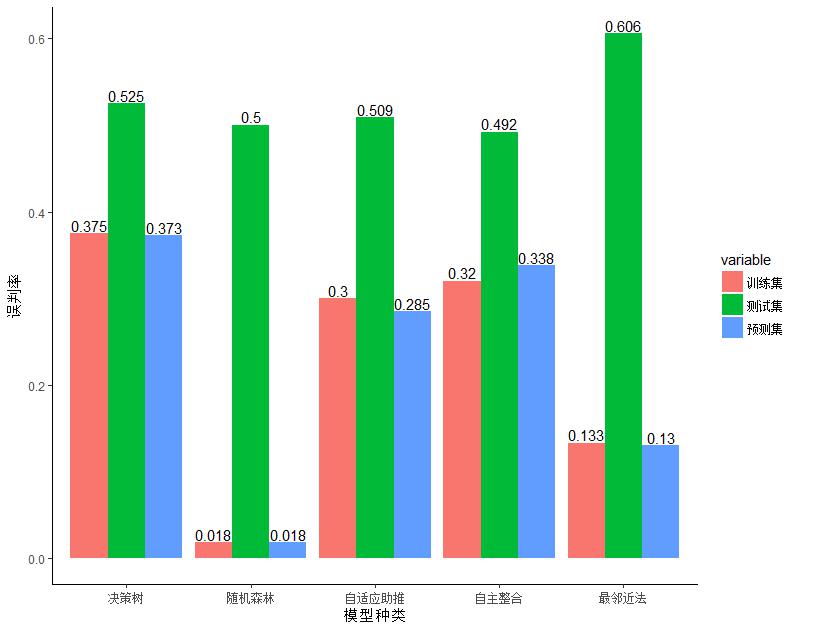
患者GOS得分的决策模型中,五种模型的五折交叉验证结果中训练集误判率分别为37.5%、1.8%、30.0%、32.0%、13.3%,随机森林模型的误判率最低; 测试集误判率分别为52.5%、50%、50.9%、49.2%、60.6%,自主整合模型的误判率最低。五种模型对本试验数据预测的误判率为37.3%、1.8%、28.5%、33.8%、13.0%,随机森林模型的误判率最低。随机森林模型的准确性最高,各模型准确度和基线指标的权重各有不同,差异较大(图 6)。
|
| 图 6 GOS得分预测模型误判率的比较 Fig 6 Comparison of misjudgment rate of each GOS prediction model |
|
|
神经重症患者常出现意识障碍、吞咽困难,不能经口进食,且机体处于应激高消耗状态,可迅速出现负氮平衡、低蛋白血症,导致营养不良、免疫功能减退,导致感染发生率及病死率增高[4]。胃肠道的作用不仅仅是单纯吸收营养,而且还在自身免疫系统中起着很重要的作用,肠道食物的刺激可防止机体肠道黏膜重要的表面屏障肠道淋巴组织的萎缩[5]。研究显示长期不进食,十二指肠黏膜会出现萎缩,并且肠道的通透性也出现异常[6]。因此,EN不仅满足机体对营养物质的需要,而且还维持肠道的生理功能,保护肠道的黏膜屏障,减少肠源性感染等[7]。近年来,国内外对于外科ICU患者的营养支持研究中,以肠内营养支持的肯定性研究占比相对更高,研究也趋于全面[8-12],但是早期肠外联合肠内营养治疗对患者预后的研究仍较匮乏。
格拉斯哥结局评分(GOS)于1975年被提出,评估简单方便,被广泛应用和接受[13]。GOS将患者结局分为:死亡(1分)、稳定的植物生存状态(2分)、严重的残疾(3分)、中度残疾(4分)、恢复良好(5分)。GOS≥4分表明预后良好。本研究将出院后GOS≥4分的占比作为主要终点指标,实验组GOS≥4分的人数比例高于对照组,而对照组GOS 3分的人数高于实验组。既往文献表明[14],所有ICU住院患者均应考虑医学营养治疗,成人危重症患者肠内肠外营养直接影响患者预后。本研究实验组的GOS评分整体高于对照组,但未对各个得分之间的显著性进行分析,结果显示联合营养可以提高患者的生活质量。值得注意的是,实验组与对照组的病死率差异无统计学意义,这可能与当前治疗手段无法逆转严重颅脑损伤的预后有关。实验组的不良反应发生种类甚至高于对照组,更容易发生肺部感染。文献表明肠内营养有利于肠内菌群的定植,实验组患者在治疗早期由于缺乏肠内营养导致消化道菌群移行至呼吸道,使肺部感染的概率增加[15]。实验组治疗过程中需要更少的日均补液量,但是肠内营养量及补充人血白蛋白的患者比例相对较多。
目前临床上常用营养状况评估指标包括白蛋白、血红蛋白等,两者持续低下不仅提示预后不良,且其下降水平与病情严重密切相关。血清白蛋白临床检测方便、快速,常被临床用来作为衡量危重症患者营养支持是否有效。本研究中两组患者血清白蛋白水平均在入院第3天出现一过性低谷,可能与患者术后白蛋白组织间丢失、应激反应、蛋白质的异常代谢有关,而这些因素又与患者入院前的基础情况、颅脑损伤程度密切相关。本文结果显示,白蛋白水平与营养方案的选择无关,但与入院意识水平和患者入院前基本白蛋白水平相关,入院意识水平反映了患者病情的严重程度,住院期间的营养治疗维持了基本血清白蛋白水平,但不能够改变因疾病而出现的急性应激反应,所以营养方式无法根本改变住院期间的白蛋白水平趋势[16]。其他衡量营养状态的指标由于各方面因素受限,未列入观察。
神经重症患者并发症较多,其中肠内营养实施过程中出现的并发症往往制约着营养支持的临床应用,而腹泻是肠内营养治疗过程中出现频率较高的并发症[17-18],已有研究建议危重症患者应尽早开始肠内营养,缩短禁食时间,有助于降低EN期间腹泻发生率[19]。在营养实施中难免出现腹泻时,在继续原喂养方案同时,及时应用蒙脱石散抑菌同时修复肠道黏膜,通常能有效控制腹泻。有研究指出在重症患者中由于早期应用时机、处方不足和长期的肠内喂养中断等因素,导致喂养不足较为常见。故而在营养支持治疗中需要注意早期给予充足的能量支持,早期应用肠外营养并充分评估营养的耐受性,及时给予合适的肠内营养才能达到更有效的治疗。
合理安排肠外营养与肠内营养的配比,既可以满足患者自身的营养需求,还可以维持胃肠道原本的结构和功能,并有助于中枢神经系统功能的恢复,从而避免机体代谢紊乱与脏器功能的损害[20]。不适当的营养支持治疗不仅不利于改善患者本身机体的营养状况,反而可能增加患者不良反应发生率,严重影响患者的临床预后。延迟给予营养支持会使重症患者出现营养不良,且后期营养治疗很难纠正[21]。早期PN联合EN支持治疗,能显著改善神经重症患者的营养状况,对存在营养不足或营养风险的患者进行营养支持治疗能提高患者对于手术应激的耐受性[5]。实施合理临床营养支持对严重应激条件下的组织分解代谢水平有抑制作用,对脏器结构和机体免疫功能也会起到维护作用,能减少患者入住ICU时间和总住院时间[22]。随着营养支持理论和实践的发展以及对营养支持认识的不断加深,可以预见早期PN联合EN在神经外科患者的治疗中必将发挥更加重要的作用。
本文所做的队列研究有几点局限性:(1)队列研究往往需要对象数量巨大,才能获得暴露组与对照组之间有统计学意义的差异。本研究共纳入255例研究对象,样本量仍不够充足,结果仍需进一步多中心大样本研究证实。(2)本文针对患者临床疗效进行分析,以GOS预后评分作为主要重点指标,在后期随访过程中面临挑战,容易产生失访偏倚。(3)本文虽然预先将住院期间的营养方式作为暴露因素,对研究对象进行了分组,但难以控制暴露以外的其他特征在两组中的分布而造成的混杂偏倚。
综上,本研究显示,早期联合肠外肠内营养疗法与传统早期肠内营养疗法相比,对于神经重症患者的预后有提升作用。
| [1] | Singer P. Improving intensive care unit outcome with total parenteral nutrition:Lessons from a case study[J]. Clin Nutr Suppl, 2009, 4(1): 9-12. DOI:10.1016/j.clnu.2009.04.005 |
| [2] | Chiang YH, Chao DP, Chu SF, et al. Early enteral nutrition and clinical outcomes of severe traumatic brain injury patients in acute stage:a multi-center cohort study[J]. J Neurotrauma, 2012, 29(1): 75-80. DOI:10.1089/neu.2011.1801 |
| [3] | Pichard C, Thibault R, Heidegger CP, et al. Enteral and parenteral nutrition for critically ill patients:A logical combination to optimize nutritional support[J]. Clin Nutr Suppl, 2009, 4(1): 3-7. DOI:10.1016/j.clnu.2009.04.007 |
| [4] | Maas AIR, Menon DK, Adelson PD, et al. Traumatic brain injury:integrated approaches to improve prevention, clinical care, and research[J]. Lancet Neurol, 2017, 16(12): 987-1048. DOI:10.1016/S1474-4422(17)30371-X |
| [5] | Lu T, Guan J. Combined application of nasogastric tubes and nasointestinal tubes in neurosurgical intensive care patients with stress ulceration:a novel solution to treatment and early enteral nutrition[J]. Springerplus, 2016, 5(1): 1769. DOI:10.1186/s40064-016-3431-7 |
| [6] | 王继伟, 王新颖. 营养支持对肠道菌群与肠黏膜免疫的影响[J]. 肠外与肠内营养, 2017, 24(5): 310-313. DOI:10.16151/j.1007-810x.2017.05.013 |
| [7] | 袁苗, 裴红红. 不同肠内营养制剂早期联合双歧杆菌三联活菌对脑出血术后患者营养及炎症反应的影响[J]. 临床急诊杂志, 2018, 19(7): 436-439. DOI:10.13201/j.issn.1009-5918.2018.07.004 |
| [8] | 姚美琪, 封秀琴, 郭芝廷, 等. 危重患者早期肠内营养支持剂量选择的meta分析[J]. 中华急诊医学杂志, 2018, 27(8): 866-871. DOI:10.3760/cma.j.issn.1671-0282.2018.08.010 |
| [9] | 邱兆磊, 王振杰, 程峰, 等. 超早期肠内营养联合微生态制剂治疗重症急性胰腺炎患者的临床价值[J]. 中华急诊医学杂志, 2018, 27(9): 967-971. DOI:10.3760/cma.j.issn.1671-0282.2018.09.003 |
| [10] | 朱娟, 王龙安, 秦历杰, 等. 肠内营养序贯疗法在重症脑血管病中的应用探讨[J]. 中华急诊医学杂志, 2018, 27(8): 872-875. DOI:10.3760/cma.j.issn.1671-0282.2018.08.011 |
| [11] | Lee JS, Jwa CS, Yi HJ, et al. Impact of early enteral nutrition on in-hospital mortality in patients with hypertensive intracerebral hemorrhage[J]. J Korean Neurosurg Soc, 2010, 48(2): 99-104. DOI:10.3340/jkns.2010.48.2.99 |
| [12] | Ridley E, Gantner D, Pellegrino V. Nutrition therapy in critically ill patients-a review of current evidence for clinicians[J]. Clin Nutr, 2015, 34(4): 565-571. DOI:10.1016/j.clnu.2014.12.008 |
| [13] | Mcmillan T, Wilson L, Ponsford J, et al. The Glasgow Outcome Scale-40 years of application and refinement[J]. Nat Rev Neurol, 2016, 12(8): 477-485. DOI:10.1038/nrneurol.2016.89 |
| [14] | Singer P, Blaser AR, Berger MM, et al. ESPEN guideline on clinical nutrition in the intensive care unit[J]. Clin Nutr, 2018, pii: S0261-5614. DOI:10.1016/j.clnu.2018.08.037 |
| [15] | 胡洁, 舒玲斌, 孙巧玲, 等. 急性腹泻患者肠道分离肺炎克雷伯菌耐药及毒力流行病学研究[J]. 中华急诊医学杂志, 2018, 27(11): 1281-1284. DOI:10.3760/cma.j.issn.1671-0282.2018.11.019 |
| [16] | Caironi P, Langer T, Gattinoni L. Albumin in critically ill patients:the ideal colloid?[J]. Curr Opin Crit Care, 2015, 21(4): 302-308. DOI:10.1097/MCC.0000000000000223 |
| [17] | 王先美, 陈卫挺, 叶立刚, 等. 浙江省ICU危重症患者肠内营养早期腹泻的调查研究[J]. 中华急诊医学杂志, 2018, 27(10): 1142-1147. DOI:10.3760/cma.j.issn.1671-0282.2018.10.016 |
| [18] | Reintam Blaser A, Deane AM, Fruhwald S. Diarrhoea in the critically ill[J]. Curr Opin Crit Care, 2015, 21(2): 142-153. DOI:10.1097/MCC.0000000000000188 |
| [19] | 王宇. 两种营养支持方法在神经外科颅脑损伤患者中疗效对比分析[J]. 现代诊断与治疗, 2018, 29(2): 288-290. DOI:10.3969/j.issn.1001-8174.2018.02.058 |
| [20] | Reintam Blaser A, Starkopf J, Alhazzani W, et al. Early enteral nutrition in critically ill patients:ESICM clinical practice guidelines[J]. Intensive Care Med, 2017, 43(3): 380-398. DOI:10.1007/s00134-016-4665-0 |
| [21] | Feng P, He C, Liao G, et al. Early enteral nutrition versus delayed enteral nutrition in acute pancreatitis:A PRISMA-compliant systematic review and meta-analysis[J]. Medicine (Baltimore), 2017, 96(46): e8648. DOI:10.1097/MD.0000000000008648 |
| [22] | Weimann A, Braga M, Carli F, et al. ESPEN guideline:Clinical nutrition in surgery[J]. Clin Nutr, 2017, 36(3): 623-650. DOI:10.1016/j.clnu.2017.02.013 |
 2019, Vol. 28
2019, Vol. 28




