2 南昌大学第二附属医院超声科 330006;
3 江西省妇幼保健院,南昌 330006
脓毒症是机体对感染的反应失调而导致危及生命的器官功能障碍[1]。目前脓毒症的研究更多地还是集中在临床救治上[2]。脓毒症休克患者常伴有交感神经过度激活,高心排血量心动过速[3]。有研究者将超短效高选择性β1受体阻滞剂艾司洛尔用于脓毒症休克患者心室率控制,研究结果尚有争议。Aboab等[4]认为艾司洛尔负性心率及负性肌力效应可能会带来低心输出量,导致微血管流量减少;Morelli等[5]却认为艾司洛尔不仅没有增加脓毒症休克患者不良事件,反而改善其预后。本研究通过艾司洛尔控制脓毒症休克患者心室率,从超声角度阐述艾司洛尔对脓毒症休克患者左室形态功能的影响,并探讨其预后。
1 资料与方法 1.1 纳入标准采用前瞻性随机队列研究方法,选取2015年9月至2017年6月在南昌大学第二附属医院治疗的年龄18~60岁,诊断符合2012年国际严重脓毒症和脓毒性休克治疗指南,经过充分的液体复苏,且血流动力学稳定,镇静镇痛治疗满意仍心率大于100次/min患者134例。
1.2 排除标准年龄 < 18周岁或 > 60周岁, 或有如下情况:⑴既往有冠心病病史; ⑵急性冠脉综合征患者; ⑶既往有肺心病病史;⑷合并慢性心功能不全者;⑸合并心脏瓣膜病者;⑹合并先天性心脏病者;⑺合并其他可导致心肌受损的心脏疾病;⑻合并肿瘤及自身免疫性疾病的患者;⑼在入院前接受过心肺复苏术的患者;⑽慢性肾功能不全病史者;⑾脓毒症休克或生命体征不能维持者;⑿入院后24 h内死亡者;⒀妊娠或哺乳期妇女;⒁不配合治疗, 资料不全者。
1.3 分组和治疗将134例6 h EGDT达标的患者按随机数字表法分为常规治疗组和艾司洛尔组。根据《2012年国际严重脓毒症和脓毒性休克治疗指南》, 两组均常规给予抗感染、液体复苏、营养支持、对症支持治疗和重要脏器功能支持治疗[6]。艾司洛尔组在基础治疗的同时经上腔静脉导管用微量泵持续泵入艾司洛尔,根据心率调整剂量,控制患者心率在60~100次/min;血压下降者适当调整去甲肾上腺素用量,维持平均动脉压(MAP)≥65 mmHg(1 mmHg=0.133 kPa);根据中心静脉压(CVP)调整补液速度,维持CVP 8~12 mmHg。
1.4 观察指标 1.4.1常规检查三大常规, 生化、胸片、心电图等安全性指标。
1.4.2给药前两组患者一般情况分析,包括心率、MAP、CVP、肌钙蛋白(CTnI)、B型脑钠肽(BNP)、肌酐(Cr)、尿量、乳酸(Lac)、APACHE Ⅱ评分、SOFA评分等。
1.4.3 经胸超声左心形态及功能测量分别在给药前0.5~2 h、心率达标后24、48、72、96 h测量:①反映心脏收缩期左室形态学参数,左室收缩末直径(LVIDs)、左室收缩末容积(LVESV);②反映心脏舒张期左室形态学参数,左室收缩末内径(LVIDd)、左室舒张末容积(LVEDV);③反映心脏收缩功能指标,左室射血分数(LVEF)、左室压力上升速率(dp/dt)和二尖瓣环收缩期速度(Sm);④反映左心舒张功能指标:E/A比值、E峰下降时间(EDT)。所有指标均由本院两名有经验的超声医师测量,Philips iE33型超声诊断仪,S1-5探头,频率1~5 MHz。
1.4.4 预后评估给药前至ICU治疗结束时每天评估患者APACHE Ⅱ评分、SOFA评分,出院或转科时记录总ICU治疗时间,机械通气时间,随访28 d病死率。
1.5 统计学方法数据统计采用SPSS 22.0统计学软件包处理,计量资料以均数±标准差(Mean±SD)表示,多组间两两比较用LSD-t检验,不同时点资料比较采用重复测量的方差分析,计数资料采用χ2检验,Kaplan-Meier方法作生存曲线,以P < 0.05为差异有统计学意义。
2 结果 2.1 两组患者基线情况分析本研究共纳入脓毒症休克患者134例,其中男性77例,女性57例,年龄(42.3±17.5)岁,随机(随机数字法)分为两组,每组67例;两组患者基线情况具有可比性(P > 0.05),见表 1。
| 指标 | 总数 (n=134) |
常规治疗组 (n=67) |
艾司洛尔组 (n=67) |
| 年龄(岁) | 42.3±17.5 | 41.9±15.3 | 41.6±16.2 |
| 心率(次/min) | 120.4±17.6 | 117.2±15.6 | 123.5±18.7 |
| 平均动脉压(mmHg) | 70.2±8.4 | 69.8±5.6 | 71.1±7.4 |
| CVP(mmHg) | 10.7±4.4 | 11.3±3.5 | 9.8±3.9 |
| NE[μg/(kg·min)] | 0.8±0.36 | 0.8±0.39 | 0.7±0.34 |
| cTnI(μg/L) | 5.7±2.3 | 6.1±2.5 | 5.5±2.4 |
| BNP(pg/mL) | 1 523.8±521.4 | 1 498.9±647.1 | 1 683.0±702.1 |
| 肌酐(μmol/L) | 150.1±57.2 | 147.8±51.3 | 155.9±62.7 |
| 尿量(mL/h) | 49.4±17.9 | 50.4±15.3 | 47.8±13.5 |
| Lac(mmol/L) | 2.7±1.7 | 2.8±1.3 | 2.5±1.9 |
| PaO2/FiO2(mmHg) | 262.7±154.8 | 273.4±147.2 | 258.6±165.7 |
| 机械通气(例,%) | 91(71.7) | 47(73.4) | 44(69.8) |
| APACHE Ⅱ评分 | 16.5±7.6 | 16.7±7.9 | 17.4±6.8 |
| SOFA评分 | 13.4±4.5 | 14.2±3.3 | 13.0±5.6 |
| 注:CVP,中心静脉压;NE,去甲肾上腺素;cTnI,肌钙蛋白;BNP,B型脑钠肽;Lac,乳酸;PaO2/FiO2,氧合指数;APACHE Ⅱ,急性生理与慢性健康评分;SOFA,序贯器官衰竭评分 | |||
心率达标48 h内,常规治疗组和艾司洛尔组LVIDs、LVESV及LVIDd、LVEDV无明显变化,72 h后艾司洛尔组LVIDs、LVESV减小,LVIDd、LVEDV增加,96 h增加明显,而常规治疗组在整个试验过程各参数均无明显变化,组间比较,差异有统计学意义(P < 0.05),见表 2。
| 组别 | LVIDs(mm) | LVESV(mL) | LVIDd(mm) | LVEDV(mL) |
| 常规治疗组 | ||||
| 0~2 h (给药前) | 31.0±7.4 | 55.5±8.3 | 41.3±6.6 | 76.3±11.3 |
| 24 h | 30.6±5.7 | 56.1±6.6 | 40.3±5.9 | 74.5±12.5 |
| 48 h | 32.2±6.9 | 54.7±9.8 | 40.1±6.7 | 78.6±14.7 |
| 72 h | 29.2±8.4 | 55.4±6.2 | 39.5±4.4 | 77.4±10.8 |
| 96 h | 30.3±9.3 | 56.2±7.1 | 41.1±8.3 | 75.4±10.8 |
| 艾司洛尔组 | ||||
| 0~2 h (给药前) | 32.2±6.5 | 55.5±8.3 | 40.3±7.5 | 75.7±13.3 |
| 24 h | 31.4±6.8 | 54.1±6.6 | 41.1±8.9 | 74.8±11.5 |
| 48 h | 33.3±7.1 | 56.7±9.8 | 40.6±6.4 | 76.2±13.7 |
| 72 h | 27.0±6.4a | 45.3±7.5a | 43.2±7.8a | 81.5±12.6a |
| 96 h | 25.5±7.3a | 41.3±5.7a | 48.2±7.8a | 89.7±14.1a |
| 注:LVIDs,左室收缩末直径;LVESV,左室收缩末容积;LVIDd,左室舒张末内径;LVEDV,左室舒张末容积;与常规治疗组同时间点比较,aP < 0.05 | ||||
心率达标24 h内艾司洛尔组患者dp/dt、Sm、LVEF不但没有上升,反而有不同程度下降,组内比较差异无统计学意义(P > 0.05);48 h后dp/dt、Sm开始回升,LVEF增加,96 h达高峰,组间比较差异有统计学意义(P < 0.05)。常规治疗组各参数变化不明显。艾司洛尔组24 h内EDT稍有上升,E/A比值变化不明显,48 h后EDT大致下降至试验前水平,E/A比值有所上升,72 h E/A比值继续升高,EDT仍有下降,96 h两者变化明显,常规治疗组整个试验过程E/A比值稍下降,EDT变化不明显,组间同时点比较,差异有统计学意义(P < 0.05)。见表 3。
| 组别 | dp/dt | Sm | LVEF | E/A值 | EDT(ms) |
| 常规治疗组 | |||||
| 0~2 h (给药前) | 1 548.2±467.5 | 4.27±0.53 | 48.2±6.5 | 1.1±0.4 | 236.2±36.4 |
| 24 h | 1 519.5±496.2 | 4.35±0.59 | 47.4±7.3 | 1.1±0.5 | 240.7±42.9 |
| 48 h | 1 497.1±516.8 | 4.21±0.49 | 49.7±6.6 | 1.0±0.4 | 241.3±26.8 |
| 72 h | 1 642.0±374.3 | 4.32±0.65 | 47.5±8.4 | 1.1±0.3 | 235.5±32.4 |
| 96 h | 1 506.4±397.7 | 4.19±0.47 | 48.5±9.5 | 0.9±0.4 | 239.1±33.7 |
| 艾司洛尔组 | |||||
| 0~2 h (给药前) | 1 478.4±521.0 | 4.31±0.54 | 47.3±8.8 | 1.0±0.4 | 241.2±31.3 |
| 24 h | 1 389.2±475.7c | 4.19±0.63c | 45.1±7.5c | 1.0±0.3 | 244.8±40.8 |
| 48 h | 1 437.5±567.3 | 4.26±0.48 | 46.7±8.6 | 1.0±0.5 | 244.3±33.4 |
| 72 h | 1 995.5±742.2a | 4.67±0.76a | 50.5±7.9a | 1.3±0.6a | 229.2±37.6a |
| 96 h | 2 223.3±871.8b | 5.89±0.73b | 53.2±7.3b | 1.5±0.5b | 218.6±32.5b |
| 注:dp/dt,左室压力上升速率;Sm,二尖瓣环收缩期速度;LVEF,左室射血分数;EDT,E峰下降时间;与常规治疗组同时间点比较,aP < 0.05, bP < 0.01;与同组间给药前比较,cP > 0.05 | |||||
艾司洛尔组患者APACHE Ⅱ评分、SOFA评分降低,机械通气时间、ICU停留时间缩短,两组间比较,差异有统计学意义(P < 0.05)。见表 4。
| 项目 | 常规治疗组(n=67) | 艾司洛尔组(n=67) |
| APACHE Ⅱ评分 | 21.2±5.3 | 10.7±3.9a |
| SOFA评分 | 8.3±3.9 | 3.4±1.5a |
| ICU治疗时间(d) | 17.4±6.8 | 10.3±5.1a |
| 机械通气时间(d) | 10.6±4.7 | 6.3±2.4a |
| 28 d病死率(例,%) | 19(28.4) | 11(16.4)b |
| 注:APACHE Ⅱ,急性生理与慢性健康评分;SOFA,序贯器官衰竭评分;与常规治疗组比较,aP < 0.05,bP < 0.01 | ||
28 d随访结果显示,常规治疗组67例患者中,死亡19例,病死率为28.4%,艾司洛尔组67例患者中,死亡11例,病死率为16.4%,根据患者死亡人数,生存状态、生存时间绘制Kaplan-Meier生存曲线分析表明,两组患者28 d病死率比较,艾司洛尔组患者28 d生存率明显较常规治疗组升高(Log Rank检验13.481,P < 0.01),差异有统计学意义(P < 0.01)。见图 1。
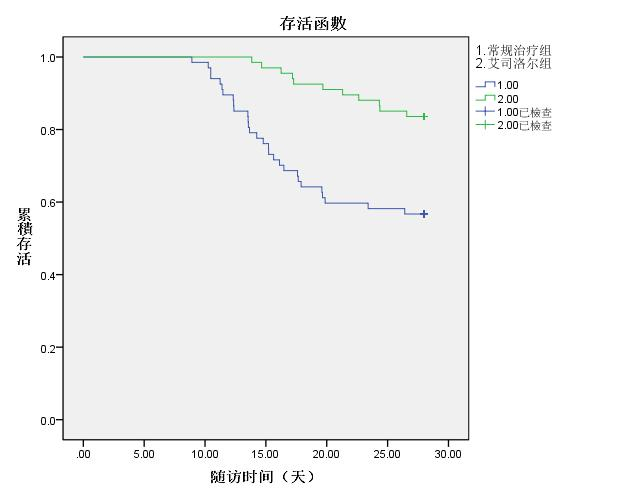
|
| 图 1 两组患者Kaplan-Meier生存曲线分析 |
|
|
脓毒症休克起病早期即可发生心肌损伤,迅速进展为心肌抑制和心功能不全,并导致临床结局恶化,是危重症患者死亡的重要原因[7]。本研究发现,给予艾司洛尔控制脓毒症休克患者心室率,患者左室收缩功能非但没有减弱,反而增强,这与传统的治疗理念(β受体阻滞剂的负性肌力作用)相悖,其原因可能与下列因素有关:(1)β受体阻滞剂能明显降低心率和短时程心率变异度,使心脏力-频率关系协调,心肌耗氧量减少[8];(2)β受体阻滞剂能降低心功能障碍时的趋化因子和炎症因子表达[9],在急性心肌顿抑时起到保护作用[10];(3)β受体阻滞剂的负性频率作用使左室舒张期延长,回心血量增加,左室射血分数增加。
LVEF反映左心室容积的相对变化,无法直接显示心肌的收缩性能,因此不可避免地受到左心室前后负荷以及心室腔大小、形态等因素的影响,单纯凭借LVEF来评价患者的左室收缩功能有一定的局限性。本研究在评价左心室收缩功能时除了测量LVEF外,同时测量dp/dt和Sm。dp/dt也是一项反映心肌收缩功能的重要指标,可能是左心室收缩功能改善的敏感因子[11]。Sm能反映左心室心肌纵向的收缩性能,被认为是预测左心室收缩功能的最强的独立因素[12]。本研究发现,心率达标后24 h内艾司洛尔组dp/dt、Sm、LVEF均有轻度下降,除去甲肾上腺素剂量稍上调外,患者的MAP、CVP、尿量及Lac均不受影响;与Hosokawa等[13]通过动物实验得出的研究结果一致。48 h后dp/dt、Sm开始回升,LVEF增加,96 h达高峰,说明艾司洛尔增强脓毒症休克患者的心肌收缩力,这与Morelli等[5]的研究结果一致。
E/A、EDT是反映左室舒张功能的可靠指标,但其存在假阳性及假阴性[14]。为了减少单个指标测量的误差,本研究在测定E/A的基础上测量患者EDT时发现,心率达标24 h内艾司洛尔组EDT稍有上升,E/A比值无明显变化,48 h后EDT大致下降至试验前水平,E/A比值有所上升,96 h两者变化明显;常规治疗组整个试验过程E/A比值稍下降,EDT变化不明显。因此,艾司洛尔不仅改善脓毒症休克患者左室收缩功能,其舒张功能也是增强的。Wei等[15]认为小剂量艾司洛尔可以改善脓毒症休克大鼠心脏舒张功能。
APACHE Ⅱ评分是疾病严重程度最成功的评分系统,而SOFA评分对ICU脓毒症及脓毒性休克患者的预后有较好的预测能力[16]。本研究发现,相比常规治疗组,艾司洛尔组患者APACHE Ⅱ评分、SOFA评分下降,ICU治疗时间及械通气时间缩短;Kaplan-Meier生存曲线分析表明,艾司洛尔组患者28 d病死率较常规治疗组明显降低(P < 0.01)。
综上所述,艾司洛尔增加脓毒症休克患者心肌收缩力,改善舒张功能;减少器官功能损害,缩短机械通气及ICU停留时间,降低28 d病死率。脓毒症休克患者是否可以使用β受体阻滞剂以及正确合理地使用β受体阻滞剂是否给临床脓毒症休克患者带来益处,需要进一步动物实验及大样本、多中心的临床研究证实。
| [1] | Singer M, Deutschman CS, Seymour CW, et al. The third international consensus. definitions for sepsis and septic shock (Sepsis-3)[J]. JAMA, 2016, 315(8): 801-810. DOI:10.1001/jama.2016.0287 |
| [2] | 何小军, 马岳峰. 脓毒症:我们能做些什么?[J]. 中华急诊医学杂志, 2017, 26(5): 483-487. DOI:10.3760/cma.j.issn.1671-0282.2017.05.001 |
| [3] | Macchia A, Romero M, Comignani PD, et al. Previous prescription ofβ-blockers is associated with reduced mortality among patients hospitalized in intensive care units for sepsis[J]. Crit Care Med, 2012, 40(10): 2768-2772. DOI:10.1097/CCM.0b013e31825b9509 |
| [4] | Aboab J, Sebille V, Jourdain M, et al. Effects of esmolol on systemic and pulmonary and on oxygenation in pigs with hymodynamic endotoxin shock[J]. Intensive Care Med, 2011, 37(8): 1344-1351. DOI:10.1007/s00134-011-2236-y |
| [5] | Morelli A, Ertmer C, Westphal M, et al. Effect of heart rate control with esmolol on hemodynamic and clinical outcomes in patients with septic shock:a randomized clinical trial[J]. JAMA, 2013, 310(16): 1683-1691. DOI:10.1001/jama.2013.278477 |
| [6] | Dellinger RP, Levy MM, Rhodes A, et al. Surviving sepsis campaign: international guidelines for management of severe sepsis and septic shock: 2012[J]. Crit Care Med, 2013, 41(2): 580-637. DOI:10.1007/s00134-012-2769-8 |
| [7] | 沈林霞, 郑亚安, 田兆兴. N末端脑钠肽前体对脓毒症休克患者左心室舒张功能障碍的预测价值[J]. 中华急诊医学杂志, 2018, 27(2): 164-167. DOI:10.3760/cma.j.issn.1671-0282.2018.02.010 |
| [8] | Joulin O, Marechaux S, Hassoun S, et al. Cardiac force-frequency relationship and frequency-dependent acceleration of relaxation are impaired in LPS-treated rats[J]. Crit Care, 2009, 13(1): R14. DOI:10.1186/cc7712 |
| [9] | Werdan K, Oelke A, Hettwer S, et al. Septic cardiomyopathy:hemodynamic quantification, occurrence, and prognostic implications[J]. Clin Res Cardiol, 2011, 100(8): 661-668. DOI:10.1007/s00392-011-0292-5 |
| [10] | Lyon AR, Rees PS, Prasad S, et al. Stress(Takotsubo)cardiomyopathy: a novel pathophysiological hypothesis to explain catecholamine induced acute myocardial stunning[J]. Nat Clin Pract Cardiovasc Med, 2008, 5(1): 22-29. DOI:10.1038/ncpcardio1066 |
| [11] | Yip G, Wang M, Zhang Y, et al. Left ventricular long axis function in diastolic. heart failure is reduced in both diastole and systole:time for a redefinition?[J]. Heart, 2002, 87(2): 121-125. DOI:10.1136/heart.87.2.121 |
| [12] | Nikitin NP, Loh PH, De Silva Rd, et al. Prognostic value of systolic mitral annular velocity measured with Doppler tissue imaging in patients with chronic heart failure caused by left ventricular systolic dysfunction[J]. Heart, 2006, 92(6): 775-779. DOI:10.1136/hrt.2005.067140 |
| [13] | Hosokawa K, Su F, Taccone FS, et al. Esmolol administration to control. Tachycardia in an ovine model of peritonitis[J]. Anesth Analg, 2017, 125(6): 1952. DOI:10.1213/ANE.0000000000002196 |
| [14] | Cheitlin MD, Armstrong WF, Aurigemma GP, et al. ACC/AHA/ASE 2003 guideline update for the clinical application of echoca rdiography: summary article: a report of the American College of Cardiology/American Heart Association Task Force on Practice Guidelines (ACC/AHA/ASE Committee to Update the 1997 Guidelines for the ClinicalApplication of Echocardiography)[J]. Circulation, 2003, 108(9): 1146-1162. DOI:10.1161/01.CIR.0000073597.57414.A9 |
| [15] | Wei C, Louis H, Schmitt M, et al. Effects of low doses of esmolol on cardiac and vascular function in experimental septic shock[J]. Crit Care, 2016, 20(1): 407. DOI:10.1186/s13054-016-1580-2 |
| [16] | Khwannimit B. Serial evaluation of the MODS, SOFA and LOD scores to predict ICU mortality in mixed critically ill patients[J]. J Med Assoc Thai, 2008, 91(9): 1336-1342. DOI:10.1186/s13054-016-1580-2 |
 2019, Vol. 28
2019, Vol. 28




