氧疗是治疗呼吸衰竭和危重症患者的主要手段之一,但长时间吸入高浓度氧气会导致组织细胞发生氧化应激、进而引起瀑布式炎症反应以及细胞凋亡,诱发急性肺损伤(hyperoxia-induced acute lung injury, HALI)[1],成为近些年国内外学者研究的热点。研究表明给予拟胆碱药物或刺激迷走神经可以抑制全身或局部的炎症反应,即“胆碱能抗炎通路(cholinergic anti-inflammatory pathway, CAP)”[2-3]。另有研究证明炎性介质TLR4和NF-κB在ALI中发挥重要作用, 抑制TLR4和NF-κB的表达可以减轻急性肺损伤[4-5]。然而,TLR4和NF-κB在HALI中的作用以及关系尚不清楚,激活CAP通路是否可以抑制两者的表达,从而较好地控制HALI炎症反应也仍未被阐明。本研究通过卡巴胆碱(carbachol,Carba)激活CAP,观察肺组织TLR4和NF-κB以及炎症因子HMGB-1、TNF-α的表达水平,以期探讨卡巴胆碱对HALI的保护作用以及TLR4、NF-κB在CAP中的作用机制。
1 材料与方法 1.1 主要试剂与仪器卡巴胆碱(美国Sigma公司); 蛋白定量试剂盒(上海翊圣生物科技有限公司); 兔抗鼠TLR4、NF-κB p65抗体(美国CST公司); TRIzol试剂、逆转录试剂盒(日本Takara公司); SYBR Green(美国Life公司); 化学发光成像仪(北京赛智创业科技有限公司); qPCR仪(美国ABI公司)。
1.2 实验动物分组及模型制备健康雄性ICR小鼠32只,体质量18~22 g(山西医科大学实验动物中心提供,清洁级),按照随机数字表法分为4组,每组8只:对照组、高氧暴露3 d组(HO3d组)、高氧暴露3 d+Carba组(HO3d+Carba组)和Carba组。对照组小鼠呼吸室内空气; HO3d组置于安装有测氧仪(深圳沃赛特科技DR70c-O2)的密闭氧气舱,持续3 d吸入高浓度氧(95%以上); HO3d+Carba组同时给予上述两种干预措施,即腹腔注射卡巴胆碱[100 μg/(kg·d)]后置于氧气舱内吸入高浓度氧(95%以上); Carba组给予腹腔注射卡巴胆碱[100 μg/(kg·d)],呼吸室内空气。
1.3 标本的收集与制备3 d后腹腔注射10%水合氯醛0.2 mL麻醉并处死小鼠,处置方法符合动物伦理学标准。迅速开胸分离取出肺脏,用生理盐水进行冲洗,肉眼观察肺脏形态学改变。取右肺下叶置于4%多聚甲醛固定,待光镜下观察肺组织病理学改变; 取左肺及剩余右肺-80 ℃冻存,待行Western-blot、RT-PCR检测。
1.4 肺组织的病理学观察常规石蜡包埋、切片,HE染色,光镜下观察各组小鼠肺组织病理学改变。
1.5 肺组织TLR4、NF-κB p65蛋白表达的测定采用Western-blot检测肺组织TLR4、NF-κB p65蛋白表达水平。提取肺组织蛋白,BCA法检测样本蛋白浓度; 将提取的蛋白100 ℃加热变性5 min,上样进行电泳后湿转至PVDF膜2 h; 5%脱脂奶粉室温封闭2 h,稀释一抗孵育膜4 ℃过夜(β-actin 1:4 000,TLR4 1:1 000,NF-κB p65 1:1 000),TBST洗膜,室温孵育二抗2 h,TBST再次洗膜; 将ECL化学发光液均匀滴于膜上,用化学发光成像仪显影曝光; 应用Image J软件进行结果分析,以目的蛋白条带/β-actin蛋白条带的灰度值作为该蛋白的相对表达水平。
1.6 肺组织HMGB-1、TNF-αmRNA表达水平测定采用RT-PCR检测肺组织HMGB-1、TNF-αmRNA表达水平。操作步骤严格按试剂盒说明书进行。引物设计参照Genebank,目的基因序列编码区采用Primer Premier 5.0软件完成,由华大基因公司合成,小鼠β-actin正向引物序列:CCCATCTACGAGGGCTAT,反向引物序列:TGTCACGCACGATTTCC; 小鼠TNF-α正向引物序列:TCTCATTCCTGCTTGTGG,反向引物序列:ACTTGGTGGTTTGCTACG; 小鼠HMGB-1正向引物序列:GCTGACAAGGCTCGTTATG,反向引物序列:CTTTGATTTTGGGGCGGTA。反应体系20 μL; 扩增条件:50 ℃ 2 min,95 ℃ 10 min,95 ℃ 15 s,60 ℃ 1 min, 反应40个循环,由ABI-7300系统执行。以β-actin为内参照,计算HMGB-1、TNF-α的相对表达量,采用2-△△Ct表示。
1.7 统计学方法采用SPSS 20.0软件进行统计学分析,GrapPad Prism 5.0软件作图,所有实验数据用均数±标准差(Mean±SD)表示, 多组间比较采用单因素方差分析,组间两两比较采用LSD-t检验,以P < 0.05为差异有统计学意义。
2 结果 2.1 肺组织的病理学变化(1) 肉眼观(图 1):对照组和Carba组小鼠肺组织新鲜粉嫩,无明显异常改变; HO3d组肺组织有多处大面积出血点,肺组织水肿; HO3d+Carba组肺组织较HO3d组出血及水肿均明显减轻。
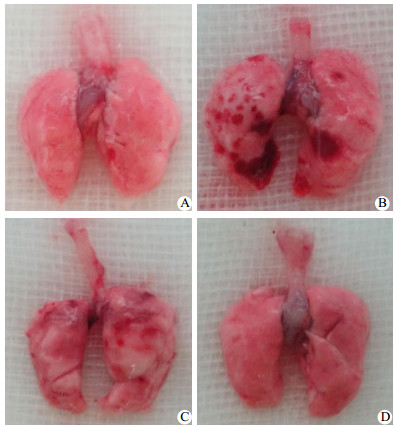
|
| A:对照组肉眼观肺脏粉嫩,无明显损伤;B:HO3d组肉眼观肺脏表面多处大片出血点,肺组织水肿;C:HO3d+Carba组肉眼观肺脏表面散在出血点,肺组织稍水肿;D:Carba组肉眼观肺脏无明显损伤 图 1 各组肺组织肉眼观察情况 Figure 1 Visual observation of lung tissue in each group |
|
|
(2) 光镜观察(图 2):对照组和Carba组肺组织结构完整,无肺间质水肿及炎症细胞浸润; HO3d组小鼠肺组织肺间质明显水肿,肺泡腔大量出血,肺组织结构明显被破坏,伴大量炎症细胞浸润; HO3d+Carba组肺间质轻度水肿,肺泡腔少量出血,轻度炎症细胞浸润。
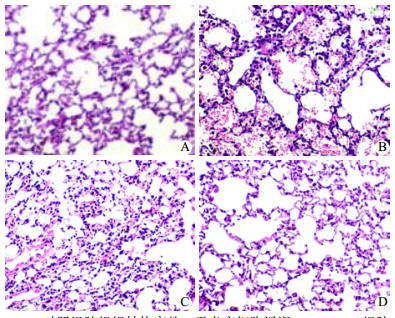
|
| A:对照组肺组织结构完整,无炎症细胞浸润;B:HO3d组肺泡腔大量出血,肺间质水肿,伴大量炎症细胞浸润,肺组织结构破坏;C:HO3d+Carba组肺泡腔少量出血,肺间质轻度水肿,少量炎症细胞浸润;D:Carba组肺组织结构无明显异常损伤 图 2 光镜下HE染色的各组肺组织切片(×400) Figure 2 HE staining of lung tissue sections of each group under light microscope (×400) |
|
|
如图 3所示,HO3d组和HO3d+Carba组小鼠肺组织TLR4(分别为0.83±0.06和0.60±0.04)和NF-κB p65(分别为0.83±0.05和0.54±0.04)表达量明显高于对照组(分别为0.35±0.02和0.41±0.02)和Carba组(分别为0.37±0.03和0.39±0.03),均P < 0.01;HO3d+Carba组小鼠肺组织TLR4、NF-κB p65蛋白的表达量明显低于HO3d组(P < 0.01),Carba组和对照组比较差异无统计学意义(分别为P=0.558和P=0.574)。
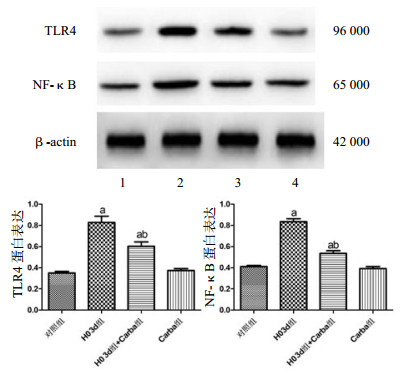
|
| 1:对照组;2:HO3d组;3:HO3d组+Carba组;4:Carba组; 与对照组比较,aP < 0.01;与HO3d组比较,bP < 0.01 图 3 Western blot检测各组小鼠肺组织TLR4、NF-κB p65蛋白的表达结果 Figure 3 Western blot analysis of TLR4 and NF-κB p65 protein expression in lung tissues of mice |
|
|
如表 1所示,HO3d组和HO3d+Carba组小鼠肺组织HMGB-1(分别为3.39±0.14和2.11±0.22)和TNF-αmRNA(分别为5.70±0.58和3.86±0.71)表达量明显高于对照组(分别为1.21±0.23和1.57±0.54)和Carba组(分别为1.17±0.20和1.64±0.36),均P < 0.01;HO3d+Carba组小鼠肺组织HMGB-1、TNF-αmRNA的表达量明显低于HO3d组(P < 0.01),Carba组和对照组比较差异无统计学意义(分别为P=0.819和P=0.878)。
| 组别 | HMGB-1 mRNA | TNF-αmRNA |
| 对照组 | 1.21±0.23 | 1.57±0.54 |
| HO3d组 | 3.39±0.14a | 5.70±0.58a |
| HO3d+Carba组 | 2.11±0.22ab | 3.86±0.71ab |
| Carba组 | 1.17±0.20 | 1.64±0.36 |
| 注:与对照组比较,aP < 0.01;与HO3d组比较,bP < 0.01。 | ||
吸入高浓度氧或高压氧在治疗ICU及严重呼吸衰竭的患者中起着不可替代的作用,但高浓度氧持续吸入反而会诱发肺损伤,成为近些年的研究热点。本研究结果显示,高氧暴露3 d小鼠即发生肺组织水肿、肺泡腔出血、肺间质炎症细胞浸润等病理学改变,称之为HALI。多项研究证实,炎症反应失控是HALI的主要原因之一,HALI可以诱导表达TNF-α、IL-6、HMGB-1等多种炎症因子,其具体机制仍有待研究阐明[6-8]。
2000年,Nature杂志上首次提出了“胆碱能抗炎通路”[9],这为临床上控制炎症反应提供了新的思路。该通路通过兴奋迷走神经释放Ach作用于α7-烟碱型乙酰胆碱受体,进而抑制炎症反应,相比体液调节更加迅速、准确。有文献指出,CAP调节通路可能会成为炎症性肺病一个新的治疗靶点[10],但其在HALI中是否起作用,目前尚不清楚。卡巴胆碱是一种胆碱能受体激动剂,它的作用与生理性的Ach非常相似,可以作为拟胆碱药激活CAP通路。本课题组在前期实验中已成功建立小鼠HALI模型[11-12],本研究通过卡巴胆碱作用于高氧诱导小鼠,发现注射卡巴胆碱后,HALI小鼠肺组织损伤减轻,HMGB-1、TNF-α炎症因子释放明显少于HALI小鼠,提示卡巴胆碱可以通过CAP途径减轻HALI的炎症反应,但其具体机制尚未明确。
TLR4是一类跨膜信号蛋白,其胞内域TIR(Toll/interleukin-1 receptor)区域可以和内源性配体结合通过髓样分化因子(myeloid differentiation factor88, MyD88)依赖的信号转导途径激活NF-κB通路,促进炎症因子的表达和炎症级联瀑布反应[13]。研究证实TLR4/NF-κB信号通路在急性肺损伤中调控炎症因子的释放,发挥重要作用[4-5]。但其在HALI中作用是否明确以及其在CAP通路中是否有影响,目前尚不明确。
本研究通过卡巴胆碱拟激活CAP通路作用于HALI小鼠来观察其保护作用及探究其机制。结果表明,吸入高氧可显著上调肺组织TLR4、NF-κB的表达,进而促进炎症因子HMGB-1、TNF-α的释放,导致肺组织炎性损伤; 卡巴胆碱干预后,肺组织病理学损伤减轻,同时肺组织TLR4和NF-κB的表达、HMGB-1和TNF-αmRNA的表达量显著降低。这说明卡巴胆碱对HALI有保护作用,其机制可能为CAP的激活抑制了TLR4/NF-κB信号通路,进而降低了HMGB-1、TNF-α等炎症因子的表达,减轻了HALI炎性反应。也有研究证实,TLR4作为细胞膜上的模式识别受体,可以被内源性的HMGB-1配体所激活,随后触发下游信号转导通路,进而正反馈维持、放大炎症反应,TLR4-HMGB1可能是炎症反应的中心环节[14-15]。
综上所述,HALI的发生是多因素参与的复杂过程,本研究证实卡巴胆碱可以通过CAP早期抑制炎性反应,在HALI中发挥保护作用; 但也有研究提出,阻断CAP通路既不改变也不加重全身的炎性反应[16]。究竟是何起点、何环节导致HALI失控性炎症反应,仍有待进一步探索,其具体机制以及关键性治疗靶点仍需深入研究完善。
| [1] | Narala VR, Fukumoto J, Hernández-Cuervo H, et al. Akap1 genetic deletion increases the severity of hyperoxia-induced acute lung injury in mice[J]. Am J Physiol Lung Cell Mol Physiol, 2018, 314(5): L860-870. DOI:10.1152/ajplung.00365.2017 |
| [2] | Martelli D, McKinley MJ, McAllen RM. The cholinergic anti-inflammatory pathway: a critical review[J]. Auton Neurosci, 2014, 182(5): 65-69. DOI:10.1016/j.autneu.2013.12.007 |
| [3] | Zila I, Mokra D, Kopincova J, et al. Vagal-immune interactions involved in cholinergic anti-inflammatory pathway[J]. Physiol Res, 2017, 66(Suppl 2): S139-145. |
| [4] | Deng GM, He H, Chen Z, et al. Lianqinjiedu decoction attenuates LPS-induced inflammation and acute lung injury in rats via TLR4/NF-κB pathway[J]. Biomed Pharmacother, 2017, 96(12): 148-152. DOI:10.1016/j.biopha.2017.09.094 |
| [5] | Zhang TZ, Wang SM. Esculin Inhibits the Inflammation of LPS-Induced Acute Lung Injury in Mice Via Regulation of TLR/NF-κB Pathways[J]. Inflammation, 2015, 38(4): 1529-1536. DOI:10.1007/s10753-015-0127-z |
| [6] | Dias-Freitas F, Metelo-Coimbra C, Roncon-Albuquerque R Jr. Molecular mechanisms underlying hyperoxia acute lung injury[J]. Respir Med, 2016, 119(10): 23-28. DOI:10.1016/j.rmed.2016.08.010 |
| [7] | Yao L, Shi YY, Zhao XY, et al. Vitamin D attenuates hyperoxia-induced lung injury through downregulation of Toll-like receptor 4[J]. Int J Mol Med, 2017, 39(6): 1403-1408. DOI:10.3892/ijmm.2017.2961 |
| [8] | Hummler JK, Dapaah-Siakwan F, Vaidya R, et al. Inhibition of rac1 signaling downregulates inflammasome activation and attenuates lung injury in neonatal rats exposed to hyperoxia[J]. Neonatology, 2017, 111(3): 280-288. DOI:10.1159/000450918 |
| [9] | Borovikova LV, Ivanova S, Nardi D, et al. Role of vagus nerve signaling in CNI-1493-mediated suppression of acute inflammation[J]. Auton Neurosci, 2000, 85(1/3): 141-147. DOI:10.1016/S1566-0702(00)00233-2 |
| [10] | Yamada M, Ichinose M. The cholinergic anti-inflammatory pathway: an innovative treatment strategy for respiratory diseases and their comorbidities[J]. Curr Opin Pharmacol, 2018, 40(1): 18-25. DOI:10.1016/j.coph.2017.12.003 |
| [11] | 申慧青, 曹大伟, 侯明霞, 等. 小窝蛋白-1在高氧诱导小鼠急性肺损伤中的作用[J]. 中华结核和呼吸杂志, 2017, 40(10): 788-790. DOI:10.3760/cma.j.issn.1001-0939.2017.10.020 |
| [12] | 孟辉, 曹大伟, 刘超锋, 等. Bruton酪氨酸激酶和核因子-κB在高氧诱导肺损伤中的作用[J]. 中华急诊医学杂志, 2017, 26(2): 181-185. DOI:10.3760/cma.j.issn.1671-0282.2017.02.012 |
| [13] | Yan ZQ. Regulation of TLR4 expression is a tale about tail[J]. Arterioscler Thromb Vasc Biol, 2006, 26(12): 2582-2584. DOI:10.1161/01.ATV.0000250933.92917.dd |
| [14] | Reino DC, Pisarenko V, Palange D, et al. Trauma hemorrhagic shock-induced lung injury involves a gut-lymph-induced TLR4 pathway in mice[J]. PLoS One, 2011, 6(8): e14829. DOI:10.1371/journal.pone.0014829 |
| [15] | Tumurkhuu G, Dagvadorj J, Jones HD, et al. Alternatively spliced myeloid differentiation protein-2 inhibits TLR4-mediated lung inflammation[J]. J Immunol, 2015, 194(4): 1686-1694. DOI:10.4049/jimmunol.1402123 |
| [16] | Plaschke K, Do T, Uhle F, et al. Ablation of the right cardiac vagus nerve reduces acetylcholine content without changing the inflammatory response during endotoxemia[J]. Int J Mol Sci, 2018, 19(2): 442. DOI:10.3390/ijms19020442 |
 2019, Vol. 28
2019, Vol. 28




