2 浙江省人民医院,杭州医学院附属人民医院麻醉科 310014;
3 中山大学附属第一医院急诊科 广州,510080
2 Department of Anesthesiology, Zhejiang Provincial People's Hospital, People's Hospital of Hangzhou Medical College, Hangzhou 310014, China;
3 Emergency Department, the First Affiliated Hospital of Sun Yat-sun University, Guangzhou 510080, China
随着心肺复苏(cardio-pulmonary resuscitation, CPR)技术的普及和发展,心脏骤停(cardiac arrest, CA)患者自主循环恢复(restoration of spontaneous circulation, ROSC)率明显提高,但在多数国家和地区患者出院存活率仍不足10%[1-2]。复苏后心功能不全(post resuscitation myocardial dysfunction, PRMD)发生率高达45%~60%,会加剧血流动力学障碍、加重脑缺血损伤,是ROSC后患者早期死亡的重要原因[3-4]。PRMD病理机制不同于心肌梗死后心肌坏死和重构引起的心功能障碍[5],本文拟对CA/ROSC后心肌损伤的特点进行研究。
1 材料与方法 1.1 动物准备本实验获中山大学动物伦理委员会批准。42只健康成年雄性Wistar大鼠,体质量300~350 g,由中山大学实验动物中心提供。动物购入后在SPF级动物房饲养1周,实验前12 h禁食不禁水。动物麻醉采用戊巴比妥钠(Sigma公司,美国)30 mg/kg腹腔内注入,酌情给予1/3的首剂量维持麻醉状态。
1.2 动物分组随机数字法将大鼠随机分为4组,分别是复苏后(post-resuscitation, PR)4 h组、PR 24 h组、PR 48 h组(均n=12)及假手术组(sham,n=6)。
1.3 手术操作及建立大鼠CA模型麻醉成功后,以14 G鞘管经口气管插管,接小动物呼吸机(Harvard Apparatus, 美国),通气频率70次/min,潮气量12 mL/kg。连续Ⅱ导联心电监护,解剖分离股动静脉,24 G留置针穿刺,静脉管用于给药,动脉管监测动脉血压。4通道生理信号采集分析系统(SantaBarbara, 美国)记录血压、心电信息。调整电热毯温度使肛温维持在(36.5±0.5)℃。采用经皮电刺激心外膜诱发室颤建立大鼠CA模型[6],室颤持续6 min后进行CPR,纯氧机械通气,通气频率70次/min,同时进行胸外按压,按压频率200次/min,按压深度为胸廓前后径1/3,2 min后进行除颤,每3 min予0.02 mg/kg肾上腺素静推,如此周而复始直至ROSC。ROSC定义为平均动脉压(mean arterial pressure,MAP) > 60 mmHg(1 mmHg=0.133 kPa)并持续10 min以上,复苏10 min无效者放弃复苏。
1.4 术后监测与取材术后监测并机械通气至ROSC 2~3 h,动物拔管回笼。各组动物分别于ROSC 4 h、24 h和48 h行超声心动图(VISUALSONICS Vevo2100,加拿大)检测射血分数(ejection fraction, EF)、心输出量(cardiac output, CO)、舒张期左室后壁(diastole left ventricular posterior wall, LVPWd)和舒张末左室容量(end-diastolic volume, EDV),PET/CT(Siemens Inveon,德国)检测最大标准化摄取值(maxmum standardized uptake value, SUVmax)均值,后安乐死(过量麻醉)剪取心脏,取左心室组织按线粒体提取试剂盒(北京普利莱)步骤提取心肌线粒体。
1.5 PET/CT检查经股静脉置管注入18F-FDG(4.25 MBq/kg),注射后40 min开始扫描。PET图像以三维有序子集最大期望值法(OSEM-3D)重建。以IRW4.1软件对大鼠心尖部、左室前壁及左室后壁对感兴趣区域(region of interest, ROI)进行勾画,勾画直径为3 mm圆形区域。心肌摄取FDG值取心尖、左室前后壁SUVmax均值,SUV=感兴趣区域峰值kBq/mL/(注射放射性强度×体质量克重)。以SUVmax值反映葡萄糖代谢水平[7]
1.6 线粒体通透性转换孔开放程度的测定以文献报道的方法,线粒体通透转换孔(mitochondrial permeability transition pore, MPTP)的开放采用分光光度计法测定,以线粒体于540 nm处吸光度下降程度间接反映MPTP的开放程度[8]。线粒体加入测定介质(125 mmol/L蔗糖,50 mmol/L KCl,2 mmol/L KH2PO4,10 mmol/L HEPES)内调整线粒体浓度(0.5 mg/mL)制备线粒体反应体系,加入CaCl2(200 μmol/L)诱发线粒体肿胀,每分钟记录吸光度值直至吸光度不再减少(约10 min)。
1.7 线粒体膜电位(mitochondrial membrane potential, MMP)的测定采用JC-1探针(线粒体膜电位检测试剂盒,碧云天),荧光酶标仪(BioTek,美国)检测心肌细胞线粒体膜电位。在线粒体膜电位高时,JC-1聚集在线粒体的基质中形成聚合物,产生红色荧光;而在线粒体膜电位低时JC-1不能聚集,此时JC-1为单体,产生绿色荧光。详细步骤按照试剂盒说明书进行,以红绿荧光的相对比例来反映线粒体膜电位高低。
1.8 心肌超微结构的观察取3 mm×3 mm×1 mm心尖部组织于2.5%戊二醛溶液中固定,修剪成约1 mm×1 mm×1 mm组织块,常规脱水、浸透、包埋、染色后制成80 nm的超薄切片,电镜(JEOL JEM-1400,日本)下观察心肌组织超微结构。
1.9 统计学方法采用SPSS 13.0软件包进行统计分析,计量资料以均数±标准差(Mean±SD)表示,并进行正态性检验。多组间比较采用单因素方差分析,多样本均数的两两比较采用LSD-t检验;非参数的多组间比较采用Kruskal-Wallis H检验,以P < 0.05为差异有统计学意义。
2 结果 2.1 基本生理参数及复苏指标各组动物体质量、心率和MAP基线值比较,差异无统计学意义(P > 0.05,表 1);各实验组动物CPR时间、除颤次数、肾上腺素用量及ROSC率的比较,差异无统计学意义(P > 0.05)。PR 4 h组、PR 24 h组和PR 48 h组各有1只、2只及4只大鼠未存活至观察时间点。
| 指标 | sham组 (n=6) |
PR 4 h组 (n=12) |
PR 24 h组 (n=12) |
PR 48 h组 (n=12) |
| 体质量(g) | 330±14 | 326±17 | 326±13 | 329±15 |
| 心率(次/min) | 407±18 | 404±21 | 401±17 | 407±20 |
| MAP(mmHg) | 89±14 | 92±13 | 90±12 | 90±10 |
| CPR时间(s) | - | 267±166 | 252±127 | 244±132 |
| 除颤次数(次) | - | 2±1 | 2±1 | 2±1 |
| 肾上腺素(μg) | - | 14±7 | 14±6 | 12±5 |
| ROSC率(只) | - | 10 | 11 | 11 |
| 存活(只) | 6 | 9 | 9 | 7 |
PR 4 h组大鼠EF值较sham组显著下降(P < 0.01,图 1),PR 24 h及PR 48 h组大鼠EF值与sham组比较差异无统计学意义(均P > 0.05);PR 4 h及PR 24 h组大鼠CO较sham组均显著下降(均P < 0.01),且PR 24 h组高于PR 4 h组(P < 0.01),但PR 48 h组与sham组比较差异无统计学意义(P > 0.05);PR 4 h及PR 24 h组大鼠LVPWd较sham组均显著增厚(均P < 0.01),PR 48 h组与sham组比较差异无统计学意义(P > 0.05);PR 4 h及PR 24 h组大鼠EDV较sham组均显著变小(均P < 0.05),PR 48 h组与sham组比较差异无统计学意义(P > 0.05)。
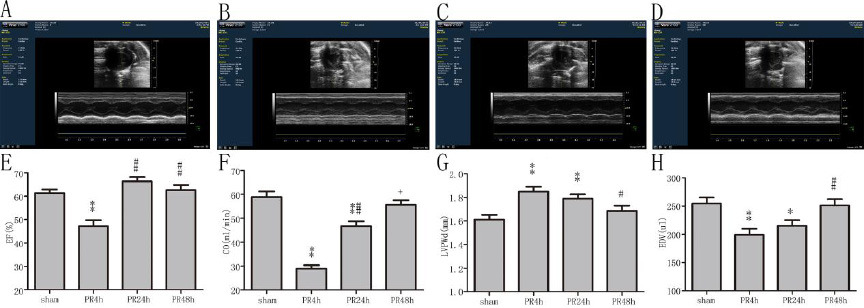
|
| A:sham组(n=6);B:PR 4 h组(n=9);C:PR 24 h组(n=9);D:PR 48 h组(n=7);E:EF值的比较;F:CO的比较;G:LVPWd的比较;H:EDV的比较;与sham组比较,aP < 0.05和bP < 0.01;与PR 4 h组比较,cP < 0.05和dP < 0.01;与PR 24 h组比较,eP < 0.05 图 1 各组动物射血分数、心输出量、舒张期左室后壁和舒张末左室容量的比较 Figure 1 Comparison of EF, CO, LVPWd and EDV among groups |
|
|
PR 4 h及PR 24 h组大鼠心肌SUVmax较sham组均显著升高(均P < 0.01,图 2),PR 24 h组低于PR 4 h组(P < 0.01),PR 48 h组与sham组比较差异无统计学意义(P > 0.05)。
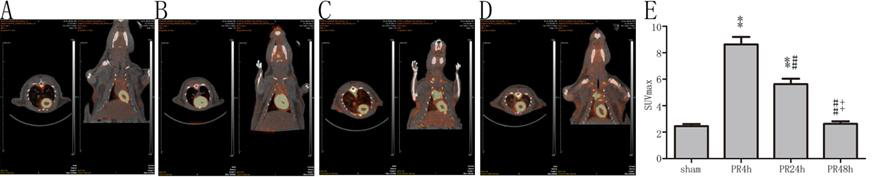
|
| A:sham组(n=6);B:PR 4 h组(n=9);C:PR 24 h组(n=9);D:PR 48 h组(n=7);E:SUVmax的比较;与sham组比较,aP < 0.01;与PR 4 h组比较,bP < 0.01;与PR 24 h组比较,cP < 0.01 图 2 各组大鼠心肌葡萄糖代谢 Figure 2 Myocardial glucose metabolism of rats in each group |
|
|
加入氯化钙诱发线粒体肿胀后,各组线粒体在540 nm处吸光度均有下降,PR 4 h及PR 24 h组吸光度下降值均高于sham组(均P < 0.01,图 3),PR 24 h组较PR 4 h组下降程度减轻(P < 0.01),PR 48 h组与sham组比较差异无统计学意义(P > 0.05);PR 4 h及PR 24 h组大鼠心肌MMP较sham组均显著下降(均P < 0.05),PR 24 h组高于PR 4 h组(P < 0.05),PR 48 h组与sham组比较差异无统计学意义(P > 0.05)。
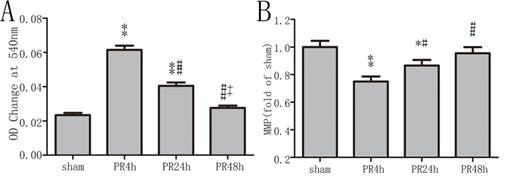
|
| A:MPTP开放程度的比较;B:MMP的比较;与sham组比较,aP < 0.05和bP < 0.01;与PR 4 h组比较,cP < 0.05和dP < 0.01;与PR 24 h组比较,eP < 0.05 图 3 各组大鼠间MPTP开放程度及MMP的比较 Figure 3 Comparison of MPTP and MMP in each group |
|
|
透射电镜下见,sham组心肌肌原纤维排列有序、Z线明显,线粒体基质致密、嵴排列浓密(图 4);PR 4 h组及PR 24 h组肌原纤维结构形态正常、Z线稍有模糊,线粒体肿胀、基质疏松、嵴排列稀疏,但线粒体被膜完整;PR 48 h组心肌超微结构与sham组相仿。

|
| A:sham组;B:PR 4 h组;C:PR 24 h组;D:PR 48 h组 图 4 电镜下心肌超微结构 Figure 4 Ultrastructure of myocardium under electron microscope |
|
|
PRMD在ROSC后数分钟即可发生,左室收缩舒张功能均受损,可引起心源性休克进而导致多脏器功能衰竭,这种早期发生的、严重的心功能障碍,可在ROSC后数天至数周内完全恢复[9-10]。Kern等[11]发现在猪的CA模型中,复苏后数小时内EF值、每搏输出量(SV)明显下降,但心功能在复苏后48 h可完全恢复。Laurent等[12]研究显示,对于CA复苏成功的患者,血流动力学不稳定主要表现在ROSC后4~7 h内,表现为心输出量明显降低,而在ROSC 24 h后患者的CO会迅速升高,72 h左右可恢复至正常水平。本研究的6 min CA模型中,ROSC 4 h时心脏收缩舒张功能均明显下降,但48 h时可恢复至正常水平,这也与之前研究中PRMD特点相符[9-12]。这种暂时性心功能障碍提示CA/ROSC后心肌损伤非持续性的损伤或梗死。
越来越多的研究证实MPTP在发生心功能障碍和细胞死亡的过程中发挥重要作用,MPTP开放状态决定细胞的生死存亡[13]。在可逆性损伤的情况下,MPTP一过性开放,活性氧簇(reactive oxygen species, ROS)过量产生、钙超载引起心肌代谢及功能障碍[14]。若损伤加重,MPTP持续性开放,MMP崩塌、线粒体肿胀破裂,最终引起细胞凋亡或坏死[15]。本研究中,ROSC 4 h时MPTP明显开放、MMP下降,但在48 h时已恢复至正常水平。ROSC 4 h及24 h电镜下见心肌线粒体肿胀、脊稀疏,但结构完整。MPTP一过性开放及心肌超微结构完整也说明心肌的损伤为可逆性。
生理情况下,心肌能量主要来自脂肪酸和葡萄糖代谢,受损心肌脂肪酸代谢下降,而葡萄糖代谢明显增强[16]。Mcnulty等[17]在心肌缺血模型中发现受损心肌葡萄糖代谢为正常心肌的6.6倍;有研究者认为受损心肌对葡萄糖的偏爱是因为葡萄糖产能耗氧更少[18];也有研究者认为葡萄糖酵解增强、产生的能量用以促进内质网对钙的转移、减轻钙超载[19]。本研究的CA模型中,ROSC 4 h心肌葡萄糖代谢为正常心肌5倍,而在48 h时已降至正常水平,ROSC后心肌葡萄糖代谢增强可能是心肌代谢受损、能量产生障碍的代偿反应。
综上所述,本研究证实CA/ROSC后发生PRMD,但ROSC后48 h受损的心功能可完全恢复,其原因可能与心肌损伤为可逆性、线粒体结构功能逐渐恢复有关。然而,本研究采用CA 6 min模型、仅对ROSC后的3个时间点进行研究,有一定局限性。更深入地探讨PRMD的病理机制及心肌损伤特点,将有助于对CA患者进行更好的救治。
| [1] | Lee SY, Song KJ, Shin SD, et al. A disparity in outcomes of out-of-hospital cardiac arrest by community socioeconomic status: A ten-year observational study[J]. Resuscitation, 2018, 126: 130-136. DOI:10.1016/j.resuscitation.2018.02.025 |
| [2] | Shao F, Li CS, Liang LR, et al. Incidence and outcome of adult in-hospital cardiac arrest in Beijing, China[J]. Resuscitation, 2016, 102: 51-56. DOI:10.1016/j.resuscitation.2016.02.002 |
| [3] | Shiyovich A, Gerovich A, Katz A. Early CPR in out-of-hospital cardiac arrest[J]. N Engl J Med, 2015, 373(16): 1572-1574. DOI:10.1056/NEJMc1509059#SA2 |
| [4] | Vancini-Campanharo CR, Vancini RL, Lira C, et al. Cohort study on the factors associated with survival post-cardiac arrest[J]. Sao Paulo Med J, 2015, 133(6): 495-501. DOI:10.1590/1516-3180.2015.00472607 |
| [5] | Cahill TJ, Kharbanda RK. Heart failure after myocardial infarction in the era of primary percutaneous coronary intervention: Mechanisms, incidence and identification of patients at risk[J]. World J Cardiol, 2017, 9(5): 407-415. DOI:10.4330/wjc.v9.i5.407 |
| [6] | 胡春林, 魏红艳, 廖晓星, 等. 兔室颤心搏骤停模型的建立[J]. 中华急诊医学杂志, 2009, 18(9): 943-947. DOI:10.3760/cma.j.issn.1671-0282.2009.09.011 |
| [7] | 吴彩军, 李春盛, 杨军, 等. 窒息心脏骤停动物模型中碳酸氢钠对复苏的影响[J]. 中华急诊医学杂志, 2015, 24(4): 403-407. DOI:10.3760/cma.j.issn.1671-0282.2015.04.015 |
| [8] | 李恒杰, 魏红艳, 邓宇斌, 等. 七氟醚对心脏骤停大鼠心肌保护作用的研究[J]. 中华急诊医学杂志, 2016, 25(1): 28-32. DOI:10.3760/cma.j.issn.1671-0282.2016.01.008 |
| [9] | Chalkias A, Xanthos T. Pathophysiology and pathogenesis of post-resuscitation myocardial stunning[J]. Heart Fail Rev, 2012, 17(1): 117-128. DOI:10.1007/s10741-011-9255-1 |
| [10] | Jentzer J, Chonde MD, Dezfulian C. Myocardial dysfunction and shock after cardiac arrest[J]. Biomed Res Int, 2015, 2015: 314796. DOI:10.1155/2015/314796 |
| [11] | Kern KB, Hilwig RW, Rhee KH, et al. Myocardial dysfunction after resuscitation from cardiac arrest: an example of global myocardial stunning[J]. J Am Coll Cardiol, 1996, 28(1): 232-240. DOI:10.1016/0735-1097(96)00130-1 |
| [12] | Laurent I, Monchi M, Chiche JD, et al. Reversible myocardial dysfunction in survivors of out-of-hospital cardiac arrest[J]. J Am Coll Cardiol, 2002, 40(12): 2110-2116. DOI:10.1016/s0735-1097(02)02594-9 |
| [13] | Kwong JQ, Molkentin JD. Physiological and pathological roles of the mitochondrial permeability transition pore in the heart[J]. Cell Metab, 2015, 21(2): 206-214. DOI:10.1016/j.cmet.2014.12.001 |
| [14] | Bernardi P, von Stockum S. The permeability transition pore as a Ca(2+) release channel: new answers to an old question[J]. Cell Calcium, 2012, 52(1): 22-27. DOI:10.1016/j.ceca.2012.03.004 |
| [15] | Halestrap AP. What is the mitochondrial permeability transition pore?[J]. J Mol Cell Cardiol, 2009, 46(6): 821-831. DOI:10.1016/j.yjmcc.2009.02.021 |
| [16] | Stanley W, Lopaschuk G, Hall J, et al. Regulation of myocardial carbohydrate metabolism under normal and ischaemic conditions. Potential for pharmacological interventions[J]. Cardiovasc Res, 1997, 33(2): 243-257. DOI:10.1016/s0008-6363(96)00245-3 |
| [17] | Mcnulty PH, Jagasia D, Cline GW, et al. Persistent changes in myocardial glucose metabolism in vivo during reperfusion of a limited-duration coronary occlusion[J]. Circulation, 2000, 101(8): 917-922. DOI:10.1161/01.cir.101.8.917 |
| [18] | Tuunanen H, Engblom E, Naum A, et al. Free fatty acid depletion acutely decreases cardiac work and efficiency in cardiomyopathic heart failure[J]. Circulation, 2006, 114(20): 2130-2137. DOI:10.1161/CIRCULATIONAHA.106.645184 |
| [19] | Xu KY, Zweier JL, Becker LC. Functional coupling between glycolysis and sarcoplasmic reticulum Ca 2+ transport[J]. Circ Res, 1995, 77(1): 88-97. DOI:10.1161/01.res.77.1.88 |
 2019, Vol. 28
2019, Vol. 28




