脓毒性休克是ICU患者的主要死亡原因,进一步发展至多器官功能不全综合征(MODS),尽管脓毒症基础和临床研究不断深入,但患者病死率仍居高不下[1]。炎症和氧化应激造成的血管内皮损伤、毛细血管渗漏,是脓毒性休克的核心病理过程。本课题组前期研究发现,严重脓毒症患者血清血管内皮生长因子(vascular endothelial growth factor, VEGF)水平在早期升高,提示血管内皮屏障破坏[2]。完整的内皮屏障由细胞粘附连接(adherent junction, AJ)维持,血管内皮钙黏蛋白(VE-cadherin, VE-Cad)及连环蛋白组成的复合体是维持内皮细胞连接的重要结构。本研究探讨血清VE-Cad在脓毒性休克患者中的动态变化及对预后的判断价值。
1 资料与方法 1.1 一般资料采用前瞻性观察研究,以2016年1月至2017年12月收住天津医科大学第二医院ICU发生脓毒性休克的44例患者为研究对象,诊断标准符合脓毒症3.0指南及2016“拯救脓毒症运动”(SSC)指南[3-4]:脓毒症为宿主对感染的反应失调而致的危及生命的器官功能障碍,脓毒性休克为脓毒症患者经充分容量复苏后仍存在持续性低血压,需血管活性药物维持平均动脉压(MAP)≥65 mmHg(1 mmHg=0.133 kPa)且血清乳酸水平 > 2 mmol/L。同时选取同期25例健康查体者作为对照组;根据28 d预后将脓毒症组分为生存组24例和死亡组20例。脓毒性休克组病种分布情况:下呼吸道感染21例,尿路感染10例,腹腔感染7例,血流感染3例,其他部位感染3例。排除标准:(1)年龄 < 18岁;(2)孕妇;(3)慢性肝肾疾病终末期、肿瘤晚期;(4)甲状腺疾病;(5)严重免疫抑制。本研究符合医学伦理学要求,患者或家属知情同意,并经医院医学伦理委员会批准。
1.2 研究方法记录患者姓名、性别、年龄、原发疾病、住院时间和转归。根据当日最差指标评定急性生理学及慢性健康状况Ⅱ (APACHEⅡ)评分及序贯器官功能衰竭评分(SOFA)。观察入院第1、3、7天血清VE-Cad、血管内皮生长因子(VEGF)、肿瘤坏死因子-α(TNF-α)和白介素-6(IL-6)水平变化。
1.3 临床管理患者治疗按照2016 SSC指南:积极抗感染、液体复苏、血管活性药物[1 μg/(kg·min)]为多巴胺起始剂量,逐渐增加剂量不超过20 μg/(kg·min), 去甲肾上腺素起始剂量为0.05 μg/(kg·min),逐渐增加剂量不超过0.5 μg/(kg·min)、肺保护性机械通气和控制血糖等在内的脓毒症集束化治疗[4]。入院当日行PiCCO监测,每天行3次测量,取平均值作为当日指标,连续记录血管外肺水指数(extravascular lung water index,EVLWI)及其它血流动力学指标,连续监测5 d或至患者死亡。
1.4 生化指标检测方法入院第1、3、7天晨时取血分离血清,-80℃保存集中测定。VE-Cad采用“三明治免疫夹心法”(Human VE Cadherin ELISA Kit, ab210968, Abcam),检测灵敏度为0.331 ng/mL。VEGF测定采用美国ADL公司ELISA试剂盒。TNF-α和IL-6测定采用美国Cusabio公司ELISA试剂盒。以上实验由检验科专业人员完成。
1.5 统计学方法计量资料以均数±标准差(x±s)或中位数及四分位数间距M (IQ)表示。两组间数据采用t检验或Mann-Whitney U检验,计数资料采用χ2检验。相关性分析采用Spearman相关。多点数据的比较采用重复测量资料的方差分析。绘制受试者特征操作曲线(ROC),比较各指标对脓毒性休克患者的预后价值。所有数据均由SPSS 20.0和GraphPad Prism7统计软件完成。以P < 0.05为差异有统计学意义。
2 结果 2.1 一般情况在44例患者中,男24例,女20例,年龄(60.2±10.6)岁。28 d生存24例,死亡20例,病死率45.5%。两组性别、年龄构成差异无统计学意义(P > 0.05)。脓毒症休克组病死率、APACHEⅡ评分和SOFA评分均高于对照组(均P < 0.01)。见表 1。
| 组别 | 性别 (男/女) |
年龄 (岁) |
死亡 (例,%) |
APACHEⅡ 评分 |
SOFA评分 |
| 对照组(n=25) | 13/12 | 55.2±9.8 | 0 | 6.1±1.2 | 2.6±0.5 |
| 脓毒性休克组(n=44) | 24/20 | 60.2±10.6 | 20(45.5) | 27.3±5.6 | 16.7±4.2 |
| t/χ2值 | 0.042 | 1.934 | 16.00 | 18.63 | 16.67 |
| P值 | 0.839 | 0.057 | < 0.01 | < 0.01 | < 0.01 |
| 注:APACHEⅡ为急性生理和慢性健康状况Ⅱ;SOFA为序贯功能衰竭评分 | |||||
入院第1天脓毒性休克组血清VE-Cad、VEGF、TNF-α和IL-6均高于对照组(均P < 0.01)。见表 2。
| 组别 | 例数 | VE-Cad (ng/mL) |
VEGF (ng/mL) |
TNF-α (pg/mL) |
IL-6 (pg/mL) |
| 对照组 | 25 | 0.26±0.05 | 65.46±8.59 | 7.16±1.02 | 5.42±0.42 |
| 脓毒性休克组 | 44 | 3.02±0.18 | 320.88±14.56 | 236.77±23.88 | 77.83±12.16 |
| t值 | 3.275 | 166 | 47.9 | 29.67 | |
| P值 | 0.002 | < 0.01 | < 0.01 | < 0.01 | |
| 注:VE-Cad为VE-钙黏蛋白;VEGF为血管内皮生长因子;TNF-α为肿瘤坏死因子-α;IL-6为白细胞介素-6 | |||||
本研究发现,血清VE-Cad与VEGF、TNF-α和IL-6均正相关(r分别为0.826、0.723和0.870,均P < 0.01)。见图 1。
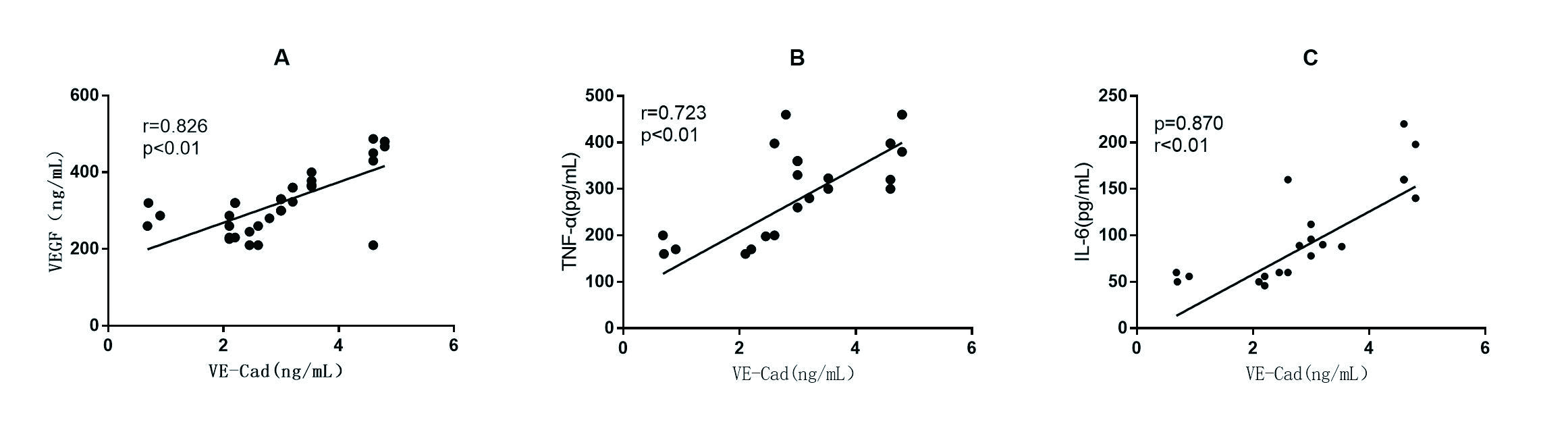
|
| 图 1 血清VE-Cad与VEGF、TNF-α和IL-6的相关性分析 Figure 1 The correlation between serum VE-cadherin and VEGF、TNF-α and IL-6 |
|
|
两组之间年龄、性别构成比、感染部位、病原学情况、ICU住院天数差异无统计学意义;而死亡组的氧合指数(PaO2/FiO2)和ALB低于生存组(P < 0.05),死亡组的EVLWI、乳酸、机械通气时间、7 d液体平衡量、起始血管活性药物剂量、APACHEⅡ评分和SOFA评分均高于生存组(P < 0.05)。见表 3。
| 指标 | 生存组(n=24) | 死亡组(n=20) | 统计值 | P值 |
| 年龄(岁) | 61.3±6.8 | 63.4±7.5 | 0.974 | 0.336 |
| 性别(男/女) | 13/11 | 12/8 | 0.151 | 0.697 |
| 感染部位(例, %) | ||||
| 呼吸道 | 12(50) | 9(45.00) | 0.109 | 0.741 |
| 泌尿道 | 5(20.83) | 5(25.00) | 0.108 | 0.743 |
| 腹腔 | 3(12.5) | 4(20.00) | 0.459 | 0.498 |
| 血流感染 | 2(8.33) | 1(5.00) | 0.191 | 0.662 |
| 其他部位 | 2(8.33) | 1(5.00) | - | - |
| 病原学(例, %) | ||||
| G+菌 | 4(16.67) | 3(15.00) | 0.023 | 0.880 |
| G-菌 | 8(33.33) | 6(30.00) | 0.056 | 0.813 |
| 真菌 | 1(4.17) | 1(5.00) | 0.017 | 0.895 |
| 混合感染 | 3(12.50) | 3(15.00) | 0.058 | 0.810 |
| 不明确 | 8(33.33) | 7(35.00) | - | - |
| PaO2/FiO2(mmHg) | 280.42±18.56 | 210.18±26.50 | 9.98 | 0.000 |
| EVLWI(mL/kg) | 5.72±0.93 | 9.90±3.66 | -5.40 | 0.000 |
| ALB(g/L) | 29.42±4.55 | 24.22±6.77 | 3.033 | 0.004 |
| 乳酸(mmol/L) | 2.62±0.51 | 3.08±0.46 | 3.113 | 0.003 |
| 机械通气时间(h) | 56.43±12.18 | 72.16±19.68 | 5.744 | 0.000 |
| ICU住院天数(d) | 6.92±1.54 | 7.08±1.13 | 0.386 | 0.702 |
| 7d液体平衡量(mL) | 1281.26±423.88 | 2286.57±526.34 | 7.02 | 0.000 |
| 去甲肾上腺素 [μg/(kg·min)] |
0.22±0.03 | 0.46±0.08 | 13.62 | 0.000 |
| 多巴胺 [μg/(kg·min)] |
4.55±0.86 | 10.36±2.48 | 10.75 | 0.000 |
| APACHEⅡ评分 | 26.42±5.4 | 32.51±3.40 | 4.369 | 0.000 |
| SOFA评分 | 8.52±1.28 | 12.26±3.31 | 5.106 | 0.000 |
| 注:PaO2/FiO2为氧分压/吸氧浓度;EVLWI为血管外肺水指数;ALB为白蛋白;APACHEⅡ为急性生理学与慢性健康评分; SOFA为序贯器官功能衰竭评分 | ||||
死亡组1、3和7 d的血清VE-Cad和VEGF水平均高于生存组(均P < 0.01);生存组血清VE-Cad和VEGF水平逐渐向正常水平回落(均P < 0.05),而死亡组血清VE-Cad和VEGF水平均维持在较高水平(P > 0.05)。见图 2。
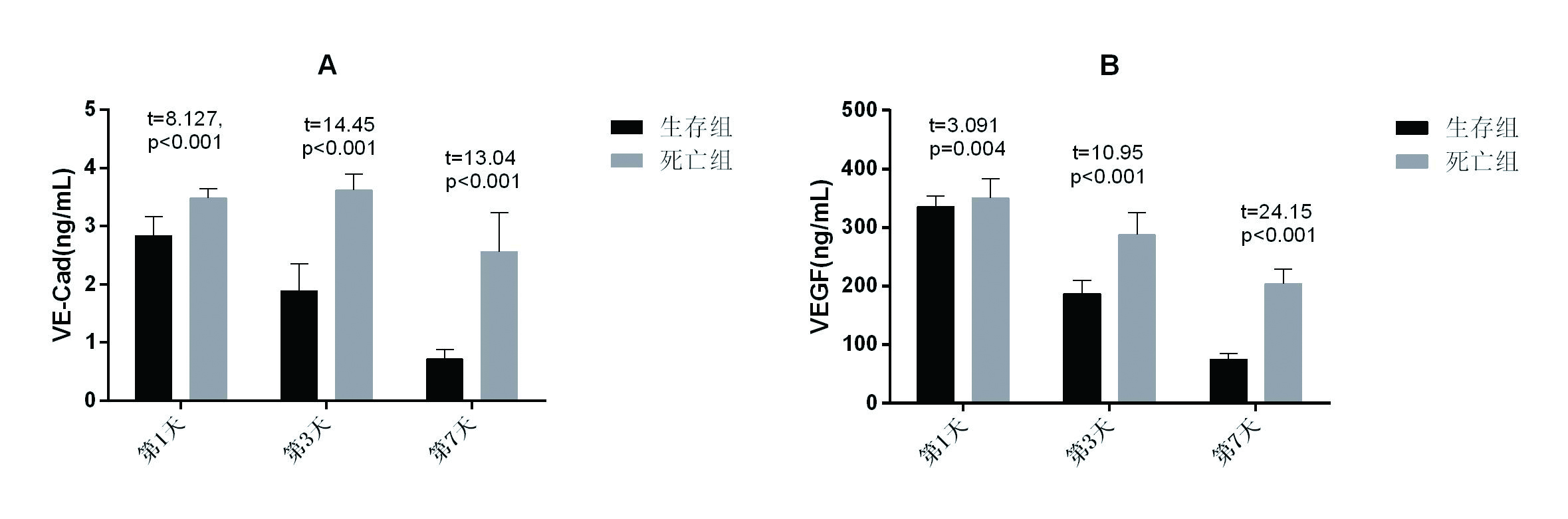
|
| 图 2 生存组和死亡组血清VE-Cad和VEGF的动态变化 Figure 2 The dynamic changes of VE-Cad and VEGF between survival and death groups patients |
|
|
本研究发现,血清VE-Cad与APACHEⅡ评分和SOFA评分均正相关(r分别为0.774、0.723和0.870,均P < 0.01)。见图 3。
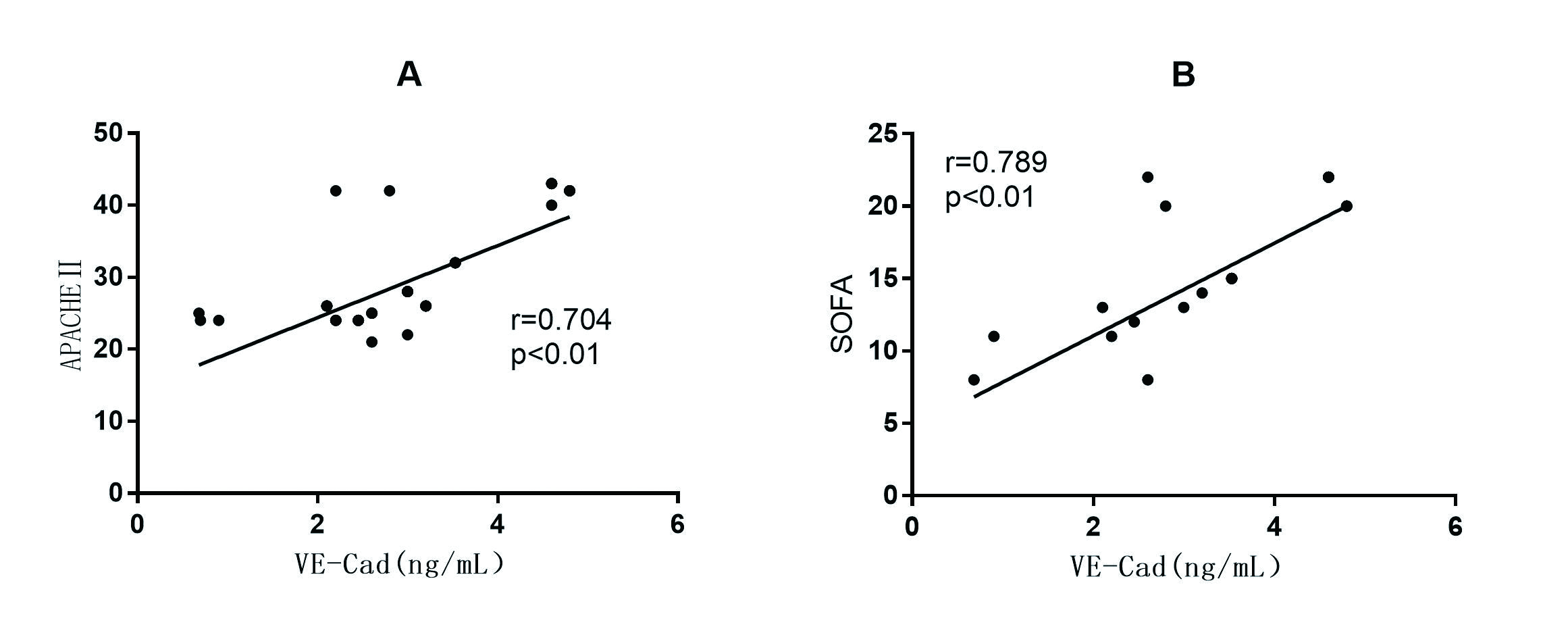
|
| 图 3 血清VE-Cad与APACHEⅡ评分和SOFA的相关性分析 Figure 3 The correlation between serum VE-cadherin and APACHEⅡand SOFA |
|
|
第1天VE-Cad与VEGF、APACHEⅡ评分和SOFA的AUC分别为0.723 (95% CI: 0.568~0.878)、0.7173(95% CI: 0.566~0.868)、0.914(95% CI: 0.831~0.996)和0.868(95% CI: 0.762~0.974)(P < 0.01)。进而对AUC进行比较,得出预测价值VE-Cad=VEGF < APACHEⅡ评分=SOFA。当VE-Cad的截断值为3.100 ng/mL时,其预测脓毒症患者死亡的灵敏度为60%,特异度为70.83%。见图 4。
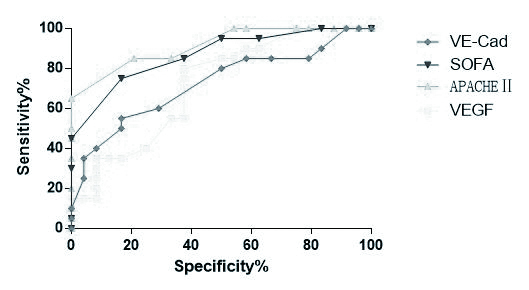
|
| 图 4 VE-Cad与VEGF、APACHEⅡ评分和SOFA判断脓毒症预后的ROC分析 Figure 4 ROC analysis of VE-Cad, VEGF, APACHEⅡand SOFA in predicting sepsis outcome |
|
|
VE -Cad(也称为钙黏蛋白-5,CD144)由5个胞外结构域、1个跨膜结构域和1个高度保守的胞内区尾部组成。VE -Cad在细胞表面形成顺式二聚体,依赖Ca2+介导细胞粘附连接。VE -Cad的胞内结构域与β、γ和P120连环蛋白结合。β和γ连环蛋白进一步与α连环蛋白结合,进而与纤维状肌动蛋白(F-actin)细胞骨架成分相结合,维持细胞粘附的稳定[5]。液体复苏是脓毒性休克的启动环节,但由于血管内皮损伤,液体正平衡会增加病死率[6]。因而研究脓毒性休克中血清VE -Cad水平变化对于判断血管内皮屏障损伤程度、指导液体复苏和评估疾病预后意义重大。
本研究结果显示,脓毒性休克组患者病死率为45.5%。血清VE-Cad和VEGF水平明显高于对照组,表明血管内皮屏障遭到破坏。本课题组前期研究发现,严重脓毒症患者血清VEGF水平在早期升高,其水平与APACHEⅡ评分具有明显正相关性,是影响预后的死亡危险因素之一[2]。脓毒症患者血清VE-Cad水平变化的临床研究较少。Zhang等[7]研究发现,严重脓毒症组可溶性VE-Cad水平明显高于对照组。Flemming等[8]研究同样发现,严重脓毒症和脓毒性休克患者血清VE-Cad水平显著升高。本研究发现,脓毒性休克组血清TNF-α和IL-6水平明显高于健康对照组,血清VE-Cad水平与TNF-α和IL-6具有正相关性。在脓毒症病生理进程中,病原微生物激活TLR4等模式识别受体,TLR4经过髓样分化分子88(MyD88)等一系列信号转导最终激活NF-κB转位入核,继而引起TNF-α、IL-1β、IL-6、一氧化氮(NO)等一系列炎症介质释放,损伤血管内皮,血管屏障完整性破坏,毛细血管渗漏进一步加剧[9]。在炎症进程中,多种细胞因子和炎症介质如VEGF、组胺、缓激肽、TNF-α、血小板活化因子(PAF)和血栓素等都会诱导VE-Cad胞内区尾部和连环蛋白的磷酸化,造成它们解聚,细胞连接破坏,缝隙形成(gap formation),血管通透性增加。在基础研究中,脂多糖对VE -Cad影响的信号通路研究的比较深入。LPS首先激活TLR4,激活炎症瀑布和细胞内信号转导。细胞内Ca2+浓度增加,Rho、PKC和Src等信号通路激活,VE-Cad胞内区尾部和P120连环蛋白磷酸化,连接复合体解聚,内皮屏障通透性增高[10]。Src同时可以激活p21活化激酶,活化的p21活化激酶磷酸化VE-Cad丝氨酸位点导致其内化,细胞间连接受损[11]。
本研究结果显示,脓毒性休克死亡组血清VE-Cad水平明显高于生存组,并且始终维持在较高水平,而生存组血清VE-Cad水平逐渐回落到正常水平;血清VE-Cad水平与危重疾病评分均具有正相关性。ROC分析提示,入院VE-Cad基线水平可以预测脓毒性休克患者不良结局。当VE-Cad的截断值为3.100 ng/mL时,其预测脓毒症患者死亡的灵敏度为60%,特异度为70.83%,但预测价值低于APACHEⅡ评分和SOFA评分。以上均表明血清VE-Cad水平可以反映疾病危重程度,是判断预后的良好指标。本研究同时发现,死亡组血清白蛋白水平、氧合指数均低于生存组,而EVLEI、机械通气时间均高于生存组。在炎症和氧化应激刺激下,VE-Cad与连环蛋白连接遭到破坏,内皮屏障受损,富含白蛋白的液体渗漏到组织间隙,血清白蛋白水平下降;肺泡腔充满了过多的液体,影响肺换气弥散功能,氧合指数下降,机械通气时间延长。由于死亡组血清VE-Cad更高,这表明血管屏障损伤更加严重,液体正平衡发生,而液体正平衡是影响死亡的独立危险因素[6]。液体正平衡增加心脏前负荷,这种机械张力会影响VE-Cad之间的连接,使细胞连接张力下降,细胞间缝隙形成[12],这也是对脓毒性休克患者进行限制性液体复苏的理论基础[13]。VE-Cad水平变化可以为临床液体复苏提供参考信息。
鉴于VE-Cad在维持内皮屏障完整性中的重要性,已有研究把VE-Cad作为内皮屏障修复的靶点。VE-Cad胞内区尾部含有9个酪氨酸磷酸位点,其中Y645、Y658、Y685、Y731和Y733参与维持内皮屏障完整性。Src信号通路激活,造成VE-Cad酪氨酸位点磷酸化是造成内皮屏障受损的主要原因,因而抑制Src信号通路可以减少内皮屏障破坏。Dong等[14]研究发现,氧二十碳三烯酸(EET)可以通过降低Src与GRP78交联和活性氧(ROS)产生,抑制RhoA/ROCK信号通路活化,避免LPS诱导的VE-cad磷酸化,保护了内皮屏障的完整性。除了VE-Cad酪氨酸位点的磷酸化,VE-Cad的内化也是造成内皮屏障功能不全的重要原因[15]。Havovi等[16]应用免疫共定位研究发现,Rab4活化能够快速的使早期内涵体运输到细胞膜表面,从而稳定VE-Cad在内皮细胞表面的表达,减少其内化。
综上,脓毒性休克患者血清VE-Cad水平升高,其水平高低可以反映血管内皮屏障损伤程度,指导液体复苏,并且与疾病危重程度相关。VE-Cad作为内皮屏障修复的靶点具有广阔前景。本研究存在一定局限性,首先,本研究是单中心、小样本研究,研究例数较少;其次,本研究结果来源于临床观察资料,还未建立合适的动物模型,以VE-Cad为治疗靶点是否可以改善脓毒症患者的预后有待于今后大规模、多中心的临床及基础研究。
| [1] | 何小军, 马岳峰. 脓毒症:我们能做些什么?[J]. 中华急诊医学杂志, 2017, 26(5): 483-487. DOI:10.3760/cma.j.issn.1671-0282.2017.05.001 |
| [2] | 刘毅, 宋诗铎, 王洪霞. 严重脓毒症患者血管内皮生长因子水平及其与预后的关系[J]. 中华急诊医学杂志, 2009, 18(2): 132-135. DOI:10.3760/cma.j.issn.1671-0282.2009.02.004 |
| [3] | Singer M, Deutschman CS, Seymour CW, et al. The Third International Consensus Definitions for Sepsis and Septic Shock (Sepsis-3)[J]. JAMA, 2016, 315(8): 801. DOI:10.1001/jama.2016.0287 |
| [4] | Rhodes A, Evans LE, Alhazzani W, et al. Surviving Sepsis Campaign: International Guidelines for Management of Sepsis and Septic Shock: 2016[J]. Intensive Care Med, 2017, 43: 304-377. DOI:10.1007/s00134-017-4683-6 |
| [5] | Dorland YL, Huveneers S. Cell-cell junctional mechanotransduction in endothelial remodeling[J]. Cell Mol Life Sci, 2017, 74: 279-292. DOI:10.1007/s00018-016-2325-8 |
| [6] | 李真玉, 赵君, 陈兵. 液体平衡和心功能变化与脓毒性休克患者预后的关系[J]. 中华普通外科杂志, 2016, 31(5): 402-405. DOI:10.3760/cma.j.issn.1007-631X.2016.05.012 |
| [7] | Zhang RY, Liu YY, Li L, et al. Increased levels of soluble vascular endothelial cadherin are associated with poor outcome in severe sepsis[J]. J Int Med Res, 2010, 38: 1497-1506. DOI:10.1177/147323001003800433 |
| [8] | Flemming S, Burkard N, Renschler M, et al. Soluble VE-cadherin is involved in endothelial barrier breakdown in systemic inflammation and sepsis[J]. Cardiovasc Res, 2015, 107(1): 32-44. DOI:10.1093/cvr/cvv144 |
| [9] | Park-Windhol C, Amore PA. Disorders of vascular permeability[J]. Annu Rev Pathol, 2016, 11: 251-281. DOI:10.1146/annurev-pathol-012615-044506 |
| [10] | Gavard J. Endothelial permeability and VE-cadherin: a wacky comradeship[J]. Cell Adh Migr, 2014, 8(2): 158-64. DOI:10.4161/cam.29026 |
| [11] | Gavard J, Gutkind JS. VEGF controls endothelial-cell permeability by promoting the beta-arrestin-dependent endocytosis of VE-cadherin[J]. Nat Cell Biol, 2006, 8: 1223-1234. DOI:10.1038/ncb1486 |
| [12] | Conway DE, Breckenridge MT, Hinde E, et al. Fluid shear stress on endothelial cells modulates mechanical tension across VE-cadherin and PECAM-1[J]. Curr Biol, 2013, 23(11): 1024-30. DOI:10.1016/j.cub.2013.04.049 |
| [13] | 李真玉, 赵华杰, 赵君, 等. 限制性液体复苏对脓毒性休克外周血单个核细胞Toll样受体4信号通路及心功能的影响[J]. 中华传染病杂志, 2015, 33(12): 731-736. DOI:10.3760/cma.j.issn.1000-6680.2015.12.003 |
| [14] | Dong R, Hu D, Yang Y, et al. EETs reduces LPS-induced hyperpermeability by targeting GRP78 mediated Src activation and subsequent Rho/ROCK signaling pathway[J]. Oncotarget, 2017, 8(31): 50958-50971. DOI:10.18632/oncotarget.17331 |
| [15] | Seung-Sik R, Koji A, Shigetomo F. Dynamic regulation of vascular permeability by vascular endothelial cadherin-mediated endothelial cell-cell junctions[J]. J Nippon Med Sch, 2017, 84(4): 148-159. DOI:10.1272/jnms.84.148 |
| [16] | Havovi C, Julie B, Huetran D, et al. Select Rab GTPases regulate the pulmonary endothelium via endosomal trafficking of vascular endothelial-cadherin[J]. Am J Respir Cell Mol Biol, 2016, 54(6): 769-781. DOI:10.1165/rcmb.2015-0286OC |
 2018, Vol. 27
2018, Vol. 27




