2 100050 北京,首都医科大学附属北京友谊医院急诊科 ;
3 100020 北京,首都医科大学附属北京朝阳医院北京市心肺脑复苏重点实验室
2. Emergency Department, Beijing Friendship Hospital, Capital Medical University, Beijing 100050, China;
3. Beijing Key Laboratory of CardiopulmoNary Cerebral Resuscitation, Beijing Chao-Yang Hospital, Capital Medical University, Beijing 100020, China
急性肺栓塞(acute pulmonary embolism, APE)是骨科大手术后致命的并发症之一,美国胸科医师学会(ACCP)报道,> 60岁的非大手术老年患者PTE的发生率是2%~4%,大手术(人工髋关节置换术、人工膝关节置换术)后APE发生率明显增加,分别为0.9%~28%、1.5%~10%[1]。其中大面积肺栓塞表现为心源性休克和心脏骤停(cardiac arrest, CA),病死率高达65%[2]。心肺复苏时抗血栓治疗可提高存活率[3]。存活者易并发心功能衰竭[4]。心肌细胞凋亡是心功能衰竭的主要病理生理机制[5]。笔者既往研究显示急性肺栓塞致心脏骤停和自主循环恢复(return of spontaneous circulation, ROSC)时左心功能明显下降[6],但其机制尚不清楚。本研究将探讨急性肺栓塞致CA和ROSC后心肌凋亡的情况,及血管紧张素转换酶抑制剂卡托普利对心肌细胞凋亡的影响及相关分子机制,从而为急性肺栓塞的治疗提供分子靶点。
1 材料与方法 1.1 实验动物近交系北京长白猪29头,3个月龄,平均体质量(28±2) kg,中国农业科学院畜牧兽医研究所提供。实验动物的使用得到首都医科大学实验动物管理委员会及伦理委员会的批准(批准号: 2010-D-013)。
1.2 试剂与主要仪器一抗:Bcl-2抗兔多克隆抗体(1:500,美国Santa cruz公司,货号:SC-492);Bax抗兔多克隆抗体(1:500,美国Santa cruz公司,货号:SC-492);Caspase-3抗鼠多克隆抗体(1:500,美国Santa cruz公司,货号:SC-7272);p-Src抗兔多克隆抗体(1:500,英国Abcam,货号:ab4816);磷酸化的胞外信号调节激酶1/2(Phosphorylated extracellular sigNal-related KiNase, p-ERK1/2)抗兔多克隆抗体(1:1 000,美国CST,货号:4376S);β-actin(1:500,北京中杉金桥,货号:TA-09);二抗:即用型SP免疫检测试剂盒(北京ZSGB-Biotechnology)、生物素标记羊抗兔IgG(H+L)HRP、生物素标记羊抗小鼠IgG(H+L)、兔抗山羊IgG(H+L) HRP(美国Santa cruz);3, 3’-二氨基联苯二胺盐酸盐显色试剂盒(北京中杉金桥,货号:ZLI-9017);PVDF膜(美国Millipore);3mm Whatman滤纸(美国Millipore);蛋白质MarKer(北京天根)。钠-钾-ATP酶酶联免疫吸附(ELISA)试剂盒(上海蓝基,货号: E07N0509)。MV-3电泳仪(香港J-MAX),ST-2转膜仪(香港J-MAX), TS-92摇床(江苏其林贝尔),MULTISKAN MK3全自动多功能酶标仪(美国Thermo),DH4000A电热恒温培养箱(天津泰斯特),MH-1试管混合器(江苏其林贝尔)。
1.3 动物模型造模前准备实验动物术前晚上禁食,可自由饮水。肌注咪达唑仑0.2 mg/kg,而后联合耳缘静脉注射异丙酚1.0 mg/kg。实验动物麻醉满意后仰卧固定于手术台上,连续静脉泵入3%戊巴比妥钠8 mg/(kg·h)维持麻醉。置入气管插管,连接CO2SMOplus呼吸监护仪及呼吸机,呼吸模式SIMV+PS,FiO2 21%,通气频率为12~20次/min,潮气量初次设为8 mL/kg,然后根据呼气末二氧化碳(保持在30~40 mmHg, 1 mmHg=0.133 kPa)调整呼吸频率和潮气量。备皮后连接心电监护,监测肢体导联心电图。将一个三腔静脉导管插入左侧股静脉以监测中心静脉压;左侧股动脉置入动脉导管,连接压力换能器及PICCO监护仪测量平均动脉压;将Swan-Ganz导管从右侧颈外静脉插入肺动脉,以监测平均肺动脉压;右侧股静脉注入6 F导管,用于输注生理盐水[8 mL/(kg·h)]以维持中心静脉压在5~12 mmHg;左侧颈外静脉置入一直径约1 cm导管,在CT引导下将其尖端置于肺动脉开口处,用于血栓注入。监护仪监测心电图和血流动力学参数。手术结束后,部分缝合伤口,将导管尖端留在体外。
1.4 APE致CA和ROSC模型的建立参考笔者前期研究既往模型建立方法[5],即每头猪从颈外静脉取100 mL血液,放置室温2~3 h自凝成血块,将10~15 mL血块切成1.5 cm × 1 cm × 1 cm大小的小血块,用生理盐水置于大导管尖端注射器中。将血栓块快速注入左侧颈外静脉内(约2 min),直到平均动脉压 < 30 mmHg [7]。随后立即从右侧颈外静脉的Swan-Ganz导管注入尿激酶(15 000 U/kg),并进行心肺复苏(严格按照2010年美国心脏协会推荐的心肺复苏国际指南)。恢复ROSC的标准是:主动脉收缩压在50 mmHg以上,并且持续时间超过10 min[8]。如果动物出现室颤,则开始200 J非同步电除颤。如至复苏开始后30 min实验动物仍未达到ROSC,则认为复苏失败,动物死亡。整个实验过程中以PULSION PiCCO plus监护仪持续监测血流动力学数据。
1.5 实验分组及ROSC后处理对照组(control,5只):完成造模前准备,不注入血栓,静脉注射异丙酚后注射15%的氯化钾10 mL,直到MAP低于30 mmHg,随后立即给予心肺复苏和电除颤,所有动物死于室颤。APE致CA组(APE-CA,5只):注入血栓后达到CA状态,但未达到ROSC状态;19头猪注射血栓后其中10头猪达到ROSC,随机(随机数字法)分为2组:卡托普利组(ROSC-Cap,5只),达到ROSC后30 min给予静脉注射卡托普利(Captopril, Cap) 22.22 mg/kg[9];生理盐水组(ROSC-SA,5只),给予同样剂量的生理盐水(saline, SA)静脉注射。达到ROSC后的实验动物给予ICU环境下监护和治疗,呼吸机持续辅助通气,通气模式:SIMV+PSV,FiO2 21%,根据呼气末二氧化碳分压(30~40 mmHg)调节通气频率和潮气量。0.5 h监测1次生命体征(心率、平均动脉压、右室压、平均肺动脉压),给予生理盐水8 mL/(kg·h)以补充丢失体液,并根据中心静脉压及尿量持续补液(生理盐水、5%糖盐水等),所需液体=生理需要量+丢失量,另加生理需要量氯化钾3~5 g。ROSC后6 h给予静脉注射异丙酚100 mg,后给予15 %氯化钾10 mL静脉注射处死。心脏组织于甲醛常温保存,用于免疫组化检测,其余标本-80 ℃保存行分子生物学检测。
1.6 Western blot分析预冷RIPA蛋白抽提试剂,加入蛋白酶抑制剂Protease inhibitor cocktail(Roche)(磷酸化蛋白需要同时加入磷酸酶抑制剂)。将组织按照10 %匀浆,20 mg加入200 μL RIPA裂解液,进行匀浆。冰上孵育20 min后,13 000 r/min(4 ℃)离心20 min。取上清,分装-80 ℃保存,待测。BCA法蛋白定量:按照BCA蛋白定量试剂盒使用说明操作,测定蛋白浓度。以RIPA调整蛋白浓度,样品终浓度为3 μg/μL,加入5×蛋白样品缓冲液,95 ℃ 5 min。根据目的蛋白的分子量,分别配制8%,10%,15%分离胶,浓缩胶浓度为5%。待检测蛋白样品上样量:24 μg/孔。电泳条件:浓缩胶恒压90 V,约20 min;分离胶恒压120 V,通过预染蛋白marker来确定电泳停止时间。湿转法,转膜条件:300 mA恒流;0.45 μm孔径PVDF膜,转膜时间40~100 min。转膜完成后丽春红染色试剂对膜进行染色,观察转膜效果。将膜完全浸没于5% BSA-TBST中,水平摇床孵育1 h(RT)。5% BSA-TBST稀释一抗,4 ℃水平摇床孵育过夜。次日,洗膜:TBST洗3次,每次10 min。5% BSA-TBST稀释二抗,山羊抗兔IgG(H+L)HRP和山羊抗鼠IgG(H+L)和兔抗山羊IgG(H+L) HRP 1 :10 000,室温孵育40 min。洗膜:TBST洗膜3次,每次10 min。ECL滴加到膜的蛋白面,反应3 min;胶片曝光:10 s至5 min(曝光时间随不同光强度而调整),显影2 min,定影。检测条带,图片扫描后,并用软件Gel Image system ver.4.00 (中国tanon)对图像进行灰度分析。
1.7 免疫组织化学染色取各组猪心肌组织石蜡切片,按以下操作过程用SP免疫检测试剂盒进行免疫酶组织化学染色。用二甲苯洗涤切片3次,每次15 min;接着分别用100%、95%和70%酒精洗涤切片1次,每次5 min。将切片置于3% H2O2(30 % H2O2:甲醇=1:9)中,避光孵育10 min。蒸馏水冲洗3次,每次2 min。将切片浸入0.01 mol/L枸橼酸盐缓冲液(pH 6.0),微波炉加热至沸腾后断电,间隔10 min,重复1次。室温冷却,磷酸盐缓冲液(phosphate buffered saline,PBS)(pH 7.2~7.6)洗涤3次,每次2 min。5%牛血清白蛋白(bovine serum albumin,BSA)封闭,室温40 min,甩去多余液体,不洗。PBS稀释特异性抗体:p-Src(1:500),p-ERK1/2(1:1 000),取约50 μL/每张的一抗稀释液覆盖切片上的心肌组织,4 ℃孵育过夜。滴加生物素标记的二抗,约50 μL/每张,室温孵育40 min。滴加链亲和素-辣根过氧化物酶标记的抗生物素抗体,室温孵育30 min。使用DAB显色试剂盒,A、B液按1:20比例稀释,混匀后加至切片。室温显色,显微镜下控制反应时间,一般30 s到5 min。除去DAB液,室温下自来水冲洗,直至片子上无DAB。苏木精复染30 s,室温下自来水冲洗,直至片子上无苏木精。脱水,透明,晾干后,中性树胶封片。显微镜下观察并摄取图像。
1.8 ELISA检测取心脏组织加入生理盐水,用手术剪将组织剪碎,匀浆器匀浆。10 000 r/min,5 min离心取组织液上清。根据试剂盒说明书操作。
1.9 统计学方法计量资料用均数±标准差(x±s)表示,采用SPSS16.0统计软件进行统计学分析,组间比较采用单因素方差分析。相关性分析采用Pearson相关性检验。以P < 0.05为差异具有统计学意义。
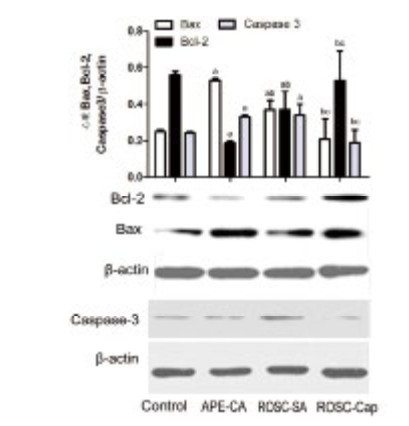
2 结果 2.1 APE时心肌细胞凋亡及卡托普利的作用检测凋亡相关因子的表达,发现与对照组相比,APE-CA和ROSC-SA组心肌Bax(0.25±0.01, 0.53±0.01, 0.37±0.05, F=14.16, P < 0.05)、Caspase-3(0.24±0.01, 0.33±0.01, 0.34±0.06, F=7.32, P < 0.05)蛋白表达明显升高,Bcl-2蛋白表达明显下降(0.56±0.02, 0.19±0.01, 0.37±0.10, F=6.68, P < 0.05);与APE-CA组相比,ROSC-SA组Bax表达明显下降(P=0.002),Bcl-2表达明显升高(P=0.020)。与ROSC-SA组相比,ROSC-Cap组Caspase-3(0.34±0.06, 0.19±0.07, P < 0.01)、Bax明显下降(0.37±0.05, 0.21±0.11, P=0.003),Bcl-2明显升高(0.37±0.10, 0.53±0.16, P=0.041)(图 1)。
|
| 与对照组比较,aP < 0.05;与APE-CA组比较,bP < 0.05;与ROSC-SA组比较,cP < 0.05 图 1 APE致CA和ROSC时凋亡因子蛋白表达及卡托普利影响 Figure 1 The levels of apoptotic factor protein expression on CA and ROSC induced by APE and effect of captopril on apoptotic factors after ROSC |
|
|
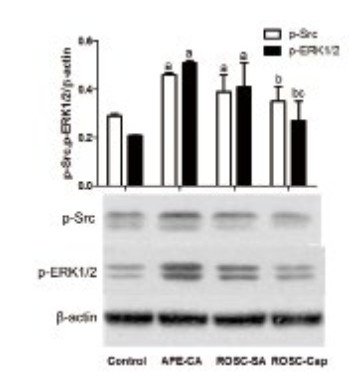
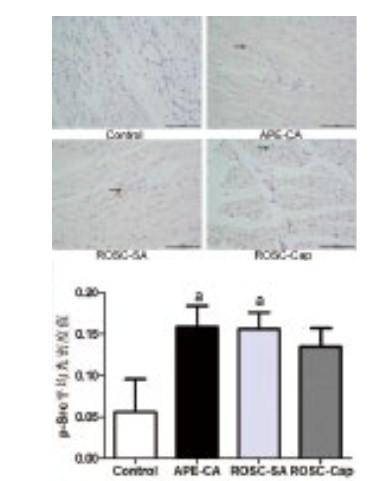
Src激酶为酪氨酸激酶家族,参与细胞生长、分化、黏附等,因此本研究探讨急性肺栓塞时心肌Src激酶的表达,以明确心肌细胞凋亡的分子机制。Western blot结果显示,与对照组相比,APE致CA时及ROSC后p-Src蛋白(0.29±0.01 vs. 0.46±0.01,0.39±0.07,F=5.60,P < 0.05)表达明显升高;与APE-CA组相比,ROSC-Cap组p-Src(0.46±0.01 vs. 0.35±0.06, P=0.031)表达明显下降(图 2)。免疫组化显示,APE致CA和ROSC后p-Src表达均明显升高,在心肌细胞的胞浆和胞核中均有表达,但卡托普利对p-Src表达的影响不显著(图 3)。分析心肌p-Src表达与凋亡因子的相关性,结果显示,p-Src与Bax正相关,r=0.745,P=0.034;与Bcl-2负相关,r=-0.772,P=0.025(图 4)。提示p-Src激活参与了心肌凋亡过程,卡托普利可能通过降低p-Src表达抑制心肌凋亡。
|
| 与对照组比较,aP < 0.05;与APE-CA组比较,bP < 0.05;与ROSC-SA组比较,cP < 0.05 图 2 Western blot检测急性肺栓塞时心肌p-Src和p-ERK1/2蛋白表达及卡托普利影响 Figure 2 Expression of cardiac p-Src and p-ERK1/2 protein and effects of captopril by western blot in acute pulmonary embolism |
|
|
|
| 黑色箭头代表p-Src表达阳性, 标尺为100 μm;与对照组比较,aP < 0.05 图 3 免疫组化检测急性肺栓塞时心肌p-Src表达及卡托普利影响 Figure 3 Expression of myocardial p-Src and effect of captopril by immunohistochemistry in acute pulmonary embolism |
|
|

|
| 图 4 心肌p-Src蛋白水平与Bax、Bcl-2蛋白水平相关性 Figure 4 The correlation between the protein levels of p-Src and Bax and Bcl-2 |
|
|
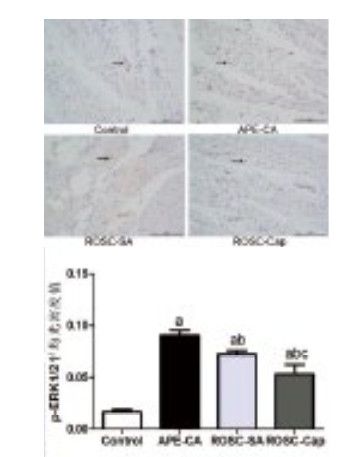
ERK1/2为细胞外信号调节激酶,对细胞生长、分裂和分化信号进行转导,可促进心肌细胞凋亡,为Src激酶下游信号通路。本研究发现,与对照组(0.21±0.02)相比,APE-CA组(0.53±0.04)和ROSC-SA组(0.41±0.10) p-ERK1/2蛋白表达明显升高(F=9.84,P < 0.05);相关性分析结果提示,p-ERK1/2与Bax正相关,r=0.878,P=0.004,与Bcl-2负相关,r=-0.960,P=0.000(图 5)。提示p-ERK1/2参与了心肌凋亡。Western blot结果显示,与生理盐水组相比,卡托普利(0.41±0.10 vs. 0.26±0.07, P < 0.05)显著降低了ROSC后心肌p-ERK1/2的蛋白表达(图 2)。免疫组化结果显示,p-ERK1/2主要表达在心肌细胞核中,急性肺栓塞致CA时表达明显升高,ROSC后表达量较CA时明显下降,卡托普利组p-ERK1/2表达量明显低于生理盐水组(F=31.08,P=0.033,图 6)。提示p-ERK1/2可能为卡托普利抑制心肌凋亡的分子机制之一。

|
| 图 5 心肌p-ERK1/2蛋白水平与Bax、Bcl-2蛋白水平相关性 Figure 5 The correlation between the protein levels of p-ERK1/2 and Bax and Bcl-2 |
|
|
|
| 黑色箭头代表p-ERK1/2表达阳性, Scale bar, 100 μm;与对照组比较,aP < 0.05;与APE-CA组比较,bP < 0.05;与ROSC-SA组比较,cP < 0.05 图 6 急性肺栓塞时心肌p-ERK1/2表达及卡托普利影响 Figure 6 Expression of myocardial p-ERK1/2 and effect of captopril by immunohistochemistry in acute pulmonary embolism |
|
|
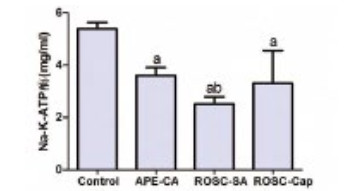
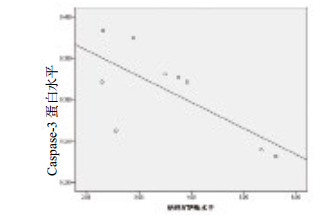
钠-钾ATP(Na+/K+-ATP)酶与Src形成复合物发挥信号转导功能,本研究分析了心肌组织Na+/K+-ATP酶的表达情况,发现急性肺栓塞致CA和ROSC时Na+/K+-ATP酶水平明显低于对照组(3.60±0.31,2.52±0.27 vs. 5.39±0.23,F=13.16,P < 0.01);与生理盐水组比较,卡托普利对Na+/K+-ATP酶的表达未产生影响(图 7)。Na+/K+-ATP酶与caspase-3蛋白表达呈负相关,r=-0.710,P=0.032(图 8)。提示Na+/K+-ATP酶可能参与了心肌细胞凋亡,但未参与到卡托普利抗心肌凋亡的分子机制中。
|
| 与对照组比较,aP < 0.05;与APE-CA组比较,bP < 0.05 图 7 急性肺栓塞致CA和ROSC后钠钾ATP酶水平及卡托普利影响 Figure 7 The levels of Na+-K+-ATPase and effect of captopril on CA and ROSC induced by acute pulmonary embolism |
|
|
|
| 图 8 心肌Na+/K+-ATP酶与caspase-3蛋白水平相关性 Figure 8 The correlation between the protein levels of Na+/K+-ATP and caspase-3 |
|
|
笔者既往研究发现,急性肺栓塞致猪心脏骤停复苏后,动物的左心功能明显下降,包括每搏指数、心排血量、每搏做功等,但卡托普利对左心功能并未产生影响[6]。本研究在此基础上,深入探究心功能变化的机制,发现急性肺栓塞致CA和ROSC后心肌Na+/K+-ATP酶水平明显减低、心肌细胞凋亡引起心功能下降,其信号通路可能激活p-Src、p-ERK1/2。卡托普利对Na+/K+-ATP水平并未产生影响,但可能通过抑制p-Src、p-ERK1/2激活抑制心肌细胞凋亡。
心肌细胞凋亡是心肌梗塞、心肌缺血-再灌注损伤、心脏骤停时的重要病理生理特点。王现涛等[10]经左心室注入微栓塞球构建大鼠冠状动脉微栓塞模型,发现心肌凋亡指数明显增加,Caspase-3表达水平显著增加。Guo等[11]通过结扎左冠状动脉前降支30 min后随后去除结扎建立心脏缺血-再灌注模型,发现Na+/K+-ATP酶活性明显下降,细胞凋亡明显增加。潘赟等[12]研究亦表明,缺血-再灌注损伤时心肌凋亡明显。Huang等[13]采用窒息6.5 min诱导大鼠心脏骤停,随后复苏,心肌细胞出现凋亡。Liang等[14]发现室颤致猪心脏骤停后心肌细胞发生凋亡,促凋亡因子Bax和caspase-3表达升高,抗凋亡因子Bcl-2表达下降。本研究通过颈外静脉注入血栓制备急性肺栓塞致CA及ROSC模型,动态观察CA和ROSC后心肌凋亡情况,发现APE致CA时心肌凋亡明显,ROSC后心肌凋亡有所降低,卡托普利可通过下调Bax、Caspase 3表达,升高Bcl-2表达明显抑制心肌细胞的凋亡。这与笔者既往研究中依那普利可抑制室颤致猪心脏骤停复苏后心肌凋亡的结果一致[15]。
Na+/K+-ATP酶是一种跨膜酶,它的功能是跨膜转运Na+和K+。Na+/K+-ATP酶包括两个非共价连接的α和β亚基,α亚基包括ATP、地高辛和其他配体结合位点,被认为为催化亚基[16]。近期发现,除了跨细胞膜的离子泵功能,Na+/K+-ATP酶尤其是α亚基,还发挥非泵功能,如信号传导[17]。α1 Na+/K+-ATP酶/Src受体复合物是α1 Na+/K+-ATP酶介导的信号转导的重要组成部分[18]。在这一受体复合物中,Src的SH2域结合到第二胞浆域,在这里,Src蛋白激酶域与α1亚单位的核苷酸位点相互作用,此作用使Src处于无活性状态[18]。α1亚单位至少通过2条途经调节细胞Src的活性:(1)它结合Src并使其保持无活性状态,当敲除α1基因的一个拷贝将导致细胞Na+/K+-ATP酶下降20%~30%,在α1+/-小鼠中,Src和ERK活性增加将超过2倍[19]。(2)Na+/K+-ATP酶/Src复合物为强心类固醇,如毒毛花苷、地高辛、海蟾蜍毒素的一个功能性受体,其与Na+/K+-ATP酶/Src复合物结合恢复了Src的活性,随后使多种因子磷酸化,导致不同信号途径激活,包括Ras/Raf/ERK/1/2 [17]。本研究中,急性肺栓塞致CA和ROSC时心肌Na+/K+-ATP酶活性下降,p-Src表达明显增加,ROSC后卡托普利可抑制心肌p-Src表达。考虑心肌Src激酶被激活的原因:(1)心肌Na+/K+-ATP酶活性下降;(2)血管紧张素Ⅱ刺激强心类固醇产生增加[20],CTS与Na+/K+-ATP酶结合后激活Src。心肌Na+/K+-ATP酶活性下降可能为急性肺栓塞致CA和ROSC时心功能障碍的主要原因,本研究发现ROSC后卡托普利对Na+/K+-ATP酶活性并未产生影响,与既往研究中卡托普利未对心功能产生影响的结论一致[6]。
Zhang等[21]研究显示,哇巴因结合Na+/K+-ATP酶进而激活Src/表皮生长因子受体复合物,从而启动多种信号途径,包括Ras/Raf/MEK/ERK1/2,从而引起心肌细胞凋亡。Chou等[22]研究显示,Src激酶抑制剂可逆转缺血-再灌注损伤诱导的心肌细胞的凋亡,提示Src激酶激活促进了缺血-再灌注损伤时的心肌细胞凋亡。我们发现急性肺栓塞致CA和ROSC时心肌p-Src、p-ERK1/2表达明显增加,并与Bax成正比,与Bcl-2成反比;Na+/K+-ATP酶活性下降,并与caspase-3正相关,提示Na+/K+-ATP酶活性下降、p-Src、p-ERK1/2激活可能为心肌细胞凋亡的分子机制。而ROSC后卡托普利可抑制心肌细胞凋亡,降低p-Src、p-ERK1/2表达,但对Na+/K+-ATP酶未产生影响,提示卡托普利抑制心肌凋亡的分子机制为降低心肌p-Src、p-ERK1/2表达。
本研究在既往急性肺血栓栓塞致CA和ROSC时心功能明显减低的研究基础上,深入探究了引起心功能改变的分子机制,发现心肌Na+/K+-ATP酶活性减低、心肌p-Src、p-ERK1/2激活参与了心肌细胞凋亡,ROSC后卡托普利通过降低p-Src、p-ERK1/2表达抑制心肌细胞凋亡。
| [1] | Geerts WH, Pineo GF, Heit JA, et al. Prevention of venous thromboembolism:the Seventh ACCP Conference on Antithrombotic and Thrombolytic Therapy[J]. Chest, 2004, 126(3 Suppl): 338S-400S. DOI:10.1378/chest.126.3_suppl.338S |
| [2] | White RH. The epidemiology of venous thromboembolism[J]. Circulation, 2003, 107(23 Suppl 1): I4-I8. DOI:10.1161/01.CIR.0000078468.11849.66 |
| [3] | Gao JP, Ying KJ. Thrombolysis during extended cardiopulmoNary resuscitation for autoimmune-related pulmonary embolism[J]. World J Emerg Med, 2015, 6(2): 153-156. DOI:10.5847/wjem.j.1920-8642.2015.02.012 |
| [4] | Yin Q, Li X, Li C. Thrombolysis after initially unsuccessful cardiopulmonary resuscitation in presumed pulmonary embolism[J]. Am J Emerg Med, 2015, 33(1): 132.e1-e2. DOI:10.1016/j.ajem.2014.06.031 |
| [5] | Hamid T, Guo SZ, Kingery JR, et al. Cardiomyocyte NF-κB p65 promotes adverse remodelling, apoptosis, and endoplasmic reticulum stress in heart failure[J]. Cardiovasc Res, 2011, 89(1): 129-138. DOI:10.1093/cvr/cvq274 |
| [6] | Xiao HL, Li CS, Zhao LX, et al. Captopril improves postresuscitation hemodynamics protective against pulmonary embolism by activating the ACE2/Ang-(1-7)/Mas axis[J]. Naunyn Schmiedebergs Arch Pharmacol, 2016, 389(11): 1159-1169. DOI:10.1007/s00210-016-1278-1279 |
| [7] | Pantazopoulos IN, Xanthos TT, Vlachos I, et al. Comparison of extracorporeal and conventional cardiopulmonary resuscitation: A meta-analysis of 2260 patients with cardiac arrest[J]. Crit Care Med, 2012, 40(3): 861-868. DOI:10.1097/CCM.0b013e318232d8de |
| [8] | Wang GN, Chen XF, Qiao L, et al. The effects of nifedipine on ventricular fibrillation mean frequency in a porcine model of prolonged cardiopulmonary resuscitation[J]. World J Emerg Med, 2017, 8(1): 5-11. DOI:10.5847/wjem.j.1920–8642.2017.01.001 |
| [9] | Ilieva I, Ohgami K, Jin XH, et al. Captopril suppresses inflammation in endotoxin-induced uveitis in rats[J]. Exp Eye Res, 2006, 83(3): 651-657. DOI:10.1016/j.exer.2006.03.005 |
| [10] | 王现涛, 李浪, 陆元, 等. TAK-242调控TLR4/NF-KB对大鼠冠状动脉微栓塞后心肌细胞凋亡的影响[J]. 中华急诊医学杂志, 2017, 26(7): 745-750. DOI:10.3760/cma.j.issn.1671-0282.2017.07.006 |
| [11] | Guo X, Cao W, Yao J, et al. Cardioprotective effects of tilianin in rat myocardial ischemia-reperfusion injury[J]. Mol Med Rep, 2015, 11(3): 2227-2233. DOI:10.3892/mmr.2014.2954 |
| [12] | 潘赟, 钱进先, 崔妍. 丹参酮ⅡA磺酸钠对大鼠心肌缺血-再灌注损伤的影响[J]. 中华急诊医学杂志, 2016, 25(7): 864-869. DOI:10.3760/cma.j.issn.1671-0282.2017.07.006 |
| [13] | Huang CH, Wang CH, Tsai MS, et al. Urocortin treatment improves acute hemodynamic instability and reduces myocardial damage in post-cardiac arrest myocardial dysfunction[J]. PLoS One, 2016, 11(11): e0166324. DOI:10.1371/journal.pone.0166324 |
| [14] | Liang LN, Zhong X, Zhou Y, et al. Cardioprotective effect of nicorandil against myocardial injury following cardiac arrest in swine[J]. Am J Emerg Med, 2017, 35(8): 1082-1089. DOI:10.1016/j.ajem.2017.02.051 |
| [15] | Wang G, Zhang Q, Yuan W, et al. Enalapril protects against myocardial ischemia/reperfusion injury in a swine model of cardiac arrest and resuscitation[J]. Int J Mol Med, 2016, 38(5): 1463-1473. DOI:10.3892/ijmm.2016.2737 |
| [16] | Xie Z, Xie J. The Na/K-ATPase-mediated signal transduction as a target for new drug development[J]. Frontiers Biosci, 2005, 10: 3100-3109. DOI:10.2741/1766 |
| [17] | Li Z, Zhang Z, Xie JX, et al. Na/K-ATPase mimetic pnaktide inhibits the growth of human cancer cells[J]. J Biol Chem, 2011, 286(37): 32394-32403. DOI:10.1074/jbc.M110.207597 |
| [18] | Tian J, Cai T, Yuan Z, et al. Binding of Src to Na+/K+-ATPase forms a functional signaling complex[J]. Mol Biol Cell, 2006, 17(1): 317-326. DOI:10.1091/mbc.E05-08-0735 |
| [19] | Chen Y, Cai T, Wang H, et al. Regulation of intracellular cholesterol distribution by Na/K-ATPase[J]. J Biol Chem, 2009, 284(22): 14881-14890. DOI:10.1074/jbc.M109.003574 |
| [20] | 文玉杰, 李晓玫. 钠钾ATP酶的信号转导功能新进展[J]. 生理科学进展, 2005, 36(2): 159-162. DOI:10.3321/j.issn:0559-7765.2005.02.015 |
| [21] | Zhang L, Zhang Z, Guo H, et al. Na+/K+-ATPase-mediated signal transduction and Na+/K+-ATPase regulation[J]. Fundam Clin Pharmacol, 2008, 22(6): 615-621. DOI:10.1111/j.1472-8206.2008.00620.x |
| [22] | Chou HC, Chen YW, Lee TR, et al. Proteomics study of oxidative stress and Src Kinase inhibition in H9C2 cardiomyocytes: a cell model of heart ischemia-reperfusion injury and treatment[J]. Free Radic Biol Med, 2010, 49(1): 96-108. DOI:10.1016/j.freeradbiomed.2010.04.001 |
 2018, Vol. 27
2018, Vol. 27




