2 510080 广州,广东省人民医院东病区、广东省老年医学研究所
2. Eastern Section, Guangdong General Hospital, Guangdong Institute of Geriatrics, Guangzhou 510080, China
创伤性脑损伤(traumatic brain injury, TBI)是常见的机械性损伤,具有极高的发生率、致残率和病死率[1-2]。TBI后脑组织缺血、缺氧是引起继发性脑损伤的重要因素[3-4],严重影响患者的预后[5-7]。缺氧诱导因子-1α(hypoxia-inducible factor-1α, HIF-1α)是在缺血、缺氧环境下维持体内氧稳态的关键性物质[8-9], 在缺氧诱导相关基因表达中起着关键作用[10-12], 参与缺氧适应、炎症反应、血管重生及神经形成等重要生命过程[13-14]。本研究探讨不同损伤程度和伤后不同时间TBI患者HIF-1α的表达差异,分析其在TBI发病过程中的作用及可能机制。
1 资料与方法 1.1 一般资料选取深圳市龙岗中心医院2016年5月至2017年11月因TBI行开颅减压手术切除的脑组织和外周血标本为研究对象。根据术前GCS评分分为:中度损伤组(9~12分)共20例,男10例,女10例,年龄21~75(52.16±1.7)岁;重度损伤组(3~8分)共20例,男12例,女8例,年龄22~74(54.22±1.5)岁;特重度损伤组(< 3分)共20例,男11例,女9例,年龄20~76(53.18±1.3)岁。致伤原因:车祸伤21例,高空坠落伤18例,暴力打击伤16例,其他5例。三组性别比例、年龄构成、致伤原因等比较差异无统计学意义(P > 0.05)。根据发病至手术时间不同分为:< 6 h组(n=20)、≥6 h且≤24 h组(n=15)、> 24 h且≤72 h组(n=16)、> 72 h组(n=11)。三组性别比例、年龄构成、致伤原因等比较差异无统计学意义(P > 0.05)。
对照组脑组织样本来自同期本院诊断为脑血管瘤需行开颅手术且排除TBI及其他中枢出血、梗死、恶性肿瘤等疾病者,留取术中摘除的血管瘤边缘少量正常脑组织,共60例,年龄19~78(51.20±1.6)岁。外周血标本来自同期我院健康体检者,共60例,年龄23~79(51.22±2.0)岁。标本的留取均已获得深圳市龙岗中心医院伦理委员会批准及患者或其家属知情同意。
1.2 研究方法 1.2.1 标本获取术中留取周围缺血半暗带 < 3 mm的脑组织[15]为研究对象。标本预处理后-80 ℃冰箱贮存, 避免反复冻融。外周血标本离心预处理后-20 ℃冰箱保存。
1.2.2 RT-PCR检测HIF-1α mRNA的表达HIF-1α引物由上海杰瑞生物工程有限公司设计合成。RT-PCR检测两组人群mRNA表达,依据各个扩增产物的CT值按照公式2-ΔΔct法计算两组HIF-1α mRNA的表达水平。
1.2.3 Western blot检测HIF-1α蛋白的含量采用凯基全蛋白提取试剂盒(凯基生物科技发展有限公司,南京,中国)进行蛋白抽提;BCA蛋白浓度测定试剂盒(碧云天生物技术研究所,上海,中国)进行定量;聚丙烯酰胺凝胶上样后电泳、转膜、漂洗封闭、加入一抗(博士德生物工程有限公司,武汉,中国)和二抗(碧云天生物技术研究所,上海,中国)、显影, 、凝胶成像仪获取图像, 用FluorChem 8900自动图像分析软件对HIF-1α光带的相对表达进行分析。
1.3 统计学方法采用SPSS 18.0软件,计量资料使用均数±标准差(x±s)表示,两两组间比较采用成组t检验, 多组变量间比较采用单因素方差分析,以P < 0.05为差异有统计学意义。
2 结果 2.1 不同损伤程度组人群HIF-1α mRNA及蛋白表达水平两组人群均能明显表达HIF-1α,其中病例组HIF-1α表达水平明显高于对照组,差异有统计学意义(P < 0.05)。随着损伤程度加重,HIF-1α表达水平增高,特重度损伤组HIF-1α表达水平明显高于重度损伤组和中度损伤组,差异有统计学意义(P < 0.05);见表 1,见图 1。
| 组别 | 例数 | 外周血标本 | 脑组织标本 | |||
| HIF-1α mRNA | HIF-1α蛋白 | HIF-1α mRNA | HIF-1α蛋白 | |||
| 对照组 | 60 | 0.35±0.12 | 0.28±0.06 | 0.65±0.08 | 0.78±0.08 | |
| 中度损伤组 | 20 | 0.46±0.18 | 0.34±0.12 | 0.84±0.12 | 0.95±0.13 | |
| 重度损伤组 | 20 | 0.62±0.15 | 0.56±0.15 | 1.25±0.17 | 1.33±0.17 | |
| 特重度损伤组 | 20 | 0.86±0.14 | 0.80±0.17 | 1.84±0.15 | 1.95±0.19 | |
| 注:与对照组比较,P < 0.05;不同损伤程度组比较,P < 0.05 | ||||||
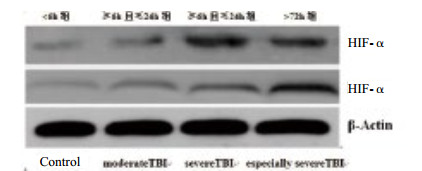
|
| 图 1 不同损伤程度及损伤后不同时间人群HIF-1α蛋白的表达水平 Figure 1 The expression of HIF-1α in TBI patients with different damage degree and different time points after the injury and control subjects |
|
|
随着伤后时间的延长,HIF-1α表达量逐渐增多,> 24 h且≤72 h组HIF-1α表达水平明显高于 > 72 h组、≥6 h且≤24 h组和 < 6 h组,差异有统计学意义(P < 0.05);见表 2,见图 1。
| 组别 | 例数 | 外周血标本 | 脑组织标本 | |||
| HIF-1α mRNA | HIF-1α蛋白 | HIF-1α mRNA | HIF-1α蛋白 | |||
| 对照组 | 60 | 0.35±0.12 | 0.28±0.06 | 0.65±0.08 | 0.78±0.08 | |
| < 6 h组 | 20 | 0.48±0.16 | 0.32±0.10 | 0.93±0.11 | 0.96±0.15 | |
| ≥6h 且≤24 h组 |
15 | 0.65±0.13 | 0.52±0.16 | 1.42±0.15 | 1.41±0.17 | |
| > 24 h 且≤72 h组 |
14 | 0.92±0.20 | 0.98±0.22 | 2.15±0.13 | 2.20±0.16 | |
| > 72 h组 | 11 | 0.85±0.18 | 0.82±0.14 | 1.92±0.18 | 1.87±0.14 | |
| 注:与对照组比较,P < 0.05;损伤后不同时间组比较,P < 0.05 | ||||||
HIF-1α是低氧时系统应答的调节中心,在缺血性心脏病、缺氧性肺损害和脑卒中等缺氧相关疾病中表达增加并发挥重要的作用[16-17]。TBI后脑组织水肿、脑血管系统损伤等导致脑组织严重缺血、缺氧,为HIF-1α的表达提供可能。有文献报道,低氧条件下局灶性脑缺血或全脑缺血-再灌注损伤中,缺血半暗带或皮质HIF-1α表达显著增高[18-19]。Shenaq等[20]发现,HIF-1α在TBI大鼠脑组织中的表达水平明显升高。本研究结果显示病例组HIF-1α mRNA及蛋白表达水平明显高于对照组,符合既往临床研究和实验研究结果,提示HIF-1α在创伤性脑损伤后可显著表达。
HIF-1α对缺氧极其敏感[21],在正常脑组织中不表达;低氧条件下,细胞内氧浓度对HIF-1α的表达进行着精细的调节,随着氧浓度降低,HIF-1α的表达量呈指数增长,同时决定HIF-1α的活性水平[22]。TBI后脑组织严重缺血缺氧是导致继发性脑功能恶化的关键因素[23]:早期损伤组织释放血管活性物质和凝血酶,脑血管狭窄、痉挛、塌陷甚至断裂等导致脑组织缺血缺氧;晚期随着损伤时间的延长及损伤程度的加重,血脑屏障破坏、脑血流自动调节障碍、血红蛋白分解、补体和炎性因子水平升高等加重血管内皮细胞和脑细胞损伤,进一步加剧脑组织缺血缺氧性损害。因此,测定TBI后HIF-1α的表达情况,可在一定程度上反映TBI后继发性脑损伤的严重程度。本课题结果显示,随着损伤程度加重,HIF-1α表达增强,特重度损伤组HIF-1α表达最强,明显高于重度损伤组和中度损伤组;随着伤后时间的延长,HIF-1α表达量逐渐增多,> 24 h且≤72 h组HIF-1α表达水平明显高于 > 72 h组、≥6 h且≤24 h组和 < 6 h组,同既往研究[22, 24-25]结果相仿。表明HIF-1α在TBI后的表达水平显著升高,参与了TBI缺血缺氧性脑损伤发生、发展过程,为TBI后脑组织存在缺血缺氧性损害提供了新的理论依据。
综上所述,HIF-1α是维持体内氧稳态的关键转录因子,在TBI后的表达水平显著升高,表达强度与脑损伤病情严重程度密切相关。HIF-1α可作为干预TBI的治疗新靶点,进一步探讨HIF-1α在TBI发生、发展过程中的作用机制可为临床医生研究和治疗TBI提供一种新的思路。
| [1] | Brazinova A, Rehorcikova V, Taylor MS, et al. Epidemiology of traumatic brain injury in Europe: a living systematic review[J]. J Neurotrauma, 2016 Aug 25. DOI: 10.1089/neu.2015.4126. http://www.ncbi.nlm.nih.gov/pubmed/26537996 |
| [2] | Kou K, Hou XY, Sun JD, et al. Current pre-hospital traumatic brain injury management in China[J]. World J Emerg Med, 2014, 5(4): 245-254. DOI:10.5847/wjem.j.issn.1920-8642.2014.04.001 |
| [3] | 汤宏, 刘家传, 张永明, 等. 高压氧对大鼠颅脑爆震伤后皮层脑组织自噬与凋亡变化的影响[J]. 中华神经医学杂志, 2010, 9(10): 1014-1017. DOI:10.3760/cma.j.issn.1671-8925.2010.10.012 |
| [4] | 杨艳艳, 刘家传, 张永明, 等. MRS联合DWI观察实验性兔颅脑爆震伤后高压氧的治疗作用[J]. 中华神经医学杂志, 2011, 10(1): 33-36. DOI:10.3760/cma.j.issn.1671-8925.2011.01.008 |
| [5] | Balu R. Inflammation and immune system activation after traumatic brain injury[J]. Curr Neurol Neurosci Rep, 2014, 14(10): 484. DOI:10.1007/s11910-014-0484-2 |
| [6] | Schwarzmaier SM, Plesnila N. Contributions of the immune system to the pathophysiology of traumatic brain injury–evidence by intravital microscopy[J]. Front Cell Neurosci, 2014, 8: 358. DOI:10.3389/fncel.2014.00358 |
| [7] | 王黎明, 徐静, 刘爱兵. 脐带间充质干细胞对颅脑外伤后大鼠认知功能的保护作用[J]. 中国急救复苏与灾害医学杂志, 2014(4): 315-317. DOI:10.3969/j.issn.1673-6966.2014.04.010 |
| [8] | Semenza GL. HIF-1: mediator of physiological and pathophysiological responses to hypoxia[J]. J Appl Physiol, 2000, 88(4): 1474-80. DOI:10.1152/jappl.2000.88.4.1474 |
| [9] | Shimoda LA, Semenza GL. HIF and the lung: role of hypoxia-inducible factors in pulmonary development and disease[J]. Am J Respir Crit Care Med, 2011, 183(2): 152-156. DOI:10.1164/rccm.201009-1393PP |
| [10] | Ergorul C, Ray A, Huang W, et al. Hypoxia inducible factor-1α (HIF-1α) and some HIF-1 target genes are elevated in experimental glaucoma[J]. J Mol Neurosci, 2010, 42(2): 183-191. DOI:10.1007/s12031-010-9343-z |
| [11] | Ge Y, Huang M, Ma YF. The effects of microRNA-34a regulating Notch-1/NF-κB signaling pathway on lipopolysaccharide-induced human umbilical vein endothelial cells[J]. World J Emerg Med, 2017, 8(4): 292-296. DOI:10.5847/wjem.j.1920–8642.2017.04.008 |
| [12] | Wang V, Davis DA, Haque M, et al. Differential gene up-regulation by hypoxia-inducible factor-1α and hypoxia-inducible factor-2α in HEK293T cells[J]. Cancer Res, 2005, 65(8): 3299-3306. DOI:10.1158/0008-5472.CAN-04-4130 |
| [13] | Lee YM, Jeong CH, Koo SY, et al. Determination of hypoxic region by hypoxia marker in developing mouse embryos in vivo: a possible signal for vessel development[J]. Dev Dyn, 2001, 220(2): 175-186. DOI:10.1002/(ISSN)1097-0177 |
| [14] | Ylikorkala A, Rossi DJ, Korsisaari N, et al. Vascular abnormalities and deregulation of VEGF in Lkb1-deficient mice[J]. Science, 2001, 293(5533): 1323-1326. DOI:10.1126/science.1062074 |
| [15] | Yanagawa Y, Ishikawa K, Jitsuiki K, et al. Fibrinogen degradation product levels on arrival for trauma patients requiring a transfusion even without head injury[J]. World J Emerg Med, 2017, 8(2): 106-109. DOI:10.5847/wjem.j.1920–8642.2017.02.004 |
| [16] | Hadjipanayi E, Schilling AF. Hypoxia-based strategies for angiogenic induction: the dawn of a new era for ischemia therapy and tissue regeneration[J]. Organogenesis, 2013, 9(4): 261-272. DOI:10.4161/org.25970 |
| [17] | Singh N, Sharma G, Mishra V, et al. Hypoxia inducible factor-1: its potential role in cerebral ischemia[J]. Cell Mol Neurobiol, 2012, 32(4): 491-507. DOI:10.1007/s10571-012-9803-9 |
| [18] | Bergeron M, Yu AY, Solway KE, et al. Induction of hypoxia‐inducible factor‐1 (HIF-1) and its target genes following focal ischaemia in rat brain[J]. Eur J Neurosci, 1999, 11(12): 4159-4170. DOI:10.1046/j.1460-9568.1999.00845.x |
| [19] | Pichiule P, Agani F, Chavez JC, et al. HIF-1α and VEGF expression after transient global cerebral ischemia[J]. Adv Exp Med Biol, 2003, 530: 611-617. DOI:10.1007/978-1-4615-0075-9_60 |
| [20] | Shenaq M, Kassem H, Peng C, et al. Neuronal damage and functional deficits are ameliorated by inhibition of aquaporin and HIF1α after traumatic brain injury (TBI)[J]. J Neurol Sci, 2012, 323(1/2): 134-140. DOI:10.1016/j.jns.2012.08.036 |
| [21] | 董瑞剑, 赵仁亮. 缺氧诱导因子-1与脑缺血耐受[J]. 国际脑血管病杂志, 2006, 14(5): 377-380. DOI:10.3760/cma.j.issn.1673-4165.2006.05.007 |
| [22] | 刘庆新, 陈金波, 朱玉红, 等. 脑出血灶周缺氧诱导因子-1a表达与脑水肿的关系[J]. 中华急诊医学杂志, 2007, 16(9): 921-924. DOI:10.3760/j.issn.1671-0282.2007.09.008 |
| [23] | 贺晓生, 章翔, 易声禹, 等. 头颅瞬间侧向旋转对脑微血管超微结构的影响[J]. 中华神经外科杂志, 2001, 17(3): 158-161. DOI:10.3760/j.issn.1001-2346.2001.03.009 |
| [24] | 李庆勇, 钱志远, 卞中国, 等. 创伤性颅脑损伤后缺氧诱导因子-1α的表达及其在血管修复中的作用[J]. 中华实验外科杂志, 2015, 32(4): 926. DOI:10.3760/cma.j.issn.1001-9030.2015.04.092 |
 2018, Vol. 27
2018, Vol. 27




