肺炎克雷伯菌是临床上常见的条件致病菌,会导致社区获得性肺炎、脑膜炎、菌血症等,引起严重的尿道感染、呼吸道感染和血流感染等医院内感染,尤其多见于重症监护病房与新生儿病房,且广泛存在于自然环境和健康人的肠道、皮肤、鼻咽、呼吸道等部位。近几年,产ESBLs和碳青霉烯酶肺炎克雷伯菌不断出现并发生流行传播,给临床治疗带来了极大的挑战。我国CHINET细菌耐药性监测数据显示,肺炎克雷伯菌对碳青霉烯类抗生素的耐药率在逐年增高,从2005年的3%上升至2016年的19.2%左右。肺炎克雷伯菌除了高耐药表现,其高毒力也是临床非常关注的问题。1986年,我国台湾地区首次报道了引起化脓性肝脓肿的高毒力肺炎克雷伯菌(hypervirulent Klebsiella pneumoniae,HvKP)[1-2],该肺炎克雷伯菌主要感染健康人群和免疫功能低下患者,导致社区获得性感染,具有高黏液表型、高度侵袭性甚至高致死性等特点,临床上主要通过拉丝试验,扩增黏液表型调控因子rmpA2及夹膜血清型K1、K2等基因,中性粒杀菌试验和多位点序列分型等方法来检测。而拉丝试验是临床最主要最便捷的方法,多表现为拉丝试验阳性,呈高黏液型菌落。在过去20年里,HvKP主要分布于我国台湾地区和东南亚,近几年来报道遍布世界[3-4]。
肠道是肺炎克雷伯菌的主要定植场所,细菌感染大多数都是从肠道定植开始[5]。有研究发现,肺炎克雷伯菌能在人体胃肠道定植,而特定夹膜血清型的肺炎克雷伯菌的定植能早于肺炎克雷伯菌侵入肠道黏膜引起胆道感染,继而引发肝脓肿,Chung等[6]报道了韩国健康人粪便中携带较高比例的肝脓肿密切相关的肺炎克雷伯菌株;有文献报道肺炎克雷伯菌能穿过胃肠道屏障引起肝脏的侵袭性感染[7]。因此,肠道肺炎克雷伯菌作为机体的潜在致病菌,应引起足够的重视。腹泻患者是免疫力低下人群,肠道中肺炎克雷伯菌的定植会对其健康有严重威胁[8],本研究针对就诊于急诊肠道门诊中成人和儿童这2个特殊群体的肠道肺炎克雷伯菌,从携带率、耐药性以及毒力基因的分子流行病学等方面进行研究,阐述不同年龄段患者肠道肺炎克雷伯菌的分子流行病学差异。
1 资料与方法 1.1 菌株来源与鉴定收集2017年5月至10月浙江大学医学院附属第二医院急诊肠道门诊成人腹泻患者非重复粪便标本800份,浙江大学医学院附属儿童医院和杭州市儿童医院肠道门诊儿童腹泻患者非重复粪便标本900份,挑取新鲜粪便标本接种于SS平板上,置于35 ℃孵箱中过夜培养,分离分纯后用质谱仪鉴定菌种,大肠埃希菌DH5α作为质谱鉴定质控菌株。大肠埃希菌ATCC25922作为药物敏感性试验的质控菌株。
1.2 材料和仪器药敏纸片(头孢吡肟、头孢他啶、美罗培南、头孢哌酮/舒巴坦、阿米卡星、头孢西丁、环丙沙星、左氧氟沙星、庆大霉素、妥布霉素)购于英国Oxoid公司;哥伦比亚血琼脂、SS琼脂、MH琼脂、中国蓝琼脂购于英国Oxoid公司,PCR反应相关试剂盒、DNA Maker DL2000购于日本Takara公司;MALDI-TOF MS购于德国Brucker公司;生化培养箱购于上海精宏实验设备有限公司;Vitek Densichek比浊仪购于法国生物梅里埃;PCR扩增仪与UVIpro紫外成像与分析系统购于德国Biometra公司;Powerpac电泳仪购于美国BIO-RAD公司;微量移液枪购于德国Eppendorf公司。
1.3 拉丝试验用接种环轻柔向上挑起在哥伦比亚血平板上37 ℃过夜培养的肺炎克雷伯菌单菌落,重复牵拉两次或两次以上,如挑起的拉丝长度≥5 mm,判为拉丝试验阳性;反之判为拉丝试验阴性。
1.4 药物敏感性试验采用K-B法测定肺炎克雷伯菌对上述12种抗生素药敏纸片的抑菌环直径,判定结果参照美国临床和实验室标准化委员会(CLSI2017)推荐的折点。
1.5 肺炎克雷伯菌毒力基因的检测用煮沸法提取细菌DNA,作为PCR扩增的模板。PCR检测肺炎克雷伯菌常见的荚膜血清型(K1和K2)[9-11],rmpA2、rmpA、iroN、iucA、entB、irp-1、irp-2、fyuA、mrkD、ybtS、magA、iutA、wcaG、fimH-1等毒力基因。
1.6 耐药基因的检测PCR扩增的方法检测常见的碳青霉烯耐药基因(blaKPC、blaNDM、blaIMP-1、blaIMP-2)、超广谱β-内酰胺酶基因(blaTEM、blaSHV、blaCTX-M-1组、blaCTX-M-2组、blaCTX-M-8组和blaCTX-M-9组)、喹诺酮类抗生素耐药基因[qnrA、qnrB、qnrC、qnrD、qnrS、aac(6')-Ib-cr、qepA、oqxA及oqxB],参考既往研究合成特异性引物[12-13]。PCR扩增产物经1%琼脂糖凝胶电泳后用Bio-Rad凝胶成像仪检测成像,阳性扩增产物进行测序分析,测序结果根据与Genbank数据库中序列比对确定基因型。
2 结果 2.1 菌株分离情况来自成人和儿童腹泻患者总计1 700份粪便标本中分离到346株肺炎克雷伯菌,携带率为20.4%,其中192株来自成人腹泻患者(192/800,携带率24%),154株来自儿童腹泻患者(154/900,携带率17.1%)。
2.2 拉丝试验结果共有17株(4.9%)肺炎克雷伯菌拉丝试验阳性,即为高黏液表型菌株,其中12株来自成人腹泻患者,5株来自儿童腹泻患者,但拉丝试验与毒力基因检测并不完全吻合,儿童腹泻患者拉丝阳性但并不携带K1、K2型荚膜血清型,成人腹泻患者拉丝阳性只有4株对应携带K1+rmpA+rmpA2+iroN组合毒力基因。
2.3 药敏实验结果不同人群中分离的肺炎克雷伯菌对抗生素敏感性结果有明显差异,见表 1。成人腹泻患者肺炎克雷伯菌对碳青霉烯类抗生素、酶抑制剂、复合药以及氨基糖苷类抗生素阿米卡星全部敏感,而儿童腹泻患者的耐药率分别为1.3%、3.2%、1.3%、2.6%,对于头孢噻肟(第三代头孢类抗生素),成人和儿童腹泻患者的耐药率分别为11.5%、11.7%,对头孢吡肟(第四代头孢菌素类)的耐药率分别为(5.2% vs. 15.6%),差异有统计学意义(P < 0.05),而对于喹诺酮类抗生素环丙沙星和左氧氟沙星,成人腹泻患者肺炎克雷伯菌的耐药率明显高于儿童腹泻患者(9.4% vs. 3.2%),差异有统计学意义(P < 0.05)。
| 抗生素 | 成人(n=192) | 儿童(n=154) | |||||
| 敏感率 | 中介率 | 耐药率 | 敏感率 | 中介率 | 耐药率 | ||
| 美罗培南 | 100 | 0 | 0 | 98.7 | 0 | 1.3 | |
| 头孢吡肟 | 89.1 | 5.7 | 5.2 | 79.9 | 4.5 | 15.6 | |
| 替加环素 | 41.1 | 56.3 | 2.6 | 61.7 | 37 | 1.3 | |
| 头孢噻肟 | 87 | 1.5 | 11.5 | 87 | 1.3 | 11.7 | |
| 哌拉西林/他唑巴坦 | 100 | 0 | 0 | 96.2 | 0.6 | 3.2 | |
| 头孢哌酮/舒巴坦 | 95.8 | 4.2 | 0 | 98.1 | 0.6 | 1.3 | |
| 阿米卡星 | 99 | 1.0 | 0 | 97.4 | 0 | 2.6 | |
| 氨曲南 | 90.1 | 5.7 | 4.2 | 89 | 4.5 | 6.5 | |
| 环丙沙星 | 83.8 | 6.8 | 9.4 | 92.3 | 4.5 | 3.2 | |
| 左氧氟沙星 | 89.6 | 1.0 | 9.4 | 96.2 | 0.6 | 3.2 | |
| 妥布霉素 | 79.1 | 4.2 | 16.7 | 92.9 | 1.3 | 5.8 | |
| 庆大霉素 | 85.4 | 0.5 | 14.1 | 94.8 | 0 | 5.2 | |
不同人群中分离的肺炎克雷伯菌的夹膜血清型和毒力基因分布有所差异。在成人腹泻患者肠道肺炎克雷伯菌中,rmpA、rmpA2、K1和K2的检出率分别为7.8%、6.7%、3.6%和3.6%,而在儿童腹泻患者肠道肺炎克雷伯菌中除了K2(0.7%)均未检出。成人和儿童腹泻患者肠道肺炎克雷伯菌entB检出率最高,分别为99.5%和100%,mrkD、fimH-1次之,检出率分别为(93.2% vs. 95.5%,94.3% vs.92.9%)而其他毒力基因irp-2、irp-1、fyuA、wcaG也有较高检出率。成人与儿童相比较,其中K1、rmpA2、rmpA、iroN、entB、irp-1、fyuA、ybtS这8个毒力基因检出率差异有统计学意义(P < 0.05),见图 1。
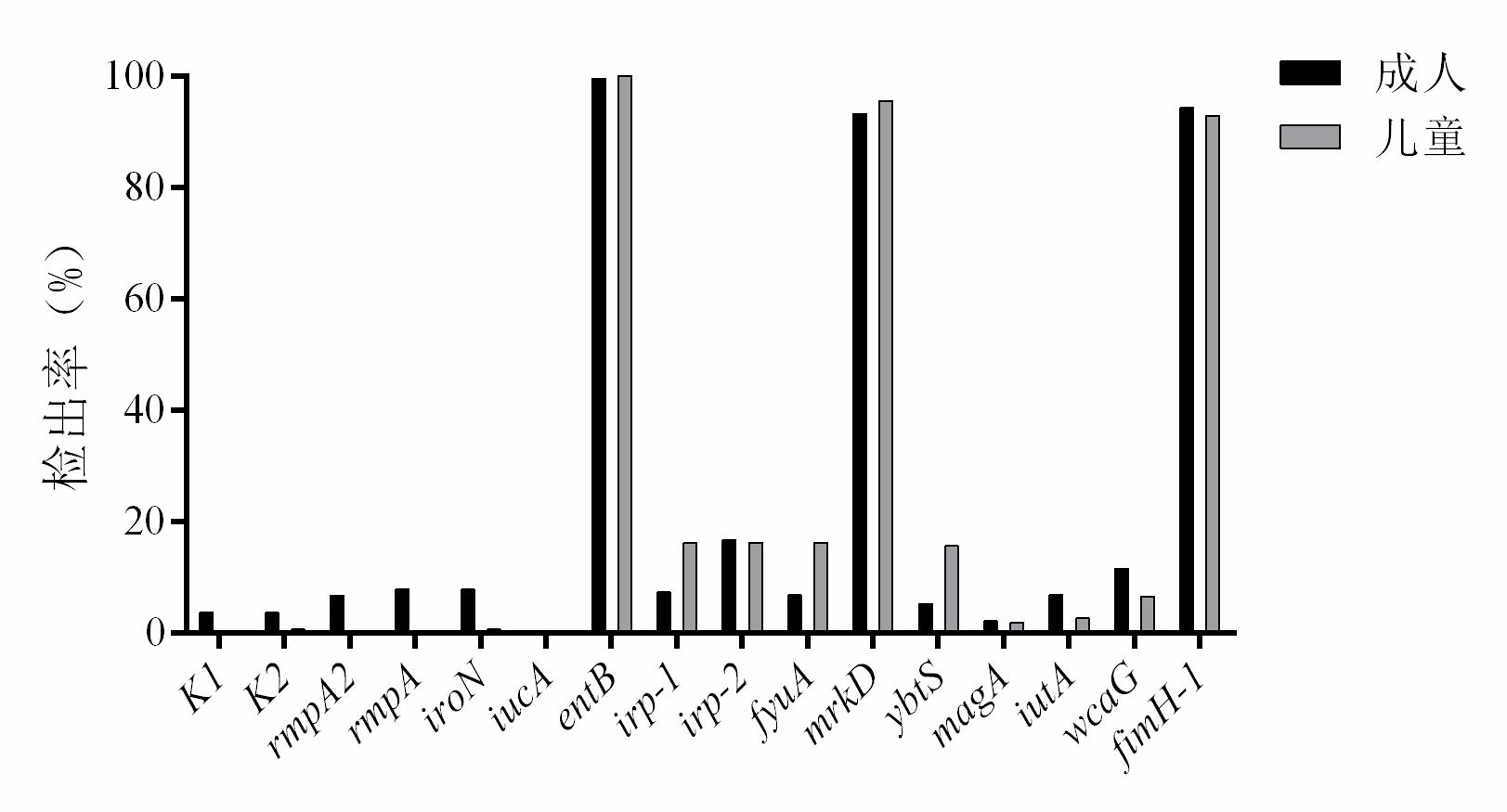
|
| 图 1 成人和儿童急性腹泻患者毒力基因的检测结果 |
|
|
364株肺炎克雷伯菌中,共有56株(15.4%)产ESBLs,成人和儿童腹泻患者产ESBLs的阳性率分别为12.5%和20.8%。其中18株产CTX-M-1组ESBLs,12株产CTX-M-9组ESBLs,其中主要为CTX-M-3(61.1%)和CTX-M-27(33.3%),41株中检测出SHV酶,主要为SHV-11(31.7%),23株为质粒介导的喹诺酮耐药基因,成人和儿童对喹诺酮耐药基因的检出率分别为9.8%和3.2%,主要基因型均为qnrB2,检出率分别为100%和50%。此外,儿童腹泻患者肠道肺炎克雷伯菌有两株碳青霉烯耐药菌株,PCR扩增检测碳青霉烯耐药基因,其中一株为blaKPC扩增阳性,经测序证实为blaKPC-2基因,另一株是除了常见碳青霉烯耐药基因以外的耐药机制。
3 讨论肺炎克雷伯菌是医院获得性感染最常见的致病菌之一,常导致免疫系统受损的患者发生各种严重感染,急性腹泻患者免疫力相对低下,而儿童自身免疫力尚未完善,非特异性和特异性免疫功能低下,因此易发生条件致病菌感染,而新生儿年龄越小发病率越高,是肺炎克雷伯菌感染的高危人群,有文献报道肺炎克雷伯菌是新生儿院内感染最常见的致病菌,检出率达37.7%[14]。此外,肠道是肺炎克雷伯菌的主要储库,不同地区不同人群肠道肺炎克雷伯菌携带情况也有所差异。印度地区儿童急性腹泻肠道肺炎克雷伯菌的检出率为7.8%[15];韩国健康成年肠道中肺炎克雷伯菌携带率为21.1%[6];浙江地区报道的成人急性腹泻患者肠道肺炎克雷伯菌的检出率为17.1%,健康体检人群高达30.5%[16]。在本次实验中,成人和儿童腹泻患者肠道肺炎克雷伯菌的携带率分别为24%和17.1%,高于国内外的研究报道。
随着全球范围内抗生素广泛使用以及不合理的滥用,临床耐药现象日益严重。其中,肺炎克雷伯菌成为临床治疗中最重要最常见的耐药菌。在2016年全国细菌耐药监测网中,肺炎克雷伯菌对第三代头孢菌素的耐药率全国平均为34.5%,在浙江耐药率达到32.9%;肺炎克雷伯菌对碳青霉烯类药物的耐药率为8.7%,而浙江省高达到15.8%。本次研究中成人和儿童腹泻患者肠道肺炎克雷伯菌中ESBLs检出率分别为12.5%和20.8%,这与文献中浙江地区人群肠道中分离的产ESBLs的肺炎克雷伯菌检出率一致(检出率为19.2%)[17]。ESBLs大多来源于TEM、SHV位的基因突变,主要基因型有blaTEM、blaSHV和blaCTX-M等。本研究中,ESBLs基因型主要为blaCTX-M,与文献报道中我国的主要基因型相符[18]。
近年来,HvKP已成为全球关注的问题[19]。荚膜多糖、LPS、菌毛及铁载体四大类毒力因子是HvKP主要毒力机制,目前,大陆地区K1和K2是临床上最常见的荚膜血清型。本研究对成人和儿童腹泻患者分离的肺炎克雷伯菌进行了K1、K2荚膜血清型和相关毒力因子进行了筛查,包括黏液表型调控因子rmpA2和rmpA,黏性相关基因magA,脂多糖合成相关wcaG,fim-H-1,菌毛粘附素基因mrkD以及铁载体编码基因irp-1、irp-2和耶尔森菌素ybtS、fyuA等,发现在成人腹泻患者肠道肺炎克雷伯菌中,rmpA、rmpA2、K1和K2的检出率分别为7.8%、6.7%、3.6%和3.6%,而在儿童腹泻患者肠道肺炎克雷伯菌中除了K2(0.7%)均未检出。成人和儿童腹泻患者肠道肺炎克雷伯菌entB检出率最高,分别99.5%和100%,mrkD、fimH-1次之,检出率分别为(93.2% vs. 95.5%,94.3% vs. 92.9%),而其他毒力基因irp-2、irp-1、fyuA、wcaG也有较高检出率。成人腹泻患者粘附素中有携带既是拉丝试验阳性,又同时是K1+rmpA2+rmpA+iroN组合的高毒力肺炎克雷伯菌,其他主要携带ybtS+fimH-1+菌素组合,儿童腹泻患者中仅有一株分离出K2荚膜血清型,其他主要携带mrkD+fimH-1+菌素组合。目前,已经有文献报道在急性腹泻儿童中分离出既携带HvKP,又对多种抗生素耐药的菌株[20],而在本实验中分离的成人腹泻患者HvKP较传统肺炎克雷伯菌较敏感,常见抗生素耐药菌株较少。
综上所述,成人腹泻患者比儿童腹泻患者肠道中肺炎克雷伯菌携带率高,成人腹泻患者比儿童腹泻患者更趋向于携带毒力基因的肺炎克雷伯菌,同时肠道肺炎克雷伯菌有多重耐药现象,儿童耐药情况甚至比成人更为严重。肠道肺炎克雷伯菌是潜在的致病菌,虽然不一定是导致腹泻的直接原因,但可能在机体免疫力低下时发生移位而造成感染,因此临床上应该关注腹泻患者肠道携带的肺炎克雷伯菌的耐药和毒力的检测。
| [1] | Decré D, Verdet C, Emirian A, et al. Emerging severe and fatal infections due to klebsiella pneumoniae in two university hospitals in France[J]. J Clin Microbiol, 2011, 49(8): 3012-3014. DOI:10.1128/JCM.00676-11 |
| [2] | Liu YC, Cheng DL, Lin CL. Klebsiella pneumoniae liver abscess associated with septic endophthalmitis[J]. Arch Intern Med, 1986, 146(10): 1913-1916. DOI:10.1001/archinte.146.10.1913 |
| [3] | Chang L, Bastian I, Warner M. Survey of Klebsiella pneumoniae, bacteraemia in two South Australian hospitals and detection of hypermucoviscous phenotype and magA/rmpA, genotypes in K. pneumoniae, isolates[J]. Infection, 2013, 41(2): 559-563. DOI:10.1007/s15010-012-0374-y |
| [4] | Mccabe R, Lambert L, Frazee B. Invasive Klebsiella pneumoniae infections, California, USA[J]. Emerg Infect Dis, 2010, 16(9): 1490-1491. DOI:10.3201/eid1609.100386 |
| [5] | Montgomerie JZ. Epidemiology of Klebsiella and hospital-associated infections[J]. Rev Infect Dis, 1979, 1(5): 736. DOI:10.1093/clinids/1.5.736 |
| [6] | Chung DR, Lee H, Park MH, et al. Fecal carriage of serotype K1 Klebsiella pneumoniae ST23 strains closely related to liver abscess isolates in Koreans living in Korea[J]. Eur J Clin Microbiol Infect Dis, 2012, 31(4): 481-486. DOI:10.1007/s10096-011-1334-7 |
| [7] | Tu YC, Lu MC, Chiang MK, et al. Genetic Requirements for Klebsiella pneumoniae-Induced Liver Abscess in an Oral Infection Model[J]. Infect Immun, 2009, 77(7): 2657. DOI:10.1128/IAI.01523-08 |
| [8] | 葛婧, 钟雪珊, 肖刚, 等. 广州地区急性腹泻患儿粪便中多重耐药及高毒力肺炎克雷伯菌分布检测[J]. 中华疾病控制杂志, 2017, 21(6): 562-566. DOI:10.16462/j.cnki.zhjbkz.2017.06.006 |
| [9] | Fang CT, Chang SC. Klebsiella pneumoniae Genotype K1: an emerging pathogen that causes septic ocular or central nervous system complications from pyogenic liver absces[J]. Clin Infect Dis, 2007, 45(3): 284. DOI:10.1086/519262 |
| [10] | Turton JF, Baklan H, Siu LK, et al. Evaluation of a multiplex PCR for detection of serotypes K1, K2 and K5 in Klebsiella sp. and comparison of isolates within these serotypes[J]. FEMS Microbiol Lett, 2008, 284(2): 247-252. DOI:10.1111/j.1574-6968.2008.01208.x |
| [11] | Fang CT, Chuang YP, Shun CT, et al. A novel virulence gene inklebsiella pneumoniaestrains causing primary liver abscess and septic metastatic complications[J]. J Exp Med, 2004, 199(5): 697-705. DOI:10.1084/jem.20030857 |
| [12] | Yigit H, Queenan AM, Anderson GJ, et al. Novel carbapenem-hydrolyzing beta-lactamase, KPC-1, from a carbapenem-resistant strain of Klebsiella pneumoniae[J]. Antimicrob Agents Chemother, 2001, 45(4): 1151-1161. DOI:10.1128/AAC.45.4.1151-1161.2001 |
| [13] | Zhang R, Hu YY, Yang X F, et al. Emergence of NDM-producing non-baumannii Acinetobacter spp. isolated from China[J]. Eur J Clin Microbiol Infect Dis, 2014, 33(5): 853. DOI:10.1007/s10096-013-2024-4 |
| [14] | Orsi GB, Scorzolini L, Franchi C, et al. Hospital-acquired infection surveillance in a neurosurgical intensive care unit[J]. J Hosp Infect, 2006, 64(1): 23-29. DOI:10.1016/j.jhin.2006.02.022 |
| [15] | Rathaur VK, Pathania M, Jayara A, et al. Clinical study of acute childhood diarrhoea caused by bacterial enteropathogens[J]. J Clin Diagn Res, 2014, 8(5): 1-5. DOI:10.7860/JCDR/2014/6677.4319 |
| [16] | 顾丹霞.不同人群肠道肺炎克雷伯菌毒力及耐药情况研究[D].杭州: 浙江大学, 2015. |
| [17] | 谢鑫友. 2016浙江省医院细菌耐药检测年鉴[M]. 杭州: 浙江大学出版社, 2017. |
| [18] | Huang SY, Pan KY, Liu XQ, et al. Analysis of the drug-resistant characteristics of Klebsiella pneumoniae isolated from the respiratory tract and CTX-M ESBL genes[J]. Genet Mol Res, 2015, 14(4): 12043. DOI:10.4238/2015.October.5.17 |
| [19] | Shon AS, Bajwa RP, Russo TA. Hypervirulent (hypermucoviscous) Klebsiella pneumoniae: a new and dangerous breed[J]. Virulence, 2013, 4(2): 107-118. DOI:10.4161/viru.22718 |
| [20] | 胡付品, 朱德妹, 汪复, 等. 2014年CHINET中国细菌耐药性监测[J]. 中国感染与化疗杂志, 2015, 15(5): 401-410. DOI:10.1128/IAI.01523-08 |
 2018, Vol. 27
2018, Vol. 27




