2 310003 杭州,浙江大学医学院附属第一医院精神卫生科
亚低温对临床多种脑组织损伤,如脑缺血、脑外伤缺血缺氧性脑病等,可改善其生存、预后,并具有一定的保护作用,但也存在病死率增加等现实问题。同时,亚低温在急性脑缺血-再灌注损伤后缺血灶葡萄糖代谢和神经干细胞增殖等的确切机制尚不明确。因此,本研究采用亚低温治疗急性脑缺血-再灌注损伤大鼠,利用18F-脱氧葡萄糖(18F-FDG)小动物正电子发射断层扫描观察不同脑区葡萄糖代谢变化,采用神经功能缺损评分和免疫组化法分别测定和评价整体神经功能恢复,5'-BrdU标记阳性细胞数量等,旨在探讨亚低温治疗脑缺血的可能分子作用机制,为该方法治疗脑缺血后神经损伤和修复等提供客观的实验依据。
1 材料与方法 1.1 实验动物采用Sprague-Dawley雄性大鼠,清洁级,体质量(250±20)g,购于浙江中医药大学动物实验中心,实验室符合国家动物实验设施屏障系统标准,动物实验条件合格证:SYXK(浙)2008-0015。实验前12 h禁食,自由饮水。
1.2 试剂与材料18F-FDG显像剂为浙江大学医学院附属第二医院核医学科制备赠送。BrdU试剂及免疫组化等相关试剂均为市售。
1.3 大鼠脑缺血-再灌注模型建立及亚低温治疗1.5%的戊巴比妥(30 mg/kg)腹腔麻醉后仰卧固定,经颈部暴露右侧颈总动脉、颈外动脉和颈内动脉。用丝线将远心端的颈外动脉结扎,并在颈外动脉近分叉处穿一丝线备用,用微型动脉夹先将颈总动脉和颈内动脉夹闭。在颈外动脉近分叉处剪一小口,将一段头端光滑圆球的单股尼龙线,自切口插入,轻柔推进栓线,打开颈内动脉上的动脉夹,使栓线沿颈内动脉进入到大脑中动脉的起始端,用备用丝线固定栓线,从颈外动脉分叉处约18~20 mm即可。整个缺血过程用照明灯保持控制直肠温度在36~37 ℃。缺血后60 min轻拉栓线退回颈外动脉开口处,并打开颈总动脉上的动脉夹行再灌注。关闭并缝合皮肤,放回饲养笼中继续饲养。正常对照亚低温组32~34 ℃,亚低温治疗组动物放入控降温箱内,使食道温度维持在32~34 ℃之间,维持24 h,然后复温,速度0.5 ℃/h[1-2]。
1.4 神经行为学检测大鼠清醒后于再灌注2 h观察神经行为学变化。按改良大鼠神经功能缺损评分:按照Masao Shmizu-Sasamata的方法对所有大鼠进行神经行为评分,评分标准包括:①自主活动的程度;②左前肢偏瘫;③提尾时左前肢伸不直;④抗侧推能力;⑤向左倾斜度;⑥向左环行度;⑦对触须的反应。以上指标无异常为0分,中等异常为1分,严重异常为2分,将各项评分相加,总分为0~14分。神经行为学评分为大于6分的(middle cerebral artery occlusion, MCAO)动物为本实验选用[3]。
1.5 18F-FDG小动物PET扫描显像将大鼠用异氟烷(1.5%)麻醉并经尾静脉注射约18.5 MBq的18F-FDG。18F-FDG注射30 min后,大鼠再次麻醉,然后将其放于小动物PET上进行10 min的静态扫描。扫描得到的图像用改进的反向投射算法进行重建。18F-FDG摄取通过ASIPro 6.0.5.0软件包计算注射剂量占每克组织的百分比。于每幅图像平面,在大脑皮质的梗死区域及对侧对应的正常区域分别画出直径2 mm的三维区域,同时算出注射剂量占每克组织百分比的平均数。损伤侧与相应正常侧的比值(L/N)被用来作半定量分析。L/N比值通过以下公式得到:L/N=损伤侧感兴趣区的平均像素数/正常侧相应区域的平均像素值。损伤区域的平均放射性活度通过平均像素值而得到反映,并计算其占正常侧非损伤区域的平均像素值的百分比而得到标准化处理。小脑标准化值=各组内小脑平均像素值/10 000。以上PET扫描显像图像分析分布在亚低温治疗后第0、1周时间点进行。
1.6 BrdU标记及免疫组化阳性细胞计数将BrdU溶于0.007 mol/L NaOH的生理盐水中,用前新鲜配制。按75 mg/kg腹腔内注射,分4次注射,每次间隔2 h。最后1次注射24 h后灌注、取材、切片(片厚40 μm)。BrdU免疫组化染色步骤:用0.01 mol/L PBS洗大脑切片5 min×3次,3%H2O2室温处理30 min,0.01 mol/L PBS洗5 min×3次,50%甲酰胺/2×标准柠檬酸钠盐,65 ℃温箱处理2 h,2×SSC洗5 min×3次,2 mol/L HCl 37 ℃温箱处理30 min,0.1 mol/L pH 8.0硼酸缓冲液洗5 min×3次,0.01 mol/L PBS 5 min×3次,1:50正常山羊血清封闭30 min,小鼠抗BrdU单抗(Sigma, 1:400)4 ℃过夜,0.01 mol/L PBS洗5 min×3次,1:200 SABC室温30 min,DAB显色液,苏木精染色,常规脱水、透明和封片。每例动物分别计数6张脑片上纹状体BrdU阳性细胞数。以6张切片上双侧纹状体BrdU阳性细胞总数反映该动物纹状体神经干细胞增殖状态。
1.7 统计学方法用SPSS 19.0软件进行统计分析。数据采用均数±标准差(x±s)表示,组间比较采用方差分析(ANOVA),组间两两比较采用SNK-q检验,以P < 0.05为差异有统计学意义。
2 结果 2.1 大鼠脑缺血后神经功能缺损评分与模型组相比,亚低温治疗组神经功能缺损评分显著提高(P < 0.05),见表 1。
| 时点 | 假手术组 | 模型组 | 亚低温治疗组 |
| 治疗第0周 | 0±0 | 12.08±2.54 | 11.92±1.87 |
| 治疗第1周 | 0±0 | 10.21±3.36 | 8.46±2.55a |
| 注:与模型组比,aP < 0.05;组间两两比较,差异有统计学意义 | |||
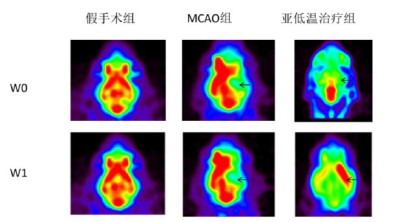
18F-FDG小动物PET观察局部亚低温治疗过程中对脑缺血大鼠的小脑区域葡萄糖高代谢,大脑中动脉阻塞性缺血梗死区低代谢,而局部亚低温治疗后小脑区域葡萄糖低代谢,缺血梗死区域葡萄糖高代谢,且差异有统计学意义,见表 2~3,图 1。
| 组别 | 左侧 | 右侧 | 小脑 |
| 假手术组 | 3 631.52±125.33 | 3 692.40±162.15 | 3 769.68±233.92 |
| 正常亚低温对照组 | 8 093.57±227.11 | 7 523.33±50.12 | 13 269.59±76.46 |
| 模型组 | 5 731.23±213.16 | 4 330.90±539.75a | 5 252.49±742.19 |
| 亚低温治疗组 | 2 385.11±31.76 | 2 271.01±40.90b | 1 602.18±236.32 |
| 注:与假手术组比较,aP < 0.01;与模型组比较,bP < 0.01 | |||
| 组别 | 左侧/右侧 | 左侧/小脑 | 右侧/小脑 | 小脑标准化值 |
| 假手术组 | 0.98 | 0.96 | 0.98 | 0.38 |
| 正常亚低温对照组 | 1.08 | 0.61 | 0.57 | 1.33 |
| 模型组 | 1.32 | 1.09 | 0.82 | 0.53 |
| 亚低温治疗组 | 1.05 | 1.49 | 1.42 | 0.16 |
|
| MCAO,大鼠大脑中动脉阻塞模型,W0为第0周,W1为第1周,黑色箭头为右侧脑缺血区域 图 1 不同组别大鼠脑缺血18F-FDG小动物PET显像 |
|
|
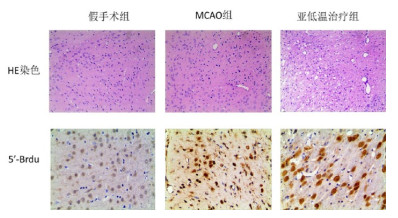
模型组缺血侧纹状体可见BrdU阳性细胞分布,亚低温组BrdU阳性细胞成簇分布。免疫组化结果提示,亚低温治疗组在促进脑缺血后纹状体神经细胞增殖方面明显(P < 0.01),见表 4,图 2。
| 组别 | 假手术组 | 模型组 | 亚低温治疗组 |
| 治疗第1周 | 5.95±1.63 | 8.14±1.87a | 11.26±2.25b |
| 注:与假手术组比,aP < 0.05;与模型组比,bP < 0.01;两组比较,差异有统计学意义 | |||
|
| MCAO,大鼠大脑中动脉阻塞模型;HE染色光镜下放大100倍,BrdU免疫组化光镜下放大200倍 图 2 亚低温治疗大鼠脑缺血梗死周围组织病理HE染色及纹状体神经干细胞5'-BrdU标记阳性细胞图像 |
|
|
亚低温治疗是脑缺血,急性重型脑损伤等最常用治疗方法之一,已有临床和实验研究结果表明,亚低温治疗后可降低病死率,提高生存率[4-7],减少脑缺血后炎症因子NF-κB的生成等[8],但相关神经保护作用机制未完全阐明。
本实验采用18F-FDG小动物PET观察大鼠脑缺血后葡萄糖代谢变化,初步发现正常对照组亚低温治疗后双侧皮质葡萄糖代谢区域对称分布,小脑区域葡萄糖代谢区域分布相对皮质提高,其左侧/小脑,右侧/小脑比值降低;模型组右侧脑缺血大鼠葡萄糖代谢率明显降低,经亚低温治疗7 d后逆转,小脑葡萄糖代谢呈低代谢分布,右侧缺血梗死区域葡萄糖呈高代谢分布,左侧/小脑,右侧/小脑比值明显提高(均P < 0.01),且以上结果与神经功能评分结果一致。提示亚低温治疗通过减少小脑葡萄糖代谢率,提高脑缺血区域葡萄糖代谢率,产生一定神经保护作用,进一步发现,局部亚低温对脑缺血损伤后纹状体脑区神经干细胞增殖水平有一定促进作用。Yuan等[9]体外实验结果表明,采用亚低温预处理可增加糖氧剥夺大鼠小脑脑片浦肯野神经细胞的存活,减少浦肯野神经细胞的凋亡,从而产生一定的神经保护作用,可能与其减少诱导型一氧化氮合酶表达有关,该体外实验结果与本实验动物发现结果一致。
运用分子影像学技术观察和评价不同治疗方法对急性脑缺血-再灌注损伤效果有一定的优势,如可无创,动态,观察脑代谢变化,采用不同的显像剂,可特异性观察生化代谢变化[10-12]。如有学者利用脑血流显像剂99mTc-HMPAO进行小动物单光子发射扫描显像(SPECT)结合CT观察亚低温对急性局灶性脑缺血大鼠脑血流情况变化,结果提示,与模型组相比,亚低温治疗可改善缺血性脑损伤脑血流量,他们认为,小动物SPECT/CT可从功能到结构水平上快速、重复半定量评价急性脑卒中治疗前后等缺血组织变化[13]。Luo等[14]运用18F-FDG PET观察亚低温治疗对新生儿缺血缺氧性脑病后脑葡萄糖代谢变化的影响,结果表明,与传统治疗组比,亚低温治疗明显改善脑葡萄糖代谢。本实验结果提示,18F-FDG小动物PET适合用于动态、定量地观察和评价亚低温对急性脑缺血的影响,并具有一定的临床转化应用价值。
综上所述,本研究通过18F-FDG PET分子影像技术观察亚低温治疗对大鼠脑缺血前后不同脑区葡萄糖代谢率结合病理学、免疫组化等结果提示,亚低温治疗具有一定的神经保护作用,可能与通过改善神经功能缺损评分,增加大脑缺血葡萄糖代谢率和促进神经干细胞的增殖有关,为临床应用亚低温治疗提供了初步的实验依据,值得进一步深入研究和探讨。
| [1] | 廖晓星, 胡春林, 文洁, 等. 兔心肺复苏后经腹腔诱导亚低温的研究[J]. 中华急诊医学杂志, 2010, 19(1): 16-20. DOI:10.3760/cma.j.issn.1671-0282.2010.01.005 |
| [2] | 胡春林, 魏红艳, 廖晓星, 等. 兔室颤心搏骤停模型的建立[J]. 中华急诊医学杂志, 2009, 18(9): 943-947. DOI:10.3760/cma.j.issn.1671-0282.2009.09.011 |
| [3] | Endres M, Namura S, Shimizu-Sasamata M, et al. Attenuation of delayed neuronal death after mild focal ischemia in mice by inhibition of the caspase family[J]. J Cereb Blood Flow Metab, 1998, 18(3): 238-247. DOI:10.1097/00004647-199803000-00002 |
| [4] | Gao XY, Huang JO, Hu YF, et al. Combination of mild hypothermia with neuroprotectants has greater neuroprotective effects during oxygen-glucose deprivation and reoxygenation-mediated neuronal injury[J]. Sci Rep, 2014, 18(4): 7091. DOI:10.1038/srep07091 |
| [5] | Murtha LA, McLeod DD, Pepperall D, et al. Intracranial pressure elevation after ischemic stroke in rats: cerebral edema is not the only cause, and short-duration mild hypothermia is a highly effective preventive therapy[J]. J Cereb Blood Flow Metab, 2015, 35(4): 592-600. DOI:10.1038/jcbfm.2014.230 |
| [6] | Piironen K, Tiainen M, Mustanoja S, et al. Mild hypothermia after intravenous thrombolysis in patients with acute stroke: a randomized controlled trial[J]. Stroke, 2014, 45(2): 486-491. DOI:10.1161/STROKEAHA.113.003180 |
| [7] | Su Y, Fan L, Zhang Y, et al. Improved neurological outcome with mild hypothermia in surviving patients with massive cerebral hemispheric infarction[J]. Stroke, 2016, 47(2): 457-463. DOI:10.1161/STROKEAHA.115.009789 |
| [8] | Webster CM, Kelly S, Koike MA, et al. Inflammation and NFkappaB activation is decreased by hypothermia following global cerebral ischemia[J]. Neurobiol Dis, 2009, 33(2): 301-312. DOI:10.1016/j.nbd.2008.11.001 |
| [9] | Yuan HB, Huang Y, Zheng S, et al. Hypothermic preconditioning reduces Purkinje cell death possibly by preventing the over-expression of inducible nitric oxide synthase in rat cerebellar slices after an in vitro simulated ischemia[J]. Neuroscience, 2006, 142(2): 381-389. DOI:10.1016/j.neuroscience.2006.06.053 |
| [10] | Yang J, Li J, Lu J, et al. Synergistic protective effect of astragaloside IV-tetramethylpyrazine against cerebral ischemic-reperfusion injury induced by transient focal ischemia[J]. J Ethnopharmacol, 2012, 140(1): 64-72. DOI:10.1016/j.jep.2011.12.023 |
| [11] | Zhang H, Song F, Xu C, et al. Spatiotemporal PET imaging of dynamic metabolic changes after therapeutic approaches of induced pluripotent stem cells, neuronal stem cells, and a chinese patent medicine in stroke[J]. J Nucl Med, 2015, 56(11): 1774-1779. DOI:10.2967/jnumed.115.163170 |
| [12] | Li JH, Lu J, Zhang H. Functional recovery after scutellarin treatment in transient cerebral ischemic rats: a pilot study with (18) F-fluorodeoxyglucose microPET[J]. Evid Based Complement Alternat Med, 2013, 2013: 507091. DOI:10.1155/2013/507091 |
| [13] | Ceulemans AG, Hernot S, Zgavc T, et al. Serial semiquantitative imaging of brain damage using micro-SPECT and micro-CT after endothelin-1-induced transient focal cerebral ischemia in rats[J]. J Nucl Med, 2011, 52(12): 1987-1992. DOI:10.2967/jnumed.110.085902 |
| [14] | Luo M, Li Q, Dong W, et al. Evaluation of mild hypothermia therapy for neonatal hypoxic-ischaemic encephalopathy on brain energy metabolism using (18)F-fluorodeoxyglucose positron emission computed tomography[J]. Exp Ther Med, 2014, 8(4): 1219-1224. DOI:10.3892/etm.2014.1884 |
 2018, Vol. 27
2018, Vol. 27




