百草枯(paraquat, PQ)是一种有效且广泛使用的除草剂,其中毒后救治成功率极低[1-2]。研究表明,PQ的急性毒性作用,表现为肺水肿和缺氧,进而发展为不可逆转的肺纤维化。糖皮质激素、抗氧化剂和细胞毒药物等虽可减轻其毒性[3-6],但是治疗效果较差,病死率居高不下[7-8]。基于目前尚无特效解毒剂, 因此研究PQ诱导的肺纤维化的分子机制对改善治疗效果和降低病死率至关重要。
结缔组织生长因子(CTGF)是富含半胱氨酸的细胞外基质相关的肝素结合蛋白,是CCN家族的成员之一[9]。正常生理状态下,CTGF在组织中有低水平的表达,而在纤维化和癌性组织中表达明显上调[10]。CTGF参与调节与纤维化相关的各种生物过程,包括细胞粘附、增殖、迁移、分化、细胞外基质(extracellular matrix, ECM)产生[11-13]和血管生成[14]。另外,研究发现CTGF能促进胶原蛋白等ECM蛋白的沉积[15]。在几种肺损伤模型中肺成纤维细胞合成的异常ECM与纤维化有关[16-17]。ECM的合成能进一步刺激肺成纤维细胞的增殖、迁移和分化成肌成纤维细胞[18]。虽然CTGF已被证明在博来霉素诱导的肺纤维化中起重要作用[19],但是这种生长因子与PQ诱导的肺纤维化之间的联系尚未明确。本研究旨在探究PQ对CTGF表达和随后的肺纤维化的影响,进一步阐明CTGF对ECM的合成、细胞增殖、迁移和肌成纤维细胞分化等的影响与PQ中毒的关系。
1 材料与方法 1.1 实验材料MRC-5肺成纤维细胞购自美国ATCC细胞库;雄性SD大鼠从南京大学动物中心(南京)购入;百草枯试剂(美国Sigma公司);CTGF试剂(美国PeproTech),CTGF抗体、α-SMA抗体和胶原蛋白I抗体(英国Abcam公司);Western-blot二抗山羊抗兔Alexa Fluor 594或488(美国Invitrogen Life Science公司);免疫组化二抗(武汉博士德公司);CCK-8试剂盒(日本,Dojindo Laboratories),苏木精-伊红(HE)试剂盒(南通碧云天)和Masson染色试剂盒(南京建成生物工程研究所),BCA试剂盒(武汉博士德生物技术有限公司)。
1.2 实验方法 1.2.1 细胞培养MRC-5人肺成纤维细胞使用高DMEM与10%胎牛血清、1%L-谷氨酰胺和1%青霉素/链霉素溶培养,在37 ℃,5%CO2中培养。细胞生长至80%融合,使用0.25%的胰蛋白酶按1:3传代。
1.2.2 CCK8检测肺成纤维细胞活力将细胞按2×106/mL的密度接种于6孔板中培养12 h,并用各种浓度的CTGF(50~200 ng/mL)处理24、48或72 h。然后转移到96孔板(n=8)中,每孔密度为2×104/100 μL, 培养12 h后取出培养基并在每孔中加入100 μL含10 μL无血清培养基的CCK-8溶液。孵育4 h后,使用多探头微孔板处理机测量波长为450 nm时的吸光度(A)。
1.2.3 Transwell检测肺成纤维细胞的迁移能力将细胞以每上层室4×104个的密度接种在无血清培养基的6孔板中。含有不同浓度CTGF(50~200 ng/mL)的培养基(含10%FBS, 1 mL)同时加到下室中。上下腔室由孔径为8 μm的可渗透聚碳酸酯膜隔开。培养24 h。而后用4%多聚甲醛固定滤膜下表面的细胞30 min,PBS洗涤3次,并用0.1%结晶紫染色30 min。用棉签轻轻刮掉上表面的残留细胞。每个膜随机选取10个不同的视野,并使用显微镜记数。实验重复进行3次。
1.2.4 动物分组和实验设计48只成年雄性SD大鼠,体质量200~250 g,随机(随机数字法)分为两组(每组n=24)。实验组接受单次腹腔注射PQ(30 mg/kg),而对照组注射等量的无菌生理盐水。分别在第7、14和28天后颈椎脱臼法处死大鼠,取出肺脏,称质量。
本研究通过南京军区总医院实验动物伦理委员会审核批准。所有的动物都按照南京大学评审委员会批准的实验道德准则处理。给老鼠喂食专用饲料,提供随意饮水,并保持12 h:12 h的光照周期。
1.2.5 组织学方法分析肺组织纤维化的严重程度用4%多聚甲醛固定大鼠左肺16 h。然后用酒精梯度脱水,二甲苯透明、石蜡包埋并制作组织切片(5 μm)。按照苏木精-伊红(HE)试剂盒和Masson染色试剂盒说明书分别将切片进行染色。使用光学显微镜检查HE染色结果并拍摄图像。由组织病理学家(不予告知实验设计)根据Masson染色法中胶原蛋白的表达情况来评估肺纤维化的严重程度。
1.2.6 免疫组织化学染色检测肺组织中CTGF表达用10%甲醛溶液固定大鼠的左肺后,通过不同梯度的酒精脱水和二甲苯处理之后,将肺组织样品包埋在石蜡中并切片(5 μm)。将样品切片固定在多聚赖氨酸包被的载玻片上。将切片用3%BSA在37 ℃封闭30 min,以阻断非特异性结合位点,然后加入CTGF的一抗(按1:200稀释),4 ℃孵育过夜。PBS洗涤3次,然后加入山羊抗兔二抗(1:200)在37 ℃孵育30 min。PBS洗涤3次,将载玻片与HRP-SA(辣根过氧化物酶标记链霉亲和素)一起温育,然后用纯水洗涤。然后将样品浸润于3, 3’-二氨基联苯胺底物溶液中10 min,用苏木精复染并盖上盖玻片。显微镜下拍摄图像。
1.2.7 免疫荧光技术检测CTGF对人肺成纤维细胞的肌成纤维细胞分化的作用用100 ng/mL CTGF处理MRC-5人肺成纤维细胞3 d。将MRC-5细胞用4%多聚甲醛固定,并用0.1%Triton X-100穿孔10 min。然后培养细胞用2%BSA在37 ℃封闭1 h。加入α-SMA一抗(1:200)和胶原蛋白I一抗(1:200)在4 ℃下孵育16 h。PBS洗涤三次,用山羊抗兔Alexa Fluor 594或488的二抗(1:400,2%BSA)于37 ℃避光孵育1 h。使用DAPI(5 μg/mL)进行核染色。使用共聚焦荧光显微镜观察细胞。
1.2.8 Western-blot检测CTGF蛋白水平用不同浓度的PQ(50~500 μmol/L)处理MRC-5细胞72 h。分别提取PQ处理后培养细胞和动物(右肺,n=8)的蛋白样品。将细胞或右肺组织使用预冷的RIPA裂解缓冲液(含有蛋白酶抑制剂混合物)裂解30 min。然后将全部裂解物以12 000 g离心30 min,并使用BCA法测定上清液中的蛋白质浓度,配成等质量的蛋白质溶液。每孔取20 μL样品进行12%SDS-PAGE电泳。将蛋白条带电泳转膜后,在封闭缓冲液(1X PBS,0.1%Tween-20, 1%BSA和5%脱脂奶粉)中37 ℃孵育1 h。后将膜放入α-SMA(1:3 000)、胶原蛋白I和β-actin的一抗于4 ℃孵育过夜。PBST洗涤3次,将膜与二抗在37 ℃下作用1 h。ECL显色。
1.2.9 检测羟脯氨酸(Hyp)含量以评估肺组织中胶原蛋白的水平根据检测试剂盒(南京建成生物工程研究所)的说明书方法提取组织样本,测量550 nm处的吸光度,并使用标准曲线(0~100 mg/mL)计算Hyp含量。
1.3 统计学方法采用SPSS 18.0进行数据统计。计量数据使用均数±标准差(x±s)表示。组间差异采用单因素方差分析。组间两两比较采用SNK-q检验。以P < 0.05为差异有统计学意义。
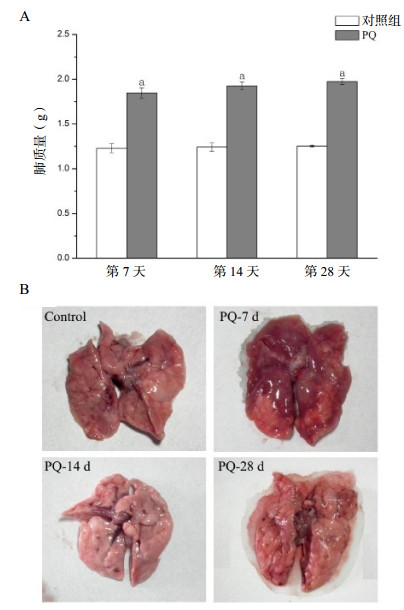
2 结果 2.1 PQ诱导的肺损伤和肺纤维化如图 1A所示,PQ给药7、14和28 d后,实验组大鼠肺质量与对照组相比,分别为(1.849±0.566)g vs.(1.230±0.050)g(P < 0.01)、(1.925±0.047)g vs.(1.242±0.046)g(P < 0.01)、(1.975±0.034)g vs.(1.252±0.011)g(P < 0.01),各组中大鼠肺质量均较对照组增加。肺的大体观察呈现纤维化改变(图 1B)。这些结果表明PQ能够在这种大鼠模型中诱导肺损伤和肺纤维化。
|
| A:对照组和PQ给药后7, 14和28 d的小鼠肺质量;数据用均数±标准差(x±s)表示,与对照组(n=8)相比,aP < 0.01;B:PQ给药后7、14和28 d的全肺的代表性图像 图 1 大鼠肺组织重量变化及大体观察情况 Figure 1 Changes in lung tissue weight and general observation in the control and PQ-treated rats |
|
|
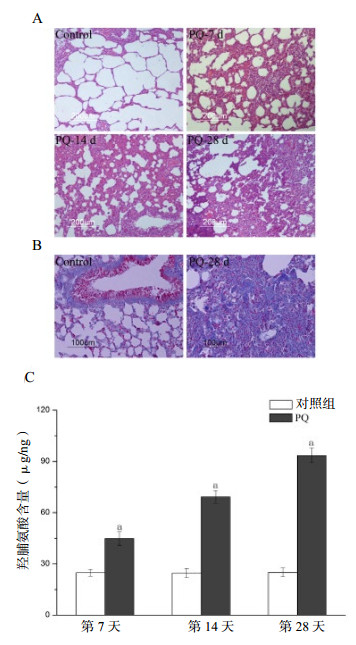
如图 2A所示,对照组的肺组织表现正常,未出现炎症或上皮损伤的迹象。而PQ处理后肺组织发生明显的结构改变。PQ处理7 d后,肺部组织出现急性损伤的征象,包括间质水肿和肺泡腔和肺泡间隔广泛的炎症细胞浸润。14 d后,可观察到明显的单核炎症细胞浸润,成纤维细胞增殖,广泛的细胞增厚和纤维化。而在第28天,HE染色显示增厚的肺泡壁和肺间质纤维化。Masson染色显示PQ组的胶原蛋白沉积(蓝色)与对照组相比增加(图 2B)。总之,组织病理学证据表明PQ给药可致大鼠肺损伤和肺纤维化。
|
| A:HE染色显示PQ给药后(7、14和28 d)大鼠肺组织的组织病理学观察;B:Masson染色显示PQ暴露后的第28天肺组织胶原(蓝色)沉积增加;C:PQ处理后第7、14和28天在大鼠肺的羟脯氨酸含量增加,具有时间依赖性;数据用均数±标准差(x±s)表示;与对照组(n=8)相比,aP < 0.01 图 2 PQ处理组肺组织病理学改变及羟脯氨酸含量变化 Figure 2 Pathological changes of lung tissue and changes of hydroxyproline content in PQ-treated rats |
|
|
如图 2C所示,在给药PQ后7、14和28 d,PQ组肺组织Hyp含量(μg/mg)均有所增加,各组与对照组相比分别为(44.85±3.86)vs.(24.87±2.00)、(69.25±3.69)vs.(24.633±2.619)、(93.49±4.41)vs.(25.13±2.57),差异有统计学意义(n=8,P < 0.05)。尤其是在第28天,PQ组的Hyp含量比对照组高3.72倍。该结果与组织病理学结果一致。
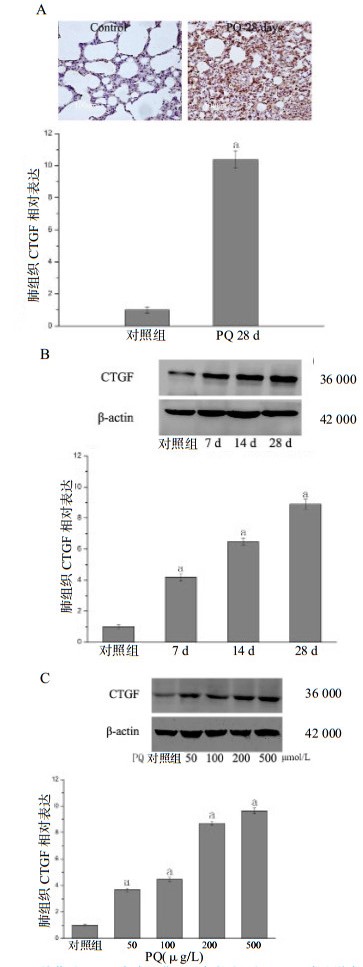
2.4 PQ诱导CTGF在肺组织和肺成纤维细胞中表达如图 3A所示,PQ处理后28 d,利用免疫组织化学染色检测CTGF(棕色)表达明显增加(n=6, P < 0.01)。同时,利用Western-blot分析进一步明确CTGF的表达增加。如图 3B所示,与对照组相比,实验组在PQ给药第7、14和28天的CTGF表达水平分别增加了(4.18±0.26)倍、(6.47±0.24)倍、(8.90±0.31)倍(均n=6, P < 0.01),具有时间依赖性。此外,在体外的表达情况如图 3C所示,在不同浓度的PQ(50~500 μmol/L)处理后,MRC-5细胞表现出较高水平的CTGF表达(P < 0.01)。
|
| A:PQ给药后28 d,免疫组化显示大鼠肺组织CTGF表达增多;B:PQ暴露后7、14和28 d,Western-blot显示大鼠肺组织CTGF的表达增加,具有时间依赖性;C:Western-blot显示MRC-5细胞暴露于PQ(50、100、200和500 μmol/L)后CTGF的表达增加;数据用均数±标准差(x±s)表示;与对照组(n=6)相比,aP < 0.01 图 3 大鼠肺和MRC-5人肺成纤维细胞中PQ诱导的CTGF表达 Figure 3 PQ-induced CTGF expression in rat lungs and MRC-5 human lung fibroblasts |
|
|
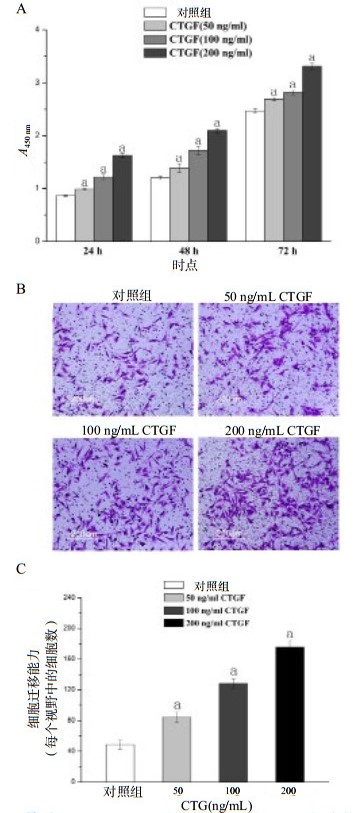
如图 4A所示,CCK8结果证实CTGF给药后MRC-5细胞活力显著增加(P < 0.01),且CTGF促进细胞增殖具有剂量依赖性和时间依赖性。另外,如图 4B~C所示,Transwell结果表明CTGF能促进肺成纤维细胞迁移(P < 0.01)。加入200 ng/mL的CTGF使细胞迁移能力增加3.6倍。
|
| A:暴露于CTGF(50、100和200 ng/mL)的MRC-5细胞的细胞增殖(n=6);B~C:Transwell显示用50、100和200 ng/mL的CTGF处理的MRC-5细胞后迁移能力增强;数据用均数±标准差(x±s)表示;与对照组(n=6)相比,aP < 0.01 图 4 CTGF诱导的肺成纤维细胞的增殖和迁移 Figure 4 CTGF-induced proliferation and migration of lung fibroblasts |
|
|
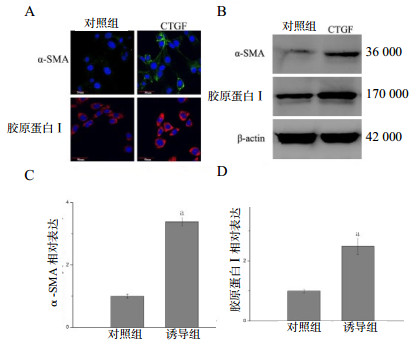
在MRC-5细胞中加入100 ng/mL的CTGF培养3 d。利用免疫荧光和Western-blot来检测α-SMA和胶原蛋白I的表达水平,以评估肌成纤维细胞分化的情况。如图 5A所示,免疫荧光染色显示,与对照组相比,CTGF诱导组的α-SMA(绿色荧光)和胶原蛋白I(红色荧光)表达增加。另外,在图 5B~D中,Western-blot亦证明CTGF诱导α-SMA和I型胶原蛋白表达水平明显增加,表明肺成纤维细胞分化成肌成纤维细胞。
|
| A:免疫荧光分析CTGF处理3 d后MRC-细胞中α-SMA和胶原蛋白I的表达(×600);B~D:Western-blot及灰度分析显示CTGF处理后MRC-细胞α-SMA和胶原蛋白I的含量增加;与对照组相比,aP < 0.01;n=6 图 5 CTGF诱导MRC-5肺成纤维细胞向肌成纤维细胞的分化 Figure 5 CTGF-induced differentiation of MRC-5 lung fibroblasts into myofbroblasts |
|
|
百草枯中毒可引起急性肺损伤和不可逆的肺间质纤维化[1]。而目前PQ诱导致肺纤维化的信号传导途径仍有待阐明。以前的研究集中在明确PQ中毒的分子机制,本研究检测了CTGF在PQ诱导的肺纤维化的胶原沉积和肌成纤维细胞分化中的作用。
CTGF是TGF-β信号传导途径的下游协同介导因子,生理状态下在许多组织中低水平表达。而在许多人类疾病动物模型的病变部位显著上调,包括肺成纤维细胞瘤、肝纤维化和各种类型的恶性肿瘤等[10, 20-21]。研究证实,重度肺纤维化患者和肺纤维化动物模型的CTGF水平升高[19, 22],其可影响肺纤维化过程中涉及的各种细胞类型,包括Ⅱ型肺泡上皮细胞、内皮细胞、间充质干细胞和肺成纤维细胞[12]。在本研究中,PQ暴露引起肺结构的改变,出现明显的间质水肿、细胞间隔增厚、具有纤维母细胞特征的间充质细胞增多、胶原沉积过多等。同时,体内及体外实验均发现PQ暴露诱导CTGF表达。有研究证实CTGF可以对多种细胞类型产生作用,从而促进与纤维化有关的生物学过程,包括细胞增殖、迁移和ECM产生[12]。本研究表明CTGF能诱导MRC-5肺成纤维细胞的增殖和迁移。因此,CTGF可能介导PQ诱导的肺纤维化过程。
越来越多的证据表明,病变区域中过表达的胶原蛋白和α-SMA与肺纤维化疾病有关[23]。胶原蛋白是肺部的主要ECM组分,在急性肺损伤的早期阶段表达增加。由肺成纤维细胞分化而来的肌成纤维细胞表现出肺成纤维细胞和平滑肌细胞的形态学和生物化学特征,被认为是患者特发性肺纤维化病变肺中ECM的主要来源[24-25]。Tomita等[26]研究证明CTGF基因敲除的动物其致病性纤维化反应减弱。研究发现,CTGF敲除细胞中胶原合成减少从而防止了纤维化发生[27-28]。本研究结果表明,PQ暴露后胶原和CTGF的表达水平以时间依赖性方式增加。同时,免疫荧光染色和Western-blot显示CTGF处理后的肺成纤维细胞胶原蛋白I和α-SMA表达增加, 表明CTGF可诱导肌成纤维细胞分化。而这一过程与肺纤维化的发生发展有关。
综上所述,PQ诱导的CTGF过表达可能通过促进肺成纤维细胞的增殖、迁移和肌成纤维细胞分化,最终导致肺纤维化。药物抑制CTGF是减轻PQ致肺纤维化损伤程度的可行策略。
| [1] | Dinis-Oliveira RJ, Duarte JA, Sánchez-Navarro A, et al. Paraquat poisonings: mechanisms of lung toxicity, clinical features, and treatment[J]. Crit Rev Toxicol, 2008, 38(1): 13-71. DOI:10.1080/10408440701669959 |
| [2] | 吴丽红, 李艳辉. 百草枯中毒发病机制的研究进展[J]. 中华急诊医学杂志, 2007, 16(5): 554-556. DOI:10.3760/j.issn.1671-0282 |
| [3] | Li LR, Sydenham E, Chaudhary B, et al. Glucocorticoid with cyclophosphamide for paraquat-induced lung fibrosis[J]. Cochrane Database Syst Rev, 2014(8): CD008084. DOI:10.1002/14651858.CD008084.pub4 |
| [4] | Lin JL, Lin-Tan DT, Chen KH, et al. Improved survival in severe paraquat poisoning with repeated pulse therapy of cyclophosphamide and steroids[J]. Intensive Care Med, 2011, 37(6): 1006-1013. DOI:10.1007/s00134-010-2127-7 |
| [5] | Moon JM, Chun BJ. The efficacy of high doses of vitamin C in patients with paraquat poisoning[J]. Hum Exp Toxicol, 2011, 30(8): 844-850. DOI:10.1177/0960327110385633 |
| [6] | Suntres ZE. Role of antioxidants in paraquat toxicity[J]. Toxicology, 2002, 180(1): 65-77. DOI:10.1016/S0300-483X(02)00382-7 |
| [7] | Koo JR, Kim JC, Yoon JW, et al. Failure of continuous venovenous hemofiltration to prevent death in paraquat poisoning[J]. Am J Kidney Dis, 2002, 39(1): 55-59. DOI:10.1053/ajkd.2002.29880 |
| [8] | Koo JR, Yoon JW, Han SJ, et al. Rapid analysis of plasma paraquat using sodium dithionite as a predictor of outcome in acute paraquat poisoning[J]. Am J Med Sci, 2009, 338(5): 373-377. DOI:10.1097/MAJ.0b013e3181b4deee |
| [9] | Harlow CR, Hillier SG. Connective tissue growth factor in the ovarian paracrine system[J]. Mol Cell Endocrinol, 2002, 187(1/2): 23-27. |
| [10] | Wang Q, Usinger W, Nichols B, et al. Cooperative interaction of CTGF and TGF-β in animal models of fibrotic disease[J]. Fibrogenesis Tissue Repair, 2011, 4(1): 4. DOI:10.1186/1755-1536-4-4 |
| [11] | Moussad EE, Brigstock DR. Connective tissue growth factor: what's in a name?[J]. Mol Genet Metab, 2000, 71(1/2): 276-292. DOI:10.1006/mgme.2000.3059 |
| [12] | Ponticos M, Holmes AM, Shi-wen X, et al. Pivotal role of connective tissue growth factor in lung fbrosis: MAPK-dependent transcriptional activation of type I collagen[J]. Arthritis Rheum, 2009, 60(7): 2142-2155. DOI:10.1002/art.24620 |
| [13] | Bogatkevich GS, Ludwicka-Bradley A, Singleton CB, et al. Proteomic analysis of CTGF-activated lung fibroblasts: identifcation of IQGAP1 as a key player in lung fibroblast migration[J]. Am J Physiol Lung Cell Mol Physiol, 2008, 295(4): L603-611. DOI:10.1152/ajplung.00530.2007 |
| [14] | Shimo T, Kubota S, Kondo S, et al. Connective tissue growth factor as a major angiogenic agent that is induced by hypoxia in a human breast cancer cell line[J]. Cancer Lett, 2001, 174(1): 57-64. DOI:10.1016/S0304-3835(01)00683-8 |
| [15] | Chujo S, Shirasaki F, Kawara S, et al. Connective tissue growth factor causes persistent proalpha2(I) collagen gene expression induced by transforming growth factor-beta in a mouse fibrosis model[J]. J Cell Physiol, 2005, 203(2): 447-456. DOI:10.1002/jcp.20251 |
| [16] | Sun Z, Gong X, Zhu H, et al. Inhibition of Wnt/β-catenin signaling promotes engraftment of mesenchymal stem cells to repair lung injury[J]. J Cell Physiol, 2014, 229(2): 213-224. DOI:10.1002/jcp.24436 |
| [17] | McAnulty RJ. Fibroblasts and myofibroblasts: their source, function and role in disease[J]. Int J Biochem Cell Biol, 2007, 39(4): 666-671. DOI:10.1016/j.biocel.2006.11.005 |
| [18] | Scotton CJ, Chambers RC. Molecular targets in pulmonary fibrosis: the myofibroblast in focus[J]. Chest, 2007, 132(4): 1311-1321. DOI:10.1378/chest.06-2568 |
| [19] | Bonniaud P, Margetts PJ, Kolb M, et al. Adenoviral gene transfer of connective tissue growth factor in the lung induces transient fibrosis[J]. Am J Respir Crit Care Med, 2003, 168(7): 770-778. DOI:10.1164/rccm.200210-1254OC |
| [20] | Lacerda AC, Rodrigues-Machado Mda G, Mendes PL, et al. Paraquat (PQ)-induced pulmonary fibrosis increases exercise metabolic cost, reducing aerobic performance in rats[J]. J Toxicol Sci, 2009, 34(6): 671-679. DOI:10.2131/jts.34.671 |
| [21] | Tung JN, Lang YD, Wang LF, et al. Paraquat increases connective tissue growth factor and collagen expression via angiotensin signaling pathway in human lung fibroblasts[J]. Toxicol In Vitro, 2010, 24(3): 803-808. DOI:10.1016/j.tiv.2009.12.015 |
| [22] | Chen CM, Wang LF, Chou HC, et al. Up-regulation of connective tissue growth factor in hyperoxia-induced lung fibrosis[J]. Pediatr Res, 2007, 62(2): 128-133. DOI:10.1203/PDR.0b013e3180987202 |
| [23] | Bhogal RK, Stoica CM, McGaha TL, et al. Molecular aspects of regulation of collagen gene expression in fibrosis[J]. J Clin Immunol, 2005, 25(6): 592-603. DOI:10.1007/s10875-005-7827-3 |
| [24] | Phan SH. Biology of fibroblasts and myofibroblasts[J]. Proc Am Thorac Soc, 2008, 5(3): 334-337. DOI:10.1513/pats.200708-146DR |
| [25] | Kendall RT, Feghali-Bostwick CA. Fibroblasts in fibrosis: novel roles and mediators[J]. Front Pharmacol, 2014, 5: 123. DOI:10.3389/fphar.2014.00123 |
| [26] | Tomita M, Okuyama T, Katsuyama H, et al. Mouse model of paraquat-poisoned lungs and its gene expression profile[J]. Toxicology, 2007, 231(2/3): 200-209. DOI:10.1016/j.tox.2006.12.005 |
| [27] | 刘小菁, 吴文超, 陈槐卿. CTGF基因沉默对肺成纤维细胞增殖及表型转化的影响[J]. 生物医学工程学杂志, 2008, 25(2): 407-412. DOI:10.3321/j.issn.1001-5515.2008.02.037 |
| [28] | 郎明健, 闵新文, 李健, 等. RNA干扰靶向抑制结缔组织生长因子拮抗肾脏纤维化的发展[J]. 中华急诊医学杂志, 2010, 19(6): 615-620. DOI:10.3760/cma.j.issn.1671-0282 |
 2018, Vol. 27
2018, Vol. 27




