随着载人航天事业的迅猛发展,航天医学研究面临诸多挑战性问题。美国航空航天局曾报道,航天飞行环境中对航天员身体健康和任务执行能力威胁最大的是创伤,应给予最高等级的关注。研究微重力环境对创伤及愈合的影响具有重要意义[1-4]。角质细胞是创伤修复的重要细胞,其增殖、迁移及分化是机体皮肤创面愈合的基础[5]。本研究釆用微重力细胞培养系统(the rotary cell culture system,RCCS),研究模拟微重力对人永生化角质形成细胞(the HaCaT human keratinocyte cell line)生长增殖及细胞骨架的变化,为航天员在失重环境中意外创伤的防治提供理论依据。
1 材料与方法 1.1 主要材料和仪器人永生化角质形成细胞HaCaT细胞株(the HaCaT human keratinocyte cell line,北京协和细胞资源中心),微载体Cytodex-3(17044802,GEHealthcare,USA),RCCS(RCCS-4D, Synthecon,USA),10 mL高截面纵横比容器(HARV-D410,Synthecon,USA),流式细胞仪(FACSCalibur,BD,USA),酶标分析仪(RT-6100,Rayto,USA),ELISA试剂盒(HB-EGF,上海硕联生物公司),激光共聚焦显微镜(OLS4500,Olympus,JPN)。
1.2 HaCaT细胞株培养扩增和实验分组人永生化角质形成细胞HaCaT细胞株以含10%胎牛血清及双抗(100 μg/mL青霉素和100 μg/mL链霉素)的DMEM高糖培养基,于37℃ CO2培养箱中培养,待细胞融合度达到80%左右进行传代。将HaCaT细胞随机(随机数字法)分为模拟微重力组(SMG)和正常重力对照组(NG),SMG组HaCaT细胞与微载体共同置入HARV在RCCS中培养。NG组HaCaT细胞置于培养瓶中正常培养。
1.3 建立RCCS微载体培养体系将准备好的数份Cytodex-3微载体分别加入HARV中,加入含10%胎牛血清的DMEM培养基。将培养好的HaCaT细胞以2×106密度接种于HARV,加满上述培养基,使用5 mL注射器排气泡后放入RCCS。RCCS中初始转速设置为12 r/min,12 h后设为14 r/min,之后密切观察并根据经验调整转速使微载体能悬浮在培养液中,根据预实验HaCaT细胞对数生长期生长曲线和倍增时间,设定培养时间分别为32 h、36 h、42 h。
1.4 流式细胞仪检测细胞周期达到细胞培育时间后,吸出HARV中混合液体于15 mL离心管中,静置5 min后弃上清液,PBS洗涤2遍,每个样本加0.25%胰酶消化液2~3 mL,37℃消化10 min后,以1000 r/min转速离心5 min。加入含血清培养基终止消化作用,轻轻吹打,使细胞从微载体上脱落,通过70 μm细胞筛过滤,获取单细胞悬液。SMG组细胞按正常消化步骤,将离心细胞分别收集到1.5 mL EP管中,加入DMEM培养液300 μL,将细胞吹打均匀,沿管壁缓慢加入预冷的无水乙醇700 μL并迅速混合均匀,-20℃保存48 h后,流式细胞仪上机进行检测。
1.5 ELISA检测细胞上清液hb-EGF分别收取微重力和正常重力培育32 h、36 h和42 h后细胞上清液,每个样本设3个复孔,分别设空白孔和待测样品孔。在酶标包被板上待测样品孔中加样品稀释液40 μL,再加待测样品10 μL。除空白孔外加入酶标试剂100 μL,用封板膜封板后置37℃温育60 min。揭封板膜,弃液甩干,每孔加满洗涤液,静置30 s后弃去,重复5次拍干。每孔按先后顺序加入显色剂A、B各50 μL,震荡混匀,37℃避光显色15 min。每孔加终止液50 μL,并在加终止液后15 min内进测定,以空白孔调零,450 nm波长依序测量各孔的吸光度。
1.6 激光共聚焦显微镜观察免疫荧光标记的细胞骨架取微重力和重力组培养42 h的细胞和微载体-细胞复合体,用PBS缓冲液漂洗,4%多聚甲醛固定30 min,加入FITC标记的小鼠抗人F-actin抗体(鬼笔环肽)37℃染色30 min,DAPI室温染色10 min,PBS漂洗后甘油封片,在激光共聚焦显微镜下观察HaCaT细胞荧光分布并拍照。
1.7 统计学方法采用SPSS 23.0(IBM Corporation,USA)统计学软件进行统计学分析,所有数据均以均数±标准差(x±s)表示,计量资料比较采用重复测量资料的方差分析和两独立样本的t检验,以P < 0.05为差异有统计学意义。
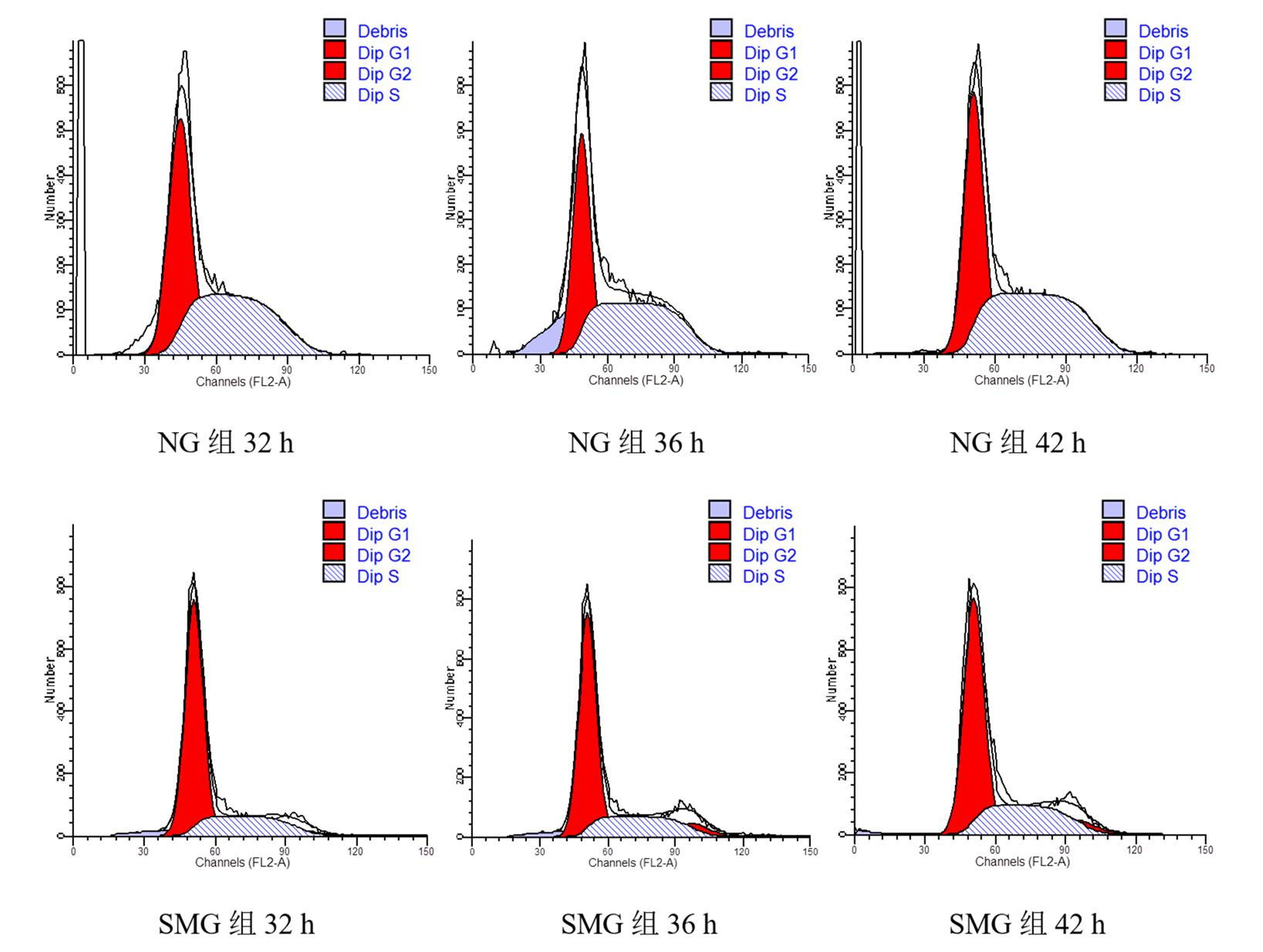
2 结果 2.1 HaCaT细胞增殖与NG组比较,SMG组HaCaT细胞经32 h、36 h和42 h培养,三个时相点的G1和G2/M期细胞数显著增加,S期细胞数显著减少(P < 0.05)。SMG组HaCaT细胞随培养时间延长,G1期细胞数呈减少趋势。见表 1、图 1。
| 组别 | 培养时间(h) | G1 | G2/M | S |
| SMG | 32 | 73.98±2.27a | 2.07±0.34a | 23.93±1.97a |
| 36 | 64.03±2.95a | 8.24±2.05a | 27.06±1.21a | |
| 42 | 60.83±4.83a | 9.72±1.60a | 29.45±3.29a | |
| NG | 32 | 50.77±2.71 | 1.01±0.23 | 48.25±2.82 |
| 36 | 48.79±2.60 | 0.81±0.28 | 50.41±2.46 | |
| 42 | 49.14±1.88 | 2.02±0.93 | 49.17±2.17 | |
| 注:与NG组对比,aP < 0.05 | ||||
|
| 图 1 两组HaCaT细胞的流式细胞术分析结果 Figure 1 Flow Cytometry Analysis of HaCaT Cells in Two Groups |
|
|
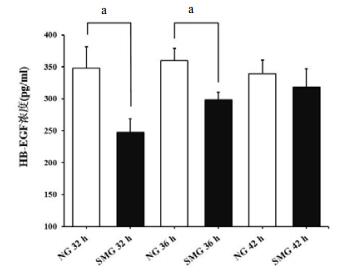
与NG组比较,SMG组HaCaT细胞经32 h和36 h后hb-EGF浓度明显下降(P < 0.01)。两组细胞在42 h培养后hb-EGF浓度差异无统计学意义(P > 0.05)。见图 2。
|
| 图 2 模拟微重力对HaCaT细胞HB-EGF自分泌的影响(x±s,aP < 0.01) Figure 2 The Effect of Simulated Microgravity on HB-EGF Autocrine in HaCaT Cells(x±s, aP < 0.01) |
|
|
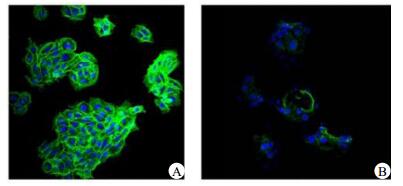
NG组HaCaT细胞的微丝骨架结构完整,清晰可见,粗细均匀,见图 3A。SMG组HaCaT细胞经42 h培养后,在激光共聚焦显微镜下荧光强度减弱,微丝排紊乱,结构破坏明显,部分模糊不可见,细胞间伪足较少且不规则,见图 3B。
|
| A:模拟微重力SMG组; B:正常重力NG组 图 3 模拟微重力对HaCaT细胞微丝形态的影响(×200) Figure 3 The Effect of Simulated Microgravity on Microfilament of HaCaT Cells(×200) |
|
|
皮肤创伤是航天飞行史上最常见的问题。失重使航天员在太空环境中作业变得相当困难,失去着力点的躯体很容易与物体发生碰撞。据Kirkpatrick等[6]报道,长期航天飞行过程中最常见的创伤为皮肤软组织伤。Davidson等[7]在航天飞行前将能够释放bFGF、PDGF或安慰剂的海绵植入Fisher 344大鼠腹部皮下,对比海绵基质内结构的改变,发现10 d飞行后动物海绵内PDGF释放延迟,愈合过程受到明显抑制,其内胶原数量比地面组低62%。贾铁利等[8]在大鼠背部皮肤制造断层创面,发现模拟失重动物的创面愈合速度慢,胶原纤维和TGF形成减少,提示模拟失重抑制皮肤创口愈合。Radek等[9]进行尾悬吊动物模型的皮肤打孔实验,发现模拟失重大鼠的伤口愈合明显延迟。Monici等[10]研究发现,微重力条件下内皮细胞血管生成时间延长,VEGF, NGAL, IL-6, IL-8等细胞因子分泌也受到了影响。本课题组前期研究表明,失重对机体细胞的结构和功能产生一系列重要作用,影响皮肤成纤维细胞的分化与增殖、细胞周期、细胞骨架、相关基因和蛋白表达等变化[11-13]。从现有文献报道看,对航天飞行过程中最容易发生的皮肤软组织创伤的基础和应用研究均比较局限,动物创伤模型的研究报道较少,结果也有差异,人体研究更缺乏,均有待于进一步系统深入研究[5]。
皮肤是人体最大的器官,皮肤创面愈合分为炎症期、增殖期和创面重塑期等三个互相重叠的阶段。角质形成细胞是表皮的重要组成细胞之一,也是皮肤更新、屏障和免疫的主要细胞,其增殖、分化和迁移是纤维增生、新血管形成和创面愈合的生理基础[5, 14]。人永生化的角质形成细胞(HaCaT细胞)来源于人的表皮细胞,与角质形成细胞的基本特性极其相似。
本研究结果显示,在RCCS微重力条件下培养,人永生化角质细胞株HaCaT细胞增殖受到明显抑制。HaCaT细胞在正常重力条件下培养32~42 h,处于对数生长期,生长增殖旺盛。失重导致HaCaT细胞G1期阻滞,S期细胞分布减少。有学者研究报道,在微重力环境中,人角质细胞可通过张力敏感信号通路引发生理节奏基因调控,并能促发人角质细胞的上皮细胞间质转型(epithelial-mesenchymal transitions,EMT),使具有极性的上皮细胞转换成为具有活动能力的间质细胞并获得侵袭和迁移能力[15-16]。显然,角质细胞暴露于微重力环境时,其生长增殖、基因表达、表观遗传修饰等发生一系列变化,微重力暴露时相与影响程度及相关机制有待进一步研究。
本实验结果表明,HaCaT细胞在微重力条件培养过程中,肝素结合性表皮生长因子(human proheparin-binding EGF-like growth factor,hb-EGF)浓度波动明显,早期显著下降,随后又明显回升。肝素表皮生长因子(hb-EGF)由HaCaT细胞、巨噬细胞等分泌产生,具有广泛的生物学作用,作为多种细胞的有丝分裂原,能促进HaCaT细胞的增殖、分化,并诱导细胞迁移[17]。本研究中hb-EGF浓度波动特点提示,HaCaT细胞的hb-EGF自分泌机能在经受微重力环境应激损伤而受抑制的同时,表现出应激适应的生理特性。据文献报道,微重力条件下EGF诱导的相关基因表达下降[18],EGF介导的信号通路受影响[19],但微重力条件对人角质细胞EGF相关信号传导通路方面尚无研究报道。
本实验通过激光共聚焦显微镜和荧光素FITC标记技术研究发现,模拟微重力培养42 h后,HaCaT细胞荧光强度减弱,细胞微丝排列紊乱,细胞骨架结构受损,细胞形状不规则,细胞伪足减少。现已明确,细胞骨架是由微管、微丝以及中间丝三类蛋白质纤维组成的非常活跃的系统,它能够在短时间内重建,即便在稳定条件下,骨架的聚合体与自由单体之间还会不断变化。微丝是细胞骨架的重要组成部分,参与维持细胞形态、细胞运动、信号传导以及细胞增殖过程。一旦细胞骨架被破坏,会严重影响细胞正常代谢和功能,甚至会引起细胞死亡。有学者认为重力影响细胞骨架改变的原因可能是细胞内原有的张力和压力平衡被打破,从而导致细胞骨架聚合和解聚的重新排列,细胞流体静力学的改变亦可调节细胞体积的敏感变化,引发细胞膜和细胞骨架之间的重新分布[20-22]。这说明微重力环境对HaCaT细胞的微丝骨架结构可造成明显影响,破坏了细胞微丝结构的有序性,与生长增殖及自分泌功能受损等共同构成了HaCaT细胞失重应激损伤的生理病理表现,并具有应激/适应或代偿/失代偿特征。
| [1] | Demontis GC, Germani MM, Caiani EG, et al. Human pathophysiological adaptations to the space environment[J]. Front Physiol, 2017, 8: 547. DOI:10.3389/fphys.2017.00547 |
| [2] | Hodkinson PD, Anderton RA, Posselt BN, et al. An overview of space medicine[J]. Br J Anaesth, 2017, 119(supp l-1): i143-i153. DOI:10.1093/bja/aex336 |
| [3] | Kirkpatrick AW, Ball CG, Campbell M, et al. Severe traumatic injury during long duration spaceflight: light years beyond ATLS[J]. Trauma Manag Outcomes, 2009, 3: 4. DOI:10.1186/1752-2897-3-4 |
| [4] | 李雨霏, 孙宏伟, 崔彦. 失重环境中创伤和应激损伤与修复的研究进展[J]. 解放军医药杂志, 2015, 27(6): 19-22. DOI:10.3969/j.issn.2095-140X.2015.06.005 |
| [5] | Sorg H, Tilkorn DJ, Hager S, et al. Skin wound healing: an update on the current knowledge and concepts[J]. Eur Surg Res, 2017, 58(12): 81-94. DOI:10.1159/000454919 |
| [6] | Kirkpatrick AW, Ball CG, Campbell M, et al. Severe traumatic injury during long duration spaceflight: Light years beyond ATLS[J]. J Trauma Manag Outcomes, 2009, 25, 3: 4. DOI:10.1186/1752-2897-3-4 |
| [7] | Davidson JM, Aquino AM, Woodward SC, et al. Sustained microgravity reduces intrinsic wound healing and growth factor responses in the rat[J]. FASEB J, 1999, 13(2): 325-329. DOI:10.1096/fasebj.13.2.325 |
| [8] | 贾铁利, 张津丽, 郑超, 等. 短期模拟失重对大鼠创面愈合的影响[J]. 现代康复, 2001, 5(8): 47-48. DOI:10.3321/j.issn.1673-8225.2001.16.020 |
| [9] | Radek KA, Baer LA, Eckhardt J, et al. Mechanical unloading impairs keratinocyte migration and angiogenesis during cutaneous wound healing[J]. Appl Physiol, 2008, 104(5): 1295-1303. DOI:10.1152/japplphysiol.00977.2007 |
| [10] | Monici M, Cialdai F, Romano G, et al. An in vitro study on tissue repair: impact of unloading on cells involved in the remodelling phase[J]. Microgravity Sci Technol, 2011, 23: 391-401. DOI:10.1007/s12217-011-9259-4 |
| [11] | 李雨霏, 付晓艳, 周立艳, 等. 模拟微重力环境对小鼠成纤维细胞增殖和创伤修复相关蛋白基因表达的影响[J]. 解放军医药杂志, 2016, 28(7): 17-20. DOI:10.3969/j.issn.2095-140X.2016.07.005 |
| [12] | 王占宇, 姜福全, 徐冰心, 等. 旋转细胞培养系统模拟微重力环境对小鼠成纤维细胞lncRNA表达的影响[J]. 解放军医学杂志, 2017, 42(10): 876-882. DOI:10.11855/j.issn.0577-7402.2017.10.07 |
| [13] | 宋向卫, 王占宇, 姜玉峰, 等. 模拟微重力对小鼠成纤维细胞miRNA表达的影响[J]. 中华创伤杂志, 2017, 33(8): 756-764. DOI:10.3760/cma.j.issn.1001-8050.2017.08.017 |
| [14] | Botchkarev VA. The Molecular revolution in cutaneous biology: chromosomal territories, higher-order chromatin remodeling, and the control of gene expression in keratinocytes[J]. J Invest Dermatol, 2017, 137(5): e93-99. DOI:10.1016/j.jid.2016.04.040 |
| [15] | Ranieri D, Cucina A, Bizzarri M, et al. Microgravity influences circadian clock oscillation in human keratinocytes[J]. FEBS Open Bio, 2015, 5: 717-723. DOI:10.1016/j.fob.2015.08.012 |
| [16] | Ranieri D, Proietti S, Dinicola S, et al. Simulated microgravity triggers epithelial mesenchymal transition in human keratinocytes[J]. Sci Rep, 2017, 7(1): 538. DOI:10.1038/s41598-017-00602-0 |
| [17] | Ockenga W, Kühne S, Bocksberger S, et al. Epidermal growth factor receptor transactivation is required for mitogen-activated protein kinase activation by muscarinic acetylcholine receptors in HaCaT keratinocytes[J]. Int J Mol Sci, 2014, 15(11): 21433-21454. DOI:10.3390/ijms151121433 |
| [18] | 张勇, 吴兴裕, 陈苏民. 重力变化对表皮生长因子诱导的信号转导的影响[J]. 航天医学与医学工程, 2001, 14(5): 373-377. DOI:10.3969/j.issn.1002-0837.2001.05.014 |
| [19] | Rijken PJ, de Groot RP, van Belzen N, et al. Inhibition of EGF-induced signal transduction by microgravity is independent of EGF receptor redistribution in the plasma membrane of human A431 cells[J]. Exp Cell Res, 1993, 204(2): 373-377. DOI:10.1006/excr.1993.1045 |
| [20] | Pegoraro AF, Janmey P, Weitz DA. Mechanical properties of the cytoskeleton and cells[J]. Cold Spring Harb Perspect Biol, 2017, 9(11): pii: a022038. DOI:10.1101/cshperspect.a022038 |
| [21] | Ingber D. How cells (might) sense microgravity[J]. FASEB J, 1999, 13: S3-15. DOI:10.1096/fasebj.13.9001.s3 |
| [22] | Kapitonova MY, Salim N, Othman S. Alteration of cell cytoskeleton and functions of cell recovery of normal human osteoblast cells caused by factors associated with real space flight[J]. Malays J Pathol, 2013, 35(2): 153-163. |
 2018, Vol. 27
2018, Vol. 27




