急性肺栓塞(acute pulmonary embolism, APE)是常见的急危重症之一[1],可引起心脏骤停[2-3]。引起APE最常见的栓子来源是下肢深静脉血栓。骨科大手术(人工髋关节置换术、人工膝关节置换术、髋部周围骨折手术等)后的下肢深静脉血流缓慢、静脉壁损伤和血液高凝都是下肢深静脉血栓和APE形成的高危因素[4]。APE引起的病理生理变化主要是内源性或外源性栓子阻塞肺动脉或其分支,引起肺动脉压升高,右心室超负荷,心输出量下降,最终引起血流动力学变化,甚至心脏骤停[5]。APE的一线治疗是溶栓与抗凝,以解除肺动脉梗阻[1, 6-7]。因此,研究APE引起的心脏骤停(cardiac arrest, CA)期间和自主循环恢复(return of spontaneous circulation, ROSC)后的血流动力学变化,将有助于提高急诊和骨科医师对APE患者的鉴别能力并指导血管活性药物的应用,提高抢救成功率。
1 材料与方法 1.1 实验动物近交系北京长白猪14头,3个月龄,体质量(28±2)kg,由中国农业科学院畜牧兽医研究所提供。在本研究中,实验动物的使用遵循首都医科大学实验动物使用管理规定,并得到首都医科大学实验动物管理委员会及伦理委员会的批准(批准号: 2010-D-013),同时遵循国际通用的Utstein指南。
1.2 主要仪器与试剂Servo 900c呼吸机(德国西门子),HP M1165多功能检测仪(美国惠普),CO2SMOplus呼吸监护仪(美国伟康),PHILIPS HeartStartMRx监护/除颤仪(荷兰飞利浦医疗公司),Swan-Ganz导管(美国爱德华生命科学贸易公司),有创动脉压监测套装(新加坡),SOMATOM Spirit医用CT机(德国西门子),1万单位注射用尿激酶(杭州澳亚生物技术有限公司)。
1.3 动物模型造模前准备实验动物术前晚上禁食,可自由饮水。肌注咪达唑仑(0.2 mg/kg),而后联合耳缘静脉注射异丙酚(1.0 mg/kg)进行诱导麻醉。麻醉后仰卧固定于手术台上,连续静脉泵入3%戊巴比妥钠[8 mL/(kg·h)]维持麻醉。置入气管插管,连接CO2SMOplus呼吸监护仪及呼吸机,呼吸模式设定为SIMV+PSV(10 cmH2O, 1 cmH2O=0.098 kPa),FiO2 21%,通气频率为12~20次/min,潮气量初次设为7 mL/kg,然后根据呼气末二氧化碳分压(保持在30~40 mmHg,1 mmHg=0.133 kPa)调整呼吸频率和潮气量。备皮后连接心电监护,监测肢体导联心电图。将一个三腔静脉导管插入左侧股静脉以输注生理盐水[8 mL/(kg·h)]并维持中心静脉压在5~12 mmHg;左侧股动脉置入动脉导管,连接压力换能器及PICCO监护仪测量平均动脉压,以热稀释法测量左心排血量(cardiac output, CO)[8];将Swan-Ganz导管从右侧颈外静脉插入肺动脉,以监测中心静脉压、平均右室压、平均肺动脉压、肺动脉楔压。左侧颈外静脉置入一直径约1 cm导管,在CT引导下将其尖端置于肺动脉开口处,用于血栓注入。手术结束后,部分缝合伤口。以上所有导管在置入前均用肝素液(肝素50 mg加入500 mL生理盐水中配制)冲管。
1.4 APE致CA-ROSC模型的建立每头猪从颈外静脉取100 mL血液,室温下放置约2~3 h自凝成血块,将约10~15 mL血块切成1.5 cm×1 cm×1 cm大小的小血块,用生理盐水置于大导管尖端(内径为1 cm)50 mL注射器中。置管手术结束后稳定30 min,记录基础状态的各项指标,如心率、平均主动脉压等。将血栓块快速注入左侧颈外静脉内(约2 min),直到平均动脉压 < 30 mmHg[9]。随后立即从右侧颈外静脉的Swan-Ganz导管注入尿激酶,并进行心肺复苏。严格按照2015年美国心脏协会推荐的心肺复苏国际指南,以30:2频率进行胸外按压和人工气囊辅助通气,胸外按压频率100~120次/min,持续按压2 min,按压深度为胸廓前后径1/3。如果动物出现室颤,则给予200 J非同步电除颤。再持续心脏按压2 min后评价动物是否ROSC。ROSC的标准:主动脉收缩压在50 mmHg以上,并且持续时间超过10 min[10]。如复苏开始后30 min实验动物仍未达到ROSC,则认为复苏失败,动物死亡。整个实验过程中以PULSION PiCCO plus监护仪持续监测血流动力学数据,分别于造模前、CA、ROSC、ROSC后0.5、1、1.5、2、2.5、4、6 h监测平均动脉压、心率、平均肺动脉压、右室压,于造模前、CA、ROSC、ROSC后1、2、4、6 h监测左心和右心功能。分别于造模前、急性肺栓塞致CA时、ROSC后应用增强胸部CT评估肺动脉栓塞程度。
1.5 统计学方法采用SPSS 17.0统计软件进行统计分析。计量资料用均数±标准差(x±s)表示。不同时间点的连续变量采用单因素方差分析,多重比较采用Bonferroni分析。以P < 0.05为差异有统计学意义。
2 结果 2.1 造模的结果14头猪中9头心肺复苏不成功,死于电-机械分离或室颤。5头猪出现ROSC,其中室颤2头,电-机械分离3头。ROSC后4 h死亡1头,死于低血压;ROSC后6 h死亡1头,死于室颤。
2.2 APE致CA和ROSC后血压和心率变化CA时平均动脉压降至最低[(9.2±14.2)mmHg],ROSC时及ROSC后0.5~2.5 h、6 h平均动脉压较基础状态的差异无统计学意义(均P > 0.05),但ROSC后4 h平均动脉压显著低于基础状态(87.6±54.9)mmHg vs.(119.8±14.8)mmHg,P < 0.05(图 1A);心率在CA时变化不明显,ROSC时及ROSC后0.5~2 h较基础状态显著增快,均P < 0.05(图 1B),ROSC 2.5 h后恢复基础水平。
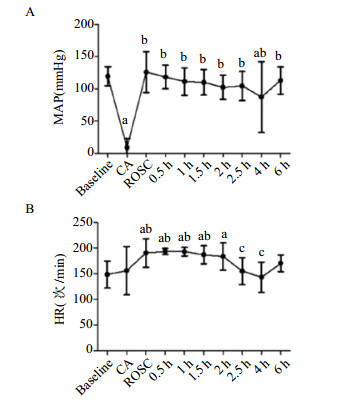
|
| 与基线水平比较,aP < 0.05;与CA比较,bP < 0.05;与ROSC比较,cP < 0.05。MAP,平均动脉压;HR,心率 图 1 急性肺栓塞致CA和ROSC后MAP(A)、HR(B)的变化 Figure 1 The levels of MAP (A), HR (B) during CA induced by APE and after ROSC |
|
|
ROSC后4 h外周血管阻力达峰值[(7 079.8±3 038.5)DS/cm5],显著高于基线[(2 848.8±1 491.5)DS/cm5]、ROSC 1 h[(3 584.8±1 172.0)DS/cm5]、2 h[(2 989.6±1 546.9)DS/cm5]水平(均P < 0.05,图 2A)。肺血管阻力在ROSC时显著高于基线[(96.5±24.8)DS/cm5 vs.(26.5±13.4)DS/cm5, P < 0.05,图 2B],ROSC后1 h和2 h下降,4 h和6 h再次升高[(98.5±0.7)DS/cm5,(98.0±1.4)DS/cm5]。与基线水平相比,ROSC时及ROSC后1~6 h左心每搏输出量、每搏指数、心输出量、心脏排血指数、左心室每搏做功指数、左心做功指数、心功能指数均显著下降(均P < 0.05, 图 3A~G)。左心每搏变异度在ROSC后1 h和4 h显著低于ROSC时[(17±1.4)% vs. (29.3±2.8)%,(19.5±3.7)% vs. (29.3±2.8)%,均P < 0.05,图 3H]。
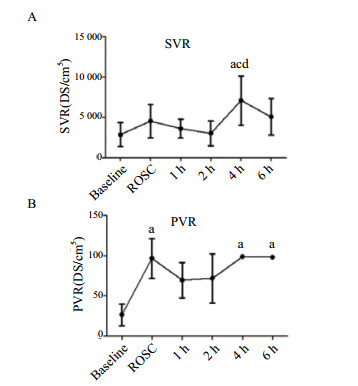
|
| 与基线水平比较, aP < 0.05;与ROSC后1 h比较, cP < 0.05;与ROSC后2 h比较, dP < 0.05。SVR,外周血管阻力;PVR,肺血管阻力 图 2 急性肺栓塞致CA和ROSC后SVR(A)、PVR(B)的变化 Figure 2 The levels of SVR (A) and PVR (B) during CA induced by APE and after ROSC |
|
|
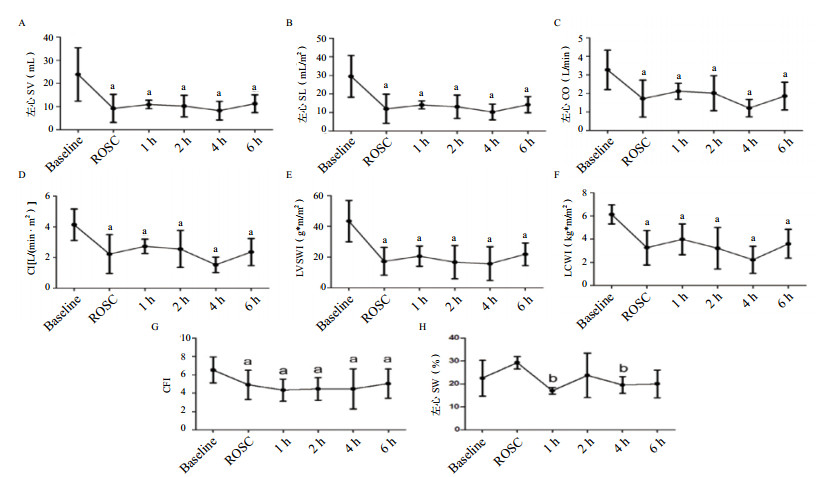
|
| A:左心每搏量(SV);B:左心每搏指数(SI);C:左心排血量(CO);D:左心心排指数(CI);E:左心每搏功输出指数(LVSWI);F:左心作功指数(LCWI);G:心功能指数(CFI);H:左心每搏变异度(SVV)。与基线比较, aP < 0.05;与ROSC比较, bP < 0.05 图 3 急性肺栓塞致CA和ROSC后左心功能变化 Figure 3 The changes of left ventricular function during CA induced by APE and after ROSC |
|
|
平均肺动脉压在CA时(40.3±17.7)mmHg较基础值(19.0±9.2)mmHg明显升高,约为基础值的2.12倍,ROSC后恢复基线水平(图 4A);平均右室压在CA时(46.2±13.0)mmHg较基础值(16.8±5.6)mmHg亦明显升高,ROSC后2.5 h(26.5±11.4)mmHg,4 h(24.8±9.3)mmHg较CA时下降明显(P < 0.05)(图 4B)。右心每搏量和右心每搏指数在ROSC后各个时间点均显著低于基线(均P < 0.05,图 4C和D)。右心排出量和心排指数在ROSC时和ROSC后4 h、6 h分别显著低于基线(均P < 0.05,图 4E和F)。
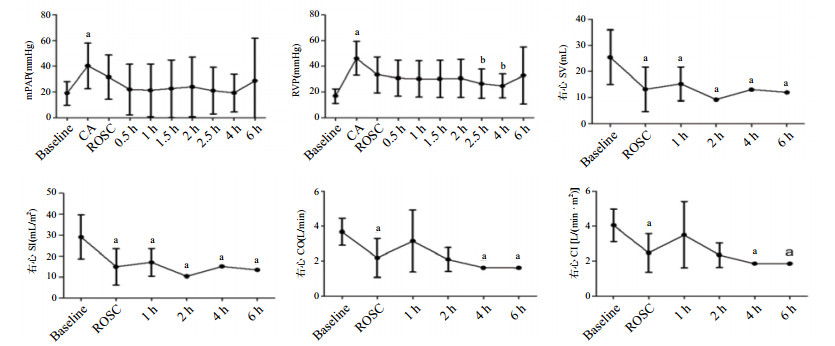
|
| A:平均肺动脉压(mPAP);B:右室压(RVP);C:右心每搏量(SV);D:右心每搏指数(SI);E:右心排血量(CO);F:右心心排指数(CI)。与基线比较, aP < 0.05;与CA比较, bP < 0.05 图 4 急性肺栓塞致CA和ROSC后右心功能变化 Figure 4 The changes of right ventricular function during CA induced by APE and after ROSC |
|
|
本实验的目的是研究APE致CA和ROSC模型的血流动力学变化。为建立动物模型,将自体凝固血栓打入猪肺动脉中导致CA,随后给予溶栓和心肺复苏治疗,使其达到ROSC。本研究发现APE致CA时平均动脉压、右室压明显升高,平均动脉压显著下降,左右心室功能亦显著下降;ROSC后血流动力学出现先代偿(ROSC后1、2 h),后失代偿(ROSC后4 h)。
第六届美国胸科医师学会(ACCP)报道了骨科患者血栓栓塞症(VTE)的危险分级及血栓发生率,其中大于60岁的非大手术、40~60岁之间的大手术为高危,APE发生率为2%~4%;极高危定义为:大于40岁,既往有VTE病史的大手术、髋或膝关节置换术、髋部骨折手术、重度创伤和脊髓损伤,此类人群APE发生率为4%~10%[11]。因此,老年人(男性大于60岁,女性大于55岁)骨科术后APE的发生率明显升高。APE的一线治疗是溶栓治疗以减轻肺动脉的阻塞[1]。既往研究显示,对7例怀疑APE的CA患者心肺复苏失败后给予溶栓治疗,5例可恢复自主循环,其中3例好转出院,2例死亡[12]。但是,即使肺动脉栓塞被解除,缩血管物质的释放也使肺血管阻力增加,持续的肺动脉高压导致急性右心衰竭和心室-血管不匹配[13]。因此即使自主循环恢复后,病死率仍很高[12]。本研究显示,动物恢复自主循环后病死率为40%,与既往临床观察结果相似[12]。
本研究的特点是建立了急性肺血栓栓塞导致的CA和ROSC模型。既往研究介绍了APE模型制备的方法,例如将球囊导管放入肺动脉分叉处,引起不可控制的休克和CA(心率 < 20次/min,平均动脉压 < 20 mmHg,SpO2 < 60 %)[14]。有学者通过中心静脉管将血栓打入肺动脉直到肺动脉压达到基础值的2.5倍(血流动力学崩塌点)[15];或将葡聚糖微球打入颈外静脉[16]。但是应用球囊导管或葡聚糖微球制作的肺栓塞模型并不符合肺血栓栓塞的病理生理特点。因此,本研究通过颈外静脉打入自体血栓制备肺血栓栓塞模型,模型制备目标为CA,与既往研究模型制备的目标(肺动脉压为基础值的2.5倍,为CA前期)不同[15]。此外,为提高APE模型制备的成功率,本研究在CT引导下将大孔径导管的尖端置于肺动脉开口处。为保证各组动物肺动脉阻塞的程度相似,本研究采用相似体质量的猪[(28±2)kg, 3个月龄]、相似的血栓剂量(10~15 mL)、相似的血栓注入时间(约2 min),达到相同的实验目标,即心脏骤停。最后,肺动脉栓塞的程度由增强胸部CT判定。
通过对APE时猪的血流动力学分析发现,注入血栓致CA时,平均动脉压由基础值的19.6 mmHg上升至41.8 mmHg,而ROSC时下降到33.5 mmHg。CA时平均右室压是基线水平的2.7倍。ROSC后心率则持续升高。与基础状态比较,ROSC时外周血管阻力水平无显著变化,但到ROSC后4 h才明显升高。肺血管阻力在ROSC时明显升高,ROSC后1 h和2 h下降,ROSC后4 h和6 h又再次升高。ROSC时及其后左心功能明显下降,包括左心排量、左心做功等。右心排量在ROSC时明显下降,ROSC后1 h和2 h有所恢复,但ROSC后4 h和6 h又明显下降。因此,ROSC后1~2 h动物存在代偿能力,表现为肺血管阻力下降、心功能改善,但ROSC后4 h出现代偿能力下降,如外周血管阻力、肺血管阻力明显升高、右心功能下降。本实验样本量相对较小,但和既往猪心肺复苏模型血流动力学研究的样本量相似。
综上所述,本研究通过制备急性肺血栓栓塞致CA和ROSC模型,发现APE致CA时肺动脉压和右室压显著升高,左右心室功能均下降,ROSC后动物血流动力学出现先代偿,后失代偿。本研究结果为提高急诊医师对急性肺栓塞致心脏骤停患者的识别和处理能力提供基础。
| [1] | Konstantinides SV, Torbicki A, Agnelli G, et al. 2014 ESC guidelines on the diagnosis and management of acute pulmonary embolism[J]. Eur Heart J, 2014, 35(43) 3033-3069, 3069a-3069k. DOI:10.1093/eurheartj/ehu283 |
| [2] | Stein PD, Henry JW. Prevalence of acute pulmonary embolism among patients in a general hospital and at autopsy[J]. Chest, 1995, 108(4): 978-981. DOI:10.1378/chest.108.4.978 |
| [3] | Heit JA Ⅲ, Silverstein MD, Mohr DN, et al. Risk factors for deep vein thrombosis and pulmonary embolism: a population based case-control study[J]. Arch Intern Med, 2000, 160(27): 809-815. DOI:10.1001/archinte.160.6.809 |
| [4] | Geerts WH, Pineo GF, Heit JA. Prevention of venous thromboembolism:the Seventh ACCP Conference on antithrombotic and thrombolytic therapy[J]. Chest, 2004, 126(3 Suppl): 338S-400S. DOI:10.1378/chest.126.3_suppl.338S |
| [5] | Gao JP, Ying KJ. Thrombolysis during extended cardiopulmonary resuscitation for autoimmune-related pulmonary embolism[J]. World J Emerg Med, 2015, 6(2): 153-156. DOI:10.5847/wjem.j.1920-8642.2015.02.012 |
| [6] | 邵利江, 马国峰, 应可净. 以心脏骤停为表现的急性肺栓塞诊治[J]. 中华急诊医学杂志, 2015, 24(9): 1042-1044. DOI:10.3760/cma.j.issn.1671-0282.2015.09.027 |
| [7] | 沈松坡, 赵尔弘. 髋关节置换术中并发肺栓塞应用重组组织型纤溶酶原激活剂抢救成功1例并文献回顾[J]. 中华骨与关节外科杂志, 2017, 10(3): 254-256. DOI:10.3969/j.issn.2095-9958.2017.03-17 |
| [8] | 武军元, 李春盛. 应用程控刺激制作猪心脏骤停模型[J]. 中华急诊医学杂志, 2008, 17(10): 1063-1065. DOI:10.3760/j.issn:1671-0282.2008.10.014 |
| [9] | Pantazopoulos IN, Xanthos TT, Vlachos I, et al. Use of the impedance threshold device improves survival rate and neurological outcome in a swine model of asphyxial cardiac arrest[J]. Crit Care Med, 2012, 40(3): 861-868. DOI:10.1097/CCM.0b013e318232d8de |
| [10] | Stadlbauer KH, Rheinberger K, Wenzel V, et al. The effects of nifedipine on ventricular fibrillation mean frequency in a porcine model of prolonged cardiopulmonary resuscitation[J]. Anesth Analg, 2003, 97(1): 226-230. |
| [11] | Hirsh J, Dalen J, Guyatt G, et al. The sixth (2000) ACCP guidelines for antithrombotic therapy for prevention and treatment of thrombosis[J]. Chest, 2001, 119(1 Suppl): 1S-2S. DOI:10.1378/chest.119.1_suppl.1S |
| [12] | Yin Q, Li X, Li C. Thrombolysis after initially unsuccessful cardiopulmonary resuscitation in presumed pulmonary embolism[J]. Am J Emerg Med, 2015, 33(1): 132.e1-2. DOI:10.1016/j.ajem.2014.06.031 |
| [13] | Smulders YM. Pathophysiology and treatment of haemodynamic instability in acute pulmonary embolism: the pivotal role of pulmonary vasoconstriction[J]. Cardiovasc Res, 2000, 48(1): 23-33. DOI:10.1016/s0008-6363(00)00168-1 |
| [14] | Kudlička J, Mlček M, Hála P, et al. Pig model of pulmonary embolism: where is the hemodynamic break point?[J]. Physiol Res, 2013, 62(Suppl 1): S173-179. |
| [15] | Tsang JY, Lamm WJ, Starr IR, et al. Spatial pattern of ventilation-perfusion mismatch following acute pulmonary thromboembolism in pigs[J]. J Appl Physiol(1985), 2005, 98(5): 1862-1868. DOI:10.1152/japplphysiol.01018.2004 |
| [16] | Mizera R, Hodyc D, Herget J. ROS scavenger decreases basal perfusion pressure, vasoconstriction and NO synthase activity in pulmonary circulation during pulmonary microembolism[J]. Physiol Res, 2015, 64(5): 683-688. |
 2018, Vol. 27
2018, Vol. 27




