膈肌功能不全是心脏外科术后的常见并发症,发生率为10%~75%不等[1-5]。临床表现不一,轻者可无症状,仅伴有呼吸频率增快或胸片提示一侧膈肌抬高,部分患者伴有劳累性呼吸困难,重者机械通气时间延长,甚至病死率增加[6-7]。单侧膈肌功能不全多见,大部分是可逆的,通常在6~12个月内恢复,但合并有慢性阻塞性肺病时预后较差[8-9],病程超过1年,症状持续存在者需要行膈肌折叠术。Stanford A型主动脉夹层累及升主动脉及主动脉弓,病死率高,通常需急诊手术,且手术难度大、时间长,通常需要深低温停循环,因此术后并发症也较多[10-11]。
评估膈肌功能的主要手段有胸片、CT、跨膈压、磁共振、超声等,各有其优缺点。其中,床旁超声技术以其无创、实时、准确、简便而广泛应用[12-13]。本研究旨在应用床旁超声技术评估Stanford A型主动脉夹层术后膈肌功能不全的发生率,分析膈肌功能不全可能的危险因素以及对患者预后的影响,同时探讨膈肌功能不全对A型主动脉夹层术后患者脱机拔管的影响。
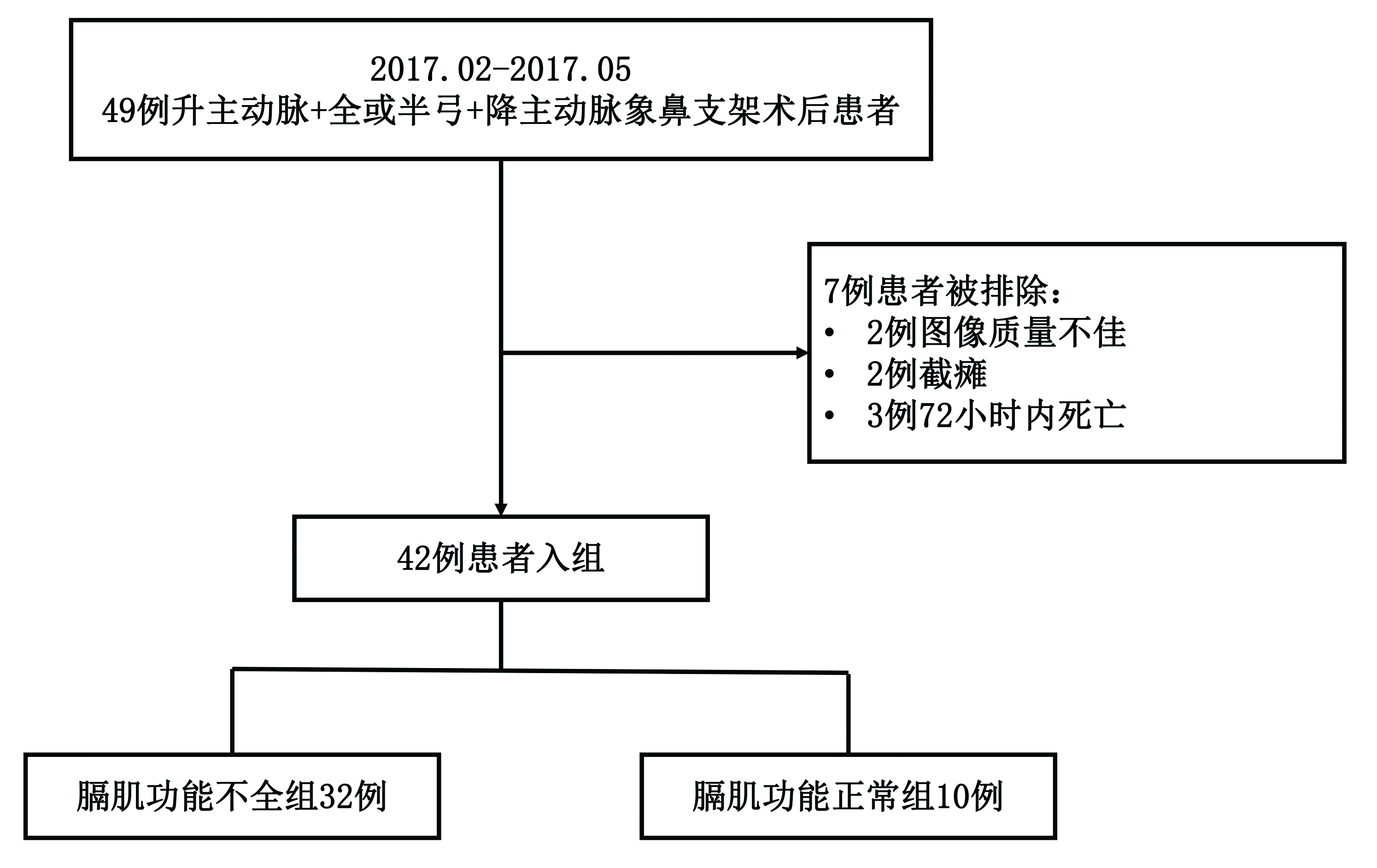
1 资料与方法 1.1 一般资料前瞻性收集2017年2月至5月入住复旦大学附属中山医院心脏外科监护室的成人升主动脉+全/半弓置换+降主动脉象鼻支架术后患者[14]。行脱机试验时(T管脱机)应用床旁超声技术测量患者双侧膈肌位移,根据膈肌位移情况将其分成两组:膈肌功能不全(diaphragmatic dysfunction, DD)组及膈肌功能正常(diaphragmatic function normal, DN)组。排除标准为超声图像质量不佳、截瘫及术后72 h内死亡的患者。本研究经复旦大学附属中山医院伦理委员会批准。
1.2 膈肌功能测量方法超声机器型号为飞利浦CX50,由有超声资质的同一位监护室医生测量。测量方法为:腹部探头测量双侧膈肌活动度,再通过血管探头测量双侧膈肌厚度,并计算膈肌厚度随呼吸运动发生的变异率。膈肌厚度变异率=(吸气末厚度-呼气末厚度)/呼气末厚度。具体方法为首先应用2D模式在腋前线或腋中线找到最佳测量路径(探头位置见图 1),然后选择M超测量膈肌位移或厚度。膈肌功能不全的定义为一侧膈肌活动度小于10 mm,或呈负向运动。负向运动指反常呼吸运动。

|
| 图 1 膈肌位移及厚度测量: A:超声探头置于左侧或右侧腋中线,两肋骨中间;B、C:M超显示膈肌位移及厚度 Figure 1 Measurement of diaphragm excursion and thickness:A: The probe was placed on the lower intercostal spaces of the midaxillary line. B and C: M model revealed the excursion and thickness of the diaphragm |
|
|
性别、年龄、欧洲心血管手术危险因素评分(European system for cardiac operative risk evaluation,EuroSCORE),急性生理学及慢性健康状态评分Ⅱ(Acute Physiology and Chronic Health Evaluation, APACHEⅡ)、体质量指数及伴随的基础疾病等。
1.3.2 手术相关情况手术名称、手术时间、体外循环时间、阻断时间、停循环时间等。
1.3.3 术后并发症脑梗死、急性肾功能衰竭、胸腔积液、感染、气胸等。本研究中急性肾功能衰竭的定义为需要行肾脏替代治疗的急性肾功能不全。
1.3.4膈肌位移、膈肌厚度及厚度变异率。
1.3.5脱机试验时的血气分析、呼吸频率、当天的射血分数及心肌标志物等。
1.3.6 预后指标机械通气时间、无创机械通气(noninvasive ventilation, NIV)、再插管、气管切开、住ICU时间、住院时间、ICU期间病死率及住院期间病死率等。
1.5 统计学方法采用SPSS 22.0统计软件进行数据统计分析,计量资料以均数±标准差(x±s)表示,计数资料以例数(n,%)表示。对计量资料进行正态分析,如符合正态分布,组间比较采用两独立样本t检验,非正态分布变量采用非参数检验。计数资料组间比较采用卡方检验或Fisher确切概率法。用二元logistic回归分析模型分析膈肌功能不全的危险因素,以性别、年龄、EuroSCORE、APACHEⅡ、体质量指数、手术时间、体外时间、停循环时间、阻断时间等可能的危险因素作为自变量。以P < 0.05为差异有统计学意义。
2 结果 2.1 基本资料和临床特征本研究共入组42例患者,其中DD组32例,DN组10例(见图 2)。两组患者在年龄、EuroSCORE、APACHEⅡ、体质量指数及性别和伴随基础疾病(糖尿病、高血压、慢阻肺)的构成比上差异无统计学意义(P > 0.05),见表 1。
|
| 图 2 患者筛选流程图 Figure 2 Patient flow diagram |
|
|
| 指标 | 总体 (n=42) |
DD组 (n=32) |
DN组 (n=10) |
t值/χ2值/Z值 | P值 |
| 年龄(岁) | 50.81±10.77 | 49.84±11.94 | 53.90±4.84 | 1.56 | 0.305 |
| 性别(男/女) | 28/14 | 23/9 | 5/5 | 1.64 | 0.200 |
| EuroSCORE | 5.79±2.20 | 5.72±2.41 | 6.00±1.41 | 0.35 | 0.729 |
| APACHEⅡ | 9.19±4.70 | 9.06±4.49 | 9.60±5.60 | 0.31 | 0.757 |
| 体质量指数(kg/m2) | 21.77±1.74 | 21.88±1.77 | 21.40±1.66 | 0.76 | 0.453 |
| 基础疾病 | |||||
| 糖尿病(例,%) | 1(2.38) | 1(3.12) | 0(0.00) | - | - |
| 高血压(例,%) | 27(64.29) | 19(59.38) | 8(80.00) | 1.41 | 0.235 |
| 慢阻肺(例,%) | 0(0.00) | 0(0.00) | 0(0.00) | - | - |
| 手术相关 | |||||
| 手术时间(h) | 6.27±0.71 | 6.36±0.70 | 6.01±0.69 | 1.30 | 0.202 |
| 体外时间(min) | 202.05±32.60 | 208.09±32.78 | 182.70±24.38 | 2.26 | 0.030 |
| 阻断时间(min) | 114.95±28.51 | 121.78±27.75 | 93.10±18.84 | 3.04 | 0.004 |
| 停循环时间(min) | 28.58±8.57 | 29.44±8.75 | 26.00±7.81 | 1.05 | 0.303 |
| 术后并发症 | |||||
| 脑梗(例,%) | 4(9.52) | 3(9.38) | 1(10.00) | 0.00 | 0.953 |
| ARF(例,%) | 8(19.05) | 7(21.88) | 1(10.00) | 0.70 | 0.404 |
| 胸腔积液(例,%) | 8(19.05) | 7(21.88) | 1(10.00) | 0.70 | 0.404 |
| 感染(例,%) | 3(7.14) | 2(6.25) | 1(10.00) | 0.16 | 0.688 |
| 气胸(例,%) | 1(2.38) | 1(3.13) | 0(0.00) | 0.32 | 0.572 |
| 术后心功能 | |||||
| BNP(pg/mL) | 2 089.45±169.54 | 2 134.93±2 314.26 | 1 943.90±1 721.63 | -0.03 | 0.976 |
| 射血分数(%) | 60.88±7.49 | 60.41±8.11 | 62.40±5.06 | -0.73 | 0.469 |
| 注:EuroSCORE: European system for cardiac operative risk evaluation, 欧洲心血管手术危险因素评分; APACHE II:Acute Physiology and Chronic Health Evaluation II, 急性生理学及慢性健康状态评分;ARF:acute kidney failure, 急性肾功能衰竭;BNP:B-type natriuretic peptide, B型钠尿肽 | |||||
与DN组相比,DD组患者阻断时间[(121.78±27.75)min vs.(93.10±18.84)min, P=0.004]及体外时间[(208.09±32.78)min vs.(182.70±24.38)min, P=0.03]明显延长,差异有统计学意义。而手术时间[(6.36±0.70)h vs.(6.01±0.69)h, P=0.202]及停循环时间[(29.44±8.75)min vs.(26.00±7.81)min, P=0.303],差异无统计学意义,见表 1。
2.3 术后并发症两组患者术后脑梗死、急性肾功能衰竭、胸腔积液、感染、气胸等的发生率对比,差异无统计学意义(P > 0.05),见表 1。
2.4 膈肌功能情况32例DD组患者中,有31例为单侧膈肌功能不全,且多数为左侧(26例)。患侧膈肌平均位移为0.45 cm,健侧为2.01 cm;DN组膈肌平均位移1.80 cm,患侧膈肌位移较健侧及DN组明显减少,差异有统计学意义。吸气末,DD组患者患侧膈肌平均厚度为0.184 cm,健侧为0.185 cm,DN组患者平均膈肌厚度为0.189 cm,两组患者膈肌厚度差异无统计学意义。DN组患者膈肌厚度变异率为23.58%,DD组患者健侧为24.16%,患侧为4.67%,较健侧及DN组患者明显下降,差异有统计学意义。(表 2)。
| 组别 | DD组 | DN组 | t值/χ2值 | P值 |
| (n=32) | (n=10) | |||
| 膈肌情况 | ||||
| 位移(cm) | 0.450±0.331(患侧) | 1.801±0.616 | -11.93 | 0.000 |
| 2.013±0.655(健侧) | 1.17 | 0.248 | ||
| 厚度(cm) | 0.184±0.028(患侧) | 0.189±0.028 | -0.11 | 0.559 |
| 0.185±0.025(健侧) | -0.53 | 0.601 | ||
| 厚度变化率(%) | 4.67±3.63(患侧) | 23.58±10.69 | -12.81 | 0.000 |
| 24.16±7.89(健侧) | 0.22 | 0.825 | ||
| 呼吸频率(次/min) | 24.13±4.98 | 20.50±3.17 | 2.16 | 0.037 |
| 血气情况 | ||||
| PH | 7.45±0.04 | 7.44±0.03 | 0.97 | 0.337 |
| PCO2(mmHg) | 39.75±5.36 | 38.56±4.12 | 0.64 | 0.524 |
| HCO3-(mmHg) | 27.20±3.60 | 25.69±2.92 | 1.21 | 0.235 |
| PaO2/ FiO2(mmHg) | 210.65±87.76 | 225.90±131.96 | -0.19 | 0.674 |
| 乳酸(mmol/L) | 1.54±0.52 | 1.42±0.25 | 0.70 | 0.488 |
两组患者脱机时血气分析(pH、PCO2、HCO3-、PaO2/FiO2、乳酸),脱机当天射血分数[(60.41±8.11)% vs.(62.40±5.06)%,P=0.469]及心肌标志物[(2 134.93±2 314.26)pg/mL vs.(1 943.90±1 721.63)pg/mL,P=0.976]差异均无统计学意义,但脱机时DD组患者呼吸频率[(24.13±4.98)次/min vs.(20.50±3.17)次/min, P=0.037]明显增快,差异有统计学意义(表 2)。
2.6 膈肌功能不全的危险因素分析二元logistic回归分析发现阻断时间延长是A型主动脉夹层术后膈肌功能不全的独立危险因素,差异具有统计学意义(P=0.045),见表 3。
| 指标 | 比值比(OR) | 95%CI | P值 |
| 性别 | 0.247 | 0.010~5.885 | 0.387 |
| 年龄(岁) | 0.868 | 0.730~1.031 | 0.107 |
| EuroSCORE | 1.083 | 0.504~2.325 | 0.839 |
| APACHEⅡ | 1.047 | 0.790~1.387 | 0.751 |
| 体质量指数(kg/m2) | 0.849 | 0.299~2.412 | 0.759 |
| 手术时间(h) | 1.024 | 0.262~3.997 | 0.973 |
| 体外时间(min) | 1.031 | 0.950~1.119 | 0.469 |
| 停循环时间(min) | 0.906 | 0.745~1.101 | 0.321 |
| 阻断时间(min) | 1.100 | 1.002~1.208 | 0.045 |
| 注:EuroSCORE: European system for cardiac operative risk evaluation, 欧洲心血管手术危险因素评分; APACHEⅡ:Acute Physiology and Chronic Health EvaluationⅡ, 急性生理学及慢性健康状态评分 | |||
两组患者术后机械通气时间(88 h vs. 37 h,P=0.194)差异无统计学意义,但DD组患者NIV使用率(46.88% vs. 10%,P=0.036)显著增加。其他指标如气管切开、再插管、住ICU时间、住院时间、ICU期间病死率及住院期间病死率差异无统计学意义(表 4)。
| 指标 | DD组 | DN组 | Z值/χ2值 | P值 |
| (n=32) | (n=10) | |||
| 机械通气时间(h) | 88(39,158) | 37(16,100) | 1.30 | 0.194 |
| NIV(例,%) | 15(46.88) | 1(10.00) | 4.39 | 0.036 |
| 再插管(例,%) | 5(15.63) | 1(10.00) | 0.20 | 0.657 |
| 气切(例,%) | 4(12.50) | 3(30.00) | 1.68 | 0.195 |
| 住ICU时间(d) | 7(5,11) | 6(4,12) | 0.99 | 0.320 |
| 住院时间(d) | 15(13,24) | 14(11,21) | 0.56 | 0.574 |
| ICU病死率(例,%) | 2(6.25) | 1(10.00) | 0.16 | 0.688 |
| 住院期间病死率(例,%) | 2(6.25) | 1(10.00) | 0.16 | 0.688 |
| 注:NIV:noninvasive ventilation, 无创机械通气。ICU: intensive care unit, 重症监护室 | ||||
本研究发现约76%的Stanford A型主动脉夹层术后患者发生膈肌功能不全,单侧居多。31例单侧膈肌功能不全患者中,26例发生在左侧。DD组患者阻断时间及体外时间均较DN组长。此外,与DN组相比,DD组患者NIV使用率也显著增加,但机械通气时间无明显延长。
正常膈肌为穹窿形的膜性肌纤维,通过自主和不自主的上升和下降来调节胸腹腔内压力来协助通气。膈肌运动主要由膈神经(颈3-5)支配[15]。文献报道心外科术后膈肌功能不全的主要原因为术中心包内放置冰屑,导致膈神经麻痹[16-18]。其他原因包括术中直接损伤,如切割伤或电刀灼伤,以及牵拉伤等[18-19]。本研究中DD组患者阻断时间及体外时间较DN组明显延长,可能与A型主动脉夹层术后膈肌功能不全发生有关,进一步logistic回归分析发现阻断时间延长是术后膈肌功能不全的高危因素。
单侧膈肌损伤通常无症状,常见表现是胸片发现一侧膈肌抬高,但准确性较差,需要进一步检查以明确诊断[20]。近年来,床旁超声在重症监护室的应用越来越广泛,其评估膈肌功能的准确性已被反复验证[21]。本研究由有多年临床经验及超声资质的监护室医生进行膈肌功能评估及数据测量,在膈肌位移的基础上对膈肌厚度及厚度变异率进行了测量,发现患侧膈肌厚度与健侧及膈肌功能正常组相近,而膈肌厚度变异率明显下降。重症监护室膈肌功能不全的常见原因包括长期机械通气导致的膈肌萎缩[22],甚至于有文献报道膈肌完全无自主活动的患者(脑死亡)在机械通气18~69 h后即可出现显著的膈肌萎缩[23]。本研究中患侧膈肌厚度与健侧及正常组膈肌厚度相比无明显变薄,可除外机械通气相关的膈肌功能不全。
Stanford A型主动脉夹层术后膈肌功能不全的临床特征目前未见大宗报道。本研究发现,Stanford A型主动脉夹层术后膈肌功能不全多伴有不同程度的临床症状,如呼吸窘迫、反常呼吸等。DD组患者机械通气时间与DN组相仿,但NIV使用率明显增加。而其他预后指标,如住ICU时间、住院时间等无明显差异。一方面,本研究中患者基础情况均较好,术前无糖尿病或慢性阻塞性肺疾病病史,心功能正常,为术后呼吸功能恢复提供了条件。另一方面,研究过程中对患者常规进行膈肌功能评估,可以早期发现膈肌功能不全,并尽早进行干预。干预手段包括拔除口插管后序贯给与无创机械通气、营养神经、鼓励患者进行深呼吸、用力吹气球等。
本研究尚存在以下局限性:1)由于单侧膈肌不全对患者影响较小,患者出院时仍可能伴有不同程度的膈肌功能不全,故本研究未就患者膈肌功能何时恢复进行随访;2)本研究样本量较小,有可能会影响二元logistic回归分析结果,如体外时间、停循环时间等均可能影响膈肌功能,但本研究上述变量未进入回归。
综上所述,Stanford A型主动脉夹层术后膈肌功能不全较常见,单侧多于双侧,左侧多于右侧,可能与阻断时间延长有关。术后拔除口插管后序贯无创机械通气治疗的方案是可行的。
| [1] | Efthimiou J, Butler J, Woodham C, et al. Diaphragm paralysis following cardiac surgery:role of phrenic nerve cold injury[J]. Ann Thorac Surg, 1991, 52(4): 1005-1008. DOI:10.1016/0003-4975(91)91268-Z |
| [2] | DeVita MA, Robinson LR, Rehder J, et al. Incidence and natural history of phrenic neuropathy occurring during open heart surgery[J]. Chest, 1993, 103(3): 850-856. DOI:10.1378/chest.103.3.850 |
| [3] | Chroni E, Patel RL, Taub N, et al. A comprehensive electrophysiological evaluation of phrenic nerve injury related to open-heart surgery[J]. Acta Neurol Scand, 1995, 91(4): 255-259. DOI:10.1111/ane.1995.91.issue-4 |
| [4] | Dimopoulou I, Daganou M, Dafni U, et al. Phrenic nerve dysfunction after cardiac operations:electrophysiologic evaluation of risk factors[J]. Chest, 1998, 113(1): 8-14. DOI:10.1378/chest.113.1.8 |
| [5] | Canbaz S, Turgut N, Halici U, et al. Electrophysiological evaluation of phrenic nerve injury during cardiac surgery——a prospective, controlled, clinical study[J]. BMC Surg, 2004, 4(2). DOI:10.1186/1471-2482-4-2 |
| [6] | Aguirre VJ, Sinha P, Zimmet A, et al. Phrenic nerve injury during cardiac surgery:mechanisms, management and prevention[J]. Heart Lung Circ, 2013, 22(11): 895-902. DOI:10.1016/j.hlc.2013.06.010 |
| [7] | Stevenson JG. Effect of unilateral diaphragm paralysis on branch pulmonary artery flow[J]. J Am Soc Echocardiogr, 2002, 15(10/2): 1132-1139. |
| [8] | Iverson LI, Mittal A, Dugan DJ, et al. Injuries to the phrenic nerve resulting in diaphragmatic paralysis with special reference to stretch trauma[J]. Am J Surg, 1976, 132(2): 263-269. DOI:10.1016/0002-9610(76)90058-1 |
| [9] | Diehl JL, Lofaso F, Deleuze P, et al. Clinically relevant diaphragmatic dysfunction after cardiac operations[J]. J Thorac Cardiovasc Surg, 1994, 107(2): 487-98. |
| [10] | 宋剑平, 胡新宇, 金静芬, 等. 急性Stanford A型主动脉夹层术后短期死亡影响因素分析[J]. 中华急诊医学杂志, 2017, 26(6): 706-709. DOI:10.3760/cma.j.issn.1671.0282.2017.06.022 |
| [11] | 肖子亚, 姚晨玲, 顾国嵘, 等. 580例主动脉夹层患者临床特征及预后分析[J]. 中华急诊医学杂志, 2016, 25(5): 644-649. DOI:10.3760/cma.i.issn.1671-0282.2016.05.020 |
| [12] | Lee JB, Tse C, Keown T, et al. Evaluation of a point of care ultrasound curriculum for Indonesian physicians taught by first-year medical students[J]. World J Emerg Med, 2017, 8(4): 281-286. DOI:10.5847/wjem.j.1920-8642.2017.04.006 |
| [13] | Rooney KP, Lahham S, Anderson CL, et al. Pre-hospital assessment with ultrasound in emergencies:implementation in the field[J]. World J Emerg Med, 2016, 7(2): 117-123. DOI:10.5847/wjem.j.1920-8642.2016.02.006 |
| [14] | Ji Q, Lai H, Sun Y, et al. Impact of presurgical mild acute respiratory Distress syndrome on surgical mortality after surgical repair of acute type A aortic dissection[J]. Int Heart J, 2017, 58(5): 739-745. DOI:10.1536/ihj.16-306 |
| [15] | Haji K, Royse A, Green C, et al. Interpreting diaphragmatic movement with bedside imaging, review article[J]. J Crit Care, 2016, 34(1): 56-65. |
| [16] | Curtis JJ, Nawarawong W, Walls JT, et al. Elevated hemidiaphragm after cardiac operations:incidence, prognosis, and relationship to the use of topical ice slush[J]. Ann Thorac Surg, 1989, 48(6): 764-768. DOI:10.1016/0003-4975(89)90667-X |
| [17] | Esposito RA, Spencer FC. The effect of pericardial insulation on hypothermic phrenic nerve injury during open-heart surgery[J]. Ann Thorac Surg, 1987, 43(3): 303-308. DOI:10.1016/S0003-4975(10)60619-4 |
| [18] | Mazzoni M, Solinas C, Sisillo E, et al. Intraoperative phrenic nerve monitoring in cardiac surgery[J]. Chest, 1996, 109(6): 1455-1460. DOI:10.1378/chest.109.6.1455 |
| [19] | Cohen AJ, Katz MG, Katz R, et al. Phrenic nerve injury after coronary artery grafting:is it always benign?[J]. Ann Thorac Surg, 1997, 64(1): 148-153. DOI:10.1016/S0003-4975(97)00288-9 |
| [20] | Chetta A, Rehman AK, Moxham J, et al. Chest radiography cannot predict diaphragm function[J]. Respir Med, 2005, 99(1): 39-44. DOI:10.1016/j.rmed.2004.04.016 |
| [21] | Zambon M, Greco M, Bocchino S, et al. Assessment of diaphragmatic dysfunction in the critically ill patient with ultrasound:a systematic review[J]. Intensive Care Med, 2017, 43(1): 29-38. DOI:10.1007/s00134-016-4524-z |
| [22] | Kim WY, Lim CM. Ventilator-induced diaphragmatic dysfunction:diagnosis and role of pharmacological agents[J]. Respir Care, 2017, 62(11): 1485-1491. DOI:10.4187/respcare.05622 |
| [23] | Levine S, Nguyen T, Taylor N, et al. Rapid disuse atrophy of diaphragm fibers in mechanically ventilated humans[J]. N Engl J Med, 2008, 358(13): 1327-1335. DOI:10.1056/NEJMoa070447 |
 2018, Vol. 27
2018, Vol. 27




