急性肾损伤(acute kidney injury, AKI)是一种常见的临床危重疾病,发病率高,早期诊断困难[1-3],预后欠佳,病死率高[4]。AKI的发病机制尚未完全明了。近年来研究发现沉默信息调节因子相关酶1(sirtuin 1,SIRT1)在缺血-再灌注损伤、肾毒性药物、脓毒血症等不同诱因诱导的AKI中能发挥强大的肾脏保护作用[5-7]。SIRT1是哺乳动物sirtuins家族中的一员,是依赖烟酰胺腺嘌呤二核苷酸(nicotinamide adenine dinucleotide, NAD+)的去乙酰化酶[8],参与多种生理功能的调节,不仅能去乙酰化组蛋白,还能作用于包括p53、过氧化物酶体增殖物激活受体γ共激活因子-1α(peroxisome proliferator-activated receptor γ coactivator-1α, PGC-1α)、核因子(nuclear factor-kappa B, NF-κB)、叉头形转录因子O亚型(forkhead box O,FOXO)等许多重要转录调控因子,调节细胞的增殖、分化、凋亡和衰老等过程[9]。SIRT1的天然激活剂白藜芦醇已被证实具有抗氧化、抗凋亡、抗炎功能,对肾脏病具有保护作用[10]。SIRT1在皮质近端肾小管上皮细胞中度表达,在髓质肾小管上皮细胞高度表达[11]。在不同机制诱导AKI中,SIRT1已被证实可通过多种信号通路调节基因转录,从而减轻肾小管上皮细胞氧化应激损伤,减轻肾脏炎症反应,改善线粒体功能,减少肾小管细胞凋亡[6]。因此,SIRT1有望成为AKI的早期诊断标志物及重要治疗靶点。现就SIRT1对AKI的保护机制做一综述。
1 SIRT1对缺血-再灌注诱导AKI保护作用 1.1 SIRT1与p53线粒体功能障碍是缺血-再灌注损伤诱导AKI机制之一[12]。有研究发现在缺血缺氧、微循环障碍时,肾脏近端小管上皮细胞的线粒体可发生功能障碍,导致ATP减少,并释放大量活性氧(reactive oxygen species, ROS),激活内源性细胞凋亡途径[13]。其中,调节细胞凋亡的关键因子p53,可被SIRT1去乙酰化修饰,因此SIRT1被认为是介导p53调节细胞凋亡的重要分子机制[9]。Zeng等[14]实验发现,在缺血-再灌注损伤诱导AKI大鼠模型中,给予SIRT1激动剂虎杖苷能提高大鼠肾小管上皮细胞中SIRT1活性和蛋白表达水平,降低p53乙酰化水平,减少p53的线粒体易位,改善线粒体功能,抑制肾小管上皮细胞凋亡,血肌酐(serum creatinine,Scr)、尿素氮(blood urea nitrogen,BUN)均低于对照组。而虎杖苷的这种保护作用可被SIRT1抑制剂EX527抑制,应用EX527后肾小管凋亡明显增加,Scr、BUN上升,因此认为SIRT1是通过调节p53去乙酰化水平来实现对缺血-再灌注肾损伤进程中的保护作用的。
1.2 SIRT1与PGC-1αPGC-1α是一种核编码的转录共激活因子,可被SIRT1去乙酰化修饰,调节核编码线粒体相关蛋白核呼吸因子(nuclear respiratory factors,NRFs),包括NRF1、NRF2[15]。SIRT1通过去乙酰化修饰PGC-1α从而调节线粒体生物合成和能量代谢,PGC-1α的过表达可增加近端肾小管上皮细胞线粒体数量和ATP浓度,促进氧化应激损伤的恢复,改善线粒体呼吸功能,维持近端肾小管上皮细胞内环境稳定[12]。Wang等[10]给予缺血-再灌注损伤诱导AKI大鼠模型复苏,发现白藜芦醇+林格复苏组(RSV+LR)与林格复苏组(LR)相比,虽然Scr和BUN值、pH无差异,但RSV+LR组较LR组血清中性粒细胞明胶酶相关脂质运载蛋白(neutrophil gelatinase-associated lipocalin,NGAL)、乳酸生成显著减少,SIRT1、PGC-1α、过氧化氢酶(catalase,CAT)、超氧化物歧化酶2(superoxide dismutase 2,SOD2)表达显著增加,NAD+ /NADH比值升高,ROS产生、脂质过氧化减少,线粒体呼吸功能恢复更快。其中,NGAL是近来发现的比Scr诊断AKI更敏感的生物标志物[16]。而敲除SIRT1基因会阻断白藜芦醇的这种保护功能,提示SIRT1是通过减少肾小管上皮细胞线粒体氧化应激以及增加线粒体生物合成实现肾保护作用的。Funk等[17]将大鼠双侧肾动脉夹闭22 min,再恢复灌注24 h,将给予SIRT1激动剂SRT1720(5 mg/kg)的大鼠设为IRS组,未给予SRT1720的大鼠设为IRV组,发现IRV组大鼠肾小管上皮细胞线粒体ATP合酶、环氧化酶1(cyclooxygenase 1, COX 1)、线粒体呼吸功能显著下降,肾损伤分子-1(kidney injury molecule-1, KIM-1)持续升高,而这些损伤在IRS组可以部分或完全恢复。肾组织病理结果显示,两组肾小管上皮细胞均表现为边界不清、炎性细胞浸润、肾小管肿胀变性、间质水肿,Scr恢复程度等差异无统计学意义,两组中尿KIM-1均升高,但IRS组在使用SRT1720 144 h后较IRV组尿KIM-1有明显降低。同时,IRS组肾小管上皮细胞表达SIRT1、去乙酰化PGC-1α水平显著增加。认为SIRT1通过去乙酰化PGC-1α、加速肾小管上皮细胞线粒体蛋白表达和功能恢复来实现肾保护作用。
1.3 SIRT1与氧化应激及炎症反应氧化应激和炎症反应是缺血-再灌注损伤诱导AKI的另一重要病理机制之一[18]。研究表明,SIRT1可促使核呼吸因子2(nuclear factor erythroid-2 related factor 2, NRF2)-kelch样环氧氯丙烷相关蛋白1(kelch-like ech-associated protein 1, Keap1)复合体释放Keap1,激活NRF2,使NRF2易位到细胞核内,调节多种抗氧化基因如SOD、CAT,对抗氧化反应[19]。SIRT1还可通过与p65亚基相互作用来抑制NF-κB活化从而阻断炎症反应[20]。Zhao等[21]发现,在缺血-再灌注损伤诱导AKI大鼠模型中,给予SIRT1激动剂总黄酮,Scr、BUN水平显著降低,SIRT1、NRF2、血红素加氧酶-1(haem oxygenase-1,HO-1)表达升高,炎症相关因子如Keap1、NF-κB p65、白细胞介素1(interleukin-1,IL-1)、白细胞介素6(interleukin-6,IL-6)、肿瘤坏死因子α(tumor necrosis factor-α,TNF-α)mRNA表达下降,氧化应激相关因子如丙二醛(malondialdehyde,MDA)、ROS水平显著降低,抗氧化应激相关因子如SOD、谷胱甘肽(glutathione,GSH)、谷胱甘肽过氧化物酶(glutathione peroxidase,GSH-Px)显著升高;肾组织显示肾小管上皮细胞肿胀、空泡形成、刷状缘脱落、坏死、炎性细胞浸润较前恢复,并且用siRNA阻断SIRT1后能抑制上述变化。大鼠体内试验的结果也已经被体外细胞试验证实。
2 SIRT1对药物诱导AKI保护作用肾脏是众多化学药物毒性作用的主要靶器官之一,因此在临床治疗中药物诱导的AKI十分常见[22]。顺铂肾毒性的关键机制之一是炎症反应[23]。Guan等[24]发现在经顺铂处理的小鼠中,20月龄小鼠与3月龄小鼠相比,肾脏表达更低水平的SIRT1和NAD+,更易发生AKI,20月龄小鼠的BUN和Scr水平是3月龄小鼠的两倍,病理结果显示20月龄小鼠的肾小管损伤较3月龄小鼠严重,包括严重的近端小管扩张、管型形成和大量肾小管上皮细胞坏死;相对于3月龄小鼠,补充烟酰胺单核苷酸(nicotinamide mononucleotide,NMN)(NAD+的前体)能更大程度恢复20月龄小鼠SIRT1活性和NAD+含量,减少老年相关AKI发生,给予20月龄小鼠NMN治疗,与无NMN治疗的对照组小鼠相比,Scr水平下降60%。该保护作用主要通过NAD+/SIRT1途径,增加SIRT1表达能调节JNK信号通路,从而减轻氧化应激反应,而SIRT1基因敲除小鼠中NMN的肾保护作用则不明显,SIRT1基因敲除小鼠较野生型小鼠BUN和Scr水平更高,存在更多肾小管损伤,更严重的线粒体碎片。提示NMN减少顺铂诱导的老年相关AKI依赖于SIRT1。Hong等[25]实验发现,在造影剂诱导的AKI小鼠模型中,给予碘海醇后,Scr水平和肾小管损伤明显增加,SIRT1和PGC-1α的表达降低,细胞存活率下降;给予白藜芦醇后肾损伤减轻,细胞死亡减少,SIRT1、PGC-1α活化表达增加,FOXO1去磷酸化增加,并且用siRNA阻断SIRT1后能抑制上述变化。小鼠体内试验的结果也已经被体外细胞试验证实。提示可通过激活SIRT1-PGC-1α-FOXO1信号通路改善造影剂诱导的AKI,减少肾小管上皮细胞凋亡。笔者近期的研究发现在造影剂泛影葡胺诱导AKI大鼠模型中,AKI组与对照组相比Scr水平升高更明显,肾小管上皮细胞损伤、髓质充血更严重,同时RT-PCR及Western Blot结果显示AKI组SIRT1和PGC-1α mRNA及蛋白表达水平较对照组升高。
3 SIRT1对脓毒血症诱导AKI保护作用AKI是脓毒血症严重并发症之一。线粒体功能障碍也是脓毒血症诱导AKI机制的重要因素之一[26]。Gao等[27]给予SIRT1基因敲除小鼠和野生型小鼠腹腔内注射LPS(5 mg/kg)诱导AKI小鼠模型,发现SIRT1基因敲除小鼠Scr、BUN、KIM-1水平升高更明显,更易发生AKI;在SIRT1基因敲除小鼠中,肾脏结构损伤严重,肾小管损伤包括肾小管肿胀、空泡形成明显增加;SIRT1基因的缺失会促进中性粒细胞浸润,加重炎症反应,增加细胞间黏附分子1(intercellular adhesion molecular-1, ICAM-1)、血管细胞黏附分子1(vascular cell adhesion molecule-1, VCAM-1)表达,激活促炎因子NF-κB、信号转导和转录活化因子3(signal transducers and activators of transcription 3, STAT3)、细胞外调节蛋白激酶(extracellular signal-regulated kinases, ERK),通过ERK/丝裂原活化蛋白激酶(mitogen-activated protein kinase, MAPK)级联调节炎症反应。Gan等[28]发现,在脓毒血症大鼠模型中,AKI大鼠Scr、BUN、血清胱抑素C、NGAL、KIM-1、TNF-α、IL-1、IL-6表达水平上升;肾组织结构不清、水肿明显,炎性细胞浸润较多,随后给予白藜芦醇治疗,上述指标及肾脏组织学损伤较未给予白藜芦醇组大鼠明显下降;白藜芦醇能上调SIRT1水平,促进NF-κB p65去乙酰化,抑制炎性因子表达,增加脓毒血症大鼠的生存率。以上实验结果均表明SIRT1可通过抑制炎症信号、减轻肾脏炎症实现脓毒血症诱导AKI的肾保护作用。Bai等[29]发现,在严重烧伤大鼠模型中,Scr、BUN水平在严重烧伤后显著升高(超过1.5倍)。烧伤组与烧伤+褪黑素组相比,管型的百分比增加。给予褪黑素可显著降低烧伤大鼠Scr、BUN水平,上调肾组织中SIRT1活性,增加其表达,从而增加FOXO1、NF-κB p65和p53去乙酰化水平,而去乙酰化的FOXO1能抑制凋亡相关分子的表达,增加抗氧化剂如SOD的合成,减少细胞氧化应激损伤;同时,上调的SIRT1也能增加抗凋亡蛋白Bcl-2表达,抑制促凋亡蛋白BAX表达,减少细胞凋亡。然而,这些效应可以被SIRT1特异性抑制剂EX527抑制。表明SIRT1能通过增加FOXO1、NF-κB p65、p53去乙酰化水平减轻肾脏炎症反应、氧化应激和细胞凋亡,改善严重烧伤诱导的AKI。Zhang等[30]实验发现,在LPS诱导的AKI小鼠模型中,给予银杏黄酮苷元能上调SIRT1的表达,减少TNF-α、IL-6等炎症因子的表达,抑制NF-κB信号通路的表达,减轻炎症反应,BUN和KIM-1水平明显降低,肾组织结果显示肾小管上皮细胞凋亡减少。此外,使用SIRT1抑制剂EX527后上述结果相反。因此认为SIRT1对LPS诱导AKI的保护作用是通过抑制NF-κB信号通路实现的。
4 展望综上所述,SIRT1的肾脏保护作用在缺血-再灌注损伤、肾毒性药物、脓毒血症诱导的AKI中得到验证。具体保护机制见图 1。SIRT1能通过不同的信号通路调节基因转录,改善线粒体功能,减轻肾脏炎症反应,减轻氧化应激损伤,减少肾小管细胞凋亡。SIRT1有望成为今后早期治疗AKI的重要靶点,探索SIRT1激动剂有望用于AKI的早期治疗。但SIRT1相关信号通路之间相互作用尚未完全清楚,有待进一步研究。
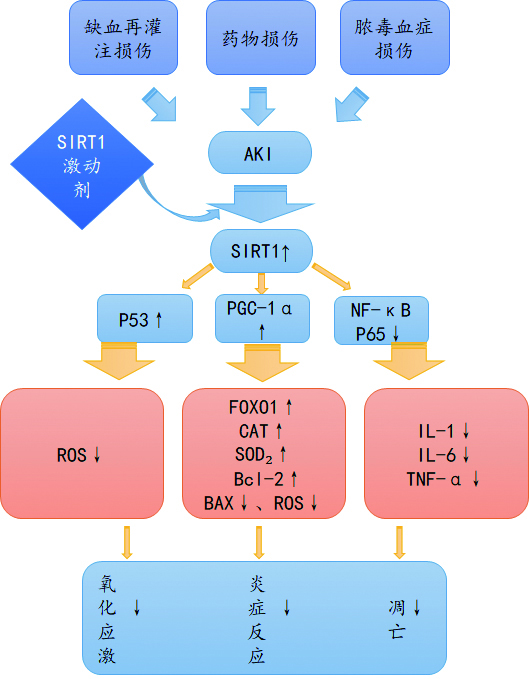
|
| 图 1 SIRT1对不同诱因诱导的AKI的保护机制 |
|
|
| [1] | Zhou F, Luo Q, Wang L, et al. Diagnostic value of neutrophil gelatinase-associated lipocalin for early diagnosis of cardiac surgery-associated acute kidney injury: a meta-analysis[J]. Eur J Cardiothorac Surg, 2016, 49(3): 746-755. DOI:10.1093/ejcts/ezv199 |
| [2] | 韩利娜, 周芳芳, 罗群. 尿液蛋白质组学在不同病因急性肾损伤早期诊断中的应用[J]. 中华肾脏病杂志, 2016, 32(4): 314-316. DOI:10.3760/cma.j.issn.1001–7097.2016.04.015 |
| [3] | Luo Q, Zhou F, Dong H, et al. Implication of combined urinary biomarkers in early diagnosis of acute kidney injury following percutaneous coronary intervention[J]. Clin Nephrol, 2013, 79(2): 85-92. DOI:10.5414/CN106852 |
| [4] | Yang L, Xing G, Wang L, et al. Acute kidney injury in China: a cross-sectional survey[J]. Lancet, 2015, 386(10002): 1465-1471. DOI:10.1016/S0140-6736(15)00344-X |
| [5] | Xu S, Gao Y, Zhang Q, et al. SIRT1/3 activation by resveratrol attenuates acute kidney injury in a septic rat model[J]. Oxid Med Cell Longev, 2016, 2016: 7296092. DOI:10.1155/2016/7296092 |
| [6] | Li WF, Yang K, Zhu P, et al. Genistein ameliorates ischemia/reperfusion-induced renal injury in a SIRT1-dependent manner[J]. Nutrients, 2017, 9(4). DOI:10.3390/nu9040403 |
| [7] | Chen L, Lan Z. Polydatin attenuates potassium oxonate-induced hyperuricemia and kidney inflammation by inhibiting NF-kappaB/NLRP3 inflammasome activation via the AMPK/SIRT1 pathway[J]. Food Funct, 2017, 8(5): 1785-1792. DOI:10.1039/c6fo01561a |
| [8] | Kumar A, Chauhan S. How much successful are the medicinal chemists in modulation of SIRT1: a critical review[J]. Eur J Med Chem, 2016, 119(30): 45-69. DOI:10.1016/j.ejmech.2016.04.063 |
| [9] | Meng X, Tan J, Li M, et al. Sirt1: Role Under the condition of ischemia/hypoxia[J]. Cell Mol Neurobiol, 2017, 37(1): 17-28. DOI:10.1007/s10571-016-0355-2 |
| [10] | Wang H, Guan Y, Karamercan MA, et al. Resveratrol rescues kidney mitochondrial function following hemorrhagic shock[J]. Shock, 2015, 44(2): 173-180. DOI:10.1097/SHK.0000000000000390 |
| [11] | Dong YJ, Liu N, Xiao Z, et al. Renal protective effect of sirtuin 1[J]. J Diabetes Res, 2014, 2014: 843786. DOI:10.1155/2014/843786 |
| [12] | Ishimoto Y, Inagi R. Mitochondria: a therapeutic target in acute kidney injury[J]. Nephrol Dial Transplant, 2016, 31(7): 1062-1069. DOI:10.1093/ndt/gfv317 |
| [13] | Hall AM, Schuh CD. Mitochondria as therapeutic targets in acute kidney injury[J]. Curr Opin Nephrol Hypertens, 2016, 25(4): 355-362. DOI:10.1097/mnh.0000000000000228 |
| [14] | Zeng Z, Chen Z, Xu S, et al. Polydatin protecting kidneys against hemorrhagic shock-induced mitochondrial dysfunction via SIRT1 activation and p53 deacetylation[J]. Oxid Med Cell Longev, 2016, 2016: 1737185. DOI:10.1155/2016/1737185 |
| [15] | Song MY, Jung HW, Kang SY, et al. Atractylenolide Ⅲ enhances energy metabolism by increasing the SIRT-1 and PGC1alpha expression with AMPK phosphorylation in C2C12 mouse skeletal muscle cells[J]. Biol Pharm Bull, 2017, 40(3): 339-344. DOI:10.1248/bpb.b16-00853 |
| [16] | 黄曼, 耿婷婷. 急性肾损伤的研究进展[J]. 中华急诊医学杂志, 2017, 26(9): 986-991. DOI:10.3760/cma.j.issn.1671-0282.2017.09.002 |
| [17] | Funk J A, Schnellmann RG. Accelerated recovery of renal mitochondrial and tubule homeostasis with SIRT1/PGC-1alpha activation following ischemia-reperfusion injury[J]. Toxicol Appl Pharmacol, 2013, 273(2): 345-354. DOI:10.1016/j.taap.2013.09.026 |
| [18] | Kocak C, Kocak FE, Akcilar R, et al. Effects of captopril, telmisartan and bardoxolone methyl (CDDO-Me) in ischemia-reperfusion-induced acute kidney injury in rats: an experimental comparative study[J]. Clin Exp Pharmacol Physiol, 2016, 43(2): 230-241. DOI:10.1111/1440-1681.12511 |
| [19] | Ding YW, Zhao GJ, Li XL, et al. SIRT1 exerts protective effects against paraquat-induced injury in mouse type Ⅱ alveolar epithelial cells by deacetylating NRF2 in vitro[J]. Int J Mol Med, 2016, 37(4): 1049-1058. DOI:10.3892/ijmm.2016.2503 |
| [20] | Zhang J, Zhang Y, Xiao F, et al. The peroxisome proliferator-activated receptor gamma agonist pioglitazone prevents NF-kappaB activation in cisplatin nephrotoxicity through the reduction of p65 acetylation via the AMPK-SIRT1/p300 pathway[J]. Biochem Pharmacol, 2016, 101: 100-111. DOI:10.1016/j.bcp.2015.11.027 |
| [21] | Zhao L, Xu L, Tao X, et al. Protective effect of the total flavonoids from rosa laevigata michx fruit on renal ischemia-reperfusion injury through suppression of oxidative stress and inflammation[J]. Molecules, 2016, 21(7). DOI:10.3390/molecules21070952 |
| [22] | Yuan Y, Qiu H, Hu XY, et al. Risk factors of contrast-induced acute kidney injury in patients undergoing emergency percutaneous coronary intervention[J]. Chin Med J (Engl), 2017, 130(1): 45-50. DOI:10.4103/0366-6999.196578 |
| [23] | 梁倩影, 彭大为. 复方苦参注射液联合紫杉醇与顺铂治疗晚期卵巢癌的临床疗效[J]. 实用肿瘤杂志, 2015, 30(5): 465-468. |
| [24] | Guan Y, Wang SR, Huang XZ, et al. Nicotinamide mononucleotide, an NAD(+) precursor, rescues age-associated susceptibility to AKI in a sirtuin 1-dependent manner[J]. J Am Soc Nephrol, 2017, 28(8): 2337-2352. DOI:10.1681/ASN.2016040385 |
| [25] | Hong YA, Bae SY, Ahn SY, et al. Resveratrol ameliorates contrast induced nephropathy through the activation of SIRT1-PGC-1alpha-Foxo1 signaling in mice[J]. Kidney Blood Press Res, 2017, 42(4): 641-653. DOI:10.1159/000481804 |
| [26] | Shum HP, Yan WW, Chan TM. Recent knowledge on the pathophysiology of septic acute kidney injury: A narrative review[J]. J Crit Care, 2016, 31(1): 82-89. DOI:10.1116/j.jcrc.2015.09.017 |
| [27] | Gao R, Chen J, Hu Y, et al. Sirt1 deletion leads to enhanced inflammation and aggravates endotoxin-induced acute kidney injury[J]. PLoS One, 2014, 9(6): e98909. DOI:10.1371/journal.pone.0098909 |
| [28] | Gan Y, Tao S, Cao D, et al. Protection of resveratrol on acute kidney injury in septic rats[J]. Hum Exp Toxicol, 2017, 36(10): 1015-1022. DOI:10.1177/0960327116678298 |
| [29] | Bai XZ, He T, Gao JX, et al. Melatonin prevents acute kidney injury in severely burned rats via the activation of SIRT1[J]. Sci Rep, 2016, 6: 32199. DOI:10.1038/srep32199 |
| [30] | Zhang J, Yang S, Chen F, et al. Ginkgetin aglycone ameliorates LPS-induced acute kidney injury by activating SIRT1 via inhibiting the NF-kappaB signaling pathway[J]. Cell Biosci, 2017, 7: 44. DOI:10.1186/s13578-017-0173-3 |
 2018, Vol. 27
2018, Vol. 27




