急性呼吸窘迫综合征(acute respiratory distress syndrome, ARDS)是ICU发病率和病死率最高的一种危重病[1-3],也是最为严重的一种肺部疾病。尽管重症医学在快速发展,诊疗水平在不断提高,但ARDS的病死率近20年无明显降低[4],其发病机制仍错综复杂,处于深入研究阶段,目前国内外众多研究表明促炎症反应和抗炎症反应失衡及免疫功能紊乱是其重要发病机制。本研究通过检测患者外周静脉血清CD3+、CD4+、CD8+T细胞和CD19+B细胞水平来探讨细胞免疫在其发病中的作用。
1 资料与方法 1.1 一般资料选取2016年1月至2017年1月入住宝鸡市中心医院重症医学科ARDS患者34例,其中男性24例,女性10例,年龄(65.97±13.01)岁; 重症肺炎16例,急性中毒6例,重症急性胰腺炎7例,急性腹膜炎5例。另选取22例本院健康体检者作为对照组,其中男性14例,女性8例,年龄(31.1±7.1)岁。按照2012年柏林定义[5]治疗标准治疗。
纳入标准:(1)年龄大于18周岁者; (2)符合2012年的“柏林定义”[3]诊断标准。
排除标准:(1)年龄≤18周岁; (2)1 d内死亡的患者; (3)在研究过程中患者或家属拒绝参与研究; (4)慢性阻塞性肺疾病和支气管哮喘; (5)上呼吸道阻塞性疾病; (6)气胸或支气管胸膜瘘或肺叶切除术后2周内; (7)急性肺栓塞; (8)心源性肺水肿; (9)严重的高颅内压疾病; (10)心脏及胸部手术后; (11)无自主呼吸者; (12)重症肌无力; (13)肌营养不良症; (14)自身免疫性疾病; (15)肿瘤患者; (16)近期接受过免疫抑制剂治疗的患者。
1.2 标本收集和指标观察本研究前告知患者家属,并签署知情同意书,分别在确诊ARDS的第1天采集患者空腹外周静脉血3 mL,采集健康体检者空腹外周静脉血3 mL, 用流式细胞技术检测血清CD3+、CD4+、CD8+T细胞和CD19+B细胞水平,检测过程由宝鸡市中心医院检验科专业医师严格按照试剂说明书进行操作。同时检测患者的血压、呼吸、心率、体温、降钙素原、C反应蛋白、血常规、肝肾功、血气、胸部X线片,若有条件行肺部CT检查; 并进行急性生理学与慢性健康状况评分系统Ⅱ评分(APACHEⅡ)。
1.3 主要试剂盒与仪器CD3+、CD4+、CD8+T细胞和CD19+B细胞试剂来自美国的BECKMAN COULTER公司,主要仪器:流式细胞分析仪(BECKMAN COULTER EPics-XL), 仪器使用前由宝鸡市中心医院检验科专人矫正符合标准。
1.4 质量控制为了保证研究资料的准确性和可靠性,本研究过程中采用了一系列质量控制措施:(1)本研究对象由宝鸡市中心医院重症医学科临床经验丰富的副主任医师严格根据2012年ARDS柏林定义标准给出明确诊断; (2)所有参与研究的人员均经过严格统一培训; (3)选用准确的测量仪器; (4)实验过程由专业技术人员完成,严格按照操作规范和说明书进行,在加样、配样过程中有专人监督; (5)所有资料均由双人独立录入数据库中,并有另外双人对录入数据进行核对。
1.5 统计学方法采用SPSS 17.0软件进行数据处理,正态分布的计量资料用均数±标准差(x±s)表示,组间比较采用独成组t检验,非正态分布的计量资料以中位数(四分位数)[M(P25, P75)]表示,组间比较采用独立样本Mann-Whitney U检验,计数资料用χ2检验,采用多个自变量的logistic回归分析ARDS预后的危险因素,以P < 0.05为差异有统计学意义。
2 结果 2.1 ARDS组与健康组比较ARDS组第1天外周血清CD3+、CD4+T细胞和CD19+B细胞水平均明显低于健康组(P < 0.05),CD8+T细胞水平与健康组比较,差异无统计学意义(P > 0.05),见表 1。
| 指标 | ARDS组(n=34) | 健康组(n=22) | t值 | P值 |
| CD3+(%) | 58.48±12.56 | 74.84±4.42 | -6.899 | < 0.01 |
| CD4+(%) | 30.65±12.71 | 46.45±6.4 | -6.064 | < 0.01 |
| CD8+(%) | 35.29±6.33 | 51.68±7.84 | -0.98 | 0.341 |
| CD19+(%) | 15.51±8.84 | 24.88±3.30 | -5.554 | < 0.01 |
ARDS确诊第1天中度组患者外周静脉血清CD3+、CD4+、CD8+T细胞和CD19+B细胞水平均高于重度组(P < 0.05),见表 2。
| 指标 | 中度组(n=20) | 重度组(n=14) | t或Z | P |
| CD3+(%) | 62.54±12.96 | 52.70±9.68 | 2.405 | 0.022 |
| CD4+(%) | 30.35(25.10, 46.10) | 21.75(18.08, 29.58) | -2.362 | 0.018 |
| CD8+(%) | 37.3(35.18, 38.67) | 34.29(25.55, 37.2) | -2.381 | 0.017 |
| CD19+(%) | 16.27(13.79, 20.77) | 10.45(7.1, 14.72) | -2.747 | 0.006 |
根据28 d预后情况进行分组,存活组20例,死亡组14例,病死率为41.18%。确诊ARDS第1天,两组患者的基本指标比较,存活组和死亡组在乳酸、血清前白蛋白差异均有统计学意义(P < 0.05)见表 3。
| 指标 | 存活组(n=20) | 死亡组(n=14) | 统计值 | P值 |
| Lac(mmol/L)a | 1.7(0.95, 3.1) | 4(3.13, 7.8) | -3.309 | 0.001 |
| PCT(ng/mL)a | 2.58(0.82, 6.93) | 4.8(2.33, 10.24) | -1.523 | 0.128 |
| APACHEⅡ(分)b | 22.5±2.534 | 22.5±2.534 | -1.517 | 0.129 |
| 白蛋白(g/L)b | 28.05±5.07 | 27.25±3.92 | 0.495 | 0.624 |
| 血清前白蛋白(g/L)b | 0.10±0.03 | 0.07±0.03 | 2.513 | 0.017 |
| CRP(mg/L)b | 127.83±53.29 | 140.91±40.98 | -0.771 | 0.446 |
| WBC(109/L)b | 13.48±6.57 | 16.81±7.90 | -1.338 | 0.19 |
| N(109/L)b | 12.93±5.16 | 14.47±3.29 | -0.984 | 0.332 |
| 年龄(岁)b | 64.05±14.39 | 68.71±10.63 | -1.087 | 0.285 |
| 性别(女/男,例) | 4/16 | 8/6 | 2.072 | 0.252 |
| 注:a为M(P25, P75),b为x±s | ||||
ARDS确诊第1天存活组患者外周静脉血清CD3+、CD4+、CD8+T细胞和CD19+B细胞水平均高于死亡组(P < 0.05),见表 4。
| 指标 | 存活组(n=20) | 死亡组(n=14) | 统计值 | P值 |
| CD3+(%)a | 62.28±12.33 | 53.06±11.15 | 2.231 | 0.033 |
| CD4+(%)b | 33.09(26.75, 46.1) | 20.95(19.08, 25.78) | -3.027 | 0.002 |
| CD8+(%)b | 37.3(35.43, 38.67) | 33.06(27.84, 37.2) | -2.451 | 0.014 |
| CD19+(%)b | 16.84(13.9, 22.33) | 9.11(7.1, 12.8) | -3.99 | < 0.01 |
| 注:a为x±s,b为M(P25, P75) | ||||
ARDS患者预后的危险因素,经单因素分析,乳酸、CD19+B细胞及血清前白蛋白在存活组和死亡组之间差异有统计学意义(P < 0.05),经logistic回归分析CD19+B细胞水平为ARDS患者预后的危险因素,见表 5。
| 因素 | B | OR | 95%CI | P值 |
| CD3+(%) | 0.123 | 1.131 | 0.899~1.425 | 0.294 |
| CD4+(%) | -0.066 | 0.936 | 0.806~1.087 | 0.384 |
| CD8+(%) | -0.342 | 0.71 | 0.473~1.06 | 0.099 |
| CD19+(%) | -0.336 | 0.715 | 0.518~0.985 | 0.04 |
| Lac | 0.682 | 1.977 | 0.795~4.919 | 0.143 |
| 血清前白蛋白 | -102.604 | 0 | 0~2748430.688 | 0.087 |
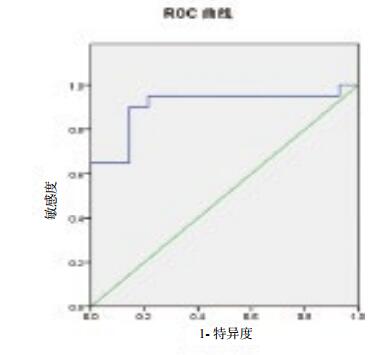
24 h内CD19+B细胞血清值对患者28 d预后的判断,曲线下面积为0.907,见图 1,ROC曲线分析,CD19+B细胞血清值预测28 d生存的最佳临界值为12.59%,其敏感度为95%,特异度为78.6%。
|
| 图 1 CD19+B细胞血清值对患者28 d预后判断的ROC曲线 Figure 1 ROC curve of CD19+B for predicting the prognosis of ARDS patients |
|
|
目前大量实验和临床资料表明,ARDS的本质是全身炎症反应,是系统性炎症反应综合征(systemic inflammatory response syndrome, SIRS)与代偿性抗炎症反应综合征(compensatory anti-inflammatory response syndrome, CARS)失衡所致机体大量炎症反应, 同时存在机体免疫调节系统失衡[6]。目前,ARDS由多种发病因素所致,脓毒症是其最主要的发病因素[1-2],机体免疫已成为脓毒症研究的热点[7]。近年来研究表明细胞免疫[7-8]在脓毒症的发生、发展过程中发挥着重要的作用。ARDS病死率仍居高不下,因此,早期预测ARDS,对于改善患者的预后、降低病死率有着重要意义。
免疫系统是机体的重要防御体系,当机体遭受细菌、病毒等病原微生物感染或理化因子损伤时,会诱发一系列的免疫应答反应。机体最重要的免疫细胞群是T淋巴细胞亚群,细胞免疫应答主要由T淋巴细胞介导参与,T细胞主要由CD3+、CD4+与CD8+T细胞构成,来调节机体的细胞免疫。CD3+仅存在T细胞表面,是组织内T淋巴细胞的标志,参与T细胞信号转导,反映机体的免疫状态; 参与T细胞识别抗原和活化,发挥T细胞对肿瘤细胞的杀伤作用,介导机体抗肿瘤免疫[9]。CD4+辅助性T细胞[10] (Th)可以分为Thl及Th2细胞,Th1细胞主要参与细胞免疫,Th2细胞主要参与体液免疫。CD4+T细胞可促进B细胞、T细胞和其他免疫细胞增殖和分化; CD8+T细胞通过分泌穿孔素、颗粒酶及表达FasL等引起靶细胞的裂解和凋亡,对各种免疫细胞具有抑制作用。Nakamura等[11]研究表明CD8+T细胞可能是肺损伤的一个重要致病因素。CD4+、CD8+T细胞在一定程度上反映了机体的免疫功能[12]。目前国内外少有针对CD3+、CD4+、CD8+与ARDS相关研究。众多研究表明,脓毒症患者早期CD4+、CD8+水平可评估患者的病情严重程度和预测其预后。
B淋巴细胞是体液免疫的重要介导细胞,B淋巴细胞的各种新型亚群及相关的细胞因子也在不断被深入研究。近年来的研究结果表明,B淋巴细胞是一种复杂的免疫细胞,CD19+B细胞是B淋巴细胞的一类特殊亚群,能产生多种自身抗体参与机体的免疫应答反应,通过自我更新来维持免疫平衡; 可以产生多种细胞因子如白介素-10和转化生长因子,可提高抗原呈递能力,维持外周免疫耐受,抑制炎症的进展[13-14];可以分泌IL-10L来发挥负向免疫调控效应和炎症反应[15-17]。目前国内外少有针对CD19+B细胞与ARDS相关研究。
本研究发现,ARDS组第1天外周血清CD3+、CD4+T细胞和CD19+B细胞水平均明显低于健康组(P < 0.01),CD8+与健康组比较差异无统计学意义(P > 0.05),可说明ARDS早期存在免疫功能低下甚至免疫麻痹状态。由于轻度组患者病例数极少被剔除后,将患者分为中度组(24例)和重度组(10例),ARDS确诊第1天中度组患者外周静脉血清CD3+、CD4+、CD8+T细胞和CD19+B细胞水平均高于重度组(P < 0.05), 提示重度组的免疫功能损害要比中度组重,同时可证明免疫功能越低,病情越重。随访28 d,根据患者的预后情况分为存活组(20例)和死亡组(14例),其中,重度组2例存活,重度组占死亡人数的85.71%,因此,ARDS的病情的严重程度在很大程度上决定了患者的预后。在ARDS发病第1天,存活组和死亡组在乳酸、血清前白蛋白比较差异有统计学意义(P < 0.05),考虑到重度组占死亡人数比例高,所以死亡组相对缺氧严重,炎症反应重,也可存在循环障碍,所以乳酸相对高; 死亡组机体高代谢状态,存在能量供给障碍,蛋白合成受阻,血清前白蛋白会明显低。ARDS确诊第1天存活组患者外周静脉血清CD3+、CD4+、CD8+T细胞和CD19+B细胞水平均高于死亡组(P < 0.05),考虑死亡组炎症反应重,缺氧严重,存在明显免疫功能受损或免疫功能麻痹。单因素分析结果表明,乳酸、CD19+B细胞、及血清前白蛋白在存活组和死亡组之间差异有统计学意义(P < 0.05),经logistic回归分析,CD19+B细胞水平是ARDS患者预后的危险因素。经ROC曲线分析,早期CD19+B细胞血清值对患者28 d预后的判断,曲线下面积为0.907,预测28 d存活的最佳临界值为12.59%,其敏感度为95%,特异度为78.6%。因此,早期ARDS患者外周血CD3+、CD4+、CD8+T细胞和CD19+B细胞水平有助于评估ARDS严重程度和预测其预后,CD19+B细胞作用尤为显著。
本研究也存在许多不足之处; ⑴本研究在抽取外周静脉血之前已经过一段时间的治疗,对检测结果有一定的影响; ⑵本研究缺少轻度组; ⑶样本量小; ⑷本研究缺少后期(第3天、第5天、第7天)ARDS患者CD3+、CD4+、CD8+T细胞和CD19+B细胞水平的追踪; (5)导致ARDS发病的因素太少。因此,以后的研究需多中心扩大样本量,综合多种发病因素和病情程度(轻度、中度和重度)进一步研究。
综上所述,早期ARDS患者外周血CD3+、CD4+、CD8+T细胞和CD19+B细胞水平有助于评估ARDS严重程度和预测其预后,CD19+B细胞水平更有助于评估ARDS严重程度和预测其预后。
| [1] | Dolinay T, Kim YS, Howrylak J, et al. Inflammasome-regulated cytokines are critical mediators of acute lung injury[J]. Am J Respir Crit Care Med, 2012, 185(11): 1225-1234. DOI:10.1164/rccm.201201-0003OC |
| [2] | 杨建中, 畅毅平, 彭鹏, 等. 细胞因子IL-9与急性呼吸窘迫综合征患者预后的临床研究[J]. 中华急诊医学杂志, 2015, 24(8): 887-892. DOI:10.3760/cma.j.issn.1671-0282.2015.08.017 |
| [3] | Dellinger RP, Levy MM, Rhodes A, et al. Surviving Sepsis Campaign: international guidelines for Management of severe sepsis and septic shock, 2012[J]. Intensive Care Med, 2013, 39(2): 165-228. DOI:10.1007/s00134-007-0934-2 |
| [4] | Tatura R, Zeschnigk M, Adamzik M, et al. Quantification of regulatory T cells in septic patients by real-time PCR-based methylation assay and flow cytometry[J]. PLoS One, 2012, 7(11). DOI:10.1371/journal.pone.0049962 |
| [5] | ARDS Definition Task Force. Acute respiratory distress syndrome:the Berlin Definition[J]. JAMA, 2012, 307(23): 2526-2533. DOI:10.1001/jama.2012.5669 |
| [6] | Duan L, Ma Y, Chi J, et al. The regulatory role of immunosuppressant on immune abnormalities in acute pancreatitis[J]. Biomed Rep, 2014, 2: 193-198. DOI:10.3892/br.2013.208 |
| [7] | Wang H, Wei Y, Zeng Y, et al. The association of polymorphisms of TLR4 and CD14 genes with susceptibility to sepsis in a Chinese population[J]. BMC Med Genet, 2014, 15(1): 125. DOI:10.1186/s12881-014-0123-4 |
| [8] | Saison J, Demaret J, Venet F, et al. CD4+CD25+CD127-assessment as a surrogate phenotype for FOXp3+regulatory T cells in HIV-1 infectedviremic and aviremic subjects[J]. Cytometry B Clin Cytom, 2013, 84(1): 50-54. DOI:10.1002/cyto.b.21047 |
| [9] | 陈慰峰. 医学免疫学[M]. 3版. 北京: 人民卫生出版社, 2000: 66-156. |
| [10] | Havel C, Arrch J, Losert H, et al. Vasopressors for hypotensive shock[J]. Cochrane Database Syst Rev, 2011(5): CD003709. DOI:10.1002/14651858.CD003709.pub4 |
| [11] | Nakamura R, Maeda N, Shibata K, et al. Interleukin-15 is critical in the pathogenesis of influenza a virus-induced acute lung injury[J]. J Virol, 2010, 84(11): 5574-5582. DOI:10.1128/JVI.02030-09 |
| [12] | Van der Flier M, Sharma DB, Estevao S, et al. Increased CD4 (+) T cell co-inhibitory immune receptor CEACAM1 in meonatal sepsis and soluble -CEACAM1 in meningococcal sepsis:a role in sepsis-associated immune suppression[J]. PLoS One, 2013, 8(7): e68294. DOI:10.1371/journal.pone.0068294 |
| [13] | Raman C. CD5, an important regulator of lymphocyte selection and immune tolerance[J]. Immunol Res, 2002, 26(1/3): 255-263. DOI:10.1385/IR:26:1-3:255 |
| [14] | Duan B, Morel L. Role of B-la cells in autoimmunity[J]. Autoimmun Rev, 2006, 5(6): 403-408. DOI:10.1016/j.autrev.2005.10.007 |
| [15] | Pers JO, Jamin C, Predine-Hug F, et al. The role of CD5-expressing B cells in health and disease (review)[J]. Int J Mol Med, 1999, 3(3): 239-245. DOI:10.389/ijmm.3.3.239 |
| [16] | Jin G, Hamaguchi Y, Matsushita T, et al. B-cell linker protein expression contributes to controlling allergic and autoimmune diseases by mediating IL-10 production in regulatory B cells[J]. J Allergy Clin Immunol, 2013, 131(6): 1674-1682. DOI:10.1016/j.jaci.2013.01.044 |
| [17] | Kalampokis I, Yoshizaki A, Tedder TF. IL-10 producing regulatory B cells (B10 cells)in autoimmune disease[J]. Arthritis Res Ther, 2013, 15 Suppl 1: S1. DOI:10.1186/ar3907 |
 2018, Vol. 27
2018, Vol. 27




