主动脉夹层(aortic dissection,AD)是由于主动脉内膜破裂,血液进入主动脉中膜,并沿主动脉长轴方向延伸剥离,最终导致主动脉真假腔形成。根据Stanford分型,破裂口起源于升主动脉者为Stanford A型,起源于降主动脉者为Stanford B型。主动脉夹层是心血管系统的灾难性病变,起病急,进展快,临床表现复杂,漏诊、误诊率高,病死率极高[1]。目前确诊主要依赖于CT血管造影(CTA)、磁共振血管成像(MRA)及数字减影血管造影(DSA)等辅助检查[2-5],国内绝大部分医院急诊科尚无常规开展上述确诊辅助检查,如何快速诊断或排除主动脉夹层是每个急诊科医师所面临的难题。本研究利用普通16层螺旋CT分别测量降主动脉、升主动脉直径及两者比值,比较三者在诊断Stanford B型AD中的意义。
1 资料与方法 1.1 一般资料研究对象选择2010年7月至2017年7月因胸背痛在温州医科大学附属第二医院急诊科治疗的患者156例(男95例,女61例),对所有怀疑AD患者先行胸部CT扫描后,再行主动脉CTA以明确,确诊Stanford B型AD 56例(男40例,女16例),非AD者100例(男55例,女45例)。同时选同期100例来我院体检的正常人作为正常对照组(男50例,女50例),三组人群年龄、性别一般情况比较见表 1。本研究严格遵守本院伦理委员会的相关规定,并由患者本人或家属签署知情同意书。
| 指标 | 对照组(n=100) | 胸痛非AD组(n=100) | AD组(n=56) |
| 年龄 | |||
| 30~49岁 | 40.04±5.22 | 42.02±5.38 | 40.80±4.65 |
| 50~80岁 | 67.52±10.47 | 69.34±8.84 | 68.96±9.56 |
| 性别(例,%) | |||
| 男性 | 50 (50) | 55 (55) | 40 (71.4) |
| 女性 | 50 (50) | 45 (45) | 16 (28.6) |
Stanford B型AD诊断标准:经主动脉CTA检查后明确主动脉夹层内膜裂口起源于降主动脉左锁骨下动脉开口远端,并向远端扩展,可直至腹主动脉(DeBakey Ⅲ)。纳入研究的胸痛患者为突发、急起、剧烈而持续且不能耐受的疼痛,伴苍白、大汗、皮肤湿冷等症状,高度可疑AD患者。胸痛患者排除标准:(1)心超证实有严重心脏或及心瓣膜解剖结构异常患者; (2)升主动脉、降主动脉瘤样扩张者; (3)确诊为Stanford A型AD患者,内膜裂口在升主动脉。健康对照组人群需除外主动脉瘤样扩张、严重胸腹主动脉移位畸形、严重心血管疾病、大动脉炎、高血压、糖尿病、严重肥胖者。
1.3 研究方法我院急诊胸部CT平扫采用荷兰PHILIPS螺旋CT扫描仪,参数设置:120 kV,250 mA,螺距0.938,层厚0.9 mm,重建增量0.4 mm。怀疑AD患者均行主动脉CTA检查,采用高压注射器,一次性注射水溶性造影剂100 mL,浓度350 mgI/mL,注射速度为4 mL/s,扫描延迟选择自动最短延迟。
各组人群升主动脉和降主动脉直径测量均由3名急诊科医师在纵膈窗上分别完成,测量完成后取其均数,并计算降主动脉与升主动脉直径比值(ratio of descending aorta diameter to ascending aorta, rDA),rDA=降主动脉直径/升主动脉直径。测量部位为CT纵膈窗主动脉根部同一层面上降主动脉和升动脉血管外径。
1.4 统计学方法采用SPSS 18.0软件对数据进行统计分析,正态分布的计量资料用均数±标准差(x±s)表示,组间参数比较采用单因素方差分析,组间两两比较采用SNK-q检验; 计数资料采用χ2检验,以P < 0.05为差异有统计学意义。绘制ROC曲线,评价降主动脉直径和rDA在不同界值时预测胸痛患者主动脉夹层的敏感度和特异度。
2 结果 2.1 不同年龄、性别正常人群降主动脉、升主动脉直径及其比值情况正常对照组人群升主动脉、降主动脉直径随年龄增长有增宽趋势,但差异均无统计学意义(P > 0.05),正常对照组人群rDA比值,差异无统计学意义(P > 0.05),见表 2。
| 不同年龄组 | 例数 | 升主动脉直径(mm) | 降主动脉直径(mm) | rDA | |||||
| 男 | 女 | 男 | 女 | 男 | 女 | ||||
| 30~49岁 | 50 | 32.62±1.96 | 31.40±2.86 | 23.31±1.51 | 22.17±1.85 | 0.72±0.45 | 0.71±0.42 | ||
| 50~80岁 | 50 | 33.47±1.73 | 32.65±1.60 | 24.11±1.56 | 23.04±1.78 | 0.72±0.57 | 0.71±0.52 | ||
Stanford B型AD组男、女患者降主动脉直径均较正常对照组及胸痛对照组明显增宽,差异有统计学意义(F=184.261,P < 0.05和F=146.78,P < 0.05); Stanford B型AD组男、女患者升主动脉直径均较正常对照组男、女人群增宽,差异有统计学意义(F=32.278,P < 0.05和F=33.574,P < 0.05),与胸痛对照组男、女患者比较,差异无统计学意义(P > 0.05); 不同年龄段Stanford B型AD患者的rDA比值较胸痛对照组和正常对照组明显升高,差异有统计学意义(F=83.948,P < 0.05和F=116.306,P < 0.05),见图 1~3。
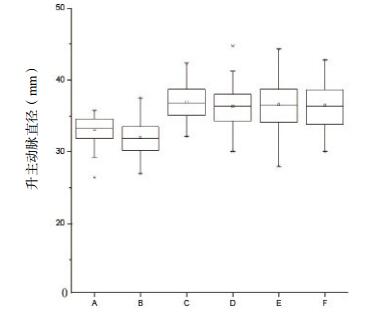
|
| A:男性正常组(n=50); B女性正常组(n=50); C:男性胸痛对照组(n=55); D:女性胸痛对照组(n=45); E:男性Stanford B型AD组(n=40); F:女性Stanford B型AD组(n=16) 图 1 各组不同性别人群升主动脉直径比较 Figure 1 Comparison of ascending aorta diameter in different groups |
|
|
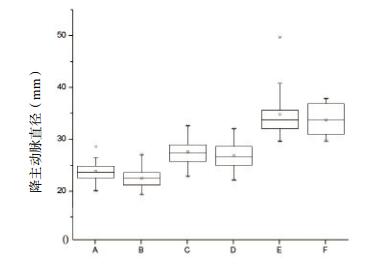
|
| A:男性正常组(n=50); B女性正常组(n=50); C:男性胸痛对照组(n=55); D:女性胸痛对照组(n=45); E:男性Stanford B型AD组(n=40); F:女性Stanford B型AD组(n=16) 图 2 各组不同性别人群降主动脉直径比较 Figure 2 Comparison of descending aorta diameter in different groups |
|
|
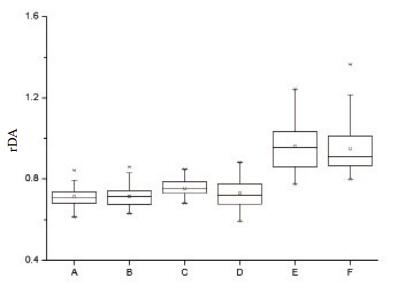
|
| A:30~49岁正常组(n=50); B:50~80岁正常组(n=50); C:30~49岁胸痛对照组(n=31); D:50~80岁胸痛对照组(n=69); E:30~49岁Stanford B型AD组(n=15); F:50~80岁Stanford B型AD组(n=41) 图 3 各组不同年龄段人群rDA的比较 Figure 3 Comparison of rDA in different age groups |
|
|
ROC曲线分析显示降主动脉直径预测胸痛患者Stanford B型AD的曲线下面积(AUC)为0.970(95%CI:0.949~0.991,P < 0.01),rDA预测Stanford B型AD的AUC为0.981(95%CI:0.964~0.997,P < 0.01)。以胸痛患者降主动脉直径30.00 mm为界值,诊断Stanford B型AD的敏感度94.6%,特异度82.0%;以胸痛患者rDA值0.8为界值,诊断Stanford B型AD的敏感度96.4%,特异度91.0%,见图 4。
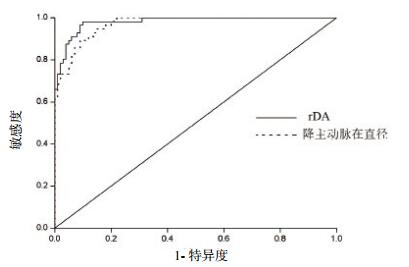
|
| 图 4 胸痛患者降主动脉直径、rDA预测Stanford B型主动脉夹层的ROC曲线 Figure 4 ROC curve of descending aorta diameter and rDA in predicting Stanford type B aortic dissection in chest pain patients |
|
|
主动脉夹层是一种严重威胁患者生命的疾病,发展迅速,预后凶险,必须尽快诊断以便治疗[6]。目前CTA、MRA等为AD确诊的辅助检查,而普通CT往往成为急诊医师常规首选检查手段。如何通过普通CT平扫最大化降低AD的误诊、漏诊率是当前急诊医师所关心的问题。研究报道CT平扫主动脉内高密度线状内膜线和钙化斑内移被认为是诊断AD最可靠的征象[7-8],但大部分患者胸部CT上缺乏钙化斑内移或高密度内膜线等典型AD征象,尤其在中青年患者。因此,仅靠普通CT特异性征象以排除或诊断AD有着明显的局限性。所以,重新寻找普通CT上AD特征显得尤为重要。
主动脉直径受多种因素影响,如患者年龄、性别、体质量指数、低密度脂蛋白以及基础疾病等[9-10]。Hannuksela等[11]发现主动脉直径随年龄增长逐渐增大,男性主动脉直径大于女性,并且随年龄增加而更加明显。Wolak等[12]研究发现主动脉直径与体表指数有明显相关性,同时发现糖尿病与升主动脉直径相关,而吸烟与降主动脉直径相关。甚至,Van等[13]研究发现在同一个心动周期中,主动脉直径的变化率可高达到27.5%。目前国内尚无统一的主动脉直径标准。本组研究测量100例健康人主动脉直径值与已有研究结果[14]相近,证实其值受性别、年龄等影响,存在不同程度差异。而AD患者的胸、腹主动脉直径通常较正常人群明显增宽,可能与主动脉中层弹力蛋白和弹性纤维减少[15]、胶原含量异常[14-16]、炎症因子和氧化应激增加[17-18]等相关。Stanford B型AD主要累及降主动脉,其降主动脉直径较正常人群明显增宽,本组56例Stanford B型AD患者降主动脉直径同样均明显增宽。
正常情况下,主动脉由近端至远端逐渐变细,可能与主动脉中弹性成分的变化有关。在胸主动脉区弹性蛋白与胶原蛋白比值较高,沿其走形逐渐下降[19]。rDA是降主动脉与升主动脉直径的比值,国内目前尚无大样本正常健康人群的rDA值。本研究共纳入100例健康正常人,经统计发现rDA值与性别、年龄等无明显相关性,可能因为rDA是同一个体两个血管比值,能够消除个体差异的影响。本研究中发现rDA值与降主动脉直径均能较好预测胸痛患者Stanford B型AD,可能与本研究设定的胸痛患者纳入标准有关。rDA与降主动脉直径相比,前者ROC曲线下面积较大,提示其预测Stanford B型AD准确性更高,并且其敏感度及特异度均优于降主动脉直径,可能与rDA能够消除个体间差异、窗宽和窗位以及心脏循环周期的影响有关。rDA相当于起着“内部校正”的作用。
本研究通过普通CT平扫测量降主动脉、升主动脉直径,并计算rDA值,为简单、快速排除或者诊断Stanford B型AD提供了一种新的方法。当不明原因胸痛患者平扫CT未发现主动脉AD典型征象,当其降主动脉直径≥30 mm,rDA≥0.8时,仍应高度怀疑Stanford B型AD,需进一步行CTA、MRA等检查明确诊断,最大限度降低AD的误诊、漏诊率。
| [1] | 薛渊, 肖子亚, 顾国嵘, 等. D-二聚体对急性主动脉夹层诊断及预后判断价值[J]. 中华急诊医学杂志, 2017, 26(8): 935-938. DOI:10.3760/cma.j.issn.1671-0282.2017.08.021 |
| [2] | Narayan P, Rogers CA, Davies I, et al. Type A aortic dissection: has surgical outcome improved with time[J]. J Thorac Cardiovasc Surg, 2008, 136(5): 1172-1177. DOI:10.1016/j.jtcvs.2008.05.040 |
| [3] | Konstantinos T, Paschalis T, Markus K, et al. The DeBakey classification exactly reflects late outcome and re-intervention probability in acute aortic dissection with a slightly modified type Ⅱ definition[J]. Eur J Cardiothorac Surg, 2011, 40(5): 1078-1084. DOI:10.1016/j.ejcts.2011.03.037 |
| [4] | Hayter RG, Rhea JT, Small A, et al. Suspected aortic dissection and other aortic disorders:multi-detector row CT in 373 cases in the emergency setting[J]. Radiology, 2006, 238(3): 841-852. DOI:10.1148/radiol.2383041528 |
| [5] | Liu Q, Lu JP, Wang F, et al. Three-dimensional contrast-enhanced MR angiography of aortic dissection:a pictorial essay[J]. Radiographics, 2007, 27(5): 1311-1321. DOI:10.1148/rg.275065737 |
| [6] | 宋剑平, 胡新宇, 金静芬, 等. 急性Stanford A型主动脉夹层术后短期死亡影响因素分析[J]. 中华急诊医学杂志, 2017, 26(6): 706-709. DOI:10.3760/cma.j.issn.1671-0282.2017.06.022 |
| [7] | LePage MA, Quint LE, Sonnad SS, et al. Aortic dissection: CT features that distinguish true lumen from false lumen[J]. AJR Am J Roentgenol, 2001, 177(1): 207-211. DOI:10.2214/ajr.177.1.1770207 |
| [8] | Koyama T, Moritani K, Shibata M, et al. Shifting calcium plaque in progressive aortic dissection[J]. Circulation, 2013, 128(16): 239. DOI:10.1161/CIRCULATIONAHA.113.003241 |
| [9] | Roman MJ, Devereux RB, Kramer-Fox R, et al. Two-dimensional echocardiographic aortic root dimensions in normal children and adults[J]. Am J Cardiol, 1989, 64(8): 507-512. DOI:10.1016/0002-9149(89)90430-X |
| [10] | Alegret JM, Masana L, Martinez-Micaelo N, et al. LDL cholesterol and apolipoprotein B are associated with ascending aorta dilatation in bicuspid aortic valve patients[J]. QJM, 2015, 108(10): 795-801. DOI:10.1093/qjmed/hcv032 |
| [11] | Hannuksela M, Lundqvist S, Bo C. Thoracic aorta--dilated or not?[J]. Scand Cardiovasc J, 2006, 40(3): 175-178. DOI:10.1080/14017430600565999 |
| [12] | Wolak A, Gransar H, Thomson LE, et al. Aortic size assessment by noncontrast cardiac computed tomography: normal limits by age, gender, and body surface area[J]. JACC Cardiovasc Imaging, 2008, 1(2): 200-209. DOI:10.1016/j.jcmg.2007.11.005 |
| [13] | Van PJ, Vincken KL, Muhs BE, et al. Toward endografting of the ascending aorta: insight into dynamics using dynamic cine-CTA[J]. J Endovasc Ther, 2007, 14(4): 551-560. DOI:10.1177/152660280701400418 |
| [14] | 陆华. 853例正常人胸主动脉形态学特征研究[D]. 上海: 第二军医大学, 2011. |
| [15] | Wang X, LeMaire SA, Chen L, et al. Decreased expression of fibulin-5 correlates with reduced elastin in thoracic aortic dissection[J]. Surgery, 2005, 138(2): 352-359. DOI:10.1016/j.surg.2005.06.006 |
| [16] | Sariola H, Viljanen T, Luosto R. Histological pattern and changes in extracellular matrix in aortic dissections[J]. J Clin Pathol, 1986, 39(10): 1074-1081. DOI:10.1136/jcp.39.10.1074 |
| [17] | Del PF, Proietta M, Tritapepe L, et al. Inflammation and immune response in acute aortic dissection[J]. Ann Med, 2010, 42(8): 622-629. DOI:10.3109/07853890.2010.518156 |
| [18] | Liao M, Liu Z, Bao J, et al. A proteomic study of the aortic media in human thoracic aortic dissection: implication for oxidative stress[J]. J Thorac Cardiovasc Surg, 2008, 136(1): 65-72. DOI:10.1016/j.jtcvs.2007.11.017 |
| [19] | Stefanadis C, Stratos C, Vlachopoulos C, et al. Pressure-diameter relation of the human aorta. A new method of determination by the application of a special ultrasonic dimension catheter[J]. Circulation, 1995, 92(8): 2210-2219. DOI:10.1161/01.CIR.92.8.2210 |
 2018, Vol. 27
2018, Vol. 27




