失血性休克时可大量激活诸如单核/巨噬细胞、中性粒细胞释放大量的白细胞介素、肿瘤坏死因子(TNF-α)等细胞因子[1]。理想的休克复苏方式应该在改善组织灌注的同时降低后期氧化应激和炎症反应,避免全身炎症反应综合征(SIRS)和多器官功能障碍综合征(MODS)的发生。醋酸钠林格液复苏有利于维持内环境稳定、机体酸碱平衡,能够减轻组织损伤,减轻机体炎症反应[2-3]。在失血性休克过程中丝裂原活化蛋白激酶(MAPK)通路的激活是介导MODS的重要步骤, 并且在失血性休克所致急性肝、肺损伤中MAPK也是一个重要信号通路[4-5]。本实验探讨醋酸钠林格液相对于其他晶体在早期液复苏失血性休克大鼠时,对其肺组织的TNF-α mRNA、IL-4 mRNA、IL-10 mRNA含量,以及JNK磷酸化和MKP-1乙酰化水平的影响,为醋酸钠林格液是否是通过增强MKP-1的乙酰化水平抑制JNK信号通路来影响失血性休克大鼠炎症反应的发生发展,在一定程度上减轻肺组织炎症反应,提供一些实验依据。为临床失血性休克早期液体复苏治疗提供参考。
1 材料与方法 1.1 实验动物选取清洁级SD大鼠32只,雌雄不拘,体质量(280±30g),年龄12~15周(上海杰思捷实验动物有限公司提供),实验动物放入标准环境中饲养7 d。
1.2 主要实验设备及试剂Medlab-u/2cs生物信号采集处理系统(南京美易科技有限公司,江苏,中国);台式高速冷冻离心机(Thermo Fisher公司,美国);核酸浓度测定仪(Thermo Fisher公司,美国);qPCR仪(Thermo Fisher公司,美国);SDS-PAGE电泳系统(BIO-Rad公司,美国);0.9%氯化钠注射液(安徽环球药业股份有限公司,安徽,中国);乳酸钠林格液(安徽环球药业股份有限公司,安徽,中国),醋酸钠林格液(湖南康源制药有限公司,湖南,中国);SuperScript Ⅲ RT反转录kit(ABI-invitrogen公司,美国);一抗稀释液(北京百奥思科生物医学技术有限公司,北京,中国);二抗稀释液(北京百奥思科生物医学技术有限公司,北京,中国);JNK antibody(北京百奥思科生物医学技术有限公司,北京,中国);MKP-1 antibody(北京百奥思科生物医学技术有限公司,北京,中国)。
1.3 动物分组与模型的建立随机数字表法随机选取大鼠进行实验,分为休克不复苏组(CR组,8只)、生理盐水复苏组(NR组,8只)、乳酸钠林格液复苏组(LR组,8只)和醋酸钠林格液复苏组(AR组,8只)。参照文献[3]的方法制作休克模型,大鼠经腹腔注射质量分数4%的水合氯醛(1 mL/100 g)进行麻醉,麻醉成功后仰卧位固定于手术台上,将大鼠双侧腹股沟区备皮,并用碘伏消毒3遍后铺巾。解剖游离出双侧股动脉、股静脉,并分别置管、固定,注入少量2.5%的枸橼酸钠葡萄糖,确保管道通畅。右侧股动脉置管连接Medlab-u/2cs生物信号采集系统(使用前进行调零及换能器定标), 用来持续监测平均动脉血压(mean arterial pressure,MAP)(2.5%的枸橼酸钠葡萄糖注射液作为测压系统中的冲洗液),左侧股动脉用于放血诱导休克,右侧股静脉用于休克后的液体复苏,左侧股静脉连接微量泵。大鼠置管后适应20 min进行休克诱导。
1.4 休克诱导和液体复苏建立休克复苏模型:预充枸橼酸钠溶液0.2 mL于2 mL注射器,以2 mL/3 min速度由左侧股动脉放血,20 min将MAP维持在40~45 mmHg(1 mmHg=0.133 kPa)之间。在休克期通过缓慢、少量放血或回输自体血维持MAP在40~45 mmHg之间60 min。分别应用生理盐水、乳酸钠林格液和醋酸钠林格液复苏(30 min完成)NR组、LR组与AR组三组大鼠。以3:1(复苏液体量:失血量为3:1)方法输注复苏液,复苏后观察4 h取大鼠肺组织。CR组不予液体复苏,观察4 h(若动物死亡则动物死亡即刻)取大鼠肺组织。在实验过程中,使用微量泵通过股静脉输注生理盐水[5 mL/(kg·h)],以弥补手术区域及呼吸道液体的丢失。
1.5 实验观察指标应用RT-PCR法检测肺组织IL-4 mRNA、IL-10 mRNA、TNF-α mRNA含量,应用Western Blot法检测肺组织JNK磷酸化和MKP-1乙酰化水平。
1.6 肺组织中IL-4、IL-10、TNF-αmRNA的表达获取标本后,用Trizol提取总RNA按照反转录试剂盒说明书将提取的RNA反转录成cDNA,建立扩增体系(20 μL),GAPDH扩增引物:F:GTTACCAGGGCTGCCTTCTC,R:GGGTTTCCCGTTGATGACC,IL-4扩增引物:F:CTTGCTGTCACCCTGTTCTG, R:CTCCGTGGTGTTCCTTGTTG;IL-10扩增引物:F:TGCGACGCTGTCATCGATTT, R:GTAGATGCCGGGTGGTTCAA;TNF-α扩增引物:F:ATGGGCTCCCTCTCATCAGT, R:GCTTGGTGGTTTGCTACGAC。按照两步法进行扩增:95℃2 min预变性,循环1次;94℃ 20 s变性,60℃ 20 s延伸,循环40次;72℃ 30 s绘制溶解曲线(所检测指标温度设置一致)。反应结束后计算mRNA的表达。
1.7 肺组织中JNK磷酸化和MKP-1乙酰化的蛋白表达取约100 mg肺组织,用预冷的PBS冲洗两次,置于匀浆管壶腹部并剪碎,加入RIPA裂解液1 mL,于冰上研磨。抽提肺组织蛋白,在4 ℃离心机中以12 000 r/min的速度离心10 min,取上清液,按照BCA蛋白质定量试剂盒对蛋白质进行定量分析,测蛋白浓度。采用10%分离胶和4%的浓缩胶进行SDS-PAGE凝胶电泳,电泳后采用PVDF膜,湿式转膜法转膜。5%脱脂奶粉封闭液于摇床上封闭1 h,分别加入对应的一抗工作液中反应,4℃摇床过夜后,加相应的二抗室温摇床轻摇1 h,用TBST洗涤三次,每次10 min,最后采用ECL发光法放置暗室曝光,进行显影定影,FluorChem灰度分析软件进行分析。目的蛋白含量=(目的蛋白灰度/β-actin灰度)×100%。
1.8 统计学方法采用SPSS 22.0统计软件进行数据处理,结果以均数±标准差(x±s)表示,大鼠体质量、基础平均动脉压、RT-PCR和Western Blot数据多组间比较采用单因素方差分析(one-way ANOVA),两两间比较采用LSD-t检验方法分析;以P < 0.05为表示差异有统计学意义。
2 结果 2.1 4组大鼠基本情况比较体质量、基础平均动脉压经单因素方差分析各组差异无统计学意义,见表 1。
| 组别 | 例数 | 体质量(g) | 平均动脉压(mmHg) |
| CR组 | 8 | 286.75±15.63 | 102.35±4.17 |
| NR组 | 8 | 284.38±10.16 | 102.85±5.94 |
| LR组 | 8 | 287.12±13.70 | 106.25±4.34 |
| AR组 | 8 | 286.13±17.75 | 100.85±7.20 |
| F值 | 0.056 | 1.350 | |
| P值 | 0.982 | 0.278 |
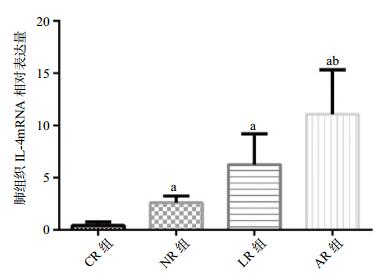
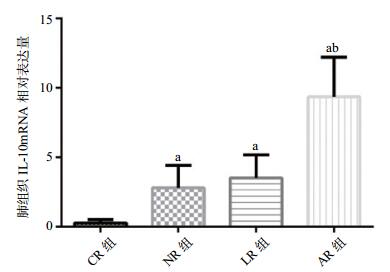
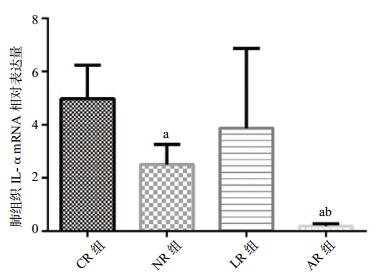
与CR组、NR组相比,AR组IL-4 mRNA表达明显增加(P < 0.01),与LR组相比AR组增加(t=2.293,P < 0.05);与CR组、NR组和LR组相比,AR组IL-10 mRNA表达明显增加(P < 0.01);与CR组和LR组相比,AR组TNF-α mRNA表达明显减少(P < 0.01);与NR组相比AR组TNF-α mRNA表达明显减少(t=7.401,P < 0.01),见表 2,和图 1-3。
| 组别 | 例数 | IL-4 mRNA | IL-10 mRNA | TNF-α mRNA |
| CR组 | 8 | 0.42±0.34 | 0.25±0.25 | 4.98±1.26 |
| NR组 | 8 | 2.60±0.66a | 2.79±1.62a | 2.50±0.76a |
| LR组 | 8 | 6.24±2.95a | 3.51±1.66a | 3.87±3.00 |
| AR组 | 8 | 11.08±4.24ab | 9.35±2.86ab | 0.19±0.09ab |
| F值 | 25.544 | 34.757 | 12.191 | |
| P值 | < 0.01 | < 0.01 | < 0.01 | |
| 注:与CR组比较,aP < 0.01;与NR组、LR组比较,bP < 0.05 | ||||
|
| 与CR组比较,aP < 0.01;与NR组比较,bP < 0.01;与LR组比较,bP < 0.05 图 1 各组大鼠肺组织IL-4 mRNA相对表达量 Figure 1 Relative expression of IL-4 mRNA in lung tissue of rats in each group |
|
|
|
| 与CR组比较,aP < 0.01;与NR组、LR组比较,bP < 0.01 图 2 各组大鼠肺组织IL-10 mRNA相对表达量 Figure 2 Relative expression of IL-10 mRNA in lung tissue of rats in each group |
|
|
|
| 与CR组比较,aP < 0.01;与NR组、LR组比较,bP < 0.01 图 3 各组大鼠肺组织TNF-α mRNA相对表达量 Figure 3 Relative expression of TNF-α mRNA in lung tissue of rats in each group |
|
|
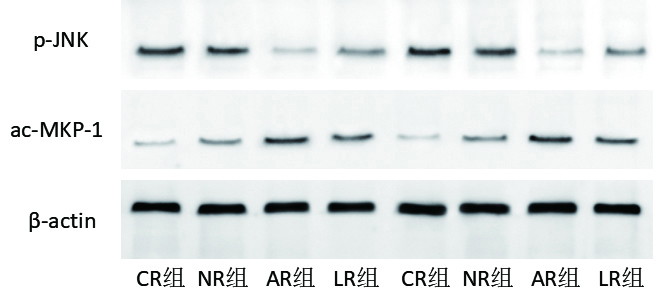
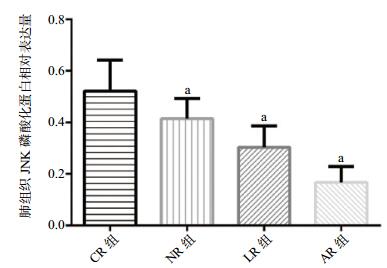
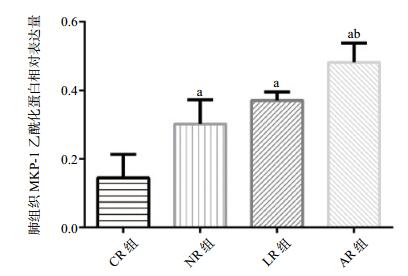
各组肺组织JNK磷酸化的蛋白相对表达量分别为:CR组:(0.52±0.12);NR组:(0.42±0.08);LR组:(0.30±0.08);AR组:(0.17±0.06);与CR组、LR组和NR组相比,AR组JNK磷酸化的蛋白相对表达量明显减少(P < 0.01)。各组肺组织MKP-1乙酰化的蛋白相对表达量分别为:CR组:(0.14±0.07);NR组:(0.30±0.07);LR组:(0.37±0.02);AR组:(0.48±0.06);与CR组、NR组和LR组相比,AR组MKP-1乙酰化的表达明显增加(P < 0.01),见图 4-6。
|
| 图 4 各组大鼠肺组织JNK磷酸化、MKP-1乙酰化蛋白条带图 Figure 4 The JNK phosphorylation and MKP-1 acetylated protein bands in lung tissue of rats in each group |
|
|
|
| 与CR组比较,aP < 0.01;与NR组、LR组比较,bP < 0.01 图 5 各组大鼠肺组织JNK磷酸化蛋白相对表达量 Figure 5 Relative expression of JNK phosphorylation protein in lung tissue of rats in each group |
|
|
|
| 与CR组比较,aP < 0.01;与NR组、LR组比较,bP < 0.01 图 6 各组大鼠肺组织MKP-1乙酰化蛋白相对表达量 Figure 6 Relative expression of MKP-1 acetylation protein in lung tissue of rats in each group |
|
|
失血性休克导致血容量迅速丧失,循环血量严重不足,机体自身调节能力下降,炎症系统被激活,产生大量的炎症介质[6],血液灌流不足时会造成凝血功能障碍, 影响休克的预后,尤以合并腹腔脏器损伤时为甚[7-8]。如果炎症系统的激活不能被终止,可产生各种免疫紊乱,甚至诱导多器官功能障碍综合征及全身炎症反应综合征的发生[9]。
研究表明,通过降低TNF-α的表达,可以阻断MAPK和NF-κB介导的细胞信号传导,进而减轻肺组织的炎症反应和氧化应激[10]。TNF-α可通过JNK的活化来发挥其功能,TNF-α诱导的细胞死亡是JNK依赖性的[11]。IL-4是一种抑炎因子能够抑制IL-6和TNF-α的分泌[12],促进IL-4分泌是机体休克抗炎反应的重要表现。另一种炎性因子IL-10,能够抑制IL-6、TNF等细胞因子的产生,是一类重要的抑制性细胞因子[13]。通过大鼠失血性休克模型实验研究表明,复苏时皮下注射重组人IL-10,可减轻失血性休克大鼠机体缺血引起的肺部炎症反应[14]。所以,本研究通过RT-PCR分别检测肺组织的TNF-αmRNA、IL-4 mRNA、IL-10 mRNA含量,来反映失血性休克液体复苏后炎性介质的表达情况。结果表明,失血性休克时相对于液体复苏组,休克不复苏组肺组织的TNF-αmRNA表达显著增加,而IL-4 mRNA、IL-10 mRNA的表达减少,从而进一步说明了失血性休克时炎症系统被激活,大量炎性介质产生。
MAPK是细胞内一类进化上高度保守的丝氨酸/苏氨酸蛋白激酶,通过三级激酶级联的方式参与多种生理以及病理过程的调节[15-16]。Liu等[17],通过研究Bruton酪氨酸激酶(BTK)在创伤性出血性休克(THS)诱导的肺损伤发病机制中的作用,结果表明抑制MAPK信号通路可显着缓解THS诱导的肺损伤。JNK属于MAPK家族,可被应激反应和TNF-α激活,JNK信号通路是细胞正常与病理状态时的一个重要调节靶点[18-19]。抑制JNK活性后出血和复苏(H/R)后cJun的活化程度也降低,从而表明在出血和复苏引起的全身炎症反应和器官损伤中至少有部分是由JNK通路介导的[20]。
MKP-1在体内以p38MAPK和JNK作为底物,可通过去磷酸化使包括JNK在内的MAPK失活,调节MKP-1表达的机制对于确定MAPK磷酸化的持续时间和免疫应答的长度至关重要[21-22]。MKP-1具有抗凋亡和抗炎特性,同时控制JNK和小胶质细胞p38MAPK的活性[23]。通过对大鼠大脑中动脉闭塞再灌注模型中的研究结果表明,MKP-1可通过抑制JNK信号途径减轻β淀粉样蛋白所诱导的细胞凋亡和神经炎症发挥神经保护作用[24]。从而表明,MKP-1能够通过抑制JNK途径来减轻炎症反应以及细胞凋亡。本研究结果表明,CR组大鼠肺组织MKP-1乙酰化水平降低,而JNK磷酸化水平比NR组、LR组、AR组明显升高,从而相对的说明了通过液体复苏能够增加肺组织MKP-1乙酰化水平,进而减少JNK磷酸化,减轻肺组织炎症反应。
早期的液体复苏是失血性休克治疗的关键措施之一,研究表明,即使是在腹腔高压时,液体复苏也能够增加休克家猪的心排血量, 改善循环状态及脑灌注[25]。醋酸钠林格液复苏能够减轻组织损伤,减少IL-6释放人血,减少肝、肺组织中TNF-α、IL-6的含量,提高失血性休克大鼠存活率[3, 26],即使在低血容量休克的条件下,醋酸盐在体内转换为碳酸氢盐的速率也比乳酸盐快,在维持机体酸碱平衡上显示出优异的缓冲效果[27],因此越来越广泛的应用于失血性休克患者的液体复苏。有研究表明[28],醋酸钠能够通过增强神经胶质细胞组蛋白、非组蛋白乙酰化程度和抑制核因子κB (NF-κB)、MAPK信号通路而减轻炎症反应。醋酸盐处理能够减少脂多糖诱导的p38和JNK磷酸化的能力,通过促炎细胞因子水平的降低和抗炎细胞因子转录的诱导来调节细胞因子的平衡,用于减轻小胶质细胞的炎症反应[29]。本研究的结果表明,相对于生理盐水和乳酸钠林格液,醋酸钠林格液复苏失血性休克大鼠可通过醋酸盐的补充,提高肺组织MKP-1乙酰化水平,进而降低JNK磷酸化水平,抑制TNF-α的释放,促进IL-10、IL-4释放,减轻了肺组织炎症反应。因此对失血性休克大鼠早期使用醋酸钠林格液复苏,效果优于生理盐水和乳酸钠林格液。
| [1] | Lee CC, Chang IJ, Yen ZS, et al. Delayer fluid resuscitation in hemorrhagic shock induces proinflammatory cytokine response[J]. Ann Emergy Med, 2007, 49(1): 37-44. DOI:10.1016/j.annemergmed.2006.05.031 |
| [2] | Ergin B, Kapucu A, Guerci P, et al. The role of bicarbonate precursors in balanced fluids during haemorrhagic shock with and without compromised liver function[J]. Br J Anaesth, 2016, 117(4): 521-528. DOI:10.1093/bja/aew277 |
| [3] | 蔡腾, 王振杰, 王林, 等. 乳酸钠林格液和醋酸钠林格液复苏对失血性休克大鼠TNF-α、IL-6和IL-10的影响[J]. 中国急救医学, 2016, 36(2): 166-170. DOI:10.3969/j.issn.1002-1949.2016.02.015 |
| [4] | Kochanek AR, Fukudome EY, Li Y, et al. Histone deacetylase inhibitor treatment atten-uates MAP kinase pathway activation and pulmonary inflammation following hemorr-hagic shock in a rodent model[J]. J Surg Res, 2012, 176(1): 185-194. DOI:10.1016/j.jss.2011.06.007 |
| [5] | Finkelstein RA, Li Y, Liu B, et al. Treatment with histone deacetylase inhibitor attenuatesMAP kinase mediated liver injury in a lethal model of septic shock[J]. J Surg Res, 2010, 163(1): 146-154. DOI:10.1016/j.jss.2010.04.024 |
| [6] | Al-Amran FG, Hadi NR, Hashim AM. Leukotriene biosynthesis inhibition ameliorates a-cute lung injury following hemorrhagic shock in rats[J]. J Cardiothorac Surg, 2011, 6(1): 81. DOI:10.1186/1749-8090-6-81 |
| [7] | 王涛, 王烁, 李春盛, 等. 急诊危重症患者凝血功能异常对预后的影响[J]. 中华急诊医学杂志, 2017, 26(4): 446-450. |
| [8] | R Wu, LG Peng, HM Zhao. Diverse coagulopathies in a rabbit model with dif-ferent abdominal injuries[J]. World J Emerg Med, 2017, 8(2): 141-147. DOI:10.5847/wjem.j.1920-8642.2017.02.011 |
| [9] | Coletta C, Módis K, Oláh G, et al. Endothelial dysfunction is a potential contributor t-o multiple organ failure and mortality in aged mice subjected to septic shock: preclinical studies in a murine model of cecal ligation and puncture[J]. Crit Care, 2014, 18(5): 511. DOI:10.1186/s13054-014-0511-3 |
| [10] | Yuan W, Li L, Hu Y, et al. Inhibition of acute lung injury by TNFR-Fc through regulation of an inflammation-oxidative stress pathway[J]. PloS one, 2016, 11(3): e0151672. DOI:10.1371/journal.pone.0151672 |
| [11] | Park J, Lee J, Kang W, et al. TGF-β1 and hypoxia-dependent expression of MKP-1 leads tumor resistance to death receptor-med-iated cell death[J]. Cell Death Disease, 2013, 4(2): e521. DOI:10.1038/cddis.2013.42 |
| [12] | Hemmerle T, Zgraggen S, Matasci M, et al. Antibody-mediated delivery of interleukin 4 to the neo-vasculature reduces chronic skin inflammation[J]. J Derm Sci, 2014, 76(2): 96-103. DOI:10.1016/j.jdermsci.2014.07.012 |
| [13] | 董军, 姜华, 陈树涛. 白细胞介素-6, 白细胞介素-10, 肿瘤坏死因子-α与冠心病关系的初步研究[J]. 天津医药, 2014, 42(11): 1112-1113. DOI:10.3969/j.issn.0253-9896.2014.11.017 |
| [14] | 刘玉, 谈大海, 唐季春, 等. 白细胞介素-10对失血性休克大鼠肺的保护作用[J]. 重庆医学, 2010, 39(2): 224-226. DOI:10.3969/j.issn.1671-8348.2010.02.040 |
| [15] | Cargnello M, Roux PP. Activation and function of the MAPKs and their substrates, the MAPK-activated protein kinases[J]. Microbiol Mol Biol Rev, 2011, 75(1): 50-83. DOI:10.1128/MMBR.00031-10 |
| [16] | Sabio G, Davis RJ. TNF and MAP kinase signalling pathways[J]. Semin Immunol, 2014, 26(3): 237-245. DOI:10.1016/j.smim.2014.02.009 |
| [17] | Liu X, Zhang J, Han W, et al. Inhibition of BTK protects lungs from trauma hemorrhagic shockinduced injury in rats[J]. Mol Med Rep, 2017, 16(1): 192-200. DOI:10.3892/mmr.2017.6553 |
| [18] | Bas DB, Abdelmoaty S, Sandor K, et al. Spinal release of tumour necrosis factor activates c-Jun N-terminal kinase and mediates inflammation induced hypersensitivity[J]. Eur J Pain, 2015, 19(2): 260-270. DOI:10.1002/ejp.544 |
| [19] | Kubilus JK, Beazley KE, Talbot CJ, et al. Nuclear ferritin mediated regulation of JN-K signaling in corneal epithelial cells[J]. Exp Eye Res, 2016, 145: 337-340. DOI:10.1016/j.exer.2016.02.002 |
| [20] | Lehnert M, Relja B, Sun-Y, et al. A peptide inhibitor of C-jun N-terminal kinase modulates hepatic damage and the inflammatory response after hemorrhagic shock and resuscitation[J]. Shock, 2008, 30(2): 159-165. DOI:10.1097/SHK.0b013e31815dd623 |
| [21] | Manetsch M, Che W, Seidel P, et al. MKP-1: a negative feedback effector that represses MAPK-mediated proinflammatory signaling pathways and cytokine secretion in human airway smooth muscle cells[J]. Cell Signal, 2012, 24(4): 907-913. DOI:10.1016/j.cellsig.2011.12.013 |
| [22] | Tomida T, Takekawa M, Saito H. Oscillation of p38 activity controls efficient proinflammatory gene expression[J]. Nat Commun, 2015, 6: 8350. DOI:10.1038/ncomms9350 |
| [23] | Liu L, Doran S, Xu Y, et al. Inhibition of mitogen-activated protein kinase phosphatase-1(MKP-1) increases experimental stroke injury[J]. Exp Neurol, 2014, 261: 404-411. DOI:10.1016/j.expneurol.2014.05.009 |
| [24] | Koga S, Kojima S, Kishimoto T, et al. Over expression of map kinase phosphatase-1(MKP-1) suppresses neuronal death through regulating JNK signaling in hypoxia/reoxygenation[J]. Brain Res, 2012, 1436: 137-146. DOI:10.1016/j.brainres.2011.12.004 |
| [25] | 祁慧, 顾勤, 刘宁, 等. 液体复苏对腹腔高压家猪血流动力学及脑灌注的影响[J]. 中华急诊医学杂志, 2017, 26(5): 528-532. DOI:10.3760/cma.j.issn.1671.0282.2017.05.009 |
| [26] | Rohrig R, Wegewitz C, Lendemans S, et al. Superiority of acetate compared with lac-tate in a rodent model of severe hemorrhagic shock[J]. Surg Res, 2014, 186(1): 338-345. DOI:10.1016/j.jss.2013.09.005 |
| [27] | Ergin B, Kapucu A, Guerci P, et al. The role of bicarbonate precursors in balanced fluids during haemorrhagic shock with and without compromised liver function[J]. Br J Anaesth, 2016, 117(4): 521-528. DOI:10.1093/bja/aew277 |
| [28] | Soliman ML, Combs CK, Rosenberger TA. Modulation of inflammatory cytokines and mitogen-activated protein kinases by acetate in primary astrocytes[J]. J Neuroimmune Pharmacol, 2013, 8(1): 287-300. DOI:10.1007/s11481-012-9426-4 |
| [29] | Soliman ML, Puig KL, Combs CK, et al. Acetate reduces microglia in flammatory sig-naling in vitro[J]. J Neurochem, 2012, 123(4): 555-567. DOI:10.1111/j.1471-4159.2012.07955.x |
 2018, Vol. 27
2018, Vol. 27




