百草枯(paraquat,PQ,C12H14Cl2N2)为一种快速非选择性有机杂环类脱叶剂及除草剂。由于其价格低廉,广谱高效,对环境影响小等优点,已在130多个国家使用[1]。但PQ缺乏有效的解毒剂,人体意外或故意摄入导致的病死率高达70%~80%[2],已经成为了一个严重的公共社会问题和急诊医学难题。
目前认为PQ肺内浓聚导致急性肺损伤和快速纤维化[3],是PQ中毒死亡的主要原因。有文献表明[4-6],在PQ导致急性肺损伤早期,氧化应激、炎症反应、细胞凋亡均参与其过程。Toll样受体(Toll-like receptors,TLRs)作为一类重要的天然模式识别受体,能识别和结合病原相关分子模式,诱导炎性因子释放导致级联放大瀑布效应,引起炎症及器官功能损害[7]。Toll样受体3(Toll-like receptor-3,TLR3)作为TLRs家族中重要成员之一,能够刺激TLR诱导核转录因子(Nuclear factor-κappa B,NF-κB)的活化,启动机体的固有免疫和获得性免疫,已被众多学者关注和研究。Cassano等[8]用LPS刺激马的间充质干细胞,发现TLR3和TLR4表达均升高;罗苑苑和林新峰[9]发现,TLR3敲除后可以减轻脓毒症小鼠心肌细胞凋亡及炎性反应的影响。但对于TLR3在PQ导致的急性肺损伤中是否发生重要作用,尚无相关文献报道。
因此,本研究通过体内和体外实验,观察TLR3、NF-κB及下游炎性因子(TNF-α、IL-1β、IL-6)在PQ致急性肺损伤早期的炎症反应中的改变,进而为临床PQ中毒致急性肺损伤的干预提供理论依据和潜在治疗靶点。
1 材料与方法 1.1 动物模型建立雄性C57BL/6J小鼠20只,8~9周龄,22~26 g,购于南京医科大学实验动物中心。小鼠在恒温恒湿通风的动物中心鼠笼中饲养:温度20~26 ℃,相对湿度30%~50 %,明暗交替12 h/12 h,自由进食进水,生长状况良好。本试验获得南京医科大学动物伦理批准(伦理编号:IACUC-14030122)。小鼠随机(随机数字法)分为2组:对照组,即生理盐水(normal saline, NS)组(n=10),处理组,即百草枯组(n=10)。PQ组小鼠单次经气道给予PQ(Sigma,美国)雾化溶剂0.2 mg/50 μL(雾化给药装置:MicroSprayer Aerosolizer, 美国),NS组小鼠单次经气道给予NS 50 μL,72 h后处死小鼠并收获支气管肺泡灌洗液(bronchoalveolar lavage fluid,BALF)和肺组织标本。
1.2 小鼠一般情况每日观察小鼠饮食、毛色、活动状态、呼吸情况、体质量下降等变化。若发现小鼠死亡,记录其死亡时间。
1.3 支气管肺泡灌洗液(BALF)收集及细胞分类计数参照本课题组前期研究处理流程[10]:小鼠处死后,立即开胸,暴露气管及双肺,行气管切开,并夹闭左侧主支气管,用0.5 mL灌洗液(50 mL PBS+5 mmol/L EDTA)行BAL 3次。BALF经红细胞裂解液(Sigma,美国)裂解后,予以1 200 r/min,10 min离心,留取上清液做酶联接免疫吸附剂测定(ELISA),细胞沉淀予涂片吉姆萨染色,行细胞总数及分类计数。
1.4 肺组织病理学检查取小鼠左肺组织样本,用10%甲醛液固定24 h后,石蜡包埋、切片、脱蜡后常规行HE染色,并于光镜下观察。
1.5 BALF的ELISA测定按照ELISA试剂盒(R & D,美国)说明书对BALF进行操作,实验中设置空白对照孔和标准品孔,选择450 nm波长检测吸光度(570 nm校正波长),并根据标准品的吸光度值及相应的浓度值,制作标准曲线。根据标准曲线计算出待测样品的浓度值。
1.6 细胞模型建立拟Ⅱ型肺泡上皮细胞(A549)购于中国科学院细胞库,A549细胞在培养箱(37 ℃、含5%CO2)中,按2×106/mL的密度接种,培养在含10%胎牛血清(Sciencell,美国)的1640培养基(Gibco,美国),2 d换液一次,细胞长至80%时,予以1:3传代处理。A549细胞分别被不同浓度的PQ(0,25,50,100,200,400 μmol/L)孵育24 h,并且根据Western-blotting的结果,用PQ 400 μmol/L在不同时间点(0,1,3,6,12,24 h)孵育A549细胞。实验中所用细胞均为状态良好的对数生长期细胞。
1.7 细胞存活率检测(CCK8实验)对数生长期收集A549细胞,将其均匀地接种于96孔板(100 μL/孔)。将96孔板放在培养箱预培养至细胞贴壁后,用含有不同浓度的PQ的培养基(其中0 μmol/L被设为对照组)与细胞培养24 h后,向每孔加入10 μL CCK-8(Dojindo,日本),96孔板继续在培养箱中孵育2 h,测得波长为450 nm的吸光度。
1.8 小鼠肺组织和A549细胞的Real-time PCR分别按照RNAiso Plus(TaKara,日本),PrimeScriptTM RTMaster Mix(TaKara,日本),SYBR®Premix Ex TaqTM Ⅱ(TaKara,日本)试剂盒说明书,分别对小鼠肺组织和A549细胞行总RNA提取,逆转录,Real-time PCR。Real-time PCR过程中所有引物均由上海捷瑞公司设计和合成见表 1。根据溶解曲线和扩增曲线得知引物特异性和扩增效率。以GAPDH作为内参基因,用2-∆∆CT法对结果进行计算和分析。
| 种属 | 检测指标 | 上游引物序列(5'-3') | 下游引物序列(5'-3') |
| 小鼠 | TLR3 | TCCTTCTCCTATCTCCCAA | GTAAATGCTCGCTTCAAACT |
| 小鼠 | TNF-α | CTCTTCTCATTCCTGCTTGT | GTGGTTTGTGAGTGTGAGG |
| 小鼠 | IL-1β | ATTGTGGCTGTGGAGAAG | AAGATGAAGGAAAAGAAGGTG |
| 小鼠 | IL-6 | ATTTCCTCTGGTCTTCTGG | CTGGCTTTGTCTTTCTTGTT |
| 小鼠 | GAPDH | AAGAAGGTGGTGAAGCAGG | GAAGGTGGAAGAGTGGGAGT |
| 人 | TLR3 | GCAACAACAACATAGCCAACAT | GGAGGTGAGACAGACCCTTTAG |
| 人 | TNF-α | CGAAGTGGTGGTCTTGTTGCT | CCCGACTATCTCGACTTTGCC |
| 人 | IL-1β | GTGGTGGTCGGAGATTCGTAG | GAAATGATGGCTTATTACAGTGGC |
| 人 | IL-6 | GCTCTGGCTTGTTCCTCACTA | AATCATCACTGGTCTTTTGGAG |
| 人 | GAPDH | GGACCTGACCTGCCGTCTAG | GTAGCCCAGGATGCCCTTGA |
小鼠肺组织或A549细胞加入适量ripa(sigma,美国)裂解后,12 000 r/min、4 ℃离心10 min,取上清液,用BCA法测定蛋白浓度,加入1/4(v/v)的loading Buffer,100 ℃ 5 min变性蛋白。每条泳道中加入30 μg总蛋白的蛋白样品,进行SDS-PAGE电泳。电泳完成后,在200 mA,120 min条件下转膜至PVDF微孔膜(Millipore,美国),用5%脱脂奶粉或3% BSA的TBST封闭液常温封闭1 h,然后加入相应的一抗封闭液稀释的抗体(TLR3,ab62566,英国;NF-κBp65,CST8242,美国;Phospho-NF-κBp65,CST 3033,美国;GAPDH,杭州贤至生物AB-P-R001,中国),4 ℃过夜孵育,用TBST洗涤膜15 min×3次。二抗HRP Goat Anti-Rabbit IgG(Jacksonimmuno,美国)用封闭液稀释抗体,常温振荡孵育1 h,用TBST洗涤膜15 min×3次。将发光液A、B混合液均匀滴到膜上,置于Bio-rad凝胶成像系统成像,Western-blotting结果经Image J软件进行灰度扫描分析。
1.10 统计学方法所有数据收集整理后以均数±标准差(x±s)表示,SPSS 17.0软件进行统计分析。两组间比较选择成组t检验,多组计量资料比较选择one-way ANOVA(单因素方差分析)检验(q检验),以P < 0.05为差异具有统计学意义。
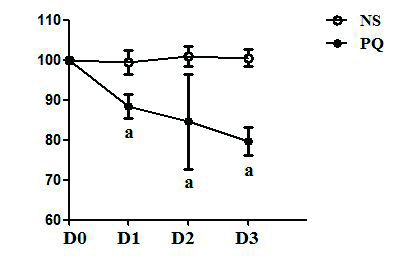
2 结果 2.1 动物的一般情况PQ组小鼠在给药24 h后出现毛发松散、呼吸急促,活动减少等症状;给药后72 h出现进食减少,体质量明显下降(图 1),毛色不光泽,呼吸费力,活动明显减少等症状。NS组一般状况良好,未出现上述症状。
|
| D0,D1,D2,D3为PQ暴露天数(d),(aP < 0.01) 图 1 小鼠体质量变化 Figure 1 Body weight change in mice |
|
|
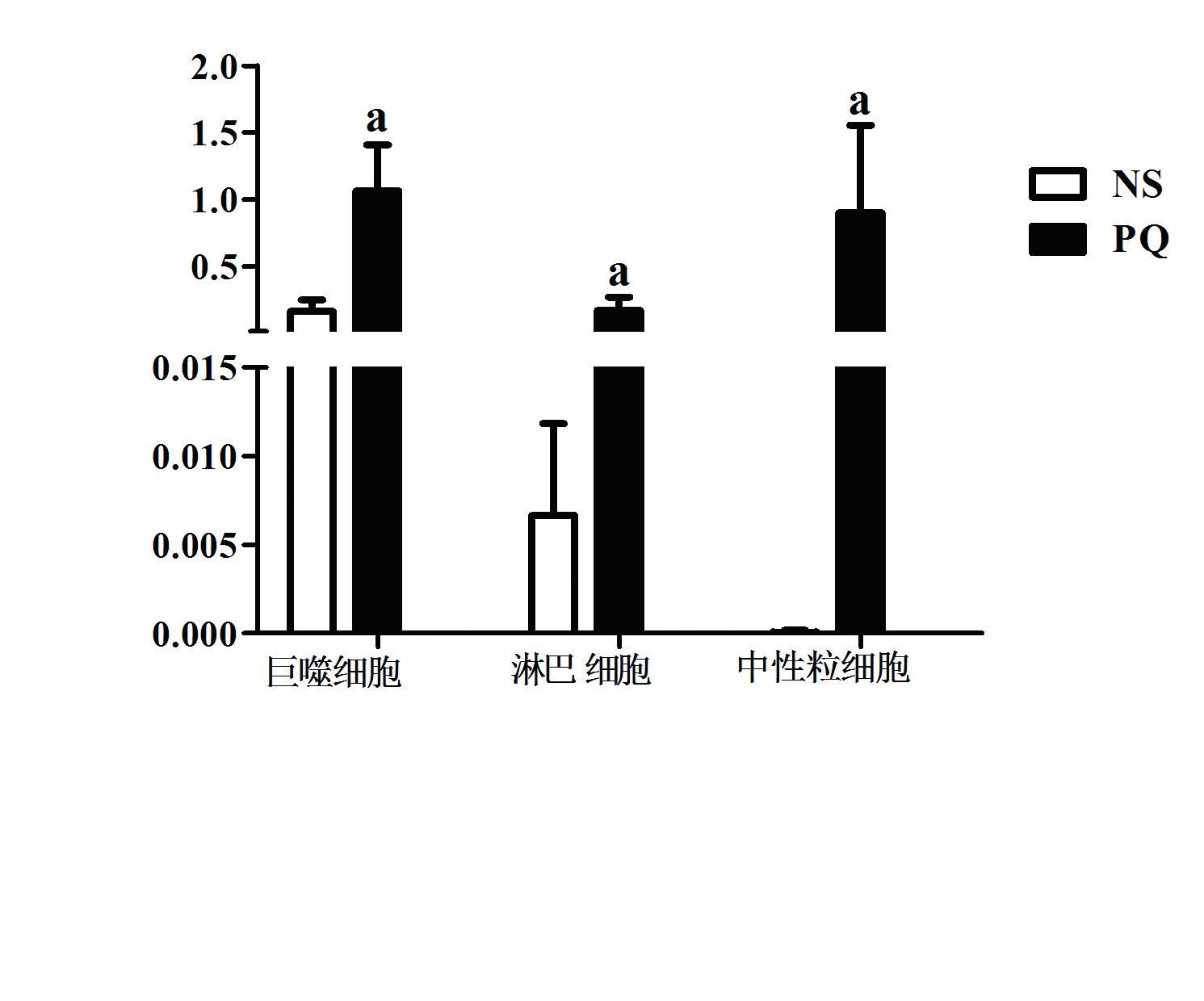
光镜下观察BALF涂片,行细胞总数及分类计数。发现与NS组比较,PQ组BALF细胞总数明显升高[NS:(0.018 8±0.102 1)×105 vs. PQ:(0.237 4±0.121 7)×105, t=9.804, P < 0.01],伴有巨噬细胞[NS:(0.162 8±0.086 53)×105 vs. PQ:(1.063 3±0.343 3)×105, t=8.043, P < 0.01],淋巴细胞[NS:(0.006 6±0.005 2)×105 vs. PQ:(0.171 2±0.099 1)×105, t=5.243, P < 0.01]和中性粒细胞[NS:(0.000 04±0.000 1)×105 vs. PQ:(0.901 9±0.652 5)×105, t=4.370, P < 0.01]明显升高(图 2)。
|
| 与NS组比较,aP < 0.01 图 2 BALF中细胞计数及分类 Figure 2 Cell counting and cytospin in BALF |
|
|
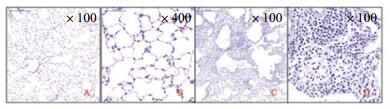
NS组小鼠肺组织标本外观呈粉红色,弹性好;病理切片(图 3A-B)见肺组织结构清晰,间质血管无扩张,无出血点,无炎性浸润,肺泡腔洁净,肺泡壁薄,支气管黏膜上皮完整。PQ组小鼠肺组织标本肿胀变大,局部充血;病理切片(图 3C-D)肺间质及肺泡腔内炎性细胞浸润,伴弥漫性肺出血、肺泡塌陷,肺间质水肿和广泛的肺泡间隔增厚。
|
| A:NS组(放大100倍);B:NS组(放大400倍);C:PQ组(放大100倍);D:PQ组(放大100倍) 图 3 小鼠肺组织病理切片HE染色 Figure 3 Pathological section of lung tissue with HE stain in mice |
|
|
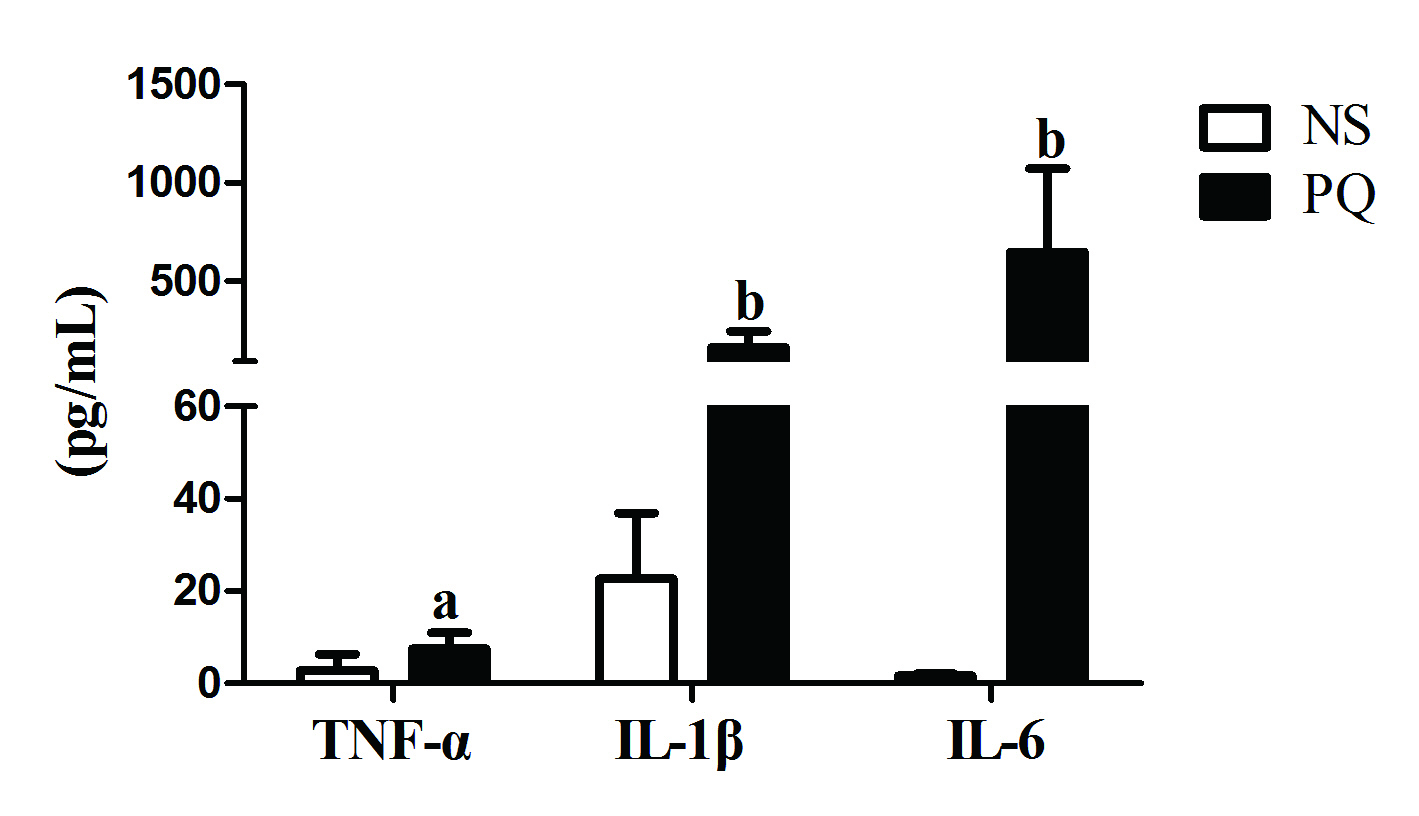
经ELISA试剂盒检测,与对NS组比较,PQ组支气管肺泡灌洗液的TNF-α、IL-1β、IL-6表达明显上升[TNF-α: NS:(2.782 1±3.521 5)vs. PQ:(7.512 6±3.459 8)pg/mL, t=3.030, P < 0.05;IL-1β: NS:(22.687 5±14.229 3)vs. PQ:(163.1004±81.118 3)pg/mL, t=5.391, P < 0.01;IL-6: NS:(1.653 3±0.442 7)vs. PQ:(648.5656±422.606 1)pg/mL, t=4.841, P < 0.01](图 4)。
|
| 与NS比较,aP < 0.05, bP < 0.01 图 4 ELISA法检测BALF中TNF-α、IL-1β、IL-6含量变化 Figure 4 Change of TNF-α, IL-1β, IL-6 level in BALF by ELISA assay |
|
|
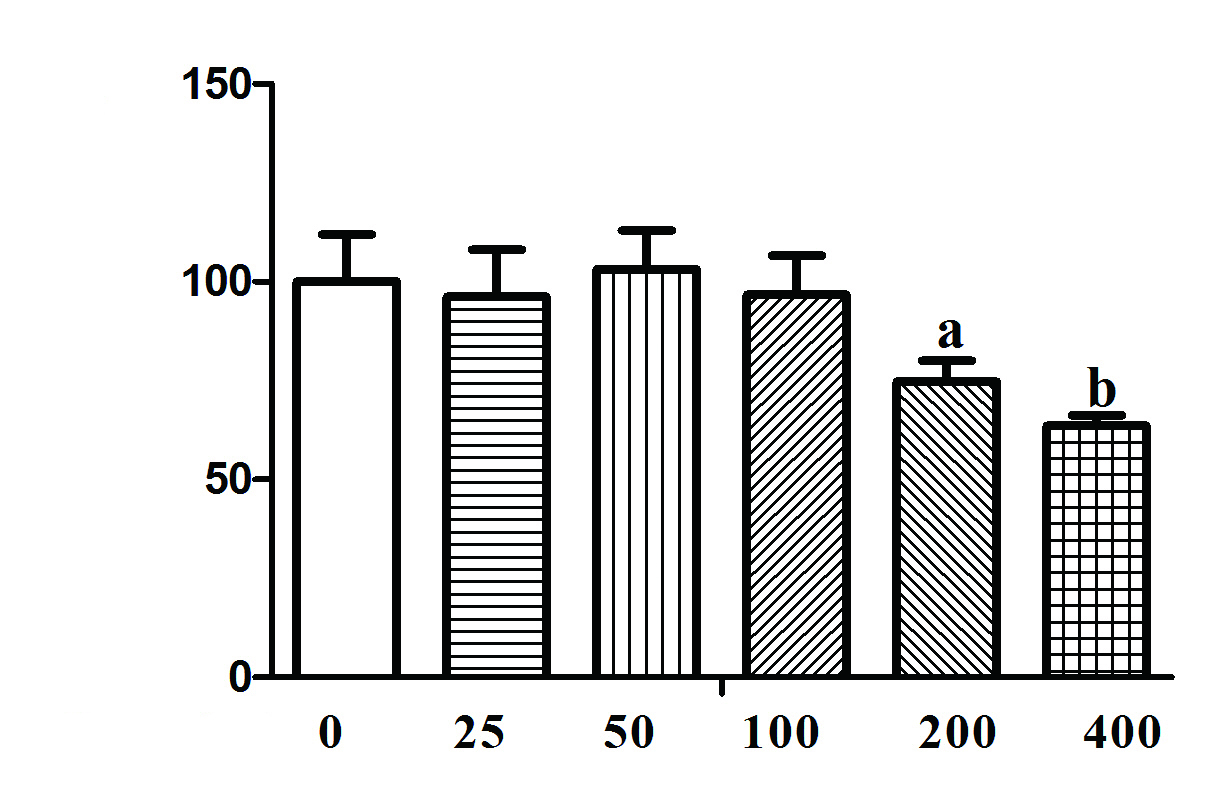
通过CCK8实验评价PQ对A549细胞损伤。不同剂量PQ对A549细胞存活率影响差异有统计学意义(F=18.07,P < 0.01)。以0 μmol/L作为对照组,进行两两比较,结果示:A549细胞在25~100 μmol/L不同浓度PQ暴露24 h,细胞存活率无明显下降;在200 μmol/L PQ情况下,细胞存活率下降约25.3%,与对照组比较差异有统计学意义(q'=4.751,P < 0.05),在400 μmol/L PQ,细胞存活率下降约36.4%,与对照组比较差异有统计学意义(q'=6.829,P < 0.01)(图 5)。
|
| 与0 μmol/L比较,aP < 0.05, bP < 0.01 图 5 CCK8检测不同浓度PQ对A549细胞存活率的影响 Figure 5 The cell viability mediated by PQ in A549 cells by CCK8 |
|
|
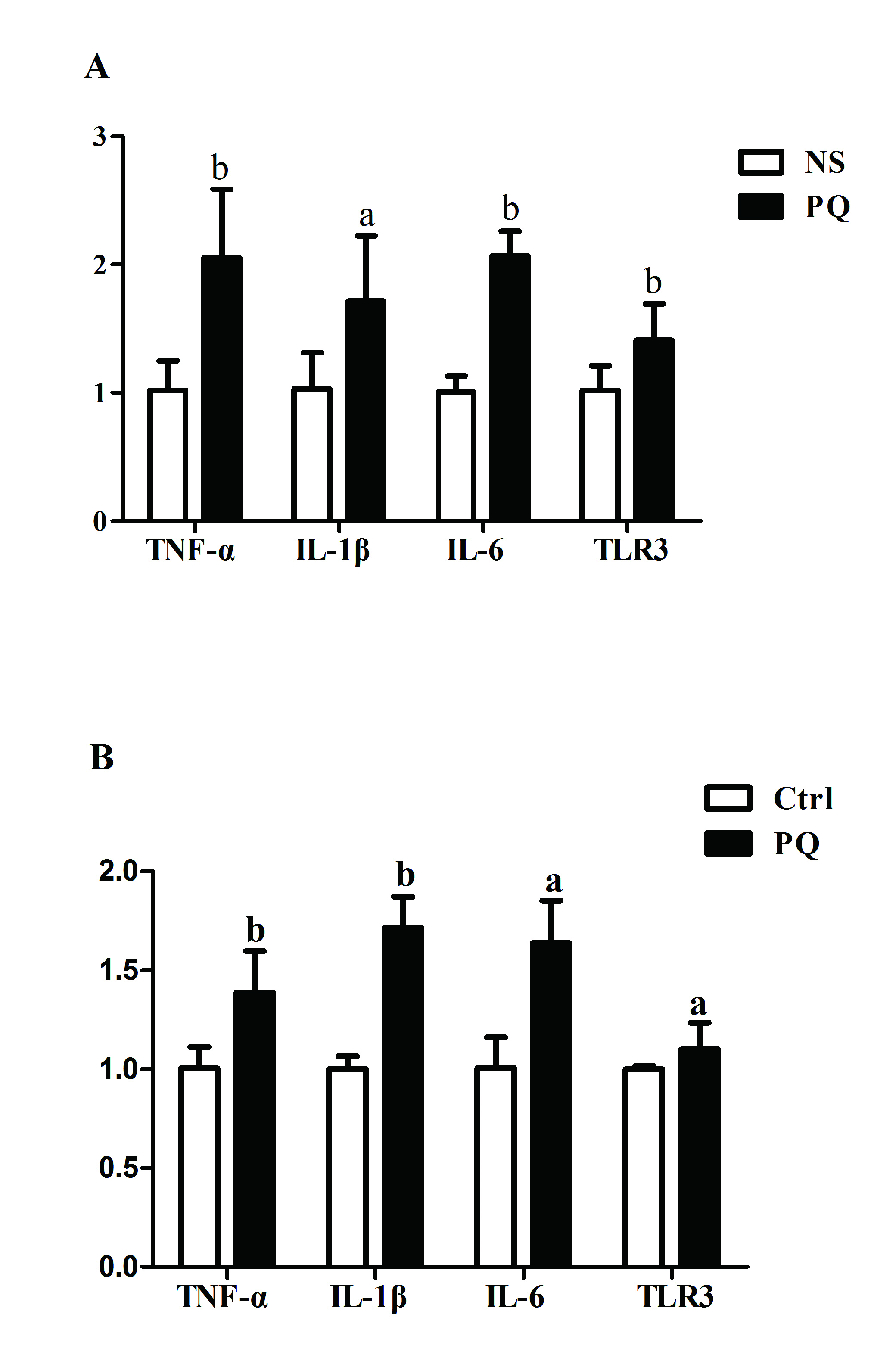
小鼠肺组织中,PQ组与NS组比较,TNF-α、IL-1β、IL-6、TLR3在mRNA水平表达均上升,差异均具有统计学意义(aP < 0.05,bP < 0.01)。A549细胞暴露在400 μmol/L PQ 1h,TNF-α、IL-1β、IL-6、TLR3在mRNA水平表达均上升,差异有统计学意义(aP < 0.05)(图 6)。
|
| A:小鼠肺组织炎性因子mRNA相对表达量;B:A549细胞在PQ 400 μmol/L暴露1 h炎性因子mRNA相对表达量,与对照组比较, aP < 0.05,bP < 0.01 图 6 TNF-α、IL-1β、IL-6、TLR3在基因水平表达变化 Figure 6 mRNA expression of TNF-α, IL-1β, IL-6 and TLR3 |
|
|
如图 7A所示,PQ组肺组织的TLR3蛋白和Phospho-NF-κBp65蛋白水平表达均明显高于NS组,差异有统计学意义(P < 0.05)。如图 7C所示,A549细胞与不同浓度的PQ(0,25,50,100,200,400 μmol/L)孵育24 h,TLR3蛋白和Phospho-NF-κBp65蛋白的表达量增加,400 μmol/L达到高峰。如图 7E所示,A549细胞的TLR3蛋白和Phospho-NF-κBp65蛋白随时间表达量而改变,1 h达到高峰。差异有统计学意义(P < 0.05或P < 0.01)。

|
| A-B:小鼠肺组织的Western-blotting结果及统计图;C-F:A549细胞Western-blotting结果及统计图;与对照组比较,aP < 0.05,bP < 0.01 图 7 PQ暴露对TLR3、Phospho-NF-κBp65蛋白表达的影响 Figure 7 TLR3 and Phospho-NF-κBp65 protein expression mediated by PQ |
|
|
PQ是全世界使用最广泛的除草剂之一,但是PQ中毒的发病机制不明,且缺乏有效的解毒剂,近几年来PQ中毒事件逐年上升,而病死率却居高不下,已为世界性难题[1-2]。由于肺泡上皮细胞可主动将PQ转运到细胞内,使肺组织中PQ浓度提高10~90倍[11]。因此,急性肺损伤和快速纤维化是PQ中毒死亡的最主要原因之一[3]。目前认为PQ中毒损伤主要涉及氧自由基损伤、线粒体损伤、免疫激活及炎性介质作用等[4]。
有研究表明[12],PQ可以诱导A549细胞炎症的发生,主要表现TNF-α、IL-1β和IL-6表达增高。Yang等[13]证实,PQ暴露可导致小鼠血清的炎性因子如TNF-α,IL-1β和IL-6和肺组织内NF-κBp65表达增高。本研究通过PQ暴露构建小鼠急性肺损伤模型,证实了小鼠肺组织病理切片有炎性细胞浸润,BALF中细胞总数明显升高,伴有中性粒细胞比例升高,炎性因子(TNF-α、IL-1β、IL-6)表达也相应增高。Shen等[14]发现产生炎性因子的上游髓样分化蛋白(Myeloid differentiation primary response factor 88,MyD88)被敲除后,PQ致急性肺损伤被明显逆转。有文献研究表明在Toll样受体家族中TLR4、TLR9通过NF-κB和MyD88途径调节PQ致急性肺损伤过程[15-16]。本课题组应用Western-blotting技术发现,动物模型和细胞模型中NF-κBp65均被激活发生磷酸化改变,导致Phospho-NF-κBp65蛋白水平表达升高,从而诱导炎性因子释放。
TLRs家族是一类重要的模式识别受体,通过识别保守的病原相关分子模式启动先天性免疫应答。TLR3作为TLRs家族中的一个重要成员,主要表达于树突状细胞、巨噬细胞和自然杀伤细胞中介导固有免疫应答[17]。既往认为TLR3通过识别病毒双链RNA,从而起到防御病毒感染的作用。但近期研究发现,TLR3在组织重塑、缺血-再灌注损伤、脓毒性休克等方面同样发挥着重要的作用。Royer等[18]实验证明TLR3可以促进MMP-9表达增高从而引起人类呼吸道上皮结构重塑。Zhang等[19]在肺缺血-再灌注损伤小鼠模型中发现,活化的TLR3可通过TRIF途径诱导的NF-κB的磷酸化导致调节促炎细胞因子(TNF-α、IL-1β、IL-6)的表达以及细胞的增殖和凋亡,从而介导肺缺血-再灌注的炎性损伤。Doughty等[20]实验证实,TLR3配体(聚胞苷酸PIC)在早期的炎症反应中释放炎症介质,引起瀑布样级联反应,从而导致脓毒性休克的发生。Gao等[21]发现TLR3基因敲除的小鼠能明显耐受细菌性脓毒血症。既往发现[15-16]TLR4、TLR9和下游NF-κB参与PQ致急性肺损伤过程。本研究通过动物模型和细胞模型发现Phospho-NF-κBp65蛋白水平表达升高的同时上游TLR3在mRNA水平和蛋白水平表达也相应的升高。
综上所述,TLR3/NF-κB信号通路可能参与了PQ致急性肺损伤的发生发展的过程,这为深入研究其发病机制及临床治疗初步奠定了基础。
| [1] | Gil HW, Hong JR, Jang SH, et al. Diagnostic and therapeutic approach for acute paraquat intoxication[J]. J Kor Med Sci, 2014, 29(11): 1441-1449. DOI:10.3346/jkms.2014.29.11.1441 |
| [2] | 乔莉, 张劲松. 我国急性中毒临床救治的现状与思考[J]. 中华急诊医学杂志, 2015, 24(11): 1193-1196. DOI:10.3760/cma.j.issn.1671-0282.2015.11.001 |
| [3] | Dinis-Oliveira RJ, Duarte JA, Sanchez-Navarro A, et al. Paraquat poisonings: mechanisms of lung toxicity, clinical features, and treatment[J]. Crit Rev Toxicol, 2008, 38(1): 13-71. DOI:10.1080/10408440701669959 |
| [4] | Gawarammana IB, Buckley NA. Medical management of paraquat ingestion[J]. Br J Clin Pharmacol, 2011, 72(5): 745-757. DOI:10.1111/j.1365-2125.2011.04026.x |
| [5] | Li SP, Han JY, Sun P, et al. Effect of SP-A/B in lipoic acid on acute paraquat poisoning[J]. World J Emerg Med, 2014, 5(1): 57-62. DOI:10.5847/wjem.j.1920-8642.2014.01.010 |
| [6] | 曹岩, 杨祥明, 信诗宇, 等. 大剂量百草枯致肺泡上皮A549细胞凋亡的研究[J]. 中华急诊医学杂志, 2017, 25(12): 1422-1426. DOI:10.3769/cma.j.issn.1671-0282.2017.12.018 |
| [7] | Mielcarska MB, Bossowska-Nowicka M, Toka FN. Functional failure of TLR3 and its signaling components contribute to herpes simplex encephalitis[J]. J Neuroimmunol, 2018, 316: 65-73. DOI:10.1016/j.jneuroim.2017.12.011 |
| [8] | Cassano JM, Schnabel LV, Goodale MB, et al. The immunomodulatory function of equine MSCs is enhanced by priming through an inflammatory microenvironment or TLR3 ligand[J]. Vet Immunol Immunopathol, 2018, 195: 33-39. DOI:10.1016/j.vetimm.2017.10.003 |
| [9] | 罗苑苑, 林新峰. TLR3对脓毒症小鼠心肌细胞炎症和凋亡的影响[J]. 检验医学与临床, 2015(2): 13-15. |
| [10] | 孙昊, 张劲松, 康健, 等. 不同时段剂量腹腔注射百草枯致小鼠肺损伤及肺纤维化效果评价[J]. 中华急诊医学杂志, 2016, 25(11): 1386-1392. DOI:10.3760/cma.j.issn.1671-0282.2016.11.007 |
| [11] | Xu JJ, Zhen JT, Tang L, et al. Intravenous injection of Xuebijing attenuates acute kidney injury in rats with paraquat intoxication[J]. World J Emerg Med, 2017, 8(1): 61-64. DOI:10.5847/wjem.j.1920-8642.2017.01.011 |
| [12] | Cai Q, L u, Hong G, et al. Recombinant adenovirus Ad-RUNrf2 reduces paraquat-induced A549 injury[J]. Hum Exp Toxicol, 2012, 31(11): 1102-1112. DOI:10.1177/0960327112450902 |
| [13] | Yang C, Song HW, Liu W, et al. Protective effects of chymostatin on paraquat-induced acute lung injury in mice[J]. Inflammation, 2018, 41(1): 122-133. DOI:10.1007/s10753-017-0670-x |
| [14] | Shen H, Wu N, Wang Y, et al. MyD88 gene knockout attenuates paraquat-induced acute lung injury[J]. Toxicol Lett, 2017, 269: 41-46. DOI:10.1016/j.toxlet.2017.01.015 |
| [15] | Shen H, Wu N, Wang Y, et al. Toll-like receptor 9 mediates paraquat-induced acute lung injury: an in vitro and in vivo study[J]. Life Sci, 2017, 178: 109-118. DOI:10.1016/j.lfs.2017.03.021 |
| [16] | 陆如凤, 黄小民, 吴海波, 等. 急性百草枯中毒大鼠肺组织Toll样受体4和核因子-κB表达的变化[J]. 中华急诊医学杂志, 2014, 23(12): 1344-1347. DOI:10.3760//cma.j.issn.1671-0282.2014.12.010 |
| [17] | Matsumoto M, Takeda Y, Tatematsu M, et al. Toll-like receptor 3 signal in dendritic cells benefits cancer immunotherapy[J]. Front Immunol, 2017, 8: 1897. DOI:10.3389/fimmu.2017.01897 |
| [18] | Royer PJ, Henrio K, Pain M, et al. TLR3 promotes MMP-9 production in primary human airway epithelial cells through Wnt/beta-catenin signaling[J]. Respir Res, 2017, 18(1): 208. DOI:10.1186/s12931-017-0690-y |
| [19] | Zhang XY, Chen C, Zhang YB, et al. Role of Toll-Like Receptor 3 in Lung Ischemia-Reperfusion Injury[J]. Shock, 2016, 46(4): 405-411. DOI:10.1097/SHK.0000000000000600 |
| [20] | Doughty LA, Carlton S, Galen B, et al. Activation of common antiviral pathways can potentiate inflammatory responses to septic shock[J]. Shock, 2006, 26(2): 187-194. DOI:10.1097/01.shk.0000223129.79759.74 |
| [21] | Gao M, Ha T, Zhang X, et al. Toll-like receptor 3 plays a central role in cardiac dysfunction during polymicrobial sepsis[J]. Crit Care Med, 2012, 40(8): 2390-2399. DOI:10.1097/CCM.0b013e3182535aeb |
 2018, Vol. 27
2018, Vol. 27




