光气是一种重要的化工原料,属于窒息性毒剂,毒性大。光气经呼吸道吸入后可出现一系列以急性肺损伤(ALI)为主的临床表现,严重者可进展为急性呼吸窘迫综合征(ARDS)甚至死亡。近年来有关光气吸入性ALI的机制研究主要集中在炎症反应,研究已证实NOD样受体热蛋白结构域相关蛋白3(NLRP3)炎症小体介导的炎性反应参与了ALI的发病发展过程。NLRP3炎症小体由NLRP3、衔接蛋白-凋亡相关的斑点样蛋白(ASC)和效应蛋白-天冬氨酸特异性的半胱氨酸蛋白水解酶(caspase-1)等组成。同时,近期研究显示NLRP3炎症小体激活可生成具有活性的caspase-1,而caspase-1不仅能促进IL-1β的成熟,还可以直接诱导细胞出现程序性细胞死亡,这种以依赖caspase-1并伴有大量促炎症因子释放为特征的细胞程序性死亡方式——近年来将其称之为细胞焦亡(pyroptosis)[1],于2001年由Cookson等首次提出[2],其形态学特征、发生及调控机制等均不同于凋亡(apoptosis)和坏死(necrosis)等细胞死亡方式。研究表明在炎症反应中观察到核转录因子-κB(nuclear factor-kappa B,NF-κB)[3-5]参与了NLRP3转录前后水平的调控,参与调控多种细胞焦亡和增殖的相关基因表达。
本实验拟复制光气吸入性急性肺损伤模型,进一步证实NLRP3炎性小体在光气吸入性急性肺损伤炎性反应中的重要作用。利用脱氧核糖核苗酸末端转移酶介导的黏性末端标记法(terminal dexynucleotidyl transferase(TdT)-mediated dUTP nick end labeling, TUNEL)检测肺脏组织的细胞焦亡情况,初步探讨依赖caspase-1并伴有大量促炎症因子释放导致的细胞焦亡在大鼠光气吸入性ALI发病机制中的作用。近年来,许多体内外实验均证实四氢化吡咯二硫代氨基甲酸脂(pyrrolidinedithiocarbamic acid,PDTC)是一种氧化还原剂,具有清除氧自由基、能够选择性地抑制NF-κB活化。本实验给予NF-κB抑制剂PDTC处理后,观察NF-κB、NLRP3炎性小体、炎症因子及细胞焦亡的变化,探讨NF-κB对光气吸入性ALI肺脏组织NLRP3炎性小体和细胞焦亡的影响。此研究将为光气吸入性急性肺损伤的诊治提供新的理论和实验基础。
1 材料与方法 1.1 实验动物4~6周龄清洁级健康雄性SD大鼠20只, 体质量(200±20)g(上海市公共卫生临床中心),实验动物生产许可证号:SCXK(沪)2010-0024。在标准动物饲养间内,给予无菌水和食物饲养。本实验中动物处置方法符合动物伦理学标准。
1.2 主要仪器及试剂动态染毒柜(上海第二军医大学),酶标仪(DENLEY DRAGON Wellscan MK-3, 芬兰Thermo公司),洗衣板(Wellwash 4 Mk2, 芬兰Thermo公司),数字显示隔水式电热恒培养箱(PYX-DHS,上海跃进医疗器械厂),离心机(TGL-168,上海安亭科学仪器厂),移液枪(Thermo labsystems), 台式高速冷冻离心机(德国Eppendorf公司),水浴振荡器(丹麦Heto公司)。固体三光气(海宁中联化学有限公司),N, N-二甲基甲酰胺(DMF,上海生工生物工程有限公司),环己烷(上海生工生物工程有限公司),牛血清白蛋白(美国Sigma公司),免疫组织化学试剂盒和DAB显色剂(丹麦DAKO公司),石蜡切片TUNEL实验:TUNEL试剂盒(美国Roche公司)IL-1β、IL-18和IL-33 ELISA试剂盒(美国R & D公司),RT-PCR反转录试剂盒和荧光定量PCR试剂盒(美国Invitrogen公司),NF-κB P65 antibody 1:1 000(美国Abcam公司),NLRP3抗体1:1 000(美国Abcam公司),ASC抗体1:100(美国Santa cruz公司),Caspase-1抗体1:1 000(美国Abcam公司),内参GAPDH(美国Santa cruz公司)。
1.3 动物分组及处理2 g固体三光气溶于5 mL环己烷中配成质量浓度为40%三光气,置于染毒柜中,20 mL N-二甲基甲酰胺(DMF)滴定使之产生光气。将SD大鼠随机(随机数字法)分为空气对照组、光气染毒组,每组10只大鼠。空气对照组:吸入与光气染毒组同等流量的空气,未注射任何药物。光气染毒组:吸入8.33 mg/L的光气(纯度为100%)。PDTC干预组:与光气染毒组同样的处理方式,染毒后立即尾静脉注入PDTC 100 mg/kg[6]。实验大鼠均置于染毒柜内,动态染毒5 min。
空气或光气暴露后6 h,予20%乌拉坦(1.2 mg/kg)腹腔注射麻醉,经腹主动脉采血处死动物,收集全血,静置2 h后4℃离心,转速为1 500 r/min,时间为10 min。收集血清,冻存于-70℃冰箱中。每组大鼠都结扎左肺,经右支气管穿刺插管,用37℃生理盐水行右侧肺灌洗,每次2 mL,反复3次,收集约4 mL的支气管肺泡灌洗液。左侧肺组织投入液氮快速冷冻后-70℃贮存,以备下一步肺组织相关检查。
1.4 肺组织病理常规HE染色取左肺上叶部分组织,常规制作10%多聚甲醛固定,低温石蜡包埋、切片、苏木精-伊红(HE)染色,在光学显微镜下观察肺组织的病理学改变。
1.5 肺湿干比的测定开胸取出大鼠左下肺脏,称湿质量后,置烤箱(80℃,48 h)烤至恒重,称干质量,计算肺组织湿干比值(wet/dry ratio,W/D)。
1.6 BALF中中性粒细胞数和蛋白含量的测定每组大鼠右上肺叶都经右支气管穿刺插管,用注射器吸取冰生理盐水(4℃)5 mL,通过气管导管以较小的压力将生理盐水缓慢注入右上肺,回抽灌洗液,如此反复抽注,直至灌洗液总量达到15 mL,用血球计数板涂片细胞计数。将所得灌洗液离心(1 000 r/min,10 min)将上清液收集于15 mL离心管中,-80℃冻存,上清液进行蛋白量测定。
1.7 免疫组织化学方法检测肺组织NLRP3的表达和分布取左肺组织石蜡切片脱蜡至水,加用3%BSA均匀覆盖组织,室温封闭30 min。在切片上滴加PBS按一定比例配好的一抗,洗涤3次,每次5 min;二抗覆盖组织,室温孵育50 min,洗涤3次,每次5 min。滴加新鲜配制的DAB显色液,显微镜下控制显色时间,阳性为棕黄色,自来水冲洗切片终止显色。Harris苏木精复染细胞核,脱水封片,显微镜镜检,图像采集分析。石蜡切片免疫组织化学结果判读:苏木精染细胞核为蓝色,DAB显出的阳性表达为棕黄色。在显微镜下观察表皮细胞着色情况(×200),按染色强度弱强。
1.8 荧光定量PCR检测肺组织中NF-κB、NLRP3、ASC和caspase-1mRNA表达量各组大鼠中随机选取每组3例左肺组织。取组织块研磨成粉末,匀浆,离心,RNA洗涤和再溶解,总RNA纯度和浓度的测定。最后进行引物设计及PCR反应:运用Primer Premier 5结合Dnastar分析软件及网上BLAST分析,设计并合成引物,见表 1。
| 基因名称 | 引物序列 | |
| NF-κB | F GGAGTACGACAACATCTCGTTGG | R GTAGAGGTGTCGTCCCATCGT |
| NLRP3 | F CAACTCACCCAAGGAGGAAG | R TCTGAATGTTACAGCCTGGG |
| ASC | F GTTCAAGATGAAGCTGCTGAC | R TTCTGGCTGTGCCCTGAGCA |
| caspase-1 | F CACATTGAAGTGCCCAAGCT | R TCCAAGTCACAAGACCAGGC |
| GAPDH | F CCTTCATTGACCTCAACTAC | R GGAAGGCCATGCCAGTGAGC |
左肺部分组织剪切成细小的碎片。一抗稀释比例:NF-kB P65抗体1:1 000,NLRP3抗体1:1 000,ASC抗体1:100,Caspase-1抗体1:1 000;洗膜液洗膜3次(每次5 min)。二抗:HRP山羊抗兔1:5000。洗膜液洗膜3次(每次5 min)。经过蛋白质抽提,蛋白质定量,电泳,转移,显像,免疫检测,化学发光检测等步骤完成。
1.10 血清及BALF中IL-1β、IL-18和IL-33含量的测定采用双抗体夹心酶标免疫分析法(ELISA法)测定血清和BALF中IL-1β、IL-18和IL-33的含量。操作步骤严格按照各试剂盒说明书步骤进行。
1.11 TUNEL法检测DNA的损伤石蜡切片脱蜡至水,修复,破膜,加试剂1, 2:按片子数量和组织大小取TUNEL试剂盒内适量试剂1 (TdT)和试剂2(dUTP)按2:29混合,阻断内源性过氧化物酶,加试剂3:切片稍甩干后,每张切片加适量试剂3(converter-POD)覆盖组织,切片平放于湿盒内,37℃温箱孵育30 min。DAB显色:切片滴加新鲜配制的DAB显色液,显微镜下控制显色时间,复染细胞核,脱水封片。
1.12 统计学方法所有的数据均是用GraphPad Prism 6.0软件进行统计学分析,所有数据以均数±标准差(x±s)表示,组间比较运用方差分析(LSD-t检验)。所有统计以P < 0.05为差异有统计学意义。
2 结果 2.1 各组大鼠的一般情况空气对照组精神状态正常,自由活动,正常摄食、饮水。光气染毒组大鼠5 min后出现躁动不安,时而嗜睡,步态蹒跚。呼吸浅快或深快,节律不齐,时有呼吸暂停。口鼻和足爪青紫。PDTC干预组大鼠表现萎靡,活动度减少、偶尔可见饮水,呼吸急促等,但明显较光气染毒组轻。大鼠均存活,无死亡。
2.2 各组大鼠肺湿/干比值(W/D)及BALF中中性粒细胞数(Leukocytes)和蛋白含量的比较采用W/D来反映肺组织的含水量及肺水肿的程度,光气染毒组肺W/D(7.408±0.206 7,n=10)明显高于健康对照组(4.486±0.130 3,n=10),差异有统计学意义(t=11.36,P < 0.01);PDTC干预组(5.169±0.141 6,n=10)与光气染毒组比较,肺W/D无明显降低,差异无统计学意义(t=8.936,P > 0.05)。正常情况下,BALF中细胞数量及蛋白含量少,但光气暴露后BALF中可见大量粒细胞并伴随蛋白含量的增加,这与局部炎症反应密切相关。与健康对照组比较,光气染毒组BALF中中性粒细胞数和蛋白含量明显升高,差异有统计学意义(t=12.94,P < 0.01)。与光气染毒组比较,PDTC干预组BALF中中性粒细胞数和蛋白含量明显降低,差异有统计学意义(t=6.235,P < 0.1)。见图 1。
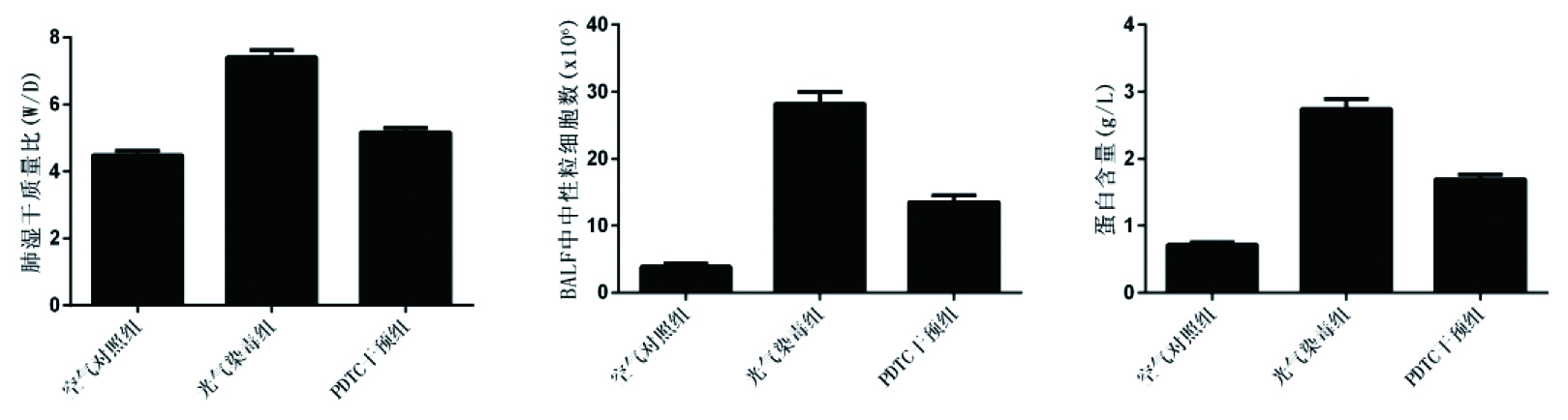
|
| 图 1 各组肺湿干质量比(W/D)及BALF中中性粒细胞数和蛋白含量比较 Figure 1 Comparison of wet/dry in lung, leukocytes and protein content in BALF of rats among groups |
|
|
光镜下(200和400倍视野),空气对照组可见肺泡间隔正常,肺间质无水肿,无明显炎性细胞渗出。光气染毒组可见肺泡结构紊乱,肺泡腔融合,肺泡间隔增宽,间质水肿,可见大量炎性细胞浸润。PDTC干预组可见大鼠肺泡结构较为清晰,肺泡壁稍增厚,伴少量炎性细胞浸润。见图 2。
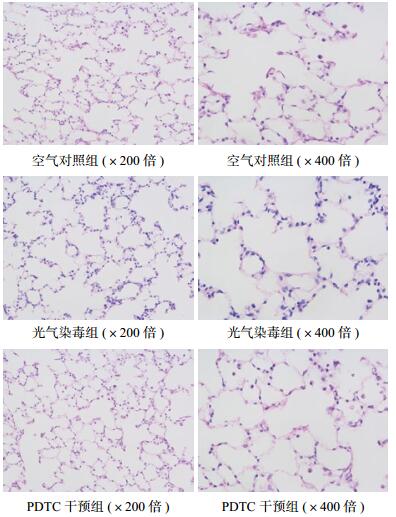
|
| 其中光气染毒组肺组织中有大量炎性细胞浸润;PDTC干预组可见大鼠肺泡结构较为清晰,肺泡壁稍增厚,伴少量炎性细胞浸润 图 2 各组大鼠肺组织病理学改变(×200倍) Figure 2 Morphological changes were observed by HE staining among groups(×200) |
|
|
光镜下(200倍视野),空气对照组大鼠肺组织结构清晰,肺泡壁薄,肺组织内几乎没有NLRP3阳性细胞。光气染毒组大鼠肺泡间隔增厚,肺组织中可见较多NLRP3阳性细胞。PDTC干预组可见大鼠肺泡结构较为清晰,肺泡壁稍增厚,肺组织中可见少量NLRP3阳性细胞。见图 3。

|
| 其中棕黄色染色为NLRP3阳性细胞 图 3 各组大鼠肺组织NLRP3免疫组织化学染色(×200倍) Figure 3 NLRP3 positive cells in lung tissue were observed by Immunohistochemical staining among groups(×200) |
|
|
与空气对照组比较,光气染毒组肺组织中NF-κB、NLRP3和caspase-1 mRNA表达量明显升高,差异有统计学意义(P < 0.05)。与光气染毒组比较,PDTC干预组大鼠肺组织中NF-κB、NLRP3和caspase-1 mRNA表达量明显降低,差异有统计学意义(P < 0.05)。ASC mRNA表达量各组间无明显变化,差异无统计学意义(P > 0.05)。见表 2。
| 组别 | NF-κB mRNA表达量 | NLRP3 mRNA表达量 | ASC mRNA表达量 | caspase-1 mRNA表达量 |
| 健康对照组 | 0.769±0.049 9 | 1.458±0.004 01 | 1.235±0.009 66 | 1.464±0.005 68 |
| 光气染毒组 | 4.139±0.431a | 1.627±0.005 78a | 1.214±0.007 81 | 1.735±0.005 93a |
| PDTC干预组 | 1.421±0.266ab | 1.593±0.012 8ab | 1.235±0.005 40 | 1.641±0.008 71ab |
| t值 | 7.764a, 5.369b | 24.07a, 2.420b | 1.765 | 33.00a, 8.877b |
| P值 | < 0.01a, 0.003b | < 0.01a, 0.036 1b | 0.108 | < 0.01a, < 0.01b |
| 注:与空气对照组比较,aP < 0.05;与光气染毒组比较,bP < 0.05 | ||||
与空气对照组比较,光气染毒组肺组织中NF-κB、NLRP3和caspase-1蛋白含量明显升高,差异有统计学意义(P < 0.05)。与光气染毒组比较,PDTC干预组大鼠肺组织中NF-κB、NLRP3和caspase-1蛋白含量明显降低,差异有统计学意义(P < 0.05)。各组大鼠肺组织中NF-κB、NLRP3和caspase-1蛋白无明显改变,差异无统计学意义(P > 0.05)。见表 3。
| 组别 | NF-κB | NLRP3 | ASC | caspase-1 |
| 健康对照组 | 0.428±0.048 3 | 0.104±0.022 2 | 1.089±0.092 82 | 0.064 2±0.005 67 |
| 光气染毒组 | 1.137±0.051 8a | 0.722± 0.110a | 1.041±0.021 87 | 1.555±0.255a |
| PDTC干预组 | 0.615±0.051 8b | 0.173±0.024 2b | 1.052±0.005 39 | 0.313±0.045 4b |
| t值 | 10.02a, 7.133b | 5.524a, 4.887b | 0.022 19 | 5.848a, 4.798b |
| P值 | 0.000 6a, 0.002b | 0.005 2a, 0.008 1b | 0.892 7 | 0.004 3a, 0.008 7b |
| 注:与空气对照组比较,aP < 0.05;与光气染毒组比较,bP < 0.05 | ||||
与空气对照组比较,光气染毒组血清及BALF中IL-1β、IL-18和IL-33含量明显升高,差异有统计学意义(P < 0.05)。与光气染毒组比较,PDTC干预组大鼠血清及BALF中IL-1β、IL-18和IL-33含量明显降低,差异有统计学意义(P < 0.05)。见表 4。
| 组别 | 血清 IL-1β(pg/mL) |
灌洗液 IL-1β(pg/mL) |
血清 IL-18(pg/mL) |
灌洗液 IL-18(pg/mL) |
血清 IL-33(pg/mL) |
灌洗液 IL-33(pg/mL) |
| 健康对照组 | 35.62±1.343 | 169.4±3.073 | 37.12±1.547 | 47.75±2.933 | 12.40±1.127 | 20.70±1.265 |
| 光气染毒组 | 138.4±4.631a | 560.8±7.334a | 140.4±4.987a | 152.2±6.060a | 26.50±1.147a | 37.90±1.260a |
| PDTC干预组 | 49.86±1.995ab | 268.9±2.609ab | 99.25±4.669ab | 87.70±5.901ab | 17.30±0.655ab | 25.70±1.230ab |
| t值 | 21.32a, 17.56b | 37.51a, 24.67b | 15.51a, 7.622b | 19.79a, 6.28b | 8.765a, 6.963b | 9.632a, 6.929b |
| P值 | < 0.01a, < 0.01b | < 0.01a, < 0.01b | < 0.01a, < 0.01b | < 0.01a, < 0.01b | < 0.01a, < 0.01b | < 0.01a, < 0.01b |
| 注:与空气对照组比较,aP < 0.05;与光气染毒组比较,bP < 0.05 | ||||||
对细胞进行免疫荧光染色,荧光绿色弱,无明显细胞焦亡,细胞焦亡呈阴性;荧光绿色强,提示肺脏组织细胞焦亡明显,细胞焦亡呈阳性。结果提示空气对照组,荧光绿色弱,无明显细胞焦亡。光气染毒后可见大鼠肺脏组织荧光绿色强,细胞焦亡呈阳性。PDTC干预组大鼠肺脏组织荧光绿色弱,无明显细胞焦亡现象。见图 4。
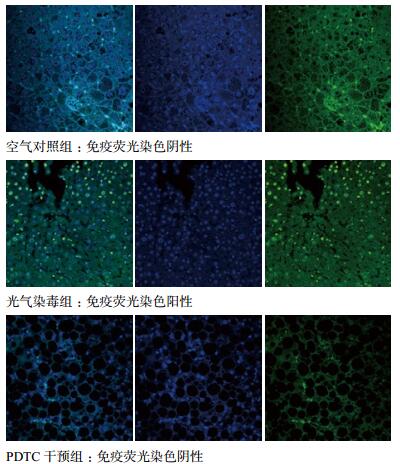
|
| 右图为TUNEL标识、中图为DAPI标识以及左图为合并图 图 4 TUNEL检测肺脏组织细胞进行免疫荧光染色 Figure 4 Pyroptosis was observed by TUNEL among groups |
|
|
光气经呼吸道吸入后可引起ALI,研究[7-10]发现过度失调的炎症反应是导致急性肺损伤发生发展的重要因素——包括中性粒细胞扣押,炎症因子升高和NF-κB途径激活等,PDTC作为特异性的NF-κB抑制剂可以显著减轻肺部炎症反应。经PDTC干预后,可减轻炎症因子介导的炎症反应,减轻急性肺损伤[6]。
NLRP3炎性小体在各种类型急性肺损伤(ALI)中扮演了重要角色[11],主要表达于嗜中性粒细胞、单核巨噬细胞和一些初级免疫细胞中。本研究发现在光气吸入性急性肺损伤中NLRP3炎症小体和NF-κB p65表达水平明显升高。NLRP3炎性小体激活后,其中的caspase-1活化可剪切加工无活性的proIL-1β、proIL-18和proIL-33,使其成为有生物学活性的IL-1β、IL-18和IL-33并分泌到细胞外,并引发炎症反应的瀑布效应,导致ALI甚至ARDS[12]。其中IL-1β是极具促炎活性的炎症因子,在光气吸入中毒后2~6 h达到高峰[7],本实验以6 h为时间点研究NF-κB、NLRP3炎症小体及下游炎症因子是否参与光气急性肺损伤的发生。光气吸入后NLRP3炎症小体表达升高并激活,同时伴有其下游产物IL-1β、IL-18和IL-33水平升高,可以认为光气吸入后可激活NLRP3炎症小体,从而引起瀑布式的炎症反应导致ALI。光气吸入染毒经PDTC干预后,NLRP3炎症小体在肺组织中表达下降,IL-1β、IL-18和IL-33等NLRP3炎症小体的下游产物亦明显下降,提示NF-κB抑制剂可降低NLRP3炎症小体的活化,同时伴有下游炎症因子IL-1β、IL-18和IL-33水平的减少。通过研究高氧诱发的ALI小鼠模型发现,NLRP3缺陷型小鼠比野生型小鼠NF-κB表达明显减少,炎症反应抑制和肺上皮细胞凋亡减弱[3]。体外实验证实内毒素可通过NF-κB等途径调节NLRP3的蛋白表达[4]。因此,在光气吸入性ALI中NF-κB信号传导通路参与了NLRP3炎症小体的表达。
张克君等[13]通过TUNEL染色检测到光气对肺上皮细胞和血管内皮细胞凋亡的诱导作用。依赖caspase-1并伴有大量促炎症因子释放为特征的细胞程序性死亡方式——近年来将其称之为细胞焦亡(pyroptosis)[1]。随着细胞焦亡的启动,炎症小体调控的caspase-1的激活,相继出现细胞核浓集及DNA断裂等现象。由于存在DNA的片段化,焦亡细胞通过TUNEL可被DNA损伤检测方法染成阳性。焦亡现象最初是在巨噬细胞及树突细胞等髓系细胞受到病原体刺激后观察到的[2],煤焦油沥青烟雾提取物(CTP)可引起人支气管上皮细胞炎症凋亡,即细胞焦亡。本研究显示在光气吸入性ALI大鼠中TUNEL染色可见肺脏组织内细胞免疫荧光染色呈绿色,同时依赖caspase-1并伴有大量促炎症因子释放,提示光气吸入性ALI中存在明显的细胞焦亡现象。
在炎症损伤中可观察到NF-κB被激活,NF-κB是目前研究最多的转录调控核因子,参与调控多种炎性分子基因表达,同时也参与细胞焦亡的调节[5]。NF-κB p65通过调节NLRP3编码基因,促进NLRP3的mRNA表达[4]。此外,NF-κB还参与了NLRP3转录后水平的调控,促进NLRP3蛋白表达,这是NLRP3炎症小体异常表达的基础。在本研究中可观察到光气吸入后NF-κB表达明显增强。而PDTC是NF-κB信号通路的抑制剂,可抑制NF-κB的活化[13],干预组大鼠NF-κB表达降低,肺组织中促焦亡的caspase-1表达明显减少,肺脏组织焦亡细胞数量较光气染毒组减少。因此,PDTC通过抑制NF-κB,进而抑制NLRP3炎症小体的表达,减少Caspase-1的活化,从而明显减少肺脏组织的细胞焦亡,NF-κB参与了依赖Caspase-1介导的细胞焦亡。
志谢: 感谢复旦大学附属金山医院中心实验室老师给予的实验技术指导。| [1] | Coll NS, Epple P, Dangl JL. Programmed cell death in the plant immune system[J]. Cell Death Differ, 2011, 18(8): 1247-1256. DOI:10.1038/cdd.2011.37 |
| [2] | Cookson BT, Brennan MA. Pro-inflammatory programmed cell death[J]. Trends Microbiol, 2001, 9(3): 113-114. |
| [3] | Fukumoto J, Fukumoto I, Parthasarathy PT, et al. NLRP3 deletion protects from hyperoxia-induced acute lung injury[J]. Am J Physiol, 2013, 305(1 Pt.1): C182-189. DOI:10.1152/ajpcell.00086.2013 |
| [4] | Liao PC, Chao LK, Chou JC, et al. Lipopolysaccharide/adenosine triphosphate-mediated signal transduction in the regulation of NLRP3 protein expression and caspase-1-mediated interleukin-1β secretion[J]. Inflammation Res, 2013, 62(1): 89-96. DOI:10.1007/s00011-012-0555-2 |
| [5] | Liu Z, Lu G, Xu Y, et al. Melatonin alleviates inflammasome‐induced pyroptosis through inhibiting NF‐κB/GSDMD signal in mice adipose tissue[J]. J Pineal Res, 2017, 63(1). DOI:10.1111/jpi.12414 |
| [6] | 袁震, 赵杰, 申捷, 等. 血管生成素-1在光气急性肺损伤中的作用[J]. 中华急诊医学杂志, 2011, 20(12): 1276-1280. DOI:10.3760/cma.j.issn.1671-0282.2011.12.014 |
| [7] | Sciuto AM, Clapp DL, Hess ZA, et al. The temporal profile of cytokines in the bronchoalveolar lavage fluid in mice exposed to the industrial gas phosgene[J]. Inhal Toxicol, 2003, 15(7): 687-700. DOI:10.1080/08958370390197254 |
| [8] | Wang P, Ye XL, Liu R, et al. Mechanism of acute lung injury due to phosgene exposition and its protection by cafeic acid phenethyl ester in the rat[J]. Exp Toxicol Pathol, 2013, 65(3): 311-318. DOI:10.1016/j.etp.2011.10.001 |
| [9] | Shen J, Gan Z, Zhao J, et al. Ulinastatin reduces pathogenesis of phosgene-induced acute lung injury in rats[J]. Toxicol Ind Health, 2014, 30(9): 785-793. DOI:10.1177/0748233712463776 |
| [10] | He DK, Shao YR, Zhang L, et al. Adenovirus-delivered angiopoietin-1 suppresses NF-kappaB and p38 MAPK and attenuates inflammatory responses in phosgene-induced acute lung injury[J]. Inhal Toxicol, 2014, 26(3): 185-192. DOI:10.3109/08958378.2013.872213 |
| [11] | 蒋磊, 赵鸣雁. NLRP3炎性体在肺损伤的作用进展[J]. 中华急诊医学杂志, 2017, 26(7): 829-833. DOI:10.3760/cma.j.issn.1671-0282.2017.07.024 |
| [12] | Feng F, Li Z, Potts-Kant EN, et al. Hyaluronan activation of the Nlrp3 inflammasome contributes to the development of airway hyperresponsiveness[J]. Environ Health Perspect, 2012, 120(12): 1692-1698. DOI:10.1289/ehp.1205188 |
| [13] | 张克君, 宋彩霞, 焦学龙, 等. NF-κB和PUMA与重症胰腺炎致急性肺损伤的关系以及PDTC的干预作用[J]. 中华急诊医学杂志, 2010, 19(9): 921-923. DOI:10.3760/cma.j.issn.1671-0282.2010.09.005 |
 2018, Vol. 27
2018, Vol. 27




