急性呼吸窘迫综合征(acute respiratory distress syndrome, ARDS)是指心源性以外的各种肺内因素和肺外因素所致的急性弥漫性肺泡毛细血管损伤导致的急性呼吸衰竭, 脓毒症是其主要诱因, 其病死率居高不下[1]。脓毒症时触发炎症反应, 血小板活化在脓毒症的发生、发展、转归中具有重要作用[2]。血小板-单核细胞聚集体(platelet-monocyte aggregates, PMA)是血小板和单核细胞各自活化后形成的复合物, 是评价血小板活化的标志物[3]。
用流式细胞术对123例脓毒症患者外周血PMA进行检测, 观察入院时脓毒症患者、不同程度脓毒症并ARDS患者外周血PMA程度的变化, 评价其预测ARDS的价值, 并与IL-6和急性生理学以及慢性健康状况评分(APACHE Ⅱ评分)进行相关性分析。
1 资料与方法 1.1 一般资料采用前瞻性观察临床研究方法, 选取2014年7月至2015年12月于贵州省人民医院急诊科就诊的脓毒症患者, 脓毒症符合2012国际脓毒症指南制定的标准[4], ARDS纳入标准依据2012 ARDS柏林定义[5]。排除标准:(1)血液系统疾病; (2)患HIV者; (3)接受放疗化疗; (4)有基础糖尿病; (5)有严重基础性心脑血管疾病; (6)肺纤维化; (7)慢性阻塞性肺疾病和支气管哮喘; (8)近3个月使用免疫抑制剂等。最终共入选脓毒症患者61例, 男性38例, 女性23例, 年龄19~68岁, (43.2±15.4)岁, 急性呼吸道感染31例, 急性尿路感染16例, 皮肤软组织感染4例, 急性胆囊炎4例, 急性化脓性脑膜炎2例, 腹腔术后感染4例。脓毒症并ARDS患者62例, 男性34例, 女性28例, 年龄25~73岁, (47.5±16.3)岁, 重症肺炎27例, 多发性创伤12例, 腹腔术后感染9例, 血源性感染9例, 压疮并感染3例, 严重烧伤2例。本研究项目符合医学伦理学要求, 经贵州省人民医院伦理委员会批准, 审批号为2014066, 并且所有检测获得患者或患者家属的知情并签署知情同意书。
1.2 实验方法 1.2.1 资料收集患者入选后即按照预先设计的数据采集表进行研究数据的采集, 对所有符合诊断标准的研究对象, 诊断当天记录其性别、年龄、生命体征等临床资料; 抽取动静脉血送检血常规、血气分析、IL-6水平, 计算并记录APACHE Ⅱ评分、PaO2/FiO2。
1.2.2 分组入选患者为脓毒症者不伴ARDS的患者为非ARDS组, 脓毒症患者发生ARDS者归入ARDS组, ARDS组按病情严重程度依据ARDS柏林定义分为轻、中、重3组。
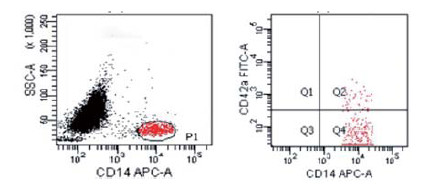
1.2.3 检测方法入选者均在诊断当日用EDTA-K2试管采集肘静脉血4 mL, 为防止血小板活化影响测定结果, 弃掉开始2 mL血, 不能使用压脉带采血, 采集好的标本立即送入中心实验室, 并在4 h内完成流式测定。取流式检测管分别加入CD14-APC 10 μL、CD42a-FITC 10 μL单克隆抗体。取100 μL全血用移液枪移入流式管中, 混匀后室内温度下阴暗处孵育20 min。加入PBS缓冲液洗涤, 固定10 min。加入溶血剂溶解红细胞15 min。溶血后1 500 r/min离心5 min。弃去上清液放入PBS缓冲液, 轻轻的振荡悬浮细胞。以IgG2b-APC和IgG1-FITC作为阴性同型对照。测定前应用Flow-check液进行光路标定, 使用CD42a/CD14设门, 在CD14/SSC直方图中, 圈出CD14阳性的群体为单核细胞(P1), 每个样本分析10 000个细胞, 以CD 14和CD 42a双阳性颗粒代表PMA(Q2), 见图 1。IL-6检测由中心实验室专职人员完成检测。
|
| 图 1 流式细胞仪检测PMA Figure 1 PMA was detected by flow cytometry |
|
|
FACSCalibur型流式细胞仪(美国Becton Dickinson公司), 离心机(美国Bio-Rad公司), 涡旋混合器(常州市国立试验设备研究所), 移液枪及排枪(德国Eppendorf公司), 鼠抗人CDl4-APC、同型对照IgG1-APC, 鼠抗人CD42a-FITC、同型对照IgG2b-FITC(美国Becton Dickinson公司), PBS缓冲液(上海书吉生物科技有限公司), 血浆IL-6检测试剂盒(上海恒远生物科技有限公司)。
1.3 统计学方法应用SPSS 17.0软件包, 对数据资料统计描述和分析。计量资料以均数±标准差(x±s)表示, 两组间比较采用成组t检, 计数资料采用χ2检验。ARDS组三组间比较采用单因素方差分析, 组间两两比较采用SNK检验。采用Pearson线性相关进行相关性分析。建立受试者工作特征曲线(ROC), 计算曲线下面积, 评价各指标在预测ARDS中的价值。以P < 0.05为差异有统计学意义。
2 结果 2.1 一般临床资料非ARDS组与ARDS组性别、年龄无明显差异(P > 0.05)。
2.2 ARDS组和非ARDS组患者各指标水平非ARDS组与ARDS组在指标PMA、IL-6、APACHE Ⅱ、PaO2/FiO2的差异有统计学意义(P < 0.01)。ARDS组的PMA、IL-6、APACHE Ⅱ高于非ARDS组, PMA、IL-6、APACHE Ⅱ随ARDS缺氧程度加重逐渐升高。ARDS组的PaO2/FiO2低于非ARDS组, PaO2/FiO2随ARDS缺氧程度加重逐渐降低, 见表 1~2。
| 组别 | 例数 | PMA | IL-6(ng/L) | APACHE Ⅱ(分) | PaO2/FiO2(mmHg) |
| 非ARDS组 | 61 | 7.97±1.11 | 15.36±4.49 | 16.48±2.98 | 390.15±24.67 |
| ARDS组 | 62 | 15.27±4.58 | 68.03±22.28 | 20.24±3.50 | 165.37±43.31 |
| t值 | -10.445 | -18.104 | -6.404 | 35.290 | |
| P值 | < 0.01 | < 0.01 | < 0.01 | < 0.01 |
| 组别 | 例数 | PMA | IL-6(ng/L) | APACHE Ⅱ(分) | PaO2/FiO2(mmHg) |
| 轻度ARDS组 | 22 | 8.30±1.74 | 19.58±5.14 | 17.27±2.03 | 239.73±14.28 |
| 中度ARDS组 | 21 | 12.68±2.89a | 43.23±14.72a | 20.48±2.73a | 156.29±17.96a |
| 重度ARDS组 | 19 | 22.96±2.76ab | 123.55±26.27ab | 23.42±2.65ab | 89.32±9.23ab |
| F值 | 182.055 | 202.054 | 31.528 | 612.957 | |
| P值 | < 0.01 | < 0.01 | < 0.01 | < 0.01 | |
| 注:与轻度ARDS组比较, aP < 0.01;与中度ARDS组比较, bP < 0.01 | |||||
Pearson线性相关分析结果显示, PMA与IL-6、APACHE Ⅱ评分均呈正相关, 与PaO2/FiO2呈负相关(均P < 0.01), IL-6与APACHE Ⅱ评分呈正相关, 与PaO2/FiO2呈负相关(均P < 0.01), 见表 3。
| 指标 | IL-6 | APACHE Ⅱ | PaO2/FiO2 | |||||
| r值 | P值 | r值 | P值 | r值 | P值 | |||
| PMA | 0.791 | <0.01 | 0.641 | <0.01 | -0.857 | <0.01 | ||
| IL-6 | - | - | 0.574 | <0.01 | -0.738 | <0.01 | ||
| APACHE Ⅱ | 0.574 | <0.01 | - | - | -0.669 | <0.01 | ||
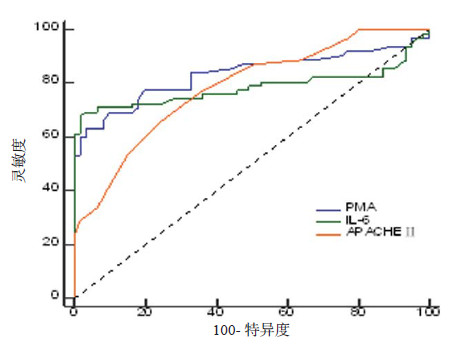
选择PMA、IL-6和APACHE Ⅱ为检验变量, 以ARDS为状态变量拟合ROC曲线。结果显示, 以PMA为检验变量时, AUC=0.833, 有显著的诊断价值(P < 0.01), PMA预测ARDS的最佳临界值为8.8%, 灵敏度为71%, 特异度为82%;以IL-6为检验变量时, AUC=0.785, 有显著的诊断价值(P < 0.01), IL-6预测ARDS最佳临界值为22.2, 灵敏度为67.7%, 特异度为98.4%;以APACHE Ⅱ为检验变量时, AUC=0.784, 有显著的诊断价值(P < 0.01), APACHE Ⅱ预测ARDS的最佳临界值为18.0, 灵敏度为66.1%, 特异度为75.4%。PMA预测ARDS发生的准确性较IL-6、APACHE Ⅱ评分高, 见表 4~5, 图 2。
| 检验变量 | AUC | S.E. | P值 | 95% CI | |
| 下限 | 上限 | ||||
| PMA | 0.833 | 0.039 | <0.01 | 0.755 | 0.894 |
| IL-6 | 0.785 | 0.047 | <0.01 | 0.701 | 0.854 |
| APACHE Ⅱ | 0.784 | 0.040 | <0.01 | 0.701 | 0.853 |
| 指标 | 临界值 | 灵敏度 | 特异度 | 阳性预测值 | 阴性预测值 |
| PMA | 8.8 | 0.710 | 0.820 | 3.94 | 0.35 |
| IL-6(ng/L) | 22.2 | 0.667 | 0.984 | 41.32 | 0.33 |
| APACHE Ⅱ(分) | 18.0 | 0.661 | 0.754 | 2.69 | 0.45 |
|
| 图 2 PMA、IL-6、APACHE Ⅱ预测ARDS发生的ROC曲线 Figure 2 ROC curves of PMA, IL-6 and APACHE Ⅱ to predict the occurrence of ARDS |
|
|
脓毒症时细菌毒素导致炎症细胞产生大量的炎性因子和细胞因子, 促进内皮细胞凋亡和单核细胞趋化蛋白的释放, 内皮细胞的损伤促进血小板活化, 血小板活化后通过P选择素(P-seletin, PS)介导与单核细胞形成PMA。PMA的形成和炎性因子的上调导致失衡和不适当的全身炎症反应, 由于炎症反应导致血小板大量激活从而PMA形成增多, 另外, PMA的形成能够促进附壁血栓形成和加重血管内皮炎症, 形成恶性循环, 这些反应参与脓毒症的病理生理过程中, 最终发生器官衰竭, 肺损伤[6], 肺内微血栓形成加重呼吸衰竭。PMA在血小板活化和炎性反应之间起到一个桥梁的作用[7]。PMA的形成主要是血小板活化所致, 因此检测PMA可以间接反映血小板活化情况。
Rondina等[8]对PMA水平和年龄在脓毒症中的前瞻性临床研究, 显示高水平的PMA与老年脓毒症的病死率是相关的(OR=2.91, 95%CI:0.64~49.61), 是脓毒症预后的标志物, 但是在脓毒症并ARDS患者中的研究罕见报道。本研究通过测定脓毒症、脓毒症并ARDS患者中PMA水平, 探讨PMA与ARDS组患者病情严重程度的关系及预测发生ARDS的意义。结果显示, 脓毒症时PMA水平升高, 与Rondina等[8]的报道相似, 随着病情进展发展为ARDS后其升高更加明显, 说明ARDS组患者血小板处于活化状态, 较非ARDS组产生微血栓程度高, 同时ARDS组患者外周血PMA水平随ARDS病情程度加重而增加, 其增加程度与APACHE Ⅱ评分、PaO2/FiO2呈正相关, 表明病情越重, PMA水平越高, 血小板活化越明显, 诱发血栓形成可能增高。
IL-6是脓毒症并ARDS最重要的促炎症细胞因子之一。Yan等[9]研究表明, IL-6等促炎因子能够促进PMA的形成, 本研究结果表明, 随着ARDS患者病情加重, 血中IL-6水平亦升高, 与PMA水平呈正相关, 说明PMA不仅是血栓形成的指标, 同样也是炎症反应的判定指标。
临床上常用IL-6、APACHE Ⅱ评分作为脓毒症并ARDS的预后指标[10]。同时本研究结果显示, PMA对预测ARDS发生的准确性较高, AUC为0.833, PMA最佳临界值为8.8%的特异度为0.82, 灵敏度为0.71, 可见PMA水平对预测ARDS有意义, 且优于IL-6和APACHE Ⅱ评分系统。因此, PMA是血小板活化的标志物, 也对ARDS的预测有重要价值。
综上所述, 本研究结果表明于脓毒症时PMA水平升高, 随着病情加重发展为ARDS时PMA水平升高更显著, 提示在脓毒症及脓毒症并ARDS患者中出现血小板活化, 有内皮细胞的损害及凝血的激活, PMA与IL-6、APACHE Ⅱ呈正相关, 其预测ARDS的价值优于IL-6和APACHE Ⅱ评分, 可作为脓毒症及脓毒症并ARDS严重程度的预测指标, 同时可能为临床中早期抗凝及内皮细胞的保护提供依据。
| [1] | Takaoka Y, Goto S, Nakano T, et al. Glyceraldehyde-3-phosphate dehydrogenase (GAPDH) prevents lipopolysaccharide (LPS)-induced, sepsis-related severe acute lung injury in mice[J]. Sci Rep, 2014, 4: 5204. DOI:10.1038/srep05204 |
| [2] | Semple JW, Freedman J. Platelets and innate immunity[J]. Cell Mol Life Sci, 2010, 67(4): 499-511. DOI:10.1007/s00018-009-0205-1 |
| [3] | Nagasawa A, Matsuno K, Tamura S, et al. The basis examination of leukocyte-platelet aggregates with CD45 gating as a novel platelet activation marker[J]. Int J Lab Hematol, 2013, 35(5): 534-541. DOI:10.1111/ijlh.12051 |
| [4] | Dellinger RP, Levy MM, Rhodes A, et al. Surviving Sepsis Campaign:international guidelines for management of severe sepsis and septic shock, 2012[J]. Intensive Care Med, 2013, 39(2): 165-228. DOI:10.1097/CCM.0b013e31827e83af |
| [5] | Ranieri VM, Rubenfeld GD, Thompson BT, et al. Acute respiratory distress syndrome:the Berlin Definition[J]. JAMA, 2012, 307(23): 2526-2533. DOI:10.1001/jama.2012.5669 |
| [6] | Garraud O, Berthet J, Hamzeh-Cognasse H, et al. Pathogen sensing, subsequent signalling, and signalosome in human platelets[J]. Thromb Res, 2011, 127(4): 283-286. DOI:10.1016/j.thromres.2010.10.015 |
| [7] | Cerletti C, Tamburrelli C, Izzi B, et al. Platelet-leukocyte interactions in thrombosis[J]. Thromb Res, 2012, 129(3): 263-266. DOI:10.1016/j.thromres.2011.10.010 |
| [8] | Rondina MT, Carlisle M, Fraughton T, et al. Platelet-monocyte aggregate formation and mortality risk in older patients with severe sepsis and septic shock[J]. J Gerontol A Biol Sci Med Sci, 2015, 70(2): 225-231. DOI:10.1093/gerona/glu082 |
| [9] | Yan SL, Russell J, Granger DN. Platelet activation and platelet-leukocyte aggregation elicited in experimental colitis are mediated by interleukin-6[J]. Inflamm Bowel Dis, 2014, 20(2): 353-362. DOI:10.1097/01.MIB.0000440614.83703.84 |
| [10] | 钟明媚, 张琳, 王璠, 等. 急性呼吸窘迫综合征患者血浆血管生成素2水平及其对预后的诊断价值[J]. 中华危重病急救医学, 2014, 26(11): 804-809. DOI:10.3760/cma.j.issn.2095-4352.2014.11.008 |
 2018, Vol. 27
2018, Vol. 27




