脓毒症是由机体对感染的反应失调而引起的危及生命的器官功能障碍[1]。具有高发病率、高病死率、治疗费用高的“三高”特点, 若治疗不及时易演变为脓毒性休克、多器官功能障碍(MODS), 甚至危及生命。尽管抗生素、器官支持、液体复苏和重症监护技术取得了重大突破, 其发生率、病死率较前有所下降, 但仍是危重病患者高发病率和病死率的主要原因[2]。不同研究报道中的病死率为30%~60%[3]。因此, 脓毒症的早期识别、临床诊断、病情评估及有效治疗对降低病死率至关重要。脓毒症的临床诊断和严重程度的评估因症状和体征的高度变异和非特异性而趋于复杂化。然而, 早期诊断和有效治疗是改善脓毒症预后的关键。生物标志物在脓毒症早期诊断、风险分层、指导抗生素使用、严重程度及预后判断、疗效评估中起主要作用[4]。目前研究发现、降钙素(procalcitonin, PCT)、C反应蛋白(C-reactive protein, CRP)对脓毒症诊断、严重程度判断及预后评估有一定的指导作用。但其敏感性和特异性不高, 故仍缺乏更有效的生物标志物。血浆游离DNA是在细胞外液中可检测的DNA片段, 包含线粒体DNA(mitochondrial DNA, mtDNA)及核DNA(nuclear DNA, nDNA)。脓毒症时, 两者由凋亡和坏死组织释放到循环中, 其浓度的增加可能是由于细胞释放增加或清除率降低所致[5]。而血浆mtDNA因其长度短、结构简单、易于分离、高拷贝数、突变率高备受关注, 目前研究发现在成人脓毒症患者中血浆mtDNA水平可反映器官损伤和休克的严重程度, 其比通常用于结果预测的乳酸盐浓度或SOFA评分更强大, 血浆mtDNA是相对独立的预测脓毒症病死率的因子, 如果水平增加1 ng/mL, 病死率将提高0.7%[5]。而在儿童脓毒症中研究较少。本研究通过动态观察脓毒症患儿不同时间点血浆mtDNA的变化, 探索血浆mtDNA对评估脓毒症患儿病情的临床价值。
1 资料与方法 1.1 一般资料将2016年7月至2017年1月收住湖南省儿童医院重症监护病房诊断为脓毒症及儿保科同时期年龄、性别匹配的健康体检儿童为入选对象, 根据器官障碍个数分为:参照器官功能障碍诊断标准[6], 分为脓毒症单器官障碍组、多器官障碍组; 按患儿有无休克分为脓毒症休克组、非休克组; 检测患儿入院后第1、3、7天血浆mtDNA水平, 观察上述指标与病情严重程度的关系。同时根据患儿结局分为脓毒症存活组、死亡组, 比较两组之间血浆mtDNA水平在不同时间点的动态变化趋势。脓毒症和脓毒性休克的临床诊断依据按照《儿童脓毒症休克(感染性休克)诊治专家共识2015版》[7]及Sepsis 3.0的诊断标准[1]。排除本身有遗传代谢性疾病、肝肾疾病、肿瘤终末期患儿。对照组为同时期年龄、性别匹配的健康体检儿童。本研究符合医学伦理学标准, 并经医院伦理委员会批准, 所有检测获得患者或家属知情同意。
1.2 检测指标及方法符合入选标准的患儿及健康体检儿童在入院后第1、3、7天用柠檬酸盐抗凝管采集股静脉血(2 mL/管), 室温下静置30 min, 3 000 r/min离心10 min, 小心地将上层淡黄色血浆吸至一洁净EP管中, 再以10 000 r/min离心10 min, 完全去掉细胞成分后吸取上层液置于一清洁干燥的冻存管中, 所得血浆分装好后置于-80 ℃冰箱中冷冻保存。采用德国QIAamp公司的微量柱离心式QIAamp DNA blood Mini抽提试剂盒严格按照试剂说明书进行DNA抽提和纯化, 采用天根生化科技(北京)有限公司的Quanti Fast SYBR Green PCR试剂盒实时荧光定量聚合酶链反应(PCR)进行血浆mtDNA定量:(1)引物合成:引物由泰和永昌(长沙)生物技术有限公司合成; (2)质粒标准品的建立:经过Genbank中核查由MT-ND2引物序列扩增后人线粒体目标基因(CACAGAAGCTGCCATCAAGTATTTCCTCACGCAAGCAACCGCATCCATAATCCTTCTAATAGCTATCCTCTTCAACAATATACTCTCCGG, 90 bp)建立质粒标准品; (3)质粒标准品的定量及梯度稀释; (4)PCR反应及扩增; (5)PCR数据处理; (6)血浆mtDNA定量PCR方法评定。同时, 样本送检验科检测C-反应蛋白、降钙素原, 收集患儿痰液进行细菌培养。
1.3 统计学方法应用SPSS 18.0统计软件对数据进行处理和分析, 所有数据进行正态性检验。符合正态分布的计量资料(年龄)用均数±标准差(x±s)表示, 非正态分布的计量资料(血浆mtDNA)采用非参数分析, 用中位数及四分位间距[M(P25, P75)]表示。计数资料(性别)比较采用χ2检验。两样本间比较采用Mann-Whitney U检验。采用受试者工作曲线(ROC)评估其灵敏度和特异度, 以P < 0.05为差异有统计学意义。
2 结果 2.1 临床资料正常对照组(27例)年龄范围3个月至1岁11个月, 男孩13例(48.1%), 女孩14例(51.9%)。脓毒症组(37例)年龄范围2个月至2岁2个月, 男孩16例(43.2%), 女孩21例(56.8%)。对照组的年龄、性别与脓毒症组差异无统计学意义(P > 0.05), 见表 1。
| 指标 | 正常对照组 (n=27) |
脓毒症组 (n=37) |
统计值 | P值 |
| 性别(男, %) | 13(48.1) | 16(43.2) | χ2=0.152 | 0.697 |
| 年龄(月, x±s) | 8.78±3.65 | 10.86±4.59 | F=2.506 | 0.118 |
| 血浆 mtDNA(pg/mL) [M(P25, P75)]) |
1 904.8 (1 267.9, 2 395.5) |
3 384.4 (1 368.5, 6 857.5) |
Z=-2.603 | < 0.01 |
在37例脓毒症患儿中, 原发感染部位所占百分比:其中颅内感染11例(29.73%); 肺部感染13例(35.14%); 胃肠道感染8例(21.62%); 血流感染1例(5.41%); 其他感染部位4例(8.11%)。
2.3 病原学分布情况细菌感染共22例(59.5%)其中鲍曼不动杆菌5例, 表皮葡萄球菌、溶血葡萄球菌、嗜麦芽窄食单胞菌混合感染1例, 大肠埃希菌4例, 肺炎克雷伯菌2例, 肺炎链球菌1例, 金黄色葡糖球菌4例, 流感嗜血杆菌合并洋葱伯克霍尔德菌感染1例, 嗜麦芽窄食单胞菌2例, 阴沟肠杆菌1例, 黏质沙雷菌1例, 支原体感染共4例(10.8%), 真菌感染共5例(13.5%), 其中热带假丝酵母菌2例, 光滑假丝酵母菌、近平滑假丝酵母菌、白假丝酵母菌各占1例, 病毒感染共3例(8.1%), 其中呼吸道合胞病毒1例, 甲、乙型流感病毒各1例, 其他不明感染共3例(8.1%)。
2.4 结局在37例脓毒症患儿中, 其中存活组32例(86.5%), 死亡组5例(13.5%)。其中4例于第3天死亡, 1例存活至第7天。
2.5 脓毒症组与对照组血浆mtDNA水平脓毒症组mtDNA含量为3 384.4(1 368.5, 6 857.5) pg/mL, 高于健康对照组1 904.8(1 267.9, 2 395.5) pg/mL, 差异有统计学意义(Z=-2.603, P < 0.01), 见表 1。
2.6 血浆mtDNA水平与脓毒症病情严重性关系 2.6.1 脓毒症单器官障碍及多器官障碍比较多器官障碍组血浆mtDNA水平明显高于单器官障碍组(表 2), 且前者mtDNA水平在第1、3天升高明显, 其中第1、3天血浆mtDNA差异有统计学意义(P < 0.01), 第7天mtDNA差异有统计学意义(P < 0.05), 并随着时间延长, 两组血浆mtDNA水平呈逐渐下降趋势, 第7天将至最低水平。
| 组别 | 例数 | 第1天 | 第3天 | 第7天(13例) |
| 单器官 障碍组 |
20 | 1 620.0 | 986.7 | 537.9 |
| (1 043.0, 3 664.9) | (495.1, 1 925.2) | (249.4, 1 214.2) | ||
| 多器官 障碍组 |
17 | 6 384.4 | 2 912.2 | 1 034.8 |
| (3 261.0, 14 214.6) | (2 004.5, 4 702.0) | (815.8, 1 507.5) | ||
| Z值 | -3.352 | -3.200 | -2.247 | |
| P值 | 0.001 | 0.001 | 0.025 |
脓毒症休克组血浆mtDNA水平显著高于非休克组(表 3), 且前者血浆mtDNA水平在第1、3天升高更明显。其中第1、3、7天血浆mtDNA差异均有统计学意义(P < 0.01), 并随着时间延长, 两组血浆mtDNA水平呈逐渐下降趋势, 第7天将至最低水平。
| 组别 | 例数 | 第1天 | 第3天 | 第7天(7例) |
| 非休克组 | 26 | 1 962.7 | 1 170.7 | 683.2 |
| (1 109.7, 3 889.9) | (516.32, 2 384.9) | (255.2, 1 005.7) | ||
| 休克组 | 11 | 11 445.3 | 3 369.2 | 1 424.6 |
| (6 384.4, 15 550.9) | (2 776.2, 8 707.3) | (1 034.8, 1 609.0) | ||
| Z值 | -3.921 | -3.821 | -3.423 | |
| P值 | < 0.01 | < 0.01 | 0.003 |
死亡组血浆mtDNA水平显著高于存活组(表 4), 其中第1、3天血浆mtDNA差异有统计学意义(P < 0.05), 第7天血浆mtDNA差异无统计学意义(P > 0.05), 随着时间延长, 两组血浆mtDNA水平逐渐呈下降趋势。
| 组别 | 例数 | 第1天 | 第3天 | 第7天(1例) |
| 非休克组 | 26 | 2 780.0 | 1 450.5 | 741.8 |
| (1 226.8, 5 261.2) | (710.6, 2 481.6) | (3 34.0, 1 254.6) | ||
| 休克组 | 11 | 1 3515.1 | 5 842.4 | 1 045.1 |
| (4 832.7, 15 2348.5) | (3 402.8-10 1937.5) | (1 045.1, 1 045.1) | ||
| Z值 | -2.399 | -3.065 | -0.735 | |
| P值 | 0.016 | 0.002 | 0.462 |
| 组别 | AUC | 最佳截断值 | 灵敏度 | 特异度 | P值 |
| mtDNA | 0.848 | 2 176.2 pg/mL | 0.89 | 0.72 | < 0.01 |
| CRP | 0.614 | 71.3 mg/L | 0.58 | 0.67 | 0.236 |
| PCT | 0.775 | 7.24 ng/L | 0.84 | 0.61 | 0.004 |
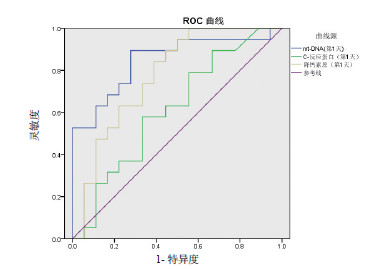
|
| 图 1 血浆mtDNA、PCT、CRP的ROC曲线 Figure 1 ROC Curve of Plasma mtDNA, PCT and CRP |
|
|
以传统MODS诊断为标准, 血浆mtDNA、CRP、PCT绘制ROC曲线, 血浆mtDNA预测脓毒症MODS的灵敏度和特异度较CRP、PCT更为理想。
2.8.2 不同时间点血浆mtDNA预测脓毒症MODS的诊断效能入院第1天血浆mtDNA曲线下面积(AUC)最大(表 6, 图 2), 提示准确性较高, 第3、7天准确性降低。
| 天数 | AUC | 最佳截断值 | 灵敏度 | 特异度 | P值 |
| 第1天 | 0.807 | 2 176.2 | 0.87 | 0.72 | 0.003 |
| 第3天 | 0.789 | 2 387.1 | 0.67 | 0.89 | 0.005 |
| 第7天 | 0.767 | 741.8 | 0.87 | 0.72 | 0.009 |
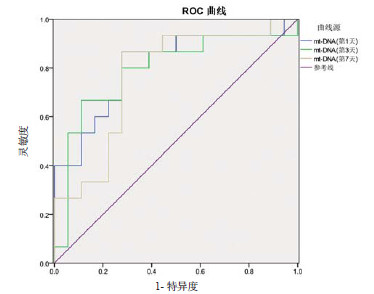
|
| 图 2 不同时间点血浆mtDNA的ROC曲线 Figure 2 The ROC curve of plasma mtDNA at different intervals |
|
|
19世纪末, 在脓毒症及内毒素血症模型中首次提到线粒体功能障碍[8], 存在于多种组织中, 包括心脏[9], 肠[10], 肝脏[11]和骨骼肌[12]等。Mela在1971年首次在感染性休克大鼠肝脏中对线粒体超微结构变化进行了相关研究, 发现脓毒症早期线粒体结构改变不明显, 在脓毒症12 h后线粒体嵴消失, 排列错杂, 有少量空泡出现, 在24 h病变最严重[13]。近来文献报道脓毒症致器官功能衰竭和死亡的首要决定性因素为线粒体损伤, 且其严重程度与炎症因子水平高低、病情的严重性和预后呈正相关。在此期间, 大量活性氮和ROS的释放导致DNA结构的含氮碱基的修饰或解离, 这促使DNA链的裂解, 缺如或突变[14]。与nDNA不同, mtDNA缺乏组蛋白的保护, 使其更易于降解, 并可能导致mtDNA片段短于nDNA[15]。在生理条件下, mtDNA编码与线粒体呼吸链复合物有关的蛋白质。mtDNA诱导嗜中性粒细胞趋化因子细胞因子IL-8的分泌, 它作为损伤相关的分子模式, 可以驱动分子过程, 导致炎症反应和器官损伤[16]。血浆游离mtDNA定义为细胞外液中可检测的DNA片段, 片段衍生自受损的线粒体, 从凋亡及坏死组织中释放到循环, 其可在多种疾病中呈现升高水平, 包括创伤, 严重脓毒症和恶性肿瘤等[17]。Bhagirath等[18]在对mtDNA、细菌DNA的抗炎研究发现与健康对照组相比, 脓毒症患者血浆mtDNA水平显著高出正常人50倍以上。Hu等[19]对36例严重受伤患者及10例健康志愿者通过实时PCR评估血浆mtDNA浓度, 发现脓毒症患者血浆mtDNA水平与健康对照组相比显著升高, 这有助于脓毒症和MODS的发展。Kung等[5]研究发现, 脓毒症及严重脓毒症患者入院时的血浆mtDNA水平显著高于健康对照组。本实验通过对37例脓毒症及27例性别、年龄相匹配的健康儿童血浆mtDNA的比较, 发现脓毒症患儿血浆mtDNA水平明显高于健康儿童(表 1), 与Kung等[5]的研究结果如出一辙。这提示着血浆mtDNA水平在一定程度上对脓毒症诱发的器官障碍有一定的诊断价值, 其连续、动态的变化过程能揭示炎症发展趋势, 很显然, 血浆mtDNA可作为脓毒症诊断及疗效评价的较有价值生物标志物之一。
脓毒症以各种方式起病, 病情进展迅速, 一旦发生, 如不及时干预, 可迅速进展为脓毒性休克, MODS, 甚至危及生命。脓毒性休克(septic shock)是指脓毒症的基础上并发严重的细胞代谢紊乱和循环障碍, 其病死率高达40%以上[20]。据报道, mtDNA增加了内皮细胞的通透性, 从而模仿了MODS中另一个重要的病理生理过程[21]。文献报道血浆mtDNA水平与脓毒性休克患者的炎症标志物、休克的严重程度、器官损伤和病死率有一定的关联[22]。在脓毒症患者和脓毒症动物模型中研究表明循环的游离mtDNA片段随炎症反应加重而增加[23-24]。Hu等[19]研究发现脓毒症和MODS组血浆mtDNA浓度明显高于无综合征的患者, 且mtDNA浓度的趋势随多器官功能衰竭评分的增加而升高。Timmermans等[22]通过对121例成人脓毒性休克及12例健康志愿者进行前瞻性研究发现血浆mtDNA水平在脓毒性休克起始时增加, 并保持升高水平。Kung等[5]通过对68例严重脓毒症患者和33例健康对照者实时定量聚合酶链反应测定血浆mtDNA水平, 发现脓毒症死亡组血浆mtDNA浓度明显高于存活组, 且在第1、4天显着升高, 第7天逐渐降至低水平。本研究通过动态观察脓毒症单器官障碍组与多器官障碍组、脓毒症非休克组及休克组血浆mtDNA水平变化, 发现脓毒症多器官障碍组血浆mtDNA明显高于单器官障碍组, 且前者血浆mtDNA水平在第1、3天升高更明显, 并随着时间延长, 两组血浆mtDNA水平呈逐渐下降趋势至第7天降至低水平(表 2)。脓毒症休克组血浆mtDNA水平显著高于非休克组, 且前者血浆mtDNA水平在第1、3天升高更明显, 并随住院时间延长, 两组血浆mtDNA水平呈逐渐下降趋势至第7天降至低水平(表 3)。本实验与Kung等[5]研究结果相符, 这提示血浆mtDNA水平在严重感染后不久增加, 经过液体复苏、强有力抗感染、器官功能支持等干预后病情好转逐渐降至低水平。在成年严重脓毒症和脓毒症休克患者的前瞻性研究中发现, 血浆mtDNA每升高1 ng/mL与病死率增加0.7%相关联[5]。这与本实验研究发现脓毒症死亡组血浆mtDNA明显高于存活组(表 4)相吻合, 而随住院时间延长, 死亡组与存活组血浆mtDNA总体趋势呈下降水平, 一方面提示患儿经机械辅助通气、器官支持等相关治疗后线粒体功能逐渐恢复, 故血浆mtDNA水平呈下降趋势; 一方面可能与患儿入院3 d后病情呈进行性加重甚至死亡, 部分标本未采集有关。综上所述, 脓毒症MODS、脓毒症休克在某种程度上促使脓毒症病死率增加, 而血浆mtDNA连续性变化过程在一定程度上反映器官功能障碍、休克、死亡情况, 因此笔者推测增加的血浆mtDNA水平可以作为脓毒症患者病情严重程度的预测因素[25]。
Di Caro等[26]通过研究表明收住重症监护室的严重脓毒症和脓毒性休克患儿血浆mtDNA浓度显著升高。与未合并MODS的患儿相比, 合并MODS的脓毒症儿童中可观察到血浆mtDNA呈升高水平。本研究发现脓毒症患儿血浆mtDNA水平显著高于正常对照组, 脓毒症多器官障碍患儿血浆mtDNA水平显著高于脓毒症单器官障碍者, 我们对不同时间点血浆mtDNA水平预测MODS进行ROC曲线分析, 结果显示:血浆mtDNA水平第1天AUC为0.848, 提示准确度为中等偏高, 在以mtDNA 2 176.2 pg/mL为临界值时, 其灵敏度和特异度分别为89%和72%(表 5), 而第1天血浆mtDNA曲线下面积最大, 准确性较高; 第3、7天曲线下面积变小, 准确性较低。Kung等[5]研究表明严重脓毒症组的血浆mtDNA水平显著高于健康对照组, 脓毒症死亡的重要预后因素包括前24 h内的机械通气、入院时SOFA评分、血清乳酸盐、血浆mtDNA水平, 其中仅有血浆线粒体DNA水平可作为独立预测死亡的因子。其最佳截断值为198 ng/mL(91%灵敏度和72%特异性), 每增加1.0 ng/mL血浆mtDNA都将病死率提高0.7%。CRP是脓毒症时较常用的经典指标, 对评估脓毒症病情发展有着举足轻重的作用, 其与感染的严重程度相关, 多项研究强调, 在鉴别病毒、细菌等疾病中缺乏一定的特异性。本研究对CRP预测脓毒症MODS的ROC曲线分析, 结果显示AUC仅为0.614, 提示准确度低下, 在以CRP 71.3 mg/L为临界值时, 灵敏度和特异度分别为58%、67%(表 5), 这可能与CRP属于急性期反应物(当机体处于应激、创伤、手术、免疫反应等状态时均可出现)有一定关联。当机体被细菌入侵时产生PCT, 并随患儿的病情改善, PCT呈现下降趋势。但PCT水平同样在应激、手术、休克、免疫反应时也升高, 这可能对脓毒症病情判断有一定局限性, 对PCT预测脓毒症MODS进行ROC曲线分析, 结果显示曲线下面积为0.775, 提示准确度为中等, 以PCT 7.24 mg/L为临界值时, 其灵敏度和特异度分别为84%、61%(表 5), 相比而言, 血浆mtDNA灵敏度、特异度更高, 因此采取连续、动态的血浆mtDNA检测更能早期预测脓毒症器官功能损伤, 对临床脓毒症早期诊断、危险分层、预后评估有一定指导作用。
在脓毒症恢复阶段, 经过液体复苏、强有力抗生素抗感染、器官功能支持等干预后, 全身各组织缺血缺氧状态逐渐恢复, 线粒体利用氧的能力增强, 线粒体数量和功能逐渐恢复, 这使得血浆mtDNA呈逐渐下降趋势, 但因本研究为单中心研究, 样本量偏小、实验操作误差可能, 需大规模前瞻性研究予以求证。
| [1] | Singer M, Deutschman CS, Seymour CW, et al. The Third International Consensus Definitions for Sepsis and Septic Shock (Sepsis-3)[J]. JAMA, 2016, 315(8): 801-810. DOI:10.1001/jama.2016.0287 |
| [2] | Ryu JA, Yang JH, Lee D, et al. Clinical usefulness of procalcitonin and c-reactive protein as outcome predictors in critically ill patients with severe sepsis and septic shock[J]. PLoS One, 2015, 10(9): e138150. DOI:10.1371/journal.pone.0138150 |
| [3] | Martin GS, Mannino DM, Eaton S, et al. The epidemiology of sepsis in the United States from 1979 through 2000[J]. N Engl J Med, 2003, 348(16): 1546-1554. DOI:10.1056/NEJMoa022139 |
| [4] | Pierrakos C, Vincent JL. Sepsis biomarkers:a review[J]. Crit Care, 2010, 14(1): R15. DOI:10.1186/cc8872 |
| [5] | Kung CT, Hsiao SY, Tsai TC, et al. Plasma nuclear and mitochondrial DNA levels as predictors of outcome in severe sepsis patients in the emergency room[J]. J Transl Med, 2012, 10: 130. DOI:10.1186/1479-5876-10-130 |
| [6] | 喻文亮. 小儿多器官功能障碍死亡风险评估[J]. 中华实用儿科临床杂志, 2013, 28(18): 1372-1375. DOI:10.3760/cma.j.issn.2095-428X.2013.18.005 |
| [7] | 中华医学会儿科学分会急救学组, 中华医学会急诊医学分会儿科学组, 中国医师协会儿童重症医师分会. 儿童脓毒性休克(感染性休克)诊治专家共识(2015版)[J]. 中华儿科杂志, 2015, 53(8): 576-580. DOI:10.3760/cma.j.issn.0578-1310.2015.08.007 |
| [8] | Crouser ED, Julian MW, Blaho DV, et al. Endotoxin-induced mitochondrial damage correlates with impaired respiratory activity[J]. Crit Care Med, 2002, 30(2): 276-284. DOI:10.1097/00003246-200202000-00002 |
| [9] | Alvarez S, Vico T, Vanasco V. Cardiac dysfunction, mitochondrial architecture, energy production, and inflammatory pathways:Interrelated aspects in endotoxemia and sepsis[J]. Int J Biochem Cell Biol, 2016, 81(Pt B): 307-314. DOI:10.1016/j.biocel.2016.07.032 |
| [10] | Crouser ED, Julian MW, Dorinsky PM. Ileal VO(2)-O(2) alterations induced by endotoxin correlate with severity of mitochondrial injury[J]. Am J Respir Crit Care Med, 1999, 160(4): 1347-1353. DOI:10.1164/ajrccm.160.4.9810116 |
| [11] | Lowes DA, Webster NR, Murphy MP, et al. Antioxidants that protect mitochondria reduce interleukin-6 and oxidative stress, improve mitochondrial function, and reduce biochemical markers of organ dysfunction in a rat model of acute sepsis[J]. Br J Anaesth, 2013, 110(3): 472-480. DOI:10.1093/bja/aes577 |
| [12] | Peruchi BB, Petronilho F, Rojas HA, et al. Skeletal muscle electron transport chain dysfunction after sepsis in rats[J]. J Surg Res, 2011, 167(2): e333-338. DOI:10.1016/j.jss.2010.11.893 |
| [13] | Carre JE, Orban JC, Re L, et al. Survival in critical illness is associated with early activation of mitochondrial biogenesis[J]. Am J Respir Crit Care Med, 2010, 182(6): 745-751. DOI:10.1164/rccm.201003-0326OC |
| [14] | Duran-Bedolla J, Montes DOM, Saldana-Navor V, et al. Sepsis, mitochondrial failure and multiple organ dysfunction[J]. Clin Invest Med, 2014, 37(2): E58-69. DOI:10.25011/cim.v37i2.21087 |
| [15] | Jiang P, Chan CW, Chan KC, et al. Lengthening and shortening of plasma DNA in hepatocellular carcinoma patients[J]. Proc Natl Acad Sci U S A, 2015, 112(11): E1317-1325. DOI:10.1073/pnas.1500076112 |
| [16] | Nakahira K, Haspel JA, Rathinam VA, et al. Autophagy proteins regulate innate immune responses by inhibiting the release of mitochondrial DNA mediated by the NALP3 inflammasome[J]. Nat Immunol, 2011, 12(3): 222-230. DOI:10.1038/ni.1980 |
| [17] | Jimenez-Sousa MA, Tamayo E, Guzman-Fulgencio M, et al. Mitochondrial DNA haplogroups are associated with severe sepsis and mortality in patients who underwent major surgery[J]. J Infect, 2015, 70(1): 20-29. DOI:10.1016/j.jinf.2014.07.005 |
| [18] | Bhagirath VC, Dwivedi DJ, Liaw PC. Comparison of the proinflammatory and procoagulant properties of nuclear, mitochondrial, and bacterial DNA[J]. Shock, 2015, 44(3): 265-271. DOI:10.1097/SHK.0000000000000397 |
| [19] | Hu Q, Ren J, Wu J, et al. Elevated levels of plasma mitochondrial dna are associated with clinical outcome in intra-abdominal infections caused by severe trauma[J]. Surg Infect (Larchmt), 2017, 18(5): 610-618. DOI:10.1089/sur.2016.276 |
| [20] | 薄禄龙, 卞金俊, 邓小明. 2016年脓毒症最新定义与诊断标准:回归本质重新出发[J]. 中华麻醉学杂志, 2016, 36(3): 259-262. DOI:10.3760/cma.j.issn.0254-1416.2016.03.002 |
| [21] | Sun S, Sursal T, Adibnia Y, et al. Mitochondrial DAMPs increase endothelial permeability through neutrophil dependent and independent pathways[J]. PLoS One, 2013, 8(3): e59989. DOI:10.1371/journal.pone.0059989 |
| [22] | Timmermans K, Kox M, Scheffer GJ, et al. Plasma nuclear and mitochondrial dna levels, and markers of inflammation, shock, and organ damage in patients with septic shock[J]. Shock, 2016, 45(6): 607-612. DOI:10.1097/SHK.0000000000000549 |
| [23] | Nakahira K, Haspel JA, Rathinam VA, et al. Autophagy proteins regulate innate immune responses by inhibiting the release of mitochondrial DNA mediated by the NALP3 inflammasome[J]. Nat Immunol, 2011, 12(3): 222-230. DOI:10.1038/ni.1980 |
| [24] | Pyle A, Burn DJ, Gordon C, et al. Fall in circulating mononuclear cell mitochondrial DNA content in human sepsis[J]. Intensive Care Med, 2010, 36(6): 956-962. DOI:10.1007/s00134-010-1823-7 |
| [25] | Nakahira K, Kyung SY, Rogers AJ, et al. Circulating mitochondrial DNA in patients in the ICU as a marker of mortality:derivation and validation[J]. PLoS Med, 2013, 10(12): e1001577. DOI:10.1371/journal.pmed.1001577 |
| [26] | Di Caro V, Walko TR, Bola RA, et al. Plasma mitochondrial DNA--a novel DAMP in pediatric sepsis[J]. Shock, 2016, 45(5): 506-511. DOI:10.1097/SHK.0000000000000539 |
 2018, Vol. 27
2018, Vol. 27




