心脏骤停(cardiac arrest,CA)动物模型的构建是开展心肺复苏基础研究的根本,一个好的动物模型应该具有操作简便,方法可靠,可重复性高等特点,并能够贴近临床实际情况。在复苏转归联盟Epistry注册研究中,各年龄组的CA患者接受急诊医疗服务后的出院生存率仅为11.4%[1]。由于心源性猝死主要由恶性心律失常所致,美国及欧洲心脏病协会联合发布的报告显示CA患者75%~80%记录到的初始心电图为室颤[2],因此电刺激诱发室颤的模型能够较好地模拟CA后心肺复苏(cardiopulmonary resuscitation, CPR)的病理生理变化过程,也是目前心肺复苏研究领域中认为是最接近临床实际的诱导CA方法。综合目前国内外常用构建CA动物模型方法,本研究选择经皮电刺激心外膜法,并给予适当改良,建立了稳定可行,安全有效,切合临床的CA动物模型。
1 材料与方法 1.1 实验动物选用健康雄性Sprague-Dawley大鼠10只,体质量330~380 g,由华中科技大学同济医学院实验动物中心提供,使用许可证编号SCXK(鄂)2016-0657,所有动物实验均经过同济医学院实验动物伦理委员会批准。
1.2 动物准备 1.2.1 手术准备大鼠术前一晚禁食,自由饮水。按照45 mg/kg腹腔注射戊巴比妥钠(sigma公司,美国)麻醉,仰卧位固定于手术台。颈部、胸壁部、背部以及左腹股沟部使用电动剃毛器(ZG-F638,广东志高空调有限公司,中国)备皮。颈部纵行切口,暴露气管,选用14 G动脉穿刺针聚乙烯外套管内置探针经口气管插管,拔出探针,固定套管,套管末端连接小动物呼吸机(ALC-V8S, 上海奥尔科特生物科技有限公司,中国),呼吸机参数设置:频率70次/min,潮气量6.5 mL/kg。经四肢皮下大头针记录标准Ⅱ导联心电图。经左股动脉放置23号PE-50聚乙烯管到达腹主动脉监测主动脉压。导管预充5 U/mL肝素生理盐水连接三通开关,一端连接肝素生理盐水注射器,一端通过压力换能器与生物机能实验系统(BL420F,成都泰盟科技有限公司,中国)连接。经左股静脉置管建立静脉输液通道。所有动物持续监测肛温,用加热灯及控温毯维持温度(36.5±0.5) ℃。
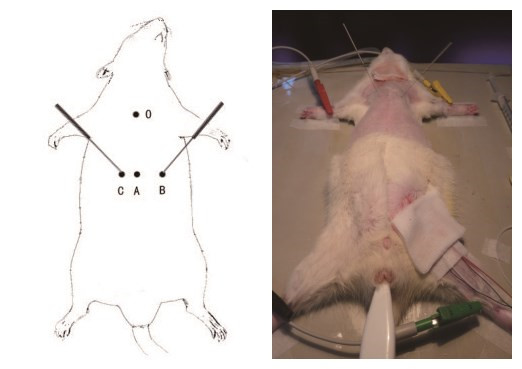
1.2.2 刺激电极的置入用无菌针灸针(环球牌0.25 mm×40 mm,苏州针灸用品有限公司,中国)作为导电极,针灸针经胸壁刺入到达心外膜。大鼠的胸壁肌层较厚,肋骨相对难以触及,骨性标志不甚明显,导电极难以透过胸壁准确到达心外膜上,鉴于此本研究根据大鼠的解剖特点,对330~380 g SD大鼠进行了定量化的定位导电极刺入点。在大鼠的前正中线上以胸骨顶端为零点O,向下定位3.2 cm的点A;再以A点为零点,向左定位0.9 cm的点B,向右定位0.5 cm的点C。则B、C两点即为针灸针刺入的点,进针深度约1~1.5 cm, 在B点进针时针灸针与水平线约呈75°角,针尖指向前正中线;在C点进针时针灸针与水平线约呈60°角,针尖指向前正中线,见图 1。刺入后,针尖到达心外膜上可见针尾的快速摆动且与大鼠心脏跳动的频率一致;心电图可有早搏,短暂室性心律失常等改变;同时有血压波形的瞬时下落,随即血压即可回升至基础值。完成上述操作后持续观察动物基础状态30 min。
|
| 图 1 刺激电极的置入位置 Figure 1 The placement of stimulating electrode |
|
|
实验设计参照USTEIN指南[3],使用BL420F生物机能实验系统的电刺激器进行电刺激, 模式为电流,方式为连续单刺激, 延时100 ms, 波宽1 ms, 频率50 Hz, 初始强度1 mA, 刺激时间3 min。如电刺激开始后10 s内动脉压不能迅速下降至25 mmHg(1 mmHg=0.133 kPa)以下,可把电流强度稍作调整,依次递增0.5 mA,最高至3 mA,若大于3 mA则认为诱导失败,停止电刺激,拔出针灸针,稳定20 min。稳定之后,调整针灸针刺入的位置和方向,重新开始诱颤,这个过程最多不应超过三次,超过三次则放弃。当动脉血压迅速降至25 mmHg以下;或动脉搏动波形消失;或停止电刺激后心电图波形为室颤、无脉性电活动或心搏停止即可判断为CA。从各项指标满足CA判定标准,予持续交流电刺激诱颤3 min,之后停止电刺激,予观察时间3 min,期间不予任何处理。由于大鼠存在个体差异,若电刺激3 min大鼠停止叹息样呼吸,则停止电刺激;若大鼠仍有叹息样呼吸,则适当延长电刺激时间,同时减少观察时间。CA总时间维持6 min。观察期间恢复自主心律且收缩压大于25 mmHg者计为诱导CA失败。所有动物在实验结束后常规进行解剖尸检,观察插管位置是否正确,有无与手术、造模相关的损伤。
1.3.2 心肺复苏方法室颤诱导前15 min记录一次大鼠基础值。按上述方法电刺激诱导室颤,室颤6 min后开始机械通气与胸外心脏按压。机械通气频率调整为100次/min,按压频率大致为200次/min,所有的胸外按压均由同一实验人员进行。将复苏后平均动脉压维持在60 mmHg以上10 min作为自主循环恢复(return of spontaneous circulation, ROSC)的指标。CPR开始后立即予静脉推注肾上腺素(20 μg/kg),必要时3 min间隔重复应用。持续按压2 min后观察,如为室颤就除颤,能量为4 J。除颤后如ROSC则停止按压,予监测心电和血流动力学指标;不能ROSC则继续按压2 min再次观察,如为室颤则除颤,否则继续按压。重复上述步骤,10 min内未能ROSC则放弃抢救。
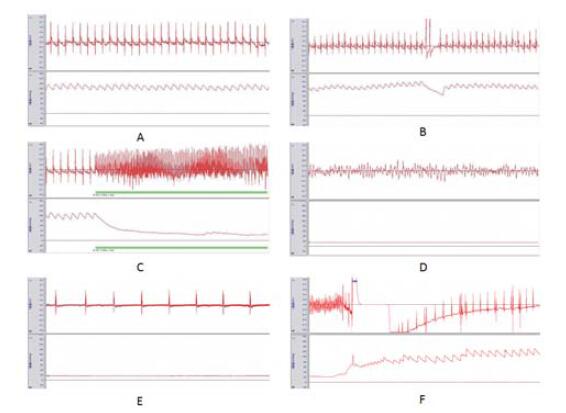
2 结果 2.1 诱发CA情况有效电刺激开始后本实验10只大鼠全部成功诱发CA。如表 1所示,诱颤的平均电流为(1.80±0.59)mA,有效电刺激后诱发CA的时间为(5.07±2.37)s,电刺激总时间为(187.50±12.75) s。大鼠在有效电剌激开始后10 s内,股动脉血压迅速降至25 mmHg以下,脉搏波形消失,停止电刺激观察,9只大鼠心电监护显示为室颤,1只大鼠显示为无脉性电活动,见图 2。
| 序号 | 体质量(g) | 心率(次/min) | 平均动脉压(mmHg) | 有效刺激电流强度(mA) | 诱发CA时间(s) | 电刺激总时间(s) | CA总时间(min) | 诱颤结果 | 肾上腺素次数 | 除颤次数 | CPR时间(s) | 并发症 |
| 1 | 330 | 320 | 118 | 2 | 7.58 | 195 | 6 | VF | 1 | 1 | 206 | 无 |
| 2 | 330 | 348 | 114 | 1.5 | 4.16 | 180 | 6 | VF | 1 | 2 | 243 | 无 |
| 3 | 330 | 430 | 135 | 2 | 3.44 | 180 | 6 | VF | 2 | 2 | 321 | 无 |
| 4 | 359 | 344 | 135 | 2.5 | 4.78 | 210 | 6 | PEA | 1 | 0 | 112 | 无 |
| 5 | 334 | 447 | 135 | 2.5 | 2.86 | 180 | 6 | VF | 1 | 2 | 245 | 无 |
| 6 | 359 | 377 | 130 | 1 | 4.28 | 180 | 6 | VF | 1 | 1 | 124 | 无 |
| 7 | 378 | 355 | 137 | 1 | 9.74 | 180 | 6 | VF | 1 | 1 | 123 | 无 |
| 8 | 380 | 370 | 128 | 1.5 | 1.89 | 180 | 6 | VF | 1 | 1 | 195 | 无 |
| 9 | 363 | 454 | 129 | 1.5 | 5.08 | 180 | 6 | VF | 1 | 1 | 129 | 无 |
| 10 | 325 | 320 | 126 | 2.5 | 6.91 | 210 | 6 | VF | 2 | 1 | 211 | 无 |
|
| A:诱颤前的基础生理参数;B:针灸针刺入心外膜时;C:给予电刺激诱发CA;D:刺激结束后心电图示室颤;E:刺激结束后心电图示无脉性电活动;F:给予除颤后 图 2 实验大鼠致颤与复苏过程中的心电及血压波形变化 Figure 2 The ECG and blood pressure waveform during cardiac arrest and CPR |
|
|
10只大鼠均ROSC,除颤次数(1.20±0.63)次,CPR时间(190.90±68.60)s,静脉推注肾上腺素次数(1.20±0.42)次。术后尸体解剖没有发现肉眼可见的心外膜下出血以及明显的肺部淤血情况。
3 讨论目前常见的CA动物模型的建立方法主要包括电刺激法(54%)、窒息法(25%)、注射氯化钾(8%)此外还有重物挤压法等[4]。窒息法是较早且长期使用的一种方法,能模拟溺水、气道异物、自缢等非心源性CA[5]。注射氯化钾法是使用高浓度钾离子抑制心肌收缩,使心搏停止在舒张期,该法不便于后续研究,重物挤压法跟临床胸部重物压迫所致外伤相似,操作简单,术后生存时间长。这些方法虽然所需实验设备及操作简单,但是诱发后的心电图多表现为无脉性电活动或者心脏停搏,这与临床常见的CA的原因室颤存在一定差异[6-7]。交流电刺激右心室内膜诱颤的方法诱颤成功率高,模型稳定,但是对仪器设备的要求比较高,不利于推广[8-9];胸外交流电休克法并发症较多,技术复杂,电流参数也难以控制[10];经食道心脏诱发起搏的方法由于食道电极的选择,以及食道电极放置部位难以相对固定,导致诱颤电压较大,模型复制稳定性受到一定影响[11-12]。直视下电击心外膜法需要打开胸腔暴露心脏或者大血管,对实验动物的创伤比较大,实验操作也比较复杂[13],因此本研究选用经皮心外膜电刺激建立室颤动物模型。
经皮心外膜电刺激的方法,关键在于进针部位的选择和进针深度的把握,尽量避免误伤及肺脏造成气胸,或者进针深度过深损伤心肌。本研究采用中医针灸用的细针与刺激器的正负极相连作为电极,利用电流总是从电阻小的通路经过这一特点,将刺激电流有效地经皮肤引导至心外膜,无需开胸就可以使用较小的电流刺激而达到目的,且操作简便、并发症少。鉴于大鼠基础心率很快,具有自动复律的特点,本研究采用了右心起搏导管电刺激致颤法中持续电刺激3 min的做法,避免了自动转复室上性心律现象的发生。已有实验采用经皮心外膜电刺激诱颤的方法制作心肺复苏模型,提出进针点的选择在于选择胸骨左缘第4肋间和胸骨右缘第3肋间作为进针点,是因为这两点可以肯定在心脏的绝对浊音界之内,因而是安全的。但要注意由于右侧心脏绝对浊音界几乎与胸骨右缘平齐,因而右侧导电细针一定要紧贴胸骨边缘进针方可避免伤及肺脏[14]。实验中笔者发现大鼠的胸壁肌层较厚,肋骨相对难以触及,骨性标志不甚明显,导电极难以透过胸壁准确到达心外膜上,因此在实验中给予改良,根据观察到的大鼠解剖后心脏和胸骨之间的定位关系,采用更加精确的定位点方式指导进针,进一步避免了肺部的损伤。本研究选用的是(350±30)g成年雄性SD大鼠,对于针灸针刺入点的选择可以采用如前所述的定位方法。经本实验观察,进针深度为1.5 cm最为合适,过深容易刺伤心肌,过浅则电刺激不能到达心外膜导致所需的诱颤电流过大。此外,本研究也对(450±30)g的SD大鼠进行了定位,其定位点稍有改变。对于(450±30)g的大鼠,同样是在大鼠的前正中线上以胸骨顶端为零点O1,向下定位3.7 cm的点A1;再以A1点为零点,向左定位1.5 cm的点B1,向右定位0.6 cm的点C1。则B1、C1两点即为针灸针刺入的点,由于(450±30)g大鼠的胸壁肌层更厚,进针深度则调整为2 cm左右, 方向不变。按照这种定位方法,进针均可到达心外膜,极少数情况下,由于SD大鼠的个体差异性,对心外膜的电刺激不够敏感,不能在10 s以内血压降到25 mmHg以下时,需要调整针灸针刺入的点,考虑到胸骨中段以上有大血管,作为刺入点极不安全,无论怎么调整针灸针刺入的点都不应该在胸骨中段以上,笔者在定位的点周围稍作调整,取得了不错的效果。操作中有1只大鼠在针灸针刺入时血压下降至40 mmHg,心率减慢至142次/min,立即拔出针灸针,其心率血压又迅速回复至正常水平(血压120 mmHg, 心率254次/min),反复几次均是如此,于是暂停针灸针的刺入步骤,追加麻药,让其平稳20 min。因在心脏区域进针,考虑针尖可能扎到心脏传导束支,刺激心脏传导系统影响到血压和心率[15-16],同时考虑有个体敏感性的差异,操作中,笔者更换了新的针灸针,稍微调整了其刺入的位置和方向,再次进针,没有出现心率和血压大幅下降的情况,诱颤过程顺利。
本次实验全部大鼠均ROSC,尸体解剖没有发现肉眼可见的心外膜下出血和肺部损伤情况,说明本方法造模稳定可靠,它与经右室心内膜电刺激诱颤相比,不需要经颈外静脉置管,减少了术中手术损伤,也不需要导丝和刺激电极,因此更加简单易行,对术者操作要求较低,值得在心肺复苏基础研究中推广。
| [1] | Benjamin EJ, Blaha MJ, Chiuve SE, et al. Heart disease and stroke statistics-2017 Update: a report from the American Heart Association[J]. Circulation, 2017, 135(10): e146-603. DOI:10.1161/CIR.0000000000000485 |
| [2] | Zipes DP, Camm AJ, Borggrefe M, et al. ACC/AHA/ESC 2006 Guidelines for Management of Patients With Ventricular Arrhythmias and the Prevention of Sudden Cardiac Death: a report of the American College of Cardiology/American Heart Association Task Force and the European Society of Cardiology Committee for Practice Guidelines (writing committee to develop Guidelines for Management of Patients With Ventricular Arrhythmias and the Prevention of Sudden Cardiac Death): developed in collaboration with the European Heart Rhythm Association and the Heart Rhythm Society[J]. Circulation, 2006, 114(10): e385-484. DOI:10.1161/CIRCULATIONAHA.106.178233 |
| [3] | Idris AH, Becker LB, Ornato JP, et al. Utstein-style guidelines for uniform reporting of laboratory CPR research. A statement for healthcare professionals from a Task Force of the American Heart Association, the American College of Emergency Physicians, the American College of Cardiology, the European Resuscitation Council, the Heart and Stroke Foundation of Canada, the Institute of Critical Care Medicine, the Safar Center for Resuscitation Research, and the Society for Academic Emergency Medicine[J]. Resuscitation, 1996, 33(1): 69-84. DOI:10.1016/S0300-9572(96)01055-6 |
| [4] | Vognsen M, Fabian-Jessing BK, Secher N, et al. Contemporary animal models of cardiac arrest: A systematic review[J]. Resuscitation, 2017, 113: 115-123. DOI:10.1016/j.resuscitation.2017.01.024 |
| [5] | 陈寿权, 李章平, 王姗姗, 等. 窒息法致大鼠心脏骤停模型复苏的影响因素[J]. 中华急诊医学杂志, 2005, 14(10): 814-817. |
| [6] | 陈锋, 林庆明, 唐夏泓, 等. 骨髓间充质干细胞移植修复心搏骤停后大鼠海马神经元损伤[J]. 中华急诊医学杂志, 2017, 26(4): 405-409. DOI:10.3760/cma.j.issn.1671-0282.2017.04.010 |
| [7] | 何宇敏, 赵燊, 黄子通, 等. 窒息法与室颤法复苏模型心脏损伤的比较研究[J]. 中华急诊医学杂志, 2015, 24(1): 28-32. DOI:10.3760/cma.j.issn.1671-0282.2015.01.009 |
| [8] | Boddicker KA, Zhang Y, Zimmerman MB, et al. Hypothermia improves defibrillation success and resuscitation outcomes from ventricular fibrillation[J]. Circulation, 2005, 111(24): 3195-3201. DOI:10.1161/CIRCULATIONAHA.104.492108 |
| [9] | Weihs W, Warenits AM, Ettl F, et al. Reduced long-term memory in a rat model of 8 minutes ventricular fibrillation cardiac arrest: a pilot trial[J]. BMC Vet Res, 2016, 12(1): 103. DOI:10.1186/s12917-016-0740-6 |
| [10] | Budhram GR, Mader TJ, Lutfy L, et al. Left ventricular thrombus development during ventricular fibrillation and resolution during resuscitation in a swine model of sudden cardiac arrest[J]. Resuscitation, 2014, 85(5): 689-693. DOI:10.1016/j.resuscitation.2014.01.030 |
| [11] | Chen MH, Liu TW, Xie L, et al. Ventricular fibrillation induced by transoesophageal cardiac pacing: a new model of cardiac arrest in rats[J]. Resuscitation, 2007, 74(3): 546-551. DOI:10.1016/j.resuscitation.2007.01.039 |
| [12] | 左艳芳, 宋凤卿, 陈蒙华, 等. WIN55, 212-2在心肺复苏后对神经细胞凋亡的作用[J]. 中华急诊医学杂志, 2016, 25(4): 455-459. DOI:10.3760/cma.j.issn.1671-0282.2016.04.012 |
| [13] | Yoshioka K, Amino M, Usui K, et al. Nifekalant hydrochloride administration during cardiopulmonary resuscitation improves the transmural dispersion of myocardial repolarization: experimental study in a canine model of cardiopulmonary arrest[J]. Circ J, 2006, 70(9): 1200-1207. DOI:10.1253/circj.70.1200 |
| [14] | Lin JY, Liao XX, Li H, et al. Model of cardiac arrest in rats by transcutaneous electrical epicardium stimulation[J]. Resuscitation, 2010, 81(9): 1197-1204. DOI:10.1016/j.resuscitation.2010.05.019 |
| [15] | 葛均波, 徐永健. 内科学[M]. 北京: 人民卫生出版社, 2013: 177. |
| [16] | Saksena S, Camm AJ. Electrophysiological Disorders of the Heart[M]. 北京: 北京大学医学出版社, 2007: 167-182. |
 2018, Vol. 27
2018, Vol. 27




