百草枯(paraquat,PQ), 又称克无踪、敌草快, 是一种使用非常广泛的季胺类高效能除草剂。因其除草效果好且对环境几乎无污染,在世界农业领域尤其在亚洲国家应用广泛,因此自服及误服中毒常有发生。百草枯中毒后对皮肤、肝脏、肺脏、肾脏等全身多器官均有不同程度的损伤, 其中以肺脏中毒损伤最为突出,这可能与百草枯可经肺泡Ⅱ型上皮细胞的多胺类物质摄取途径被主动摄取有关[1]。肝X受体(liver X receptors, LXRs)属核受体超家族的配体激活型转录因子,过去认为肝X受体主要调节胆固醇代谢平衡,同时也参与调节肝脏脂肪生成[2]。研究表明,肝X受体能通过多种途径减轻急性肺损伤[3-4]。本研究采用LXRs激动剂GW3965干预百草枯染毒小鼠,然后观察其对百草枯诱导的急性肺损伤的改善情况,并进一步研究其可能的作用机制。
1 材料与方法 1.1 动物分组与处理本实验采用SPF级雄性c57小鼠,体质量18~22 g,由中国医科大学实验动物中心提供,动物检疫合格证号:SCXK(京)2014-0008。40只雄性c57小鼠随机(随机数字法)分为4组, 每组10只小鼠。对照组:0.1 mL生理盐水腹腔注射,10 min后再次0.1 mL生理盐水腹腔注射;百草枯染毒组:百草枯28 mg/kg腹腔注射,10 min后0.1 mL生理盐水腹腔注射;GW3965低剂量处理组:百草枯染毒后10 min给予GW3965 10 mg/kg腹腔注射;GW3965高剂量处理组:百草枯染毒后10 min给予GW3965 50 mg/kg腹腔注射。在百草枯染毒后72 h处死小鼠,收集肺组织及血液标本。
1.2 主要试剂百草枯及GW3965购自美国Sigma公司,IL-1β、TNF-αELISA试剂盒及MDA试剂盒购自南京建成生物工程研究所,p38 MAPK, Bax及Bcl-2抗体购自英国abcam公司,TUNEL试剂盒购自瑞士罗氏公司。
1.3 血清IL-1β和TNF-α测定将小鼠血液标本在4℃、10 000 r/min离心10 min,收集上清液严格按照相关ELISA试剂盒说明书操作检测血清中IL-1β和TNF-α含量。
1.4 血清MDA含量测定将小鼠血液标本在4℃、10 000 r/min离心10 min,收集上清液,采用硫代巴比妥酸法(TBA)法并严格按照试剂盒说明书操作检测血清中MDA含量。
1.5 肺湿/干质量比测定腹腔注射百草枯或生理盐水后72 h处死小鼠,分离并取出右肺中叶,称肺湿质量后将肺组织置入80℃烘箱内烘48 h后称量肺的干质量,然后用肺脏湿质量除以肺脏干质量得到肺脏湿/干质量比,以此衡量肺脏组织的水肿的程度。
1.6 肺组织病理学改变及损伤评分处死小鼠后取右肺下叶于4%多聚甲醛中固定72 h,石蜡包埋并制备石蜡切片,苏木素及伊红染色,脱水、透明、封片后在光学显微镜镜下(200倍)观察肺组织病理学改变。并按Mikawa等[5]方法进行肺损伤评分。评分标准如下:对①肺泡充血、②出血、③肺泡腔或血管壁中性粒细胞浸润或聚集、④肺泡壁增厚和(或)透明膜形成四项指标,分别依病变轻重评0 ~4分(0:无病变或非常轻微,1:轻度病变,2:中度病变,3:重度病变,4:极重度病变),各项评定分数相加为肺损伤总评分。
1.7 Western blot法检测肺组织p-p38,Bax及Bcl-2的表达水平提取肺组织蛋白并采用BCA试剂盒检测蛋白含量,取40 μg蛋白电泳、转印、封闭后分别加入p-p38(1:1 000);Bax(1:2 000);Bcl-2(1:400)一抗4℃孵育过夜。振洗后加入羊抗兔IgG-HRP(二抗) 37 ℃孵育45 min,以β-actin为内参,ECL底物发光后扫描图像,用凝胶图象处理系统(Gel-Pro-Analyzer软件)分析目标条带的吸光度值。
1.8 TUNEL检测肺组织细胞凋亡情况将固定好的肺组织标本石蜡包埋切片后按照TUNEL试剂盒说明书操作进行TUNEL染色,400倍光学显微镜下观察肺组织细胞凋亡情况。细胞核染成棕褐色或棕黄色为阳性反应,正常细胞细胞核为蓝色。在每张玻片上随机取4个视野,计算凋亡指数(AI):心肌细胞凋亡指数(%)=凋亡心肌细胞核数/总计心肌细胞核数×100%
1.9 统计学方法采用SPSS 17.0统计软件进行分析。数据均采用均数±标准差(x ± s)表示,多组间比较采用单因素方差分析(ANOVA),组间两两比较采用LSD-t法,以P < 0.05为差异具有统计学意义。
2 结果 2.1 血清及肺组织中IL-1β和TNF-α含量测定结果百草枯染毒组小鼠血清中IL-1β和TNF-α含量较对照组显著增加(P < 0.05),GW3965处理组小鼠血清中IL-1β和TNF-α含量较百草枯染毒组明显下降(P < 0.05),且下降幅度与GW3965剂量正相关(P < 0.05)。见表 1~2。
| 组别 | IL-1β (μg/L) | TNF-α (μg/L) | MDA (nmol/mL) |
| 对照组 | 24.65±1.76 | 47.60±3.84 | 3.49±0.36 |
| 百草枯染毒组 | 49.72±3.45a | 102.93±7.28a | 12.35±0.78a |
| GW3965低剂量组 | 37.18±2.46b | 88.62±5.37b | 9.48±0.74b |
| GW3965高剂量组 | 29.30±1.69bc | 62.11±4.17bc | 5.52±0.67bc |
| 注:与对照组比较,aP < 0.05;与百草枯染毒组比较,bP < 0.05;与GW3965低剂量组比较,cP < 0.05 | |||
| 组别 | IL-1β(μg/L) | TNF-α(μg/L) |
| 对照组 | 46.08±3.58 | 166.86±6.12 |
| 百草枯染毒组 | 138.84±4.57a | 340.34±8.29a |
| GW3965低剂量组 | 108.37±6.88b | 268.86±12.94b |
| GW3965高剂量组 | 90.35±4.92bc | 210.63±12.44bc |
| 注:与对照组比较,aP < 0.05;与百草枯染毒组比较,bP < 0.05;与GW3965低剂量组比较,cP < 0.05 | ||
百草枯染毒组小鼠血清中MDA含量较对照组显著增加(P < 0.05),GW3965处理组小鼠血清中MDA含量较百草枯染毒组明显下降(P < 0.05),且下降幅度与GW3965剂量正相关(P < 0.05)。见表 1。
2.3 肺湿/干质量比测定结果与对照组比较,百草枯染毒组小鼠肺湿/干质量比上升明显(P < 0.05),GW3965腹腔注射能明显抑制小鼠肺湿/干质量比上升(P < 0.05),且这一作用呈明显的剂量依赖性(P < 0.05)。见表 2。
2.4 肺组织病理学观察及肺损伤评分结果如图 1所示,对照组小鼠肺组织中肺泡结构清晰,肺泡壁薄,肺间质内无充血及炎症细胞浸润。百草枯染毒组小鼠肺组织内肺泡结构破坏严重,肺泡腔塌陷,部分肺泡腔充满粉染均质水肿液以及大量红细胞,肺泡及间质内炎症细胞浸润严重,部分有透明膜形成。GW3965处理组小鼠肺组织损伤程度明显减轻,且GW3965高剂量组效果更显著。
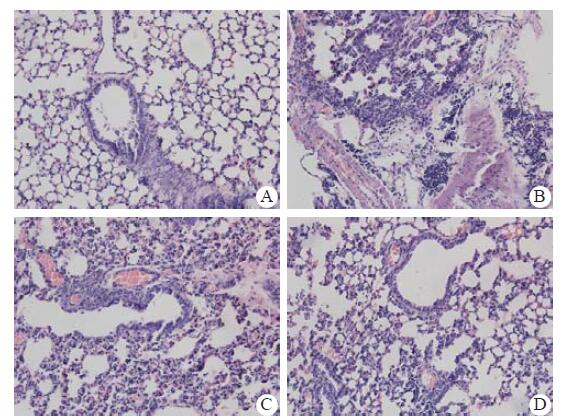
|
| A:对照组;B:百草枯染毒组;C:GW3965低剂量组;D:GW3965高剂量组 图 1 各组小鼠肺组织病理学改变 Figure 1 Pathological changes of lung tissue in mice of each group |
|
|
与对照组比较,百草枯染毒组小鼠肺损伤评分显著升高(P < 0.05),GW3965处理组小鼠肺损伤评分较百草枯染毒组明显下降(P < 0.05),且GW3965高剂量组效果更显著(P < 0.05)。见表 3。
| 组别 | 肺湿/干质量比 | 肺损伤评分 |
| 对照组 | 3.1±0.52 | 0.49±0.14 |
| 百草枯染毒组 | 8.7±0.74a | 9.2±0.82a |
| GW3965低剂量组 | 7.0±0.71b | 7.1±0.68b |
| GW3965高剂量组 | 4.8±0.36bc | 4.3±0.44bc |
| 注:与对照组比较,aP < 0.05;与百草枯染毒组比较,bP < 0.05;与GW3965低剂量组比较,cP < 0.05 | ||
百草枯染毒组小鼠p-p38 MAPK的表达明显高于对照组(P < 0.05),GW3965处理组p-p38的表达较百草枯染毒组明显下降(P < 0.05),且GW3965高剂量组效果更显著(P < 0.05)。见图 2。
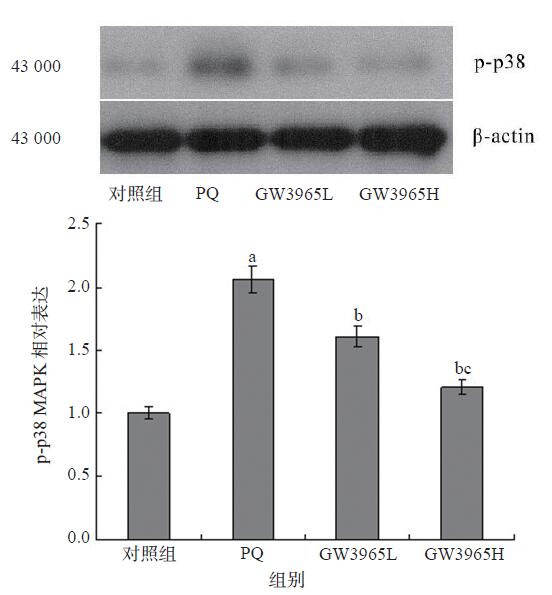
|
| GW3965L:GW3965低剂量处理组;GW3965H: GW3965高剂量处理组;与对照组比较,aP < 0.05;与百草枯染毒组比较,bP < 0.05;与GW3965低剂量组比较,cP < 0.05 图 2 p38 MAPK在肺组织的表达 Figure 2 Expression of p38 MAPK in lung tissue |
|
|
与对照组比较,百草枯染毒组小鼠Bax/Bcl-2比值显著增加(P < 0.05)。GW3965处理能有效抑制百草枯诱导的Bax/Bcl-2比值增加(P < 0.05),高剂量组抑制效果更明显(P < 0.05)。见图 3。
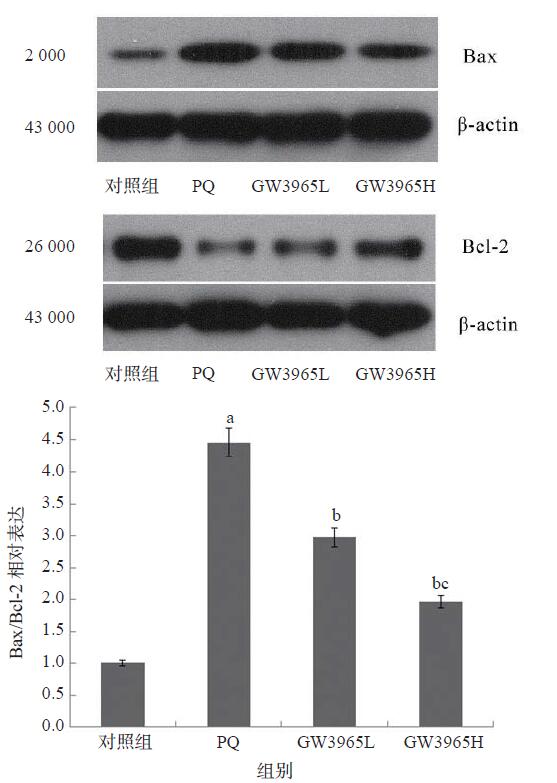
|
| GW3965L:GW3965低剂量处理组;GW3965H:GW3965高剂量处理组;与对照组比较,aP < 0.05;与百草枯染毒组比较,bP < 0.05;与GW3965低剂量组比较,cP < 0.05 图 3 Bax及Bcl-2在肺组织的表达 Figure 3 Expression of Bax and Bcl-2 in lung tissue |
|
|
百草枯染毒组小鼠凋亡指数显著高于对照组(P < 0.05),与百草枯染毒组比较GW3965处理组凋亡指数明显下降(P < 0.05),且GW3965高剂量组效果更显著(P < 0.05)。见图 4。
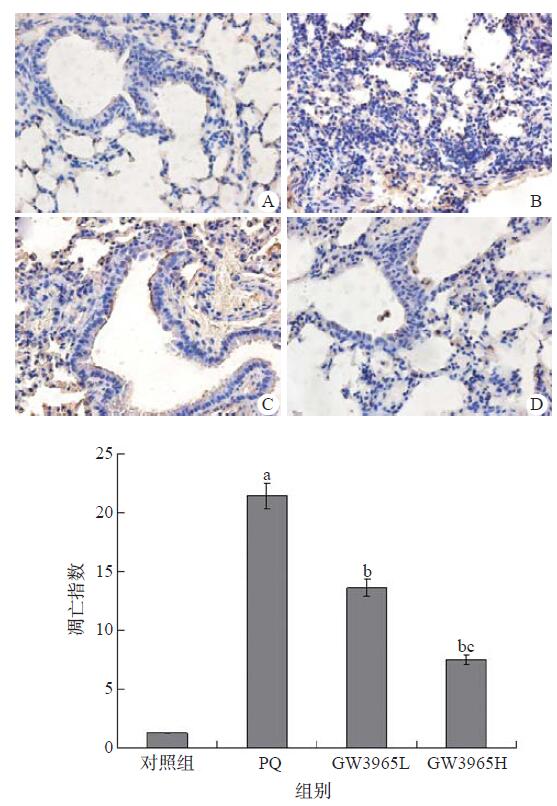
|
| GW3965L:GW3965低剂量处理组;GW3965H:GW3965高剂量处理组;与对照组比较,aP < 0.05;与百草枯染毒组比较,bP < 0.05;与GW3965低剂量组比较,cP < 0.05 图 4 TUNE染色检测各组小鼠肺组织细胞凋亡比较 Figure 4 Comparison of apoptosis in lung tissues of mice in each group by TUNEL staining |
|
|
百草枯进入体内后通过多胺摄取途径可迅速在肺组织内蓄积[6],在中毒早期即可引起急性肺损伤(ALI)及急性呼吸窘迫综合征(ARDS),在中后期常常出现进行性加重的肺纤维化,患者通常死于顽固性低氧血症。目前,百草枯的中毒机制尚不完全清楚,被学术界广泛认可的一种学说是百草枯进入体内后可通过一系列氧化还原反应诱导大量活性氧(reactive oxygen species ROS)的产生,如超氧阴离子(O2-),过氧化氢(H2O2)及羟自由基(HO·)等[7]。大量活性氧的产生攻击生物膜磷脂中的多聚不饱和脂肪酸,引发脂质过氧化反应损伤组织细胞并产生脂质过氧化代谢产物MDA[8]。同时大量产生的ROS可以激活p38 MAPK信号通路从而诱导大量促炎因子的产生并诱导细胞凋亡,进一步加重肺组织损伤[9]。
MAPK是一种广泛存在于哺乳动物体内的一大类丝/苏氨酸蛋白激酶,MAPK家族的信号通路主要包括细胞外信号调控的蛋白激酶(ERK)、c-Jun N端激酶(JNK)和p38 MAPK[10]。多种理化因素可以有效激活p38 MAPK信号通路,如氧化应激、紫外线、缺氧、炎症因子等。p38 MAPK激活后可通过调控AP-1、NF-κB等下游转录因子诱导多种炎症因子如TNF-α、IL-1、IL-6和IL-8等的产生及释放。同时p38 MAPK还可通过激活下游促炎基因iNOS和COX-2的表达介导中性粒细胞的激活进一步加重炎症反应[11]。另外,p38 MAPK激活后还可参与凋亡信号通路的调控。Owens等[12]报道p38 MAPK激活后可明显上调促凋亡基因Bax的表达但同时下调抑凋亡基因Bcl-2的表达,Bax/Bcl-2比值的升高激活线粒体凋亡途径,诱导线粒体跨膜电位下降并释放细胞色素c等促凋亡蛋白从而最终导致细胞凋亡。
肝X受体(liver X receptors, LXRs)属核受体超家族的配体激活的转录因子,其成员有LXRα(NR1H3)和LXRβ(NR1H2),LXRα主要在肝、肾、脾、肠等组织以及巨噬细胞上表达,而LXRβ在几乎所有组织细胞中表达,人工合成的GW3965、TO901317是其特异的激活剂[2]。过去认为肝X受体主要调节胆固醇的输出、胆汁酸的生成及脂质转运蛋白的合成, 从而调控脂质的动态平衡[13-14]。近年来随着对肝X受体的深入研究发现,其作用并不只局限于对脂肪及胆固醇的合成及代谢的调控,在调控炎症[15-16]及细胞凋亡[17-18]中也发挥重要作用。GW3965作为LXRs特异性激动剂被证实能有效抑制IgE及内毒素诱导的小鼠肥大细胞释放IL-1及IL-6等炎症因子[19]。在体内试验中GW3965也被证实能有效抑制小鼠心肌组织的炎症反应[20]。本实验证实,小鼠百草枯染毒后肺组织中p38 MAPK显著过表达,IL-1β,TNF-α和MDA含量较对照组显著增加,细胞凋亡指数显著增高,肺组织损伤明显。肝X受体激动剂GW3965腹腔注射能明显抑制p38 MAPK的表达,降低血清及肺组织中IL-1β,TNF-α和MDA含量,减轻细胞凋亡及肺组织损伤情况,GW3965这一保护作用呈明显的剂量依赖性。
综上所述,肝X受体激动剂GW3965能有效抑制百草枯诱导的小鼠肺组织炎症反应及细胞凋亡从而减轻小鼠急性肺损伤,其机制可能与肝X受体激活后抑制p38 MAPK信号通路的表达有关。本实验为临床治疗百草枯中毒提供了新的思路及可能的治疗靶点。
| [1] | Hoet PH, Lewis CP, Demedts M, et al. Putrescine and paraquat uptake inhuman lung slices and isolated type Ⅱ pneumocytes[J]. Biochem Pharmacol, 1994, 48(3): 517-524. DOI:10.1016/0006-2952(94)90281-X |
| [2] | Gabbi C, Warner M, Gustafsson JÅ. Action mechanisms of Liver X Receptors[J]. Biochem Biophys Res Commun, 2014, 446(3): 647-650. DOI:10.1016/j.bbrc.2013.11.077 |
| [3] | Birrell MA, Catley MC, Hardaker E, et al. Novel role for the liver X nuclear receptor inthe suppression of lung inflammatory responses[J]. J Biol Chem, 2007, 282(44): 31882-31890. DOI:10.1074/jbc.M703278200 |
| [4] | Smoak K, Madenspacher J, Jeyaseelan S, et al. Effects of liver X receptor agonist treatment on pulmonary inflammation and host defense[J]. J Immunol, 2008, 180(5): 3305-3312. DOI:10.4049/jimmunol.180.5.3305 |
| [5] | Mikawa K, Nishina K, Takao Y, et al. ONO-1714, a nitric oxidesynthase inhibitor, attenuates endotoxin-induced acute lunginjury in rabbits[J]. Anesth Analg, 2003, 97(6): 1751-1755. DOI:10.1213/01.ANE.0000086896.90343.13 |
| [6] | Smith LL, Lewis CP, Wyatt I, et al. The importance of epithelial uptake systems in lung toxicity[J]. Environ Health Perspect, 1990, 85: 25-30. DOI:10.2307/3430662 |
| [7] | Dinis-Oliveira RJ, Duarte JA, Sa'nchez-Navarro A, et al. Paraquat poisonings: mechanisms of lung toxicity, clinical features, and treatment[J]. Crit Rev Toxicol, 2008, 38(1): 13-71. DOI:10.1080/10408440701669959 |
| [8] | Zhang HL, Liu YF, Luo XR, et al. Saturated hydrogen saline protects rats from acute lung injury induced by paraquat[J]. World J Emerg Med, 2011, 2(2): 149-153. DOI:10.5847/wjem.j.1920-8642.2011.02.013 |
| [9] | Chen Z, Gibson TB, Robinson F, et al. MAP kinases[J]. Chem Rev, 2001, 101(8): 2449-2476. DOI:10.1021/cr000241p |
| [10] | Roux PP, Blenis J. ERK and p38 MAPK-activated protein kinases: a family of protein kinases with diverse biological functions[J]. Microbiol Mol Biol Rev, 2004, 68(2): 320-344. DOI:10.1128/MMBR.68.2.320-344.2004 |
| [11] | Dong X, Liu Y, Du M, et al. p38 mitogen-activated protein kinase inhibition attenuates pulmonary inflammatory response in a rat cardiopulmonary bypass model[J]. Eur J Cardiothorac Surg, 2006, 30(1): 77-84. DOI:10.1016/j.ejcts.2006.02.040 |
| [12] | Owens TW, Valentijn AJ, Upton JP, et al. Apoptosis commitment and activation of mitochondrial Bax during anoikis is regulated by p38MAPK[J]. Cell Death Differ, 2009, 16(11): 1551-1562. DOI:10.1038/cdd.2009.102 |
| [13] | Willy PJ, Umesono K, Ong ES, et al. LXR, a nuclear receptor that defines a distinct retinoid response pathway[J]. Genes Dev, 1995, 9(9): 1033-1045. DOI:10.1101/gad.9.9.1033 |
| [14] | Lehmann JM, Kliewer SA, Moore IB, et al. Activation of the nuclear receptor LXR by oxysterols defines a new hormone response pathway[J]. J Biol Chem, 1997, 272(6): 3137-3140. DOI:10.1074/jbc.272.6.3137 |
| [15] | Zelcer N, Tontonoz P. Liver X receptors as integrators of metabolicand inflammatory signaling[J]. J Clin Invest, 2006, 116(3): 607-614. DOI:10.1172/JCI27883 |
| [16] | Myhre AE, Agren J, Dahle MK, et al. Liver X receptor is a key regulator of cytokine release in human monocytes[J]. Shock, 2008, 29(4): 468-474. DOI:10.1097/shk.0b013e31815073cb |
| [17] | Joseph SB, Bradley MN, Castrillo A, et al. LXR-dependent gene expression is importantfor macrophage survival and the innate immune response[J]. Cell, 2004, 119(2): 299-309. DOI:10.1016/j.cell.2004.09.032 |
| [18] | Valledor AF, Hsu LC, Ogawa S, et al. Activation of liver X receptors and retinoid X receptors prevents bacterial-induced macrophage apoptosis[J]. Proc Natl Acad Sci U S A, 2004, 101(51): 17813-17818. DOI:10.1073/pnas.0407749101 |
| [19] | Nunomura S, Okayama Y, Matsumoto K, et al. Activation of LXRs using the synthetic agonist GW3965 represses the production of pro-inflammatory cytokines by murine mast cells[J]. Allergol Int, 2015, 64(Suppl): S11-17. DOI:10.1016/j.alit.2015.03.001 |
| [20] | He Q, Pu J, Yuan A, et al. Liver X receptor agonist treatment attenuates cardiac dysfunction in type 2 diabetic db/db mice[J]. Cardiovasc Diabetol, 2014, 13(1): 149. DOI:10.1186/s12933-014-0149-0 |
 2018, Vol. 27
2018, Vol. 27




