全氟异丁烯(perfluoroisobutylene,PFIB)是氟聚合物(如:聚四氟乙烯,又名特氟隆)工业生产过程中一种常见的副产物,全氟丁烯的一种异构体,多见于火灾等意外事故生成的有毒烟雾中,可穿透防毒面具[1]。研究表明PFIB少量吸入就可产生急性肺损伤(acute lung injury,ALI),严重者可出现肺水肿乃至死亡[2, 3]。人体内的T细胞分为两个亚群[4],Th1细胞为炎症促进细胞[5],主要产生细胞因子IL-2、肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)和IFN-γ;Th2细胞主要产生IL-4、IL-5等多种白细胞介素。IFN-γ是典型的Th1类细胞因子[5],具有抑制成纤维细胞增生及胶原聚集等作用,并且可以拮抗Th2类细胞因子IL-4、TGF-β(转化生长因子-β)的作用[6]。IL-4是由单核细胞、淋巴细胞产生和释放的抗炎细胞因子,能够抑制LPS诱导的炎性细胞因子生成[7]。TGF-β作为一种重要的细胞因子,通过抑制介导巨噬细胞活化的炎性介质如TNF-α和MMP-12以及趋化因子的表达从而抑制其活化[8-9]。IFN-γ和IL-4分别是Th1和Th2的代表性细胞因子,以IFN-γ/IL-4表示Th1/Th2的平衡状态。正常情况下,机体中Th1/Th2细胞处于相对平衡的状态,但机体发生功能异常时,Th1/Th2之间的平衡状态被打破,很可能造成人体细胞因子网络的动态平衡被破坏,进而引起许多疾病的产生和发展[10]。鉴于此,本文通过研究在PFIB吸入性ALI中TGF-β、IFN-γ和IL-4的变化以及IFN-γ和IL-4分别代表的Th1和Th2平衡关系的规律,为进一步从免疫水平治疗PFIB吸入性肺损伤提供研究依据。
1 材料与方法 1.1 试剂与仪器PFIB(上海有机氟材料研究所,纯度:98%);磷脂检测试剂盒(Wako公司);IL-4 ELISA试剂盒(Sigma);IFN-γ ELISA试剂盒(Sigma);TGF-β ELISA试剂盒(R & D)。
1.2 方法与分组 1.2.1 实验动物SPF/VAF级Wistar雄性大鼠,体质量180~220 g,由北京维通利华实验动物技术有限公司提供。动物实验前先适应性喂养2~3 d,自由饮食饮水,每笼饲养6只,于染毒前禁食1夜。
1.2.2 分组PFIB吸入性肺损伤实验:实验设7个处理组,即健康对照组(NC组)与PFIB染毒后3、6、12、24、72和168 h组(即3 h组、6 h组、12 h组、24 h组、72 h和168 h组),每组6只大鼠,每天染毒前、后均称动物体质量并记录,分别在染毒后3 h、6 h、12 h、24 h、72 h和168 h时处死大鼠。
1.3 观测指标 1.3.1 肺系数测定在PFIB染毒后指定时间点,动物于麻醉后经腹主动脉放血处死。待血液排净后,打开胸腔,分离出气管并于气管分叉处结扎右支气管,将右气管连同全肺及右肺副叶全部取出,剔除肺外组织,生理氯化钠漂洗,滤纸吸干后测量湿肺净质量。肺系数:湿肺/体重比=(湿肺净重/体质量)×100%。
1.3.2 肺组织匀浆和BALF的制备及蛋白和磷脂含量测定如上所述,在取出右肺后,经左支气管插管,参照文献[11]所述方法制备支气管肺泡灌洗液(BALF)。右肺(副叶除外)用于制备10%肺组织匀浆。Lowry法测BALF中总蛋白含量,采用Wako公司磷脂试剂盒测定磷脂含量。
1.3.3IL-4, IFN-γ和TGF-β渐变采用ELISA试剂盒检测血浆与BLAF中的IL-4、IFN-γ和肺组织匀浆的TGF-β。
1.4 统计学方法采用方差分析进行统计分析;计量资料采用(x±s)表示, 多组间两两比较采用方差分析(SNK-q检验),以P < 0.05为差异有统计学意义。
2 结果 2.1 PFIB染毒对大鼠肺组织大体病理学的影响在PFIB暴露后既定时间点解剖动物时,肉眼可见,随着染毒后时间延长,实验动物肺组织逐渐出现肺部瘀血、水肿,并进行性加剧,至染毒后24 h,受试动物全肺呈现弥漫性水肿、瘀血表现,其后随着肺水肿逐渐恢复,肺部瘀血、水肿等表现逐渐减少,但肺体积仍较健康对照组为大。
2.2 PFIB染毒对大鼠肺系数的影响在PFIB暴露后6 h,即可观察到湿肺质量较健康对照组明显升高,并持续升高至染毒后72 h,在暴露后168 h有所回落(图 1A);肺系数的变化与肺质量的变化规律一致(图 1B)。
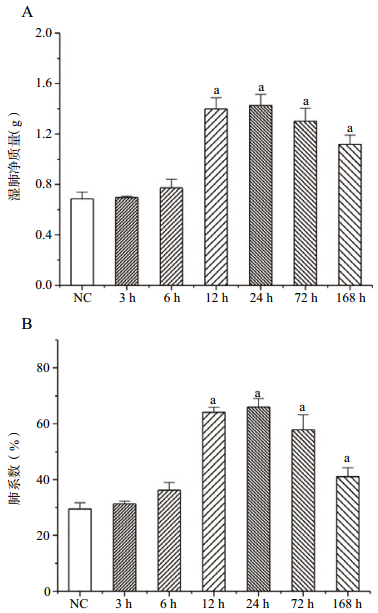
|
| NC(健康对照组);与NC组比较,aP<0.01;bP<0.01 图 1 PFIB染毒后大鼠肺质量与肺系数变化 |
|
|
BALF中蛋白质和磷脂的含量变化(图 2)与肺质量变化相似,不同之处在于变化更加显著,提示PFIB吸入暴露后肺血气屏障通透性进行性升高,肺表面活性物质损失进行性加剧。
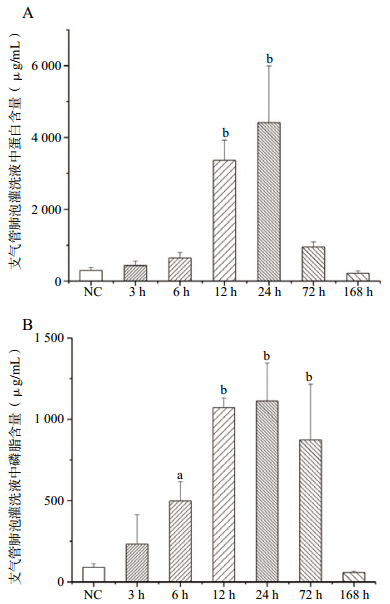
|
| NC(健康对照组);与NC组比较,aP<0.005;bP<0.01; 图 2 PFIB染毒后大鼠肺匀浆及BALF中蛋白质和磷脂的含量变化 |
|
|
在PFIB暴露后,血浆中IFN-γ含量进行性升高,至暴露后24 h达峰,其后缓慢降低至染毒后168 h,基本恢复至正常水平(图 3A)。这一变化与前述肺损伤(肺质量、肺系数、BALF的蛋白质和磷脂含量)严重程度的变化在时间上相吻合。而血浆中的IL-4含量极低,变化较小(图 3B),因此IFN-γ/IL-4的平衡关系主要以IFN-γ变化为主。
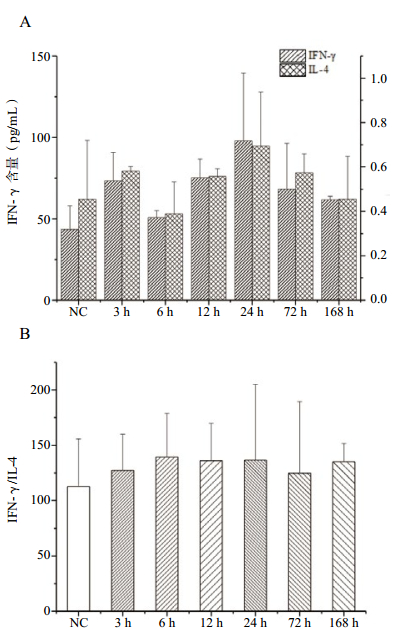
|
| NC(健康对照组);与NC组比较 图 3 PFIB染毒后大鼠血浆中IFN-γ和IL-4含量变化 |
|
|
在PFIB暴露后,BALF中IFN-γ含量进行性降低,变化非常显著,至暴露后24 h达谷,其后至染毒后72 h,缓慢升高,仍远低于正常水平(图 4A)。这一变化与前述肺损伤(肺质量、肺系数、BALF中蛋白质和磷脂含量)严重程度的变化在时间上相吻合,但是趋势相反。而BALF中的IL-4(图 4A)含量变化趋势与IFN-γ的相似,IFN-γ/IL-4(图 4B)进行性降低,变化显著,至暴露后24 h达谷值,其后至染毒后168 h,缓慢升高,仍远低于正常水平。
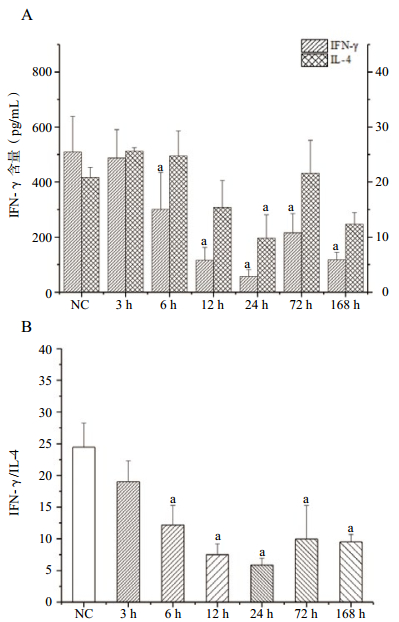
|
| NC(健康对照组);与NC组比较,aP<0.01 图 4 PFIB染毒后大鼠血浆中IFN-γ和IL-4含量变化 |
|
|
在PFIB暴露后,肺组织匀浆中TGF-β含量进行性降低,至暴露后72 h到谷,其后缓慢升高(图 5)。这一变化与前述肺损伤(肺质量、肺系数、BALF中蛋白质和磷脂含量)严重程度的变化在时间上基本吻合。
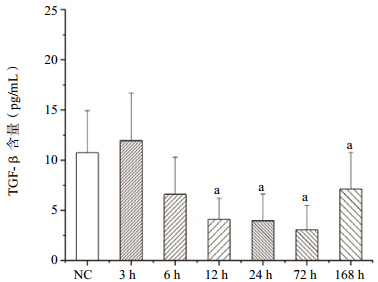
|
| NC(健康对照组);与NC组比较,aP<0.01 图 5 PFIB染毒后大鼠肺组织匀浆中TGF-β含量变化 |
|
|
既往研究显示在急性肺损伤组织中由激活的炎症细胞所释放的各种组织损伤因子中,IFN-γ和IL-4在急性肺损伤发病过程中的不同时期发挥着关键性的作用,同时以IFN-γ/IL-4比值来衡量急性肺损伤中Th1/Th2类细胞之间的平衡关系。在LPS诱导的C57BL小鼠ALI中,Li等[12]研究发现,IFN-γ释放减少而IL-4的释放增加,Th1/Th2之间的平衡呈现出Th2方向的偏移状态;与此发现略有不同,本研究在PFIB诱导的ALI中,发现IFN-γ与IL-4的释放均表现为减少,但是Th1/Th2之间的平衡依旧呈现出Th2方向的偏移状态;我们课题组研究发现PFIB诱导ALI早期(30 min~4 h),尽管没有明显的肺水肿,但透射电镜观察肺气血屏障的主要功能细胞出现不同程度的凋亡,这也解释IFN-γ与IL-4的释放减少[13]。
纤维化是一个慢性的、长期的过程。TGF-β作为具有多种功能的Th2细胞因子和纤维化进程中的重要细胞因子,具有诱导肺组织结构重塑、刺激肺成纤维细胞增生的作用,并伴有胶原和纤维素沉积增多,引起肺泡壁基底膜增厚,促进肺纤维化形成。本研究发现PFIB亚致死剂量吸入暴露后,肺组织中TGF-β含量呈现先下降后升高的变化,提示出现组织损伤-修复的变化,但是结合前期对单次PFIB暴露所致ALI的长期观察研究[14-15]发现PFIB暴露所致ALI未发生肺纤维化(pulmonary fibrosis, PF),尚需开展长期研究以进一步阐明TGF-β在PFIB暴露所致急性肺损伤和修复过程中的作用。
综上所述,在急性肺损伤中,不同时期的IFN-γ和IL-4释放变化以及所代表的Th1/Th2细胞因子之间平衡的失衡是肺损伤形成的一个关键环节,防止Th1/Th2失衡发展成为一种针对ALI的临床治疗方法。课题组前期研究表明,在PFIB吸入暴露后,中性粒细胞在肺内聚集,活化,释放蛋白酶、细胞因子,从而导致血管通透性增加,损伤肺泡上皮屏障,导致Ⅰ型、Ⅱ型肺泡细胞的损伤坏死,肺气血屏障通透性升高,形成肺损伤,进而发展成为肺水肿。
| [1] | Luzina EL, Popov AV. Synthesis of 3, 3, 3-trifluoroethyl isocyanate, carbamate and ureas. Anticancer activity evaluation of N-(3, 3, 3-trifluoroethyl)-N'-substituted ureas[J]. J Fluor Chem, 2015, 176(1): 82-88. DOI:10.1016/j.jfluchem.2015.06.005 |
| [2] | Luh SP, Chiang CH. Acute lung injury/acute respiratory distress syndrome (ALI/ARDS): the mechanism, present strategies and future perspectives of therapies[J]. J Zhejiang Univ Sci B, 2007, 8(1): 60-69. DOI:10.1631/jzus.2007.B0060 |
| [3] | Butt Y, Kurdowska A, Allen TC. Acute lung injury: a clinical and molecular review[J]. Arch Pathol Lab Med, 2016, 140(4): 345-350. DOI:10.5858/arpa.2015-0519-RA |
| [4] | Romagnani S. Human TH1 and TH2 subsets: doubt no more[J]. Immunol Today, 1991, 12(8): 256-257. DOI:10.1016/0167-5699(91)90120-I |
| [5] | Cope A, Le Friec G, Cardone J, et al. The Th1 life cycle: molecular control of IFN-gamma to IL-10 switching[J]. Trends Immunol, 2011, 32(6): 278-286. DOI:10.1016/j.it.2011.03.010 |
| [6] | 谷秀, 刘宏博, 张晓晔, 等. Th1/Th2细胞因子的平衡与实验性肺间质纤维化[J]. 山东医药, 2010, 50(24): 43-44. DOI:10.3969/j.issn.1002-266X.2010.24.017 |
| [7] | Jakubzick C, Kunkel SL, Puri RK, et al. Therapeutic targeting of IL-4- and IL-13-responsive cells in pulmonary fibrosis[J]. Immunol Res, 2004, 30(3): 339-349. DOI:10.1385/IR.30.3.339 |
| [8] | Wang Y, Ait-Oufella H, Herbin O, et al. TGF-beta activity protects against inflammatory aortic aneurysm progression and complications in angiotensin Ⅱ-infused mice[J]. J Clin Invest, 2010, 120(2): 422-432. DOI:10.1172/JCI38136 |
| [9] | Lee C M, Park J W, Cho W K, et al. Modifiers of TGF-beta1 effector function as novel therapeutic targets of pulmonary fibrosis[J]. Korean J Intern Med, 2014, 29(3): 281-290. DOI:10.3904/kjim.2014.29.3.281 |
| [10] | 姚金晶, 陈宜涛. Th1/Th2平衡调节与疾病发生的研究进展[J]. 现代生物医学进展, 2009, 9(13): 2597-2600. |
| [11] | 赵建, 丁日高, 阮金秀, 等. 四氢吡咯二硫代氨基甲酯联合应用盐酸四环素对抗全氟异丁烯吸入性急性肺损伤[J]. 中国工业医学杂志, 2007(6): 370-372. DOI:10.3969/j.issn.1002-221x.2010.06.003 |
| [12] | Li H, Du S, Yang L, et al. Rapid pulmonary fibrosis induced by acute lung injury via a lipopolysaccharide three-hit regimen[J]. Innate Immun, 2009, 15(3): 143-154. DOI:10.1177/1753425908101509 |
| [13] | 孟革, 赵建, 丁日高, 等. 全氟异丁烯诱发急性肺损伤后肺血气屏障病理学及超微结构的变化[C]. 中国毒理学会第五次全国学术大会, 贵阳, 2009. |
| [14] | 刘芳, 张东泉, 许兴兴, 等. 低剂量全氟异丁烯致大鼠急性肺损伤及清开灵早期治疗长期效果观察[J]. 中国药理学与毒理学杂志, 2016, 30(5): 517-525. |
| [15] | 孟革, 王和枚, 赵建, 等. 全氟异丁烯单次暴露诱发小鼠急性肺损伤的长期效应(英文)[J]. 中国药理学与毒理学杂志, 2011, 25(6): 525-531. |
 2018, Vol. 27
2018, Vol. 27




