心脏骤停(cardiac arrest, CA)复苏后,机体出现以心肺复苏(cardiopulmonary resuscitation, CPR)后心脑损伤为主的多脏器功能不全,是自主循环恢复(return of spontaneous circulation, ROSC)后患者死亡的重要原因[1]。其中,肠道作为CA后最早发生缺血性损害的脏器之一,已被认为是ROSC后多器官功能障碍综合征发生的始动部位与中心器官[2-3]。CA复苏所致的肠缺血-再灌注损伤,造成肠黏膜屏障破坏,致使大量细菌与毒素吸收入血,刺激肿瘤坏死因子-α(tumor necrosis factor-α, TNF-α)产生,活化中性粒细胞,诱发和释放大量炎性介质,出现全身炎症反应综合征,最终导致多器官功能障碍综合征[1, 4]。
研究证实,治疗性亚低温具有包括肠道在内的ROSC后多器官保护作用。系列动物实验显示,亚低温可以通过减轻肠黏膜组织炎症反应与氧化应激损伤、改善能量代谢等途径,促进ROSC后肠黏膜屏障功能的恢复[5-7]。另有研究发现,通过腹腔灌注低温液体以快速诱导低温,能够产生优于传统体表降温法的ROSC后肠保护效应[8]。因而优化低温诱导速率,可能是加强ROSC后亚低温肠保护作用的重要途径。
近来研究报道,食道作为毗邻心脏与大血管的器官,在其内留置降温导管以灌注循环冰水,能实现3.0℃/h的快速降温效果[9]。另外,食道降温导管制作方便、成本低、留置简便、无创,与传统冰毯仪连接即可使用,非常利于临床推广。当前研究中,我们自主研发新型食道降温导管,选择与人类生理参数接近的猪作为实验动物,利用猪CPR模型系统地评价经食道诱导低温的效果及其对ROSC后肠黏膜损伤的保护效应,为其临床转化提供依据。
1 材料与方法 1.1 实验动物及分组国产健康雄性白猪27头,体质量(36±2)kg,购自上海甲干生物科技有限公司,动物合格证号SCXK(沪)2015-0005。所有动物标准饲料喂养,自由饮水。采用随机数字表法分为3组(每组n=9):常温组(NT组)、体表降温组(SC组)与食道降温组(EC组)。NT组利用冰毯仪全程维持正常体温(38.0±0.5)℃。复苏成功后5 min,EC组与SC组外接冰毯仪,分别经食道降温导管与体表冰毯进行降温,目标温度33 ℃,持续至复苏后24 h,再以1 ℃/h复温5 h。
1.2 动物准备实验前,动物禁食12 h,不禁水。实验中,氯胺酮(鄞州医药药材有限公司,宁波)20 mg/kg肌肉注射诱导麻醉后,戊巴比妥钠(Merck公司,美国)30 mg/kg经耳缘静脉实施静脉全麻,此后戊巴比妥钠8 mg/(kg·h)维持麻醉状态,芬太尼(鄞州医药药材有限公司,宁波)2 μg/(kg·h)持续镇痛治疗。静脉全麻后,经口长直喉镜(Welch Allyn公司,美国)辅助气管插管,连接ETCO2/SPO2监测仪(PMSH-300,三埃弗公司,上海)和呼吸机(SynoVent E5,迈瑞公司,深圳),进行机械通气。呼吸机参数设置为潮气量12 mL/kg、峰流速40 L/min和FiO2 21%。通过调节呼吸机呼吸频率维持呼气末二氧化碳分压(PETCO2)在35~40 ㎜ Hg。通过双侧上下肢心电电极,进行常规的Ⅱ导联心电图(BeneView T6,迈瑞公司,深圳)连续监测。
暴露右股动脉,用于植入Swan-Ganz导管(EDWARDS,美国)监测胸主动脉血压与采集动脉血标本。暴露右股静脉,用于植入Swan-Ganz导管监测右心房压、核心温度和采集静脉血标本。暴露右颈外静脉,用于植入诱颤电极(EP Technologies Inc., 美国)至右心室。实验动物准备过程中,使用冰毯仪(Blanketrol Ⅲ,美国)维持动物正常体温在(38.0±0.5)℃。
1.3 电刺激法诱导室颤诱颤前10 min,采集动物的基础数据,如基础体温、血流动力学参数、动脉血气分析及静脉血标本等。经诱颤电极释放1 mA交流电至右心室,诱导心室颤动。诱颤成功标准为心电图呈室颤波形,动脉血压显著下降、搏动波形消失。室颤成功后,断开呼吸机,停止机械通气,无干预观察8 min,然后开始CPR,其包括人工胸外按压和球囊辅助通气,比例30:2。ZOLL除颤监护仪用于实时监测胸外按压质量,保证按压深度5~6 cm、频率100~120次/min。CPR 2.5 min时,静脉注射肾上腺素20 μg/kg。CPR 5 min时,给予能量150 J的双向波电除颤(E Series,ZOLL公司,美国)1次,并判断是否出现ROSC。ROSC的标准为室上性自主心律伴平均动脉压>50 mmHg,持续5 min以上[10]。若无ROSC,立即进行2 min的CPR,然后电除颤1次。如此重复此流程5次后,动物仍未达到ROSC,视为复苏失败。肾上腺素在首次注射后,每3 min重复使用一次。复苏成功的动物,重新机械通气观察30 h,然后静脉注射戊巴比妥钠150 mg/kg予以安乐死,迅速获取组织标本,以及进行动物尸体解剖,记录重要脏器的解剖结果。
1.4 观察指标实验过程中,持续监测所有动物的心率、血压、PETCO2与核心体温等。CPR期间,记录所有动物的复苏情况,如冠脉灌注压(coronary perfusion pressure, CPP)、复苏时间、复苏成功率、肾上腺素用量及除颤次数等。在CA前抽取动脉血,进行血气分析,检测动脉血乳酸水平。在CA前与复苏后3、6、12、24与30 h时,采集静脉血标本,离心获取血清,应用酶联免疫吸附试验法(ELISA)法检测血清肠型脂肪酸结合蛋白(intestinal fatty acid binding protein, IFABP)的含量与二胺氧化酶(diamine oxidase, DAO)的活性(美轩生物科技有限公司,上海)。复苏后30 h时,动物实施安乐死,迅速获取回肠末端10 cm处肠组织,制备组织匀浆液,应用ELISA检测小肠组织TNF-α与白细胞介素-6(interleukin-6, IL-6)的含量(美轩生物科技有限公司,上海)。另外,制作病理组织标本,应用原位末端标记法(TUNEL,博士德生物工程有限公司,武汉)检测细胞凋亡,将组织切片置于200倍光镜下,每张切片随机选取5个视野,计数棕黄色阳性细胞数占总细胞数的百分比,计算平均值作为细胞凋亡指数;以及应用免疫组织化学染色法检测半胱氨酸天冬氨酸蛋白酶-3(caspase-3,博士德生物工程有限公司,武汉)的蛋白表达,同样将组织切片置于200倍光镜下,每张切片随机选取5个视野,以胞浆内出现棕黄色颗粒为阳性细胞,应用Image-Pro Plus 6.0图像分析软件检测每个视野中caspase-3蛋白阳性表达的累积吸光度(IOD),取其平均值作为caspase-3蛋白IOD值。
1.5 统计学方法使用SPSS 18.0统计软件进行统计学分析。正态分布的计量资料以均数±标准差(x±s)表示。计量资料采用重复测量的方差分析,每个时间点的组间比较采用单因素方差分析,多重比较采用Bonferroni。计数资料比较采用χ2检验。以P<0.05为差异有统计学意义。
2 结果 2.1 各组动物的基础特征各组动物的体质量、PETCO2、心率、平均动脉压、血乳酸和核心体温的组间差异均无统计学意义(均P>0.05,表 1)。
| 组别 | 体质量 (kg) |
PETCO2 (mmHg) |
心率 (次/min) |
MAP (mmHg) |
乳酸 (mmol/L) |
核心体温 (℃) |
| NT组 | 36.7±2.4 | 40±3 | 107±12 | 119±12 | 1.2±0.4 | 38.0±0.3 |
| SC组 | 36.1±2.9 | 39±3 | 107±11 | 115±12 | 1.3±0.4 | 37.9±0.3 |
| EC组 | 36.7±2.1 | 40±2 | 105±11 | 119±11 | 1.1±0.3 | 37.9±0.4 |
| 注:PETCO2,呼气末二氧化碳分压;MAP,平均动脉压;NT,常温组;SC,体表降温组;EC,食道降温组 | ||||||
三组动物心肺复苏期间的CPP、ROSC成功率、复苏时间、除颤次数和肾上腺素用量的差异均无统计学意义(均P>0.05,表 2和3)。
| 组别 | CPP (mmHg) | ||||
| 1 min | 2 min | 3 min | 4 min | 5 min | |
| NT组 | 17±3 | 22±3 | 28±3 | 37±3 | 26±4 |
| SC组 | 18±3 | 22±3 | 29±5 | 38±4 | 27±6 |
| EC组 | 17±2 | 23±3 | 30±5 | 37±6 | 27±8 |
| 注:CPP,冠脉灌注压;NT,常温组;SC,体表降温组;EC,食道降温组 | |||||
| 组别 | ROSC | 复苏时间(min) | 除颤次数 | 肾上腺素用量(mg) |
| NT组 | 8/9 | 6.6±3.3 | 1.7±1.3 | 1.29±0.97 |
| SC组 | 8/9 | 6.1±3.3 | 1.4±1.3 | 1.02±0.93 |
| EC组 | 8/9 | 6.1±3.3 | 1.4±1.3 | 1.03±0.85 |
| 注:ROSC,自主循环恢复;NT,常温组;SC,体表降温组;EC,食道降温组 | ||||
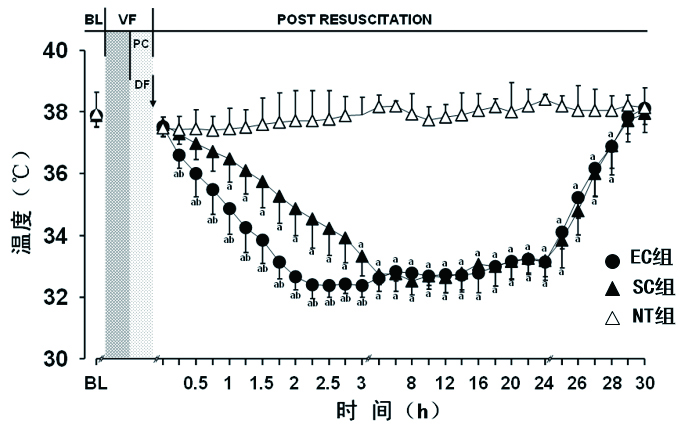
降温阶段,EC组与SC组动物的核心体温迅速下降,且EC组较SC组的体温下降更为迅速,在ROSC后15 min组间差异均有统计学意义(均P<0.05);低温维持与复温阶段,EC组与SC组动物核心体温的差异均无统计学意义(均P<0.05,图 1)。EC组降温速率和达标时长均显著优于SC组(2.8 ℃/h vs. 1.5 ℃/h,102 min vs. 185 min,均P<0.05)。
|
| BL,基线值;VF,室颤;PC,胸外按压;DF,除颤;NT,常温组;SC,体表降温组;EC,食道降温组。与NT组比较,aP<0.05;与SC组比较,bP<0.05 图 1 各组动物核心体温的变化(x±s) Figure 1 The changes of core temperature in each group (x±s) |
|
|
与NT组相比,EC组在ROSC后3 h IFABP含量与DAO活性显著降低,而SC组在ROSC后6 h IFABP含量与DAO活性显著下降(均P<0.05)。与SC组相比,EC组在ROSC后6 h IFABP含量及在ROSC后12 h DAO活性均显著下降(均P<0.05,表 4)。
| 组别 | IFABP(pg/mL) | DAO(U/mL) | |||||||||||
| BL | PR 3 h | PR 6 h | PR 12 h | PR 24 h | PR 30 h | BL | PR 3 h | PR 6 h | PR 12 h | PR 24 h | PR 30 h | ||
| NT组 | 488±36 | 673±30 | 830±37 | 1 086±40 | 1 265±53 | 1 170±63 | 11.4±1.5 | 21.6±2.2 | 29.6±2.8 | 49.8±2.5 | 39.5±2.7 | 34.9±2.3 | |
| SC组 | 493±23 | 635±44 | 777±52a | 960±64a | 1 143±63a | 1 006±45a | 11.9±1.4 | 19.5±2.5 | 25.4±2.8a | 43.4±3.2a | 34.0±3.1a | 29.4±2.2a | |
| EC组 | 488±30 | 623±26a | 710±32ab | 870±49ab | 1 022±65ab | 882±71ab | 11.7±1.5 | 18.3±1.8a | 23.3±1.8a | 39.9±1.9ab | 30.6±2.4ab | 26.1±2.7ab | |
| 注:IFABP,肠型脂肪酸结合蛋白;DAO,二胺氧化酶;BL,基线值;PR,复苏后;NT,常温组;SC,体表降温组;EC,食道降温组。与NT组比较,aP<0.05;与SC组比较,bP<0.05 | |||||||||||||
与NT组相比,EC组与SC组肠黏膜组织TNF-α和IL-6含量均显著降低(均P<0.05)。与SC组相比,EC组上述炎症因子含量进一步下降(均P<0.05,表 5)。与NT组相比,EC组与SC组肠黏膜组织凋亡指数及caspase-3蛋白阳性表达的IOD值均降低(均P<0.05)。与SC组相比,EC组肠黏膜组织细胞凋亡指数明显降低(均P<0.05,表 5)。
| 组别 | TNF-α (pg/mL) |
IL-6 (pg/mL) |
凋亡指数 (%) |
caspase-3 IOD值 |
| NT组 | 1111±129 | 912±94 | 17.8±2.8 | 22.2±4.1 |
| SC组 | 922±125a | 697±132a | 12.8±3.0a | 15.9±1.9a |
| EC组 | 721±94ab | 454±69ab | 6.2±2.6ab | 8.9±1.6ab |
| 注:TNF-α,肿瘤坏死因子-α;IL-6,白介素-6;caspase-3,半胱氨酸天冬氨酸蛋白酶-3;NT,常温组;SC,体表降温组;EC,食道降温组。与NT组比较,aP<0.05;与SC组比较,bP<0.05 | ||||
亚低温是心肺复苏指南明确推荐的保护性干预手段,能减轻复苏后多器官损伤,其作用在复苏后肠保护中亦得到体现。Albrecht等[5]制作猪心肺复苏模型,研究发现亚低温能通过降低肠黏膜组织IL-1β水平而抑制炎症反应。宋华强和李湘民[6]研究发现亚低温能调节大鼠心肺复苏后肠黏膜组织氧化/抗氧化失衡而减轻氧化应激损伤。Lu等[7]在猪心肺复苏模型中同样观察到亚低温的复苏后肠保护作用,其机制与提高肠黏膜组织Na+-K+-ATP酶和Ca2+-ATP酶活性有关。在本研究中我们也发现亚低温可通过抑制炎症反应和细胞凋亡保护心肺复苏后的肠黏膜损伤。然而,目前如何优化低温实施方案,以提升复苏后多器官保护效应,仍然是研究的热点。
近年来,一些快速诱导低温的新方法,如经肺全氟化碳冷却液通气降温、血管内导管降温、经腹腔灌注低温液体降温等[8, 11-12],显示出优于传统体表降温法的复苏后器官保护效应。在复苏后肠保护研究中,戴瑄等[8]研究发现经腹腔诱导的快速低温优于传统体表低温,能进一步降低肠黏膜组织炎症反应。然而,这些新方法存在需要特殊装置、创伤大、成本高、不宜长时间使用等限制因素,不利于临床推广应用。当前利用食道降温装置实施体温管理策略可以弥补上述方法的不足。而且,研究逐步证实,经食道不仅能快速降温以达到33℃的目标性亚低温,而且能双向调控患者体温至正常范围[9, 13]。
本研究中根据液体流量、接触面积及热传导材质等热交换影响要素,自主优化设计新型经食道降温导管,在猪心肺复苏模型上首先评价该导管的低温诱导效果。结果显示,亚低温诱导阶段,经食道降温的速率达到2.8 ℃/h、达标时长仅102 min,其降温效率接近于传统体表降温法的两倍;低温维持与复温阶段,经食道或体表均能保障动物亚低温的稳定维持与稳步复温。上述研究结果提示,经食道降温可以实现早期快速诱导低温的优化治疗策略。
其次,笔者发现经食道降温可更显著降低复苏后肠黏膜损伤标志物IFABP与DAO。IFABP位于胃肠道黏膜,在黏膜组织缺血损伤时释放入血,是肠黏膜屏障功能损害的早期、特异、敏感的生化诊断指标[14]。DAO是肠黏膜上层绒毛细胞胞浆中具有高度活性的细胞内酶,以空、回肠活性最高,同样在肠黏膜屏障破坏时释放入血,是反映小肠黏膜结构和功能的理想指标[15]。本研究结果显示,ROSC后IFABP与DAO的血清水平明显升高,提示肠黏膜屏障功能受损;实施亚低温治疗策略后,血清IFABP与DAO水平降低,且食道降温组较体温降温组的肠黏膜损伤标志物水平进一步下降,提示经食道诱导的快速低温可以加强ROSC后的肠保护效应。
CA复苏是全身缺血-再灌注损伤的特殊形式,其导致的肠缺血-再灌注损伤是ROSC后肠黏膜损伤及保护性屏障破坏的重要原因,后者的主要病理损伤机制为炎症、氧化应激与细胞凋亡等,在ROSC后多器官功能障碍综合征的发展过程中起着重要作用[4]。本研究中,项目组观察到猪CA复苏后肠黏膜组织存在炎症反应、细胞凋亡等病理损伤。在进行亚低温治疗后,上述病理损伤减轻,表现为肠组织TNF-α与IL-6含量明显降低,细胞凋亡指数与caspase-3蛋白表达显著减少。另外,与传统体表降温法相比,经食道诱导的快速低温进一步减轻肠黏膜组织炎症反应与细胞凋亡等病理损伤程度,进而加强复苏后肠保护效应。
综上所述,猪ROSC后经食道可成功地快速诱导低温,其效果优于传统的体表降温,并且可显著地减轻ROSC后肠黏膜组织的炎症反应、细胞凋亡等病理损伤,实现进一步提升ROSC后肠保护作用的目的,这将为经食道实施体温管理策略的临床转化应用提供依据。
| [1] | Neumar RW, Nolan JP, Adrie C, et al. Post-cardiac arrest syndrome: epidemiology, pathophysiology, treatment, and prognostication[J]. Circulation, 2008, 118(23): 2452-2483. DOI:10.1161/CIRCULATIONAHA.108.190652 |
| [2] | Korth U, Krieter H, Denz C, et al. Intestinal ischaemia during cardiac arrest and resuscitation: comparative analysis of extracellular metabolites by microdialysis[J]. Resuscitation, 2003, 58(2): 209-217. DOI:10.1016/S0300-9572(03)00119-9 |
| [3] | Carrico CJ, Meakins JL, Marshall JC, et al. Multiple-organ-failure syndrome[J]. Arch Surg, 1986, 121(2): 196-208. DOI:10.1001/archsurg.1986.01400020082010 |
| [4] | Deitch EA. Multiple organ failure. Pathophysiology and potential future therapy[J]. Ann Surg, 1992, 216(2): 117-234. DOI:10.1097/00000658-199208000-00002 |
| [5] | Albrecht M, Gruenewald M, Zitta K, et al. Hypothermia and anesthetic postconditioning influence the expression and activity of small intestinal proteins possibly involved in ischemia/reperfusion-mediated events following cardiopulmonary resuscitation[J]. Resuscitation, 2012, 83(1): 113-118. DOI:10.1016/j.resuscitation.2011.06.038 |
| [6] | 宋华强, 李湘民. 乌司他汀联合亚低温对心肺复苏后大鼠肠道黏膜机械屏障功能的保护[C]. 中华医学会急诊医学分会第17次全国急诊医学学术年会, 2014, PU-0223. http://cpfd.cnki.com.cn/Article/CPFDTOTAL-JXJZ201408001272.htm |
| [7] | Lu Y, Wang S, Li CS. Hypothermia ameliorates gastrointestinal ischemic injury sustained in a porcine cardiac arrest model[J]. Chin Med J (Engl), 2012, 125(24): 4406-4411. DOI:10.3760/cma.j.issn.0366-6999.2012.24.015 |
| [8] | 戴瑄, 胡春林, 魏红艳, 等. 新型腹腔降温法对心肺复苏后兔肠黏膜损伤的影响[J]. 中华普通外科学文献(电子版), 2010, 4(4): 307-310. DOI:10.3877/cma.j.issn.1674-0793.2010.04.004 |
| [9] | Schroeder DC, Guschlbauer M, Maul AC, et al. Oesophageal heat exchangers with a diameter of 11mm or 14.7mm are equally effective and safe for targeted temperature management[J]. PLoS One, 2017, 12(3): e0173229. DOI:10.1371/journal.pone.0173229 |
| [10] | Chen W, Weng Y, Wu X, et al. The effects of a newly developed miniaturized mechanical chest compressor on outcomes of cardiopulmonary resuscitation in a porcine model[J]. Crit Care Med, 2012, 40(11): 3007-3012. DOI:10.1097/CCM.0b013e31825d924d |
| [11] | Chenoune M, Lidouren F, Adam C, et al. Ultrafast and whole-body cooling with total liquid ventilation induces favorable neurological and cardiac outcomes after cardiac arrest in rabbits[J]. Circulation, 2011, 124(8) 901-11, 1-7. DOI:10.1161/CIRCULATIONAHA.111.039388 |
| [12] | Deye N, Cariou A, Girardie P, et al. Endovascular versus external targeted temperature management for patients with out-of-hospital cardiac arrest: a randomized, controlled study[J]. Circulation, 2015, 132(3): 182-193. DOI:10.1161/CIRCULATIONAHA.114.012805 |
| [13] | Williams D, Leslie G, Kyriazis D, et al. Use of an esophageal heat exchanger to maintain core temperature during nurn excisions and to attenuate pyrexia on the burns intensive care unit[J]. Case Rep Anesthesiol, 2016, 2016: 7306341. DOI:10.1155/2016/7306341 |
| [14] | Hanssen SJ, Derikx JP, Vermeulen Windsant IC, et al. Visceral injury and systemic inflammation in patients undergoing extracorporeal circulation during aortic surgery[J]. Ann Surg, 2008, 248(1): 117-125. DOI:10.1097/SLA.0b013e3181784cc5 |
| [15] | 董妮珊, 郑曙云. 肠屏障功能检测方法的研究现状及展望[J]. 中华老年多器官疾病杂志, 2014, 13(4): 309-312. DOI:10.3724/SP.J.1264.2014.00072 |
 2018, Vol. 27
2018, Vol. 27




