传统定义认为脓毒症的关键在于机体感染引起全身状态改变,包括体温、心率、呼吸、血白细胞计数等指标的改变[1];最新定义的重点在于机体出现全身炎症反应的同时,抗炎免疫抑制反应被启动,最终两者失调导致器官功能障碍[2]。ST2基因是IL-1受体的特异性配体IL-33是IL-1家族中的成员,最初是在高壁内皮细胞中发现的核因子[3]。IL-33/ST2信号通路参与多种炎症性疾病的病理生理过程,且与炎症及免疫耐受有关,在多种炎症性疾病、自身免疫性疾病中,患者的血清sST2浓度均有不同程度的升高[4]。研究[5]发现只有不到10%的脓毒症患者外周血中可检测到TNF-α、IL-1β等促炎因子,而多数患者可检测到IL-4、IL-10等抗炎因子浓度升高。IL-4、IL-5、IL-13等抗炎细胞因子均由Th2细胞产生,在多种免疫反应中,Th2细胞介导的免疫反应在脓毒症中占主导地位。IL-33与活化Th2细胞表面的ST2受体结合,促进抗炎细胞因子产生,同时,细胞外存在sST2受体,IL-33与之结合但不发挥生物学作用,从而阻断其与细胞表面ST2受体结合[6]。IL-33/ST2信号通路通过以上机制参与到脓毒症的病理生理中来,是脓毒症病程中的重要组成部分。本研究旨在通过测定脓毒症患者早期血清sST2水平,结合降钙素原(PCT)、C反应蛋白(CRP)、白细胞计数(WBC)等指标,分析sST2对脓毒症早期诊断及评估预后方面可能存在的价值,进而能够对脓毒症的早期干预治疗提供一定的帮助,并从炎症与免疫机制方面间接地深化对脓毒症发病的认识。
1 资料与方法 1.1 一般资料选择2015年9月至2016年10月就诊于北京医院急诊科并收入抢救室救治的患者,根据欧洲危重病医学会2016年脓毒症第三版国际共识定义[7],选择存在感染、SOFA评分≥2分即存在器官功能障碍的患者为研究对象,取得患者知情同意,记录患者年龄、性别等基础资料,收集患者入组时体温、呼吸频率、心率、血压、白细胞计数、血小板、肌酐、总胆红素、C反应蛋白等临床数据,24 h内完善降钙素原(PCT)检测,并随访其28 d死亡与否情况。
排除标准:年龄<18岁;曾于3个月内接受免疫抑制药物或细胞毒性药物治疗;合并自身免疫性或免疫相关性疾病,如系统性红斑狼疮、强直性脊柱炎、类风湿性关节炎、炎症性肠病等;合并急性心肌梗死、急性心力衰竭(包括慢性心功能不全急性加重)等已有研究证明可能影响血清sST2浓度的疾病的患者。
1.2 研究对象的分组根据患者脓毒症严重程度分为2组:①普通脓毒症组(44例):机体存在某一或多个部位或器官感染;初筛qSOFA评分≥2分(呼吸频率≥22次/min、Glasgow昏迷评分≤13分及收缩压≤100 mmHg,每项各计1分);进一步筛选SOFA评分≥2分,即存在器官功能障碍。②脓毒性休克组(19例):符合上述脓毒症诊断标准;持续性低血压,经充分容量复苏后仍需血管收缩药以维持平均动脉压≥65 mmHg,血清乳酸浓度>2 mmol/L。根据脓毒症患者28 d结局分为存活组(45例)、死亡组(18例)。选择30例健康查体人员作为对照组。
1.3 样本采集与检测患者入组后12 h内,用内含惰性分离胶及促凝剂的黄头生化管采集静脉血,用离心机以3 000 r/min的转速离心20 min后,将血清及血细胞分离,取血清置于-70℃冰箱保存备用,标本避免反复冻融。同时留取患者静脉血标本,于检验科完善降钙素原等检测。试验采用北京科盈美公司Human Stromelysin-2酶联免疫吸附法(ELISA)试剂盒,标本于6个月内测定sST2浓度。
1.4 统计学方法采用SPSS 23.0软件进行统计学分析。采用非参数K-S检验进行正态评价,符合正态分布的计量资料以均数±标准差(x±s)表示,两组间比较采用两独立样本t检验,多组间比较采用单因素方差分析;不符合正态分布的资料以中位数(四分位数间距)表示,进行Mann-Whitney U检验;相关性检验采用Spearman相关性分析;对患者28 d结局的相关影响因素的评价使用受试者工作曲线(ROC曲线),评价sST2、PCT等指标对预后的评估作用。以P<0.05为差异有统计学意义。
2 结果 2.1 脓毒症患者与对照组比较脓毒症患者入组共63例,平均年龄为77.4岁(62~95岁),男性39例,女性24例。脓毒症组与对照组资料在性别、年龄方面相比差异无统计学意义(P>0.05)(表 1)。
| 指标 | 对照组 | 脓毒症组 | 统计值 | P值 |
| 年龄(岁) | 75.93±2.42 | 77.38±10.93 | 0.715 | 0.476 |
| 男/女 | 18/12 | 39/24 | 0.031 | 0.860 |
| sST2浓度(pg/mL) | 569.28±163.46 | 1 382.12±384.07 | 14.298 | 0.000 |
与健康对照组比较(表 1),脓毒症患者血清sST2水平明显升高,差异有统计学意义;经Spearman相关性分析,sST2与SOFA评分正相关(r=0.364,P=0.003)。即脓毒症患者血清sST2浓度与病情的严重程度正相关。
进一步比较发现(表 2),脓毒性休克患者血清sST2水平较普通脓毒症组升高(P<0.05),差异有统计学意义。普通脓毒症组、脓毒性休克组的28天病死率分别为13.64%和63.16%,差异有统计学意义(χ2=10.65,P=0.001),其中,在普通脓毒症组患者中,最终死亡患者sST2水平高于最终存活患者(t=-2.595,P=0.013),在脓毒性休克患者中同样发现最终死亡患者sST2水平较高(t=-5.106,P=0.0002)。
| 普通脓毒症组 | 脓毒性休克组 | 统计值 | P值 | |
| 例数 | 44 | 19 | - | - |
| sST2浓度(pg/mL) | 1 255.44±265.70 | 1 675.49±457.59 | -3.738 | 0.001 |
通过存活组与死亡组比较发现(表 3),年龄、性别、血白细胞计数、血小板计数、血肌酐等指标对比中两者差异无统计学意义(P>0.05),最终死亡组病例的PCT及血清sST2水平比之最终存活组者升高,差异有统计学意义。
| 指标 | 存活组 | 死亡组 | 统计值 | P值 |
| 性别(男/女) | 25/20 | 14/4 | 2.692 | 0.101 |
| 年龄(岁) | 75.93±11.97 | 81.00±6.74 | -1.687 | 0.097 |
| 白细胞计数(×109/L) | 12.64±3.90 | 14.49±4.43 | -1.633 | 0.108 |
| 降钙素原(ng/ml) | 3.79±3.88 | 16.37±16.36 | -3.227 | 0.005 |
| sST2(pg/ml) | 1217.19±258.99 | 1794.47±335.18 | -7.333 | 0.000 |
| 血小板(×109/L) | 172.31±85.74 | 150.11±74.75 | 0.961 | 0.34 |
| 血肌酐(μmol/L) | 93.00 (73.50, 143.50) |
131.50 (79.00, 184.25) |
-0.784 | 0.433 |
| 入院时呼吸频率(次/min) | 20.00 (18.00, 23.00) |
22.00 (18.75, 24.25) |
-1.277 | 0.202 |
| SOFA评分 | 4(3, 5) | 6(5, 8) | -3.742 | 0.000 |
将P值小于0.05的指标带入二元Logistic分析可得(表 4),血清sST2浓度对脓毒症患者28天结局有独立判断意义(OR=1.006,P=0.005),其次是PCT(OR=1.113,P=0.022)。通过ROC曲线(图 1,表 5)分析,sST2的曲线下面积大于PCT(0.917 vs. 0.884),其预测价值高于PCT,但二者联合的曲线下面积为0.944,高于二者分别单独分析的结果。另外,sST2对脓毒症预后预测的灵敏度为88.9%,特异度82.2%,PCT的灵敏度72.2%,特异度93.3%, 二者均有较高的预测价值,二者联合ROC曲线分析灵敏度85.3%,特异度95.6%,特异度较前升高。
| 指标 | 标准误 | Wald | P值 | Exp(B) | EXP(B)的95%CI置信区间 | |
| sST2 | 0.002 | 7.850 | 0.005 | 1.006 | 1.002~1.010 | |
| PCT | 0.086 | 1.540 | 0.022 | 1.113 | 0.940~1.317 | |
| SOFA评分 | 0.311 | 0.903 | 0.342 | 1.344 | 0.731~2.471 | |
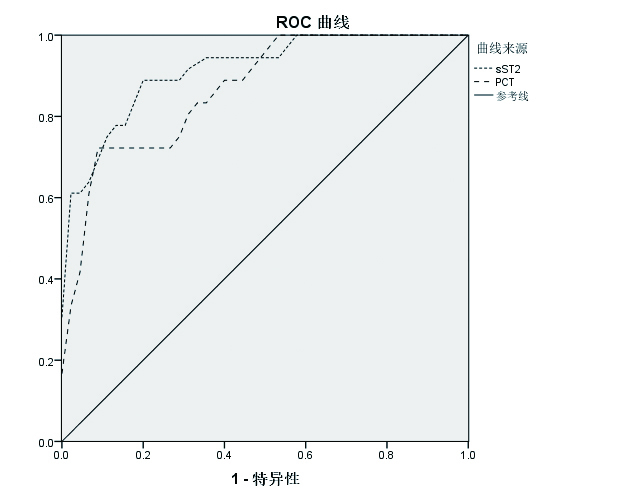
|
| 图 1 sST2和PCT的ROC曲线 Figure 1 ROC curve of sST2 and PCT |
|
|
| 指标 | AUC | 灵敏度 | 特异度 |
| sST2 | 0.917 | 88.9% | 82.2% |
| PCT | 0.884 | 72.2% | 93.3% |
| sST2联合PCT | 0.944 | 85.3% | 95.6% |
脓毒症患者每年占住院患者的1%~2%,在重症监护室患者中的比例高达6~30%[8]。脓毒症的发病机制涉及大量炎性介质释放导致全身炎性反应、免疫功能失调引起免疫抑制与障碍等多种病理生理学改变,IL-33/ST2信号通路在这一过程中发挥着重要作用[9],当机体严重感染,出现细胞损伤或坏死时,血清IL-33浓度增加,与ST2受体复合物结合,调节Th2细胞因子的转录从而诱发免疫反应[10],同时,sST2作为负性调节因子与IL-33结合,参与其后的免疫抑制过程[11]。
以往的几项研究都证实[12-14],脓毒症组患者血清sST2浓度明显高于健康对照组,其中研究之一[12]结果显示SOFA评分更高的组,sST2浓度显著升高,而当脓毒症患者血清sST2浓度较高或PCT浓度较高时,其病死率显著升高。以上有限的研究表明,sST2可能辅助脓毒症的诊断、对病情严重程度的判断及预后评估,同样,PCT作为反映感染的良好标志物,可能也对脓毒症的预后有评估作用。在本研究中,脓毒症患者血清sST2浓度明显高于健康对照组,然而其血清sST2浓度显著升高的机制尚不明确,可能与IL-33/ST2参与T细胞介导的免疫应答有关。
Th2细胞膜表面的ST2L与IL-1RAcP组成受体复合物,其特异性配体IL-33与之结合,促使细胞外调节蛋白激酶1/2(ERK1/2)、c-Jun氨基末端激酶(JNK)、p38MAPK等激酶磷酸化[9],在肿瘤坏死因子受体相关因子6(TRAF6)、IL-1相关蛋白激酶(IRAK)和下游信号分子髓样分化因子88(MyD88)的作用下,调节基因的转录,促进Th2细胞因子IL-4、IL-5、IL-13的产生、分泌。或依赖IL-1RAcP激活NF-κB抑制蛋白α(IκBα)[15],抑制NF-κB对炎症因子释放的激活作用[16]。IL-33可以通过直接激活小鼠体内的树突状细胞从而诱导Th0细胞向Th2细胞转化,促进Th2细胞产生并提高IL-4、IL-5、IL-13等细胞因子的表达[17]。而sST2作为IL-33/ST2通路的负性调节因子,其与IL-33结合但无生物学功能,从而抑制ST2L的作用,进而参与到脓毒症炎性状态发生和发展过程中[11]。
通过比较伴或不伴休克的脓毒症患者血清sST2水平发现,脓毒性休克患者血清sST2水平较普通脓毒症组升高,提示病情越严重的患者,其血清sST2水平越高。在普通脓毒症及严重脓毒症患者中,最终结局为死亡的患者,其sST2浓度较最终存活者升高,提示血清sST2水平可以反映患者28 d后的结局情况,脓毒症患者sST2水平越高,其预后可能相对较差。本研究还发现,SOFA评分更高的患者,血sST2浓度更高,即患者的预后越差,这与其他研究的结果也是一致的。故本研究结果认为,sST2可协助早期识别脓毒症严重程度,其水平测定可指导临床对病情较重的脓毒症患者加强监护,采取早期抗感染及液体复苏等有效措施。
研究还对比了确诊脓毒症28 d时不同预后的患者的血清sST2、PCT浓度。在本研究中,死亡组患者的血清sST2及PCT水平较存活组升高,提示血清sST2及PCT水平越高,病情可能越重,预后越差。多数研究报告,脓毒性休克患者病死率在50%~55%左右,但其入组患者的平均年龄多在65~68岁左右[18-19],本研究中,脓毒性休克患者病死率为63%,似乎高于一般研究报告,但本研究病例平均年龄为77.4岁,基础疾病较多,各器官功能较差,可能是影响不良结局发生与否的重要因素,若剔除年龄大于80岁的患者,则其病死率为54.5%,与文献报告相近。本研究人群的年龄段更偏向老年,可以为老年脓毒症患者的诊治提供更多参考价值。
通过ROC曲线分析得出,sST2对预后的综合预测价值或许高于PCT。研究证明PCT是早期诊断脓毒症的特异性较高的炎症指标[21],在某些非感染性疾病PCT也会有所升高,但一般不会超过其在感染性疾病中的升高程度。非特异性感染、病毒炎症及局部感染等疾病时,PCT浓度不增加或轻微增加;而在全身严重感染时,PCT水平会明显增加[21]。因此认为,sST2与PCT都可以作为脓毒症的评估指标,但在评估预后方面,PCT预测的敏感性不如血清sST2,但特异性高于sST2。sST2对脓毒症患者28 d预后的预测更敏感,而sST2与PCT联合对预后的判断更准确。两者联合对脓毒症患者预后的评价效能更高。
| [1] | Novotny AR, Reim D, Assfalg V, et al. Mixed antagonist response and sepsis severity-dependent dysbalance of pro-and anti-inflammatory responses at the onset of postoperative sepsis[J]. Immunobiology, 2012, 217(6): 616-21. DOI:10.1016/j.imbio.2011.10.019 |
| [2] | 刘军. 对全身性感染免疫与炎症关系的思考[J]. 中华急诊医学杂志, 2017, 26(11): 1230-1235. DOI:10.3760/cma.j.issn.1671-0282.2017.11.002 |
| [3] | Griesenauer B, Paczesny S. The ST2/IL-33 Axis in Immune Cells during Inflammatory Diseases[J]. Front Immunol, 2017, 24(8): 475. DOI:10.3389/fimmu.2017.00475 |
| [4] | Kakkar R, Lee RT. The IL-33/ST2 pathway: therapeutic target and novel biomarker[J]. Nature Reviews Drug Discovery, 2008, 7(10): 827-840. DOI:10.1038/nrd2660 |
| [5] | Heidecke CD, Hensler T, Weighardt H, et al. Selective defects of T lymphocyte function in patients with lethal intraabdominal infection[J][J]. American journal of surgery, 1999, 4: 288-292. |
| [6] | Hui Xu, Heth R, Turnquist, et al. Role of the IL-33-ST2 axis in sepsis[J]. Mil Med Res, 2017, 4: 3. DOI:10.1186/s40779-017-0115-8 |
| [7] | Singer M, Deutschman CS, Seymour CW, et al. The Third International Consensus Definitions for Sepsis and Septic Shock (Sepsis-3)[J]. JAMA, 2016, 315(8): 801-810. DOI:10.1001/jama.2016.0287 |
| [8] | Jawad I, Luksic I, Rafnsson SB. Assessing available informationon on the burden of sepsis: global estimates of incidence, prevalence and mortality[J]. J Global Health, 2012, 2: 1-9. DOI:10.7189/jogh.02.010404 |
| [9] | Villarreal DO, Weiner DB. Interleukin33: a switch-hitting cytokine[J]. Cur Opin Imm, 2014, 28: 102-106. DOI:10.1016/j.coi.2014.03.004 |
| [10] | Schmitz J, Owyang A, Oldham E, et al. IL-33, an interleukin-1 like cytokine that signals via the IL-1 receptor-related protein ST2 and induces T helper type 2-associated cytokines[J]. Immunity, 2005, 23(5): 479-90. DOI:10.1016/j.immuni.2005.09.015 |
| [11] | Fattori V, Hohmann MSN, Rossaneis AC, et al. Targeting IL-33/ST2 signaling: regulation of immune function and analgesia[J]. Expert Opin Ther Targets, 2017, 21(12): 1141-1152. DOI:10.1080/14728222.2017.1398734 |
| [12] | Hur M, Kim H, Kim HJ, et al. Soluble ST2 has a prognostic role in patients with suspected sepsis[J]. Ann Lab Med, 2015, 35(6): 570-577. DOI:10.3343/alm.2015.35.6.570 |
| [13] | Markus B, Claus K, Georg R, et al. Increased levels of soluble ST2 protein and IgG1 production in patients with sepsis and trauma[J]. Intensive Care Med, 2004, 30: 1468-1473. DOI:10.1007/s00134-004-2184-x |
| [14] | Jacobien J, Micheal W, Marieke A, et al. Soluble ST2 plasma concentrations predict mortality in severe sepsis[J][J]. Intensive Care Med, 2010, 36: 630-637. DOI:10.1007/s00134-010-1773-0 |
| [15] | Matta BM, Lott JM, Mathews LR, et al. IL-33 is an unconventional alarmin that stimulates IL-2 secretion by dendritic cells to selectively expand IL-33R/ST2+ regulatory T cells[J]. J Immuno, 2014, 193(8): 4010-4020. DOI:10.4049/jimmunol.1400481 |
| [16] | Ge Y, Huang M, Ma YF. The effects of microRNA-34a regulating Notch-1/NF-κB signaling pathway on lipopolysaccharide-induced human umbilical vein endothelial cells[J]. World J Emerg Med, 2017, 8(4): 292. DOI:10.5847/wjem.j.1920–8642.2017.04.008 |
| [17] | Duan L, Chen J, Zhang H, et al. Interleukin-33 ameliorates experimental colitis through promoting Th2/Foxp3+ regulatory T-cell responses in mice[J]. Mol Med, 2012, 18: 753-761. DOI:10.2119/molmed.2011.00428 |
| [18] | Lonneke A, Peter MC, Spitoni C, et al. Incidence, risk factors and attributable mortality of secondary infections in the intensive care unit after admission for sepsis[J]. JAMA, 2016, 315(14): 1468-1479. DOI:10.1001/jama.2016.2691 |
| [19] | 刘晓, 刘志广, 范志松, 等. 严重脓毒症与脓毒性休克患者预后分析[J]. 山东大学医学报, 2016, 54(10): 80-84. DOI:10.6040/j.issn.1671-7554.0.2015.957 |
| [20] | Nasa P, Juneja D, Singh O, et al. Severe sepsis and its impact on outcome in elderly and very elderly patients admitted in intensive care unit[J]. J Inten Care Med, 2012, 27(3): 179-183. DOI:10.1177/0885066610397116 |
| [21] | 刘君钊, 刘铮, 刘鸿, 等. 在脓毒症诊断和危险分层中的应用价值[J]. 中华急诊医学杂志, 2017, 26(2): 168-171. DOI:10.3760/cma.j.issn.1671-0282.2017.02.009 |
 2018, Vol. 27
2018, Vol. 27




