脓毒症和脓毒症休克是目前危重病领域研究的热点问题。尽管治疗措施不断改善,但脓毒症和脓毒症休克的病死率并未出现明显改善,波动于30%~60%左右[1-2]。由于大多数脓毒症患者早期临床血流动力学表现为高动力状态,心脏泵功能障碍问题往往不易被发现。近年研究[3-6]表明,心功能障碍在全身性感染患者中十分普遍。随着诊断技术的进步,尤其是心脏超声等无创心功能评估方法的改进,脓毒症休克过程中心室扩张、射血分数降低以及舒张功能障碍等特征被逐步描述[7]。然而,系统评估脓毒症血流动力学变化并通过心脏超声观察心功能与患者预后关系的研究并不多见。本研究结合血流动力学监测与心脏彩色多普勒超声,从心脏收缩功能与舒张功能两方面观察心功能在脓毒症休克患者中的动态变化,并分析其与预后的关系。
1 资料与方法 1.1 一般资料选取北京朝阳区医院急诊ICU 2014年1月至2016年1月住院的129例脓毒症休克患者。入院诊断包括重症肺炎、重症急性胰腺炎、心肺复苏后、胸腹联合伤等基础疾病合并脓毒症。入选标准按照2012年美国危重病医学会制定的脓毒症和脓毒症休克治疗指南[8]。排除标准包括:既往慢性心功能、肾功能及肝功能不全者;急性严重肾功能不全(血肌酐>300 mmol/L)以及肝功能不全(总胆红素>120 mmol/L)者;年龄>80岁或<18岁。两组患者均按指南接受常规抗休克治疗。
1.2 监测指标及方法 1.2.1 血流动力学监测经挠动脉留置导管,连接Vigileo监护仪(Edwards Lifesciences,美国),以脉搏轮廓波形法持续监测心率(heart rate, HR)心指数(cardiac index,CI)、平均动脉血压(mean arterial pressure,MAP)和全身血管阻力指数(systemic vascular resistance index, SVRI)。锁骨下静脉或颈内静脉放置双腔导管用于持续监测中心静脉压(central venous pressure, CVP)。
1.2.2 心脏超声选用SIMENS S2000超声诊断仪(SIMENS,德国),凸阵探头,频率为2.546 MHz。患者取左侧卧位,每个参数连续测量3次,取平均值。取胸骨旁左心室长轴切面,测量左心房内径(LAD)、左心室后壁厚度(LVPWd)、室间隔厚度(IVSd)和左心室舒张末内径(LVEDD);在标准心尖四腔心切面上,测量二尖瓣舒张早期血流峰速(E)和舒张晚期血流峰速(A),计算E/A比值;利用改良Simpson单平面法计算LVEF;然后进入组织多普勒成像(tissue Doppler imaging, TDI)模式,将取样容积置于左心室室间隔二尖瓣瓣环水平处,获取DTI图谱,测量二尖瓣环舒张早期速度(E'),并计算E/E'比值(图 1)。
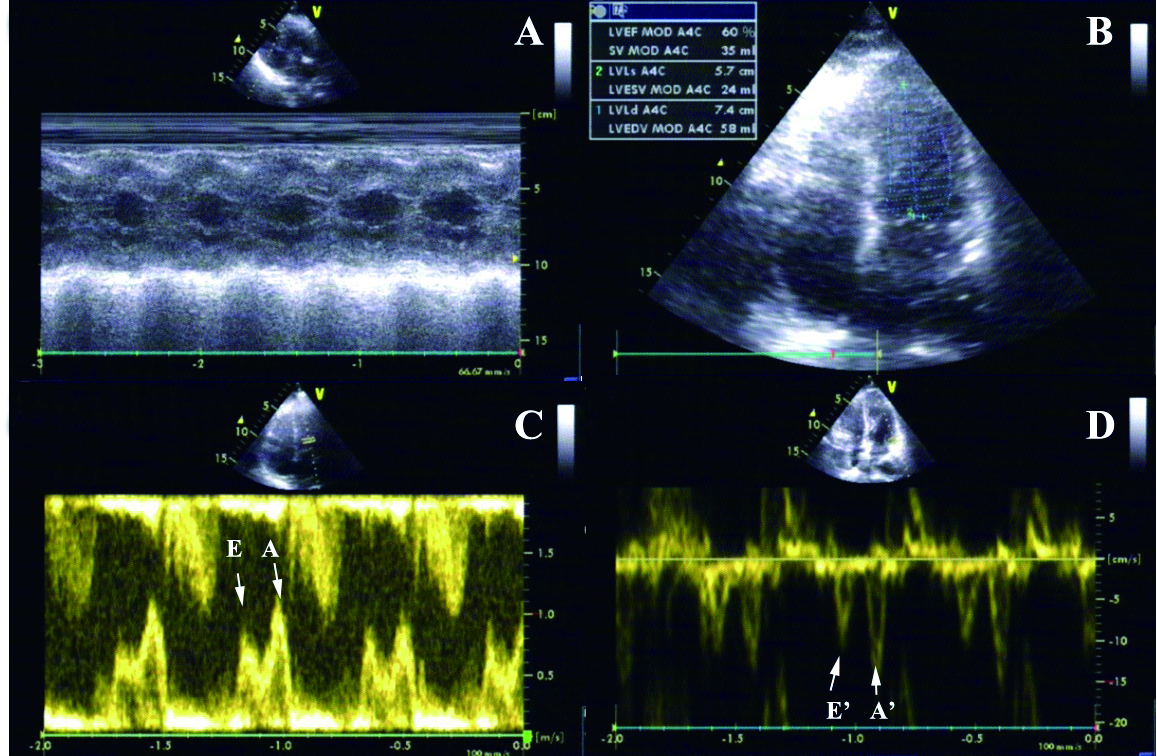
|
| A:M型超声测量左心参数;B:改良Simpson单平面法计算LVEF;C:E峰即二尖瓣舒张早期充盈速度,A峰即二尖瓣舒张晚期充盈速度;D:E'即二尖瓣环舒张早期速度,A'即二尖瓣环舒张晚期速度 图 1 心脏超声及参数 Figure 1 Parameters of echocardiogram |
|
|
所有患者在入院即刻监测血流动力学、急性生理学与慢性健康状况评分系统Ⅱ(APACHEⅡ)评分及心脏超声检查;在入院1周后复查上述指标。根据患者28 d预后分为生存组(n=84)或死亡组(n=45)。
1.4 统计学方法采用SPSS10.0软件进行统计学分析,计量资料以均数±标准差(x±s)表示。计数资料比较采用χ2检验或Fish精确概率法;计量资料采用成组t检验或Mann-Whitney U检验;危险因素分析采用Logistic回归。以P<0.05为差异有统计学意义。
2 结果 2.1 一般情况入选患者中,男性78例,女性51例;年龄(62.39±15.77)岁;APACHEⅡ评分9~24分,平均(15.65±6.32)分。死亡组患者APACHEⅡ评分显著高于生存组(P=0.022, 表 1)。死亡组与生存组患者之间的性别、年龄和疾病谱差异无统计学意义(均P>0.05)。
| 指标 | 生存组(n=84) | 死亡组(n=45) | t/χ2 | P值 |
| 性别(男/女) | 49/35 | 29/16 | 0.458 | 0.499 |
| 年龄 | 60.4±14.3 | 62.5±17.7 | 0.275 | 0.796 |
| APACHE Ⅱ | 12.64±5.36 | 18.52±4.79 | 2.139 | 0.022 |
| 疾病谱 | ||||
| 重症肺炎 | 41(%) | 20(%) | 0.636 | 0.713 |
| 重症胰腺炎 | 12(%) | 8(%) | 0.601 | 0.617 |
| CPR术后 | 15(%) | 9(%) | 0.766 | 0.814 |
| 胸腹联合伤 | 5(%) | 2(%) | 0.719 | 1.000 |
| 其他 | 11(%) | 6(%) | 0.970 | 1.000 |
所有患者入院当日CI增高至(4.40±0.79)L/(min·m2)(正常值2.5~4.2 L/(min·m2)),而SVRI显著降低至(1 458±270)dyn·s·cm-5·m2(正常值1 900~2 400 dyn·s·cm-5·m2),从而导致MAP明显低于正常降低至(53.2±16.8)mmHg(正常值70~105 mmHg),即典型的“高排低阻”型休克。生存组与死亡组患者入院即刻HR、MAP、CVP、CI和SVRI差异无统计学意义(均P>0.05,表 2)。入院后第7天生存组患者MAP、CVP及SVRI均高于第1天(均P<0.05),CI和HR低于第1天(均P<0.05);死亡组患者除外,CI显著低于第1天(P<0.05),SVRI和CVP显著高于第1天(均P<0.05),而MAP和HR无显著变化(均P>0.05)。入院后第7天,与生存组患者相比除CVP外其他参数,死亡组患者HR和SVRI显著升高(均P<0.05),MAP和CI显著降低(均P<0.05),而CVP差异无统计学意义(P>0.05)。
| 指标 | 生存组(n=84) | 死亡组(n=45) | ||
| 第1天 | 第7天 | 第1天 | 第7天 | |
| HR(次/min) | 105±16 | 88±13b | 109±19 | 111±21a |
| MAP (mmHg) | 52.9±15.6 | 94.3±21.2b | 54.3±18.4 | 53.4±27.5a |
| CVP (mmHg) | 3.45±1.11 | 6.25±0.99b | 4.12±1.60 | 6.71±1.61b |
| CI [L/(min·m2)] | 4.30±0.71 | 3.88±0.51b | 4.52±0.91 | 2.52±0.87ab |
| SVRI (dyn·s·cm-5·m2) | 1 447±297 | 2 044±266b | 1 488±233 | 3 201±32ab |
| 注:HR,心率;MAP,平均动脉压;CVP,中心静脉压;CI,心脏指数;SVRI,全身血管阻力指数。与生存组相比较,aP<0.05;与第1天相比,bP<0.05 | ||||
与第1天相比,生存组患者第7天LVEDD比第1天显著增加(P<0.05,表 3);其余各项指标的差异均无统计学意义(均P>0.05)。死亡组患者第7天LAD、LVEDD和E/E'均比第1天显著增加(均P<0.05);LVEF和E/E'(P<0.01)均比第1天显著降低(均P<0.05)。生存组和死亡组患者第1天的各个指标的差异均无统计学意义(均P>0.05);而死亡组患者第7天的LAD、LVEDD和E/E'均比第1天生存组显著增加(均P<0.05),而;LVEF和E'均比第1天显著降低(均P<0.05)。
| 指标 | 生存组(n=84) | 死亡组(n=45) | ||
| 第1天 | 第7天 | 第1天 | 第7天 | |
| LAD (mm) | 29.99±4.27 | 31.12±4.23 | 30.12±4.69 | 34.07±5.37ab |
| LVPWd (mm) | 8.45±0.79 | 8.97±0.64 | 8.61±0.57 | 8.49±0.59 |
| IVSd (mm) | 8.39±0.57 | 8.42±0.61 | 8.55±0.54 | 8.53±0.66 |
| LVEDD (mm) | 33.77±6.12 | 38.47±8.39b | 34.21±5.33 | 43.21±6.98ab |
| LVEF (%) | 69.1±12.5 | 64.4±16.3 | 69.5±11.2 | 54.4±17.6ab |
| E (cm/s) | 69.2±7.4 | 70.1±9.2 | 72.0±9.5 | 69.1±11.5 |
| A (cm/s) | 71.2±7.9 | 73.4±8.2 | 70.7±8.4 | 66.9±14.3 |
| E/A | 0.92±0.20 | 0.94±0.29 | 1.01±0.27 | 0.89±0.46 |
| E’ (cm/s) | 8.47±1.17 | 8.85±1.47 | 8.14±1.43b | 7.16±1.89ab |
| E/E’ | 8.43±0.59 | 8.73±0.67 | 8.89±0.64 | 9.97±0.55ab |
| 注:与生存组相比较,aP<0.05;与第1天相比,bP<0.05 | ||||
以患者28 d预后为因变量,以入院后第7天各项血流动力学及心脏超声指标为自变量进行二分类Logistic回归分析,结果显示APACHE Ⅱ评分、CI和E/E'是患者28 d死亡的独立危险因素(表 4)。
| 变量 | B | SE | P值 | OR | 95% CI |
| APACHE Ⅱ | 0.511 | 0.052 | 0.001 | 1.667 | 1.322~1.863 |
| CI | -0.212 | 0.026 | 0.001 | 0.809 | 0.612~0.912 |
| E/E’ | 0.198 | 0.011 | 0.006 | 1.219 | 1.030~1.501 |
脓毒症休克患者早期的心脏损害主要表现为可逆性的心功能障碍,主要是由于心肌力学的改变导致的血流动力学异常[9],如心肌收缩及舒张功能异常、对容量负荷反应减弱、收缩峰值压力与收缩末期容积比值下降、LVEF下降、心室扩张及代偿性心动过速,尤其是重症患者中,DTI参数异常者比例高达67%,提示心功能障碍是重症患者的一个普遍特征[10]。
超声心动图是临床常用的无创心功能检测方法,可以方便地通过多普勒频移量测量各部位血流速度。二尖瓣口血流流速的变化在二维超声心动图上形成E和A两个峰值:E峰是由舒张期左室主动松弛快速吸入左房血液产生,A峰是由左房收缩血射入左室产生,E/A比值是传统心脏舒张功能的评价指标,其随着年龄增长呈下降趋势[11]。但心房顺应性、心肌松弛状态、瓣膜反流、心室前后负荷变化均会改变血液的充盈形态,使二尖瓣血流参数评价左室舒张功能的可靠性受到一定程度的影响,甚至部分患者还会出现假性正常化。TDI技术的出现,使直接从心肌组织中提取频移信号成为可能,它相对不依赖于前负荷,通过测量室壁或瓣环等组织的纵向移动速度,能更准确地评价心室舒张功能[12-14]。E'代表二尖瓣环舒张早期运动速度峰值,是常用的通过TDI检测心脏舒张功能的指标。Nagueh等[15]研究发现,用E'评价左室舒张功能,与肺毛细血管楔压有很好的相关性(r=0.87)。但E与E'也受左室主动松弛度和年龄的影响,为了消除这种影响,可以通过计算二者比值,使E/E'就成为左房压或左室充盈压的衡量参数。在一般人群中,该参数的正常值为<8。E'降低,E/E'升高提示心肌松弛减弱,左室充盈压升高。因此,E/E'可能是反映左室舒张功能更敏感的指标[16]。
脓毒症休克患者经充分复苏后血流动力学特征是高心排出量和低外周血管阻力,正如本研究入选患者的血流动力学参数变化所示,CI较正常略高而SVRI明显低于正常。然而,尽管心排出量正常或增加,但TDI仍显示E/E'高于正常,提示存在着心脏舒张功能障碍。随着疾病的进展及治疗的进行,生存组患者血流动力学趋于正常;而死亡组患者进展为“低排高阻”型休克。至入院第7天时,CI明显低于生存组,而SVRI明显高于生存组,此时病情将很难逆转。同时心脏超声证实无论是反映收缩功能的EF,还是反映舒张功能的E/E'均出现恶化。E/A也能反映心脏舒张功能,但在本研究中死亡组患者该参数虽有下降趋势,但差异无统计学意义,也表明了该参数在反映心脏舒张功能变化时可能并无E/E'敏感。Logistic回归结果显示APACHEⅡ评分、CI和E/E'是预测28 d死亡的独立危险因素。APACHEⅡ评分综合反映了患者的病情严重程度,与预后相关。反映心脏收缩和舒张功能的CI和E/E'都被证实与预后相关,提示在脓毒症休克的发生和发展过程中心脏收缩和舒张功能同时受损并影响患者预后。而病情缓解后,CI在生存组恢复正常,而E/E'仍然较正常升高(E/E'>8),这提示在脓毒症休克患者中心脏舒张功能受损更易发生且不易恢复。
值得注意的是,在脓毒症休克的早期复苏目标中恰当的容量负荷与血管活性药物的合理应用是临床医生特别关注的,这是对维持血流动力学的稳定具有决定意义。而近年研究提示[17-18],按照更新指南推荐意见进行的液体复苏往往可能会让67%的严重全身感染、感染性休克患者存在容量过负荷的临床表现。而越来越多的研究证实,容量过负荷不仅是引起全身性感染患者心脏舒张功能障碍加重的高危因素之一,而且还与病死率的增加密切相关[19-20]。因此,警惕容量过负荷具有重要的临床意义。本研究中两组患者的CVP与LVEDD均明显增加,一方面可能与心脏舒张功能障碍有关,另一方面也可能容量负荷增加有关。
脓毒症性心功能障碍是决定脓毒症预后的主要因素之一,但其发生机制尚未完全阐明。目前证据认为,心肌缺血和微循环障碍可导致心肌功能不全,多种促炎介质及它们之间的相互作用可通过某些通路抑制心肌功能,导致心功能受损[21-22]。心功能障碍的机制除了涉及心肌细胞凋亡、氧自由基损伤、心肌线粒体损伤及自主神经功能不全等,还可能有其他多种因素参与[23-25],各种机制之间也有相互影响。因此,还需要更多的基础研究来解释本研究中发现的有关现象。
| [1] | Angus D C, Linde-Zwirble W T, Lidicker J, et al. Epidemiology of severe sepsis in the United States: Analysis of incidence, outcome, and associated costs of care[J]. Critical Care Medicine, 2001, 29(7): 1303-1310. DOI:10.1097/00003246-200107000-00002 |
| [2] | Angus DC, Wax RS. Epidemiology of sepsis: an update[J]. Crit Care Med, 2001, 29(7 Suppl): S109-S116. DOI:10.1097/00003246-200107001-00035 |
| [3] | Vincent JL, De Backer D. Circulatory shock[J]. N Engl J Med, 2013, 369(18): 1726-1734. DOI:10.1056/NEJMra1208943 |
| [4] | Rudiger A, Singer M. Mechanisms of sepsis-induced cardiac dysfunction[J]. Crit Care Med, 2007, 35(6): 1599-1608. DOI:10.1097/01.CCM.0000266683.64081.02 |
| [5] | Li L, Hu BC, Chen CQ, et al. Role of mitochondrial damage during cardiac apoptosis in septic rats[J]. Chin Med J, 2013, 126(10): 1860-1866. |
| [6] | Kumar A, Haery C, Parrillo JE. Myocardial dysfunction in septic shock[J]. Crit Care Clin, 2000, 16(2): 251-287. DOI:10.1016/s0749-0704(05)70110-x |
| [7] | Fernandes CJ Jr, Akamine N, Knobel E. Cardiac troponin: a new serum marker of myocardial injury in sepsis[J]. Intensive Care Med, 1999, 25(10): 1165-1168. DOI:10.1007/s001340051030 |
| [8] | Dellinger RP, Levy MM, Rhodes A, et al. Surviving sepsis campaign: international guidelines for management of severe sepsis and septic shock: 2012[J]. Crit Care Med, 2013, 41(2): 580-637. DOI:10.1097/CCM.0b013e31827e83af |
| [9] | 罗滔, 王彦平, 毕志斐, 等. 脓毒症小鼠死亡高发期心功能变化的动态观察[J]. 中国病理生理杂志, 2010, 26(5): 839-843. DOI:10.3969/j.issn.1000-4718.2010.05.002 |
| [10] | Sturgess DJ, Marwick TH, Joyce CJ, et al. Tissue Doppler in critical illness: a retrospective cohort study[J]. Crit Care, 2007, 11(5): R97. DOI:10.1186/cc6114 |
| [11] | Firstenberg MS, Greenberg NL, Main ML, et al. Determinants of diastolic myocardial tissue Doppler velocities: influences of relaxation and preload[J]. J Appl Physiol, 2001, 90(1): 299-307. DOI:10.1152/jappl.2001.90.1.299 |
| [12] | Veselka J. Role of Doppler echocardiography in the diagnostics and therapy of hypertrophic cardiomyopathy[J]. Cas Lek Cesk, 2006, 145(4): 279-283. |
| [13] | Rajiv C, Vinereanu D, Fraser AG. Tissue Doppler imaging for the evaluation of patients with hypertrophic cardiomyopathy[J]. Curr Opin Cardiol, 2004, 19(5): 430-436. DOI:10.1097/01.hco.0000131537.78399.52 |
| [14] | Nikitin NP, Witte KK. Application of tissue Doppler imaging in cardiology[J]. Cardiology, 2004, 101(4): 170-184. DOI:10.1159/000076694 |
| [15] | Nagueh SF, Middleton KJ, Kopelen HA, et al. Doppler tissue imaging: a noninvasive technique for evaluation of left ventricular relaxation and estimation of filling pressures[J]. J Am Coll Cardiol, 1997, 30(6): 1527-1533. DOI:10.1016/s0735-1097(97)00344-6 |
| [16] | 瑞强, 尹家保, 周立明, 等. 多普勒组织成像定量分析心肌梗死后左心室局部与整体的舒缩功能[J]. 中华超声影像学杂志, 2002, 11(5): 261-264. DOI:10.3760/j.issn:1004-4477.2002.05.001 |
| [17] | Kelm DJ, Perrin JT, Cartin-Ceba R, et al. Fluid overload in patients with severe sepsis and septic shock treated with early goal-directed therapy is associated with increased acute need for fluid-related medical interventions and hospital death[J]. Shock, 2015, 43(1): 68-73. DOI:10.1097/SHK.0000000000000268 |
| [18] | Mitchell KH, Carlbom D, Caldwell E, et al. Volume Overload: Prevalence, Risk Factors, and Functional Outcome in Survivors of Septic Shock[J]. Ann Am Thorac Soc, 2015, 12(12): 1837-1844. DOI:10.1513/AnnalsATS.201504-187OC |
| [19] | Vincent JL, Sakr Y, Sprung CL, et al. Sepsis in European intensive care units: results of the SOAP study[J]. Crit Care Med, 2006, 34(2): 344-353. DOI:10.1097/01.ccm.0000194725.48928.3a |
| [20] | Prowle JR, Echeverri JE, Ligabo EV, et al. Fluid balance and acute kidney injury[J]. Nat Rev Nephrol, 2010, 6(2): 107-115. DOI:10.1038/nrneph.2009.213 |
| [21] | 田惠玉, 王澜涛, 田慧艳, 等. 脓毒症早期大鼠肾上腺Toll样受体4、肿瘤坏死因子-α mRNA表达及地塞米松影响[J]. 中华实验外科杂志, 2009, 26(3): 292-294. DOI:10.3760/cma.j.issn.1001-9030.2009.03.008 |
| [22] | Kurt AN, Aygun AD, Godekmerdan A, et al. Serum IL-1beta, IL-6, IL-8, and TNF-alpha levels in early diagnosis and management of neonatal sepsis[J]. Mediators Inflamm, 2007, 2007: 31397. DOI:10.1155/2007/31397 |
| [23] | Flierl MA, Rittirsch D, Huber-Lang MS, et al. Molecular events in the cardiomyopathy of sepsis[J]. Mol Med, 2008, 14(5-6): 327-336. DOI:10.2119/2007-00130.Flierl |
| [24] | Nduka O O, Parrillo J E. The Pathophysiology of Septic Shock[J]. Critical Care Nursing Clinics of North America, 2011, 23(1): 41-66. DOI:10.1016/j.ccell.2010.12.003 |
| [25] | Andrades ME, Ritter C, Dal-Pizzol F. The role of free radicals in sepsis development[J]. Front Biosci (Elite Ed), 2009, 1: 277-287. |
 2018, Vol. 27
2018, Vol. 27




