肺动脉高压(pulmonary hypertension,PH)指肺动脉压力升高超过一定界值的一种血流动力学和病理生理状态,可导致右心衰竭。其诊断标准为:静息状态下经右心导管评估的平均肺动脉压≥25mmHg,临床上分为5型:1型-动脉性肺动脉高压;2型-继发于左心疾病的肺动脉高压;3型-继发于肺部疾患或低氧的肺动脉高压;4型-慢性血栓性肺动脉高压;5型-原因不明或机制复杂的肺动脉高压。临床上大部分PH是由其他疾病进展而来,是继发于危重病的结果,患者一旦出现肺动脉高压往往使病情迅速恶化。脓毒症是因感染引起宿主反应失调而导致危及生命的器官功能障碍[1],感染引起的全身炎症反应释放的细胞因子及炎症介质导致血管收缩、血管内皮细胞损伤和毛细血管内微血栓形成[2],累及肺血管会造成肺动脉压力升高。同时,脓毒症并发急性肺损伤时导致低氧血症、脓毒症心肌损伤引起左心功能障碍,与炎症共同促进PH的发生发展。本研究以脓毒症患者作为研究对象,回顾相关临床资料,分析脓毒症并发PH的发生率以及患者的临床特征,探讨脓毒症患者发生PH的危险因素,为临床诊治脓毒症合并PH提供理论依据。
1 资料与方法 1.1 一般资料采用回顾性分析方法,选择2015年6月至2017年6月北京大学第三医院急诊科入院24 h内出现脓毒症的患者作为研究对象,均符合2016年美国重症医学会与欧洲重症医学会联合发布的脓毒症3.0定义及诊断标准:脓毒症相关的序贯器官功能衰竭评分(sequentialorgan failure assessment,SOFA)急性改变≥2分,即“脓毒症=感染+ SOFA ≥2 ”。排除标准:①慢性肺部疾病;②慢性器官功能衰竭;③急性肺栓塞。
1.2 分组根据是否存在PH分为PH组和非PH组。PH诊断参照2015 ESC肺动脉高压管理指南:超声心动图检测三尖瓣反流速率(tricuspid regurgitation velocity, TRV)≥2.9 m/s(当TRV 2.9~3.4 m/s,有其他超声心动图参数支持肺动脉高压)。
1.3 方法⑴记录入选患者性别、年龄、呼吸、心率、血压、入院24 h内APACHEⅡ评分以及SOFA评分等临床资料;⑵患者入院24 h内常规测定血红蛋白、红细胞比容、白蛋白及血肌酐;⑶入院24 h内检测N末端脑钠肽前体、肌钙蛋白I、降钙素原和D-二聚体,使用仪器为AQT90 FLEX快速免疫分析仪(丹麦雷度);⑷入院24 h内使用ABL90 FLEX自动血气分析仪(丹麦雷度)检测动脉血气pH值、乳酸、氧分压,并计算氧合指数;⑸入院72 h内完成超声心动图检查,测定左房内径(LAD)、左房压(LAP)、右室舒张末期内径(RVDd)、左心室舒张未内径(LVDd)、左室射血分数(LVEF)、三尖瓣反流速率(TRV)、肺动脉收缩压(PASP)、二尖瓣口舒张早期血流峰速度(E)、二尖瓣口舒张晚期血流峰速度(A)及二尖瓣瓣环舒张早期速度(E'),计算E/A、E/E'值,使用仪器为彩色多普勒超声诊断仪Vivid E99(美国通用)。
1.4 统计学方法应用SPSS 22.0软件进行统计分析,符合正态分布的计量资料以均数±标准差(x±s)表示,组间比较采用成组t检验或t'检验;非正态分布的计量资料经自然对数转化为正态分布后进行分析。计数资料以例数(百分比)表示,组间比较采用χ2检验;多因素Logistic回归分析脓毒症并发PH的危险因素,绘制受试者工作特征曲线(ROC曲线),计算曲线下面积(AUC),分析变量的灵敏度和特异度。以P<0.05为差异有统计学意义。
2 结果 2.1 脓毒症肺动脉高压患者临床资料最终纳入患者136例,脓毒症肺动脉高压患者32例,发病率为23.5%;脓毒症休克患者36例,14例发生PH,发病率为38.9%;根据超声心动图肺动脉高压的严重程度分级标准(轻度肺动脉高压:PASP<40mmHg、中度肺动脉高压:PASP 40~69 mmHg、重度肺动脉高压:SPAP≥70 mmHg),其中27例患者为轻度肺动脉高压,5例患者为中度肺动脉高压, 脓毒症患者并发PH的严重程度较轻; 病因构成情况,继发于左心功能不全13例(40.63%),继发于呼吸衰竭(低氧)9例(28.13%),继发于左心功能不全和呼吸衰竭10例(31.25%), 继发于左心功能不全的PH所占比例最高,见表 1。
| 指标 | 例数 | 构成比(%) |
| PH分级 | ||
| 轻度 | 26 | 81.25 |
| 中度 | 6 | 18.75 |
| 病因构成 | ||
| 左心功能不全 | 13 | 40.63 |
| 呼吸衰竭 | 9 | 28.13 |
| 左心功能不全和呼吸衰竭 | 10 | 31.2 |
PH组28 d死亡15例,病死率46.88%;非PH组28 d死亡27例,病死率25.96%;两组28 d病死率比较χ2=5.014、P=0.025,差异有统计学意义。
2.3 PH组与非PH组患者一般临床资料比较两组间性别、年龄、心率、平均动脉压、呼吸频率、APACHEⅡ、SOFA评分比较差异均无统计学意义(P>0.05),见表 2。
| 组别 | 性别 (男/女) |
年龄 (岁) |
心率 (次/min) |
平均动脉压 (mmHg) |
呼吸 (次/min) |
APACHE-Ⅱ | SOFA |
| LVDD组(n =32) | 23 9 | 72.46±17.68 | 107.05±21.52 | 71.65±16.61 | 25.25±4.72 | 14.05±5.17 | 4.20±1.67 |
| 非LVDD组(n =104) | 59 45 | 69.97±17.16 | 107.06±25.45 | 72.67±14.73 | 24.25±5.36 | 13.15±5.92 | 3.50±1.41 |
| t/t'/χ2值 | 2.345 | 0.615 | 0.001 | 0.236 | 0.697 | 0.609 | 1.692 |
| P值 | 0.126 | 0.540 | 0.999 | 0.813 | 0.490 | 0.102 | 0.102 |
与非PH组比较,PH组氧合指数减低,NT-proBNP水平升高,超声心动图检测E值、E/A值和左房内径增大,两组比较差异均有统计学意义(P<0.05),见表 3。
| 组别 | lgNT-proBNP | lgTNI | 肌酐 (umol/L) |
乳酸 (mmol/L) |
降钙素原 (ug/L) |
D-二聚体 (mg/L) |
| LVDD组(n =32) | 3.67±0.41 | -1.86±0.54 | 132.12±117.73 | 4.53±3.53 | 29.13±49.63 | 6.17±8.60 |
| 非LVDD组(n =104) | 3.33±0.59 | -1.62±0.69 | 127.39±113.23 | 4.21±3.64 | 29.35±49.96 | 4.25±6.49 |
| t/t'值 | 3.101 | 1.623 | 0.177 | 0.362 | 0.019 | 1.187 |
| P值 | 0.003 | 0.109 | 0.861 | 0.719 | 0.986 | 0.239 |
| 组别 | PaO2/FiO2 | pH | ALB (g/L) |
Hct (%) |
PLT (×109/L) |
HB (g/L) |
| LVDD组(n =32) | 291.90±51.62 | 7.35±0.15 | 32.00±6.09 | 34.56±10.16 | 187.09±106.27 | 111.42±24.83 |
| 非LVDD组(n =104) | 326.40±88.16 | 7.37±0.13 | 29.94±6.44 | 34.00±8.93 | 234.50±132.13 | 114.90±30.53 |
| t/t'值 | 2.445 | 0.692 | 1.271 | 0.231 | 1.450 | 0.462 |
| P值 | 0.017 | 0.491 | 0.209 | 0.819 | 0.152 | 0.646 |
| 组别 | LVEF (%) |
E (cm/s) |
A (cm/s) |
E' (cm/s) |
E/A | |
| LVDD组(n =32) | 68.28±7.32 | 86.12±30.43 | 83.20±20.30 | 10.61±3.73 | 1.09±0.46 | |
| 非LVDD组(n =104) | 64.65±12.33 | 67.73±21.49 | 83.95±19.97 | 9.26±3.45 | 0.83±0.29 | |
| t/t'值 | 1.836 | 2.819 | 0.165 | 1.665 | 2.609 | |
| P值 | 0.071 | 0.008 | 0.869 | 0.099 | 0.014 | |
| 组别 | E/E' | LAD (mm) |
LAP (mmHg) |
RVDd (mm) |
LVDd (mm) |
|
| LVDD组(n =32) | 8.83±5.35 | 36.49±5.97 | 11.52±5.67 | 20.26±3.19 | 46.54±5.20 | |
| 非LVDD组(n =104) | 7.33±3.10 | 31.32±4.69 | 10.63±3.86 | 18.83±3.30 | 44.15±6.25 | |
| t/t'值 | 1.339 | 3.833 | 0.677 | 1.822 | 1.679 | |
| P值 | 0.191 | 0.001 | 0.505 | 0.071 | 0.096 | |
| 注:PH酸碱值;PO2氧分压;PCO2二氧化碳分压;HCO3-碳酸氢根;Lac乳酸;LAD左房内径;LAP左房压;RVDd右室舒张末期内径;LVDd左心室舒张未内径; | ||||||
单因素分析显示,氧合指数、N末端脑钠肽前体、E值、E/A值、E'值、LAD与脓毒症肺动脉高压相关(P<0.05)。将上述单因素分析中有统计学意义的指标纳入多因素Logistic回归模型,分析显示,LAD是脓毒症出现肺动脉高压的独立危险因素(P<0.05),见表 4。
| 指标 | B值 | OR值 | 95% CI | P值 |
| lgNT-proBNP | 0.888 | 2.430 | 0.768~7.686 | 0.131 |
| PaO2/FiO2 | -0.005 | 0.995 | 0.987~1.003 | 0.204 |
| E(cm/s) | 0.002 | 1.002 | 0.974~1.031 | 0.887 |
| E/A | 1.394 | 4.029 | 0.686~23.679 | 0.123 |
| LAD(mm) | 0.181 | 1.198 | 1.043~1.376 | 0.010 |
| 注:OR为优势比,95% CI为95%可信区间 | ||||
绘制LAD预测脓毒症肺动脉高压的ROC曲线,得到曲线下面积(AUC)为0.723(95%可信区间为0.611~0.835),测截点值为31 mm,敏感度为82.6%,特异度为49.0%,见图 1。
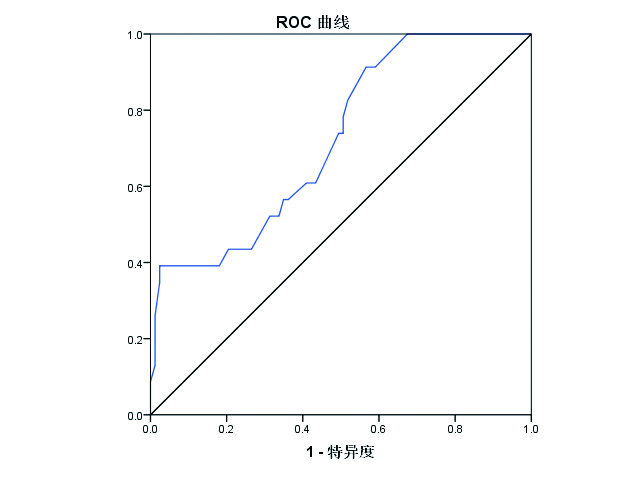
|
| 图 1 LAD预测脓毒症肺动脉高压的ROC曲线 Figure 1 ROC curve of Prediction of LAD on pulmonary hypertension in sepsis patients |
|
|
PH被定义为肺动脉压力上升,通常是由于一些病因导致肺血管阻力上升和(或)肺静脉压升高[3]。越来越多的研究表明,炎症在肺动脉高压的进展中发挥着重要的作用,炎性细胞及其分泌的细胞因子影响着肺血管的收缩和舒张功能,炎性细胞的浸润、迁移和聚集影响肺动脉内皮和平滑肌细胞的增殖,导致肺动脉的重构和血管内血栓形成[4-5]。脓毒症的本质是严重感染导致的全身性炎症反应,作用的靶器官是血管内皮细胞和微循环[6]。脓毒症时炎症细胞及其释放的炎症因子可以直接损伤肺血管内皮细胞,引起肺血管收缩、血管内微血栓形成和微循环障碍,导致PH[7]。有研究证实,当肺血管内皮细胞受到内毒素、TNF等炎症因子刺激后,可造成肺部微血管损伤[8],Huertas等[9]研究亦发现,2L-1β和TNF-α可引发纤连蛋白的蓄积,可致肺血管受损,继而发生PH。炎症因子还可以引起心肌损伤和急性肺损伤,造成左心功能不全和低氧血症,诱发2型和3型PH。脓毒症并发PH临床并不少见,然而,针对脓毒症患者PH发病情况的研究依然缺乏。
本研究结果显示,脓毒症PH的发病率为23.5%,低于Jentzer等所报道的危重患者PH的发病率(42%),而脓毒症的危重情况——脓毒症休克患者中PH的发病率为38.9%,接近危重患者PH的发病率。在脓毒症PH患者中,40.6%继发于左心功能不全,所占比例最高,呼吸衰竭所致PH为28.1%,31.2%为左心功能不全和呼吸衰竭共同作用的结果,2015年欧洲心脏病学会肺动脉高压管理指南也指出左心疾病相关PH是最常见的。在32例脓毒症PH患者中,轻度PH为26例(占81.2%),中度PH为6例(占18.8),由此可见,脓毒症导致的PH其程度多较轻,这可能与左心功能不全是脓毒症出现PH的主要原因有关,研究发现左心疾病相关PH肺动脉压力升高多不明显。本研究结果显示PH组28 d病死率高于非PH组,这也支持脓毒症出现肺动脉高压时病情容易恶化、诱发或加重右心功能不全。
单因素分析发现,PH组氧合指数降低,N末端脑钠肽前体水平升高,两组间差异有统计学意义P<0.05),提示低氧血症和心功能障碍与脓毒症PH的发生密切相关。在脓毒症患者中, 急性肺损伤、急性呼吸窘迫综合征等是常见的并发症,临床上表现为低氧血症,而低氧可引起肺动脉压升高,发生低氧性肺血管收缩,而低氧持续存在时,则形成不可逆性的肺血管重构,这也是低氧性肺动脉高压发病的重要病理基础[10-12]。左心疾病相关性肺动脉是最常见的一类PH,超过40%的脓毒症患者存在心功能障碍,以左心受累最为多见,而N末端脑钠肽前体是心力衰竭及心功能预测敏感而有效的指标[13],其水平升高提示左心功能不全在脓毒症PH的发生中起着重要的作用。超声心动图指标E值、E/A值在PH组增加,两组间差异有统计学意义(P<0.05)。童晓明等通过心导管检测将56例患者分为肺动脉高压组和肺静脉高压组,研究发现肺静脉高压组E值、E/A值增大,而肺动脉高压组则相反,E/A值是鉴别二者的可靠指标,这也提示脓毒症患者肺动脉压力升高的原因中,左心功能不全造成的肺静脉压力升高为主,而肺血管阻力上升不显著。
多因素分析显示,左房内径增大是脓毒症出现PH的独立危险因素。左房增大往往提示左心舒张功能不全[14],左心压力升高并向肺循环逆传,肺静脉压力被动性升高,该类型被称为静脉型肺动脉高压。研究认为,左心衰竭患者肺动脉高压病变初期,血管会出现反应性改变,主要表现为肺微血管痉挛;而在病变后期,在长期缺氧、炎性反应等因素的诱导下,肺血管内皮受损,一氧化氮合成障碍,肺血管系统可以发生重塑[15]。本研究结果说明脓毒症导致左心功能障碍在肺动脉高压形成的早期起到主要作用,脓毒症并发PH与左心功能密切相关。LAD预测脓毒症并发PH的ROC曲线下面积(AUC)为0.723,有一定预测价值。本研究的不足之处是使用超声心动图指标诊断PH,不能鉴别肺动脉压力升高的原因是血管阻力增加还是肺静脉压力增高、或者二者并存,下一步研究拟引入右心导管技术,更加全面和准确的评价肺动脉高压。
综上所述,脓毒症发生PH其肺动脉压力多为轻度升高,且以2型-继发于左心疾病的肺动脉高压多见,氧合指数降低和N末端脑钠肽前体与PH的发生相关,左房内径是脓毒症发生PH的独立危险因素,早期以肺静脉压力增高为主。
| [1] | Singer M, Deutschman CS, Seymour CW, et al. The third international consensus de?nitions for sepsis and septic shock (sepsis-3)[J]. JAMA, 2016, 315(8): 801-810. DOI:10.1001/jama.2016.0287 |
| [2] | 邓秋明, 陈爱和, 尚东, 等. 肝素影响脓毒症休克血管内皮细胞功能及预后[J]. 中华急诊医学杂志, 2017, 26(4): 377-380. DOI:10.3760/cma.j.issn.1671-0282.2017.04.004 |
| [3] | 赵万桂, 顾虹. 超声心动图评估肺动脉高压的研究进展[J]. 心肺血管病杂志, 2016, 35(12): 1005-1007. DOI:10.3969/j.issn.1007-5062.2016.12.021 |
| [4] | Price LC, Wort SJ, Perros F, et al. Inflammation in pulmonary arterial hypertension[J]. Chest, 2012, 141(1): 210-221. DOI:10.1378/chest.11-0793 |
| [5] | 王辰, 程显声. 肺动脉高压[M]. 北京: 人民卫生出版社, 2014. |
| [6] | 孙力超, 张国强. 促血管生成素(Ang)-一种新的脓毒症血清标志物[J]. 中华急诊医学杂志, 2016, 24(2): 128-132. DOI:10.3760/cma.j.issn.1671-0282.2015.02.003 |
| [7] | Sharawy N, Lehmann C. New directions for sepsis andseptic shock research[J]. J Surg Res, 2015, 194(2): 520-527. DOI:10.1016/j.jss.2014.12.014 |
| [8] | Stacher E, Graham BB, Hunt JM, et al. Modern age pathology of pulmonary arterial hypertension[J]. Am J Respir Crit Care Med, 2012, 186(3): 261-272. DOI:10.1164/rccm.201201-0164OC |
| [9] | Huertas A, Perros F, Tu L, et al. Immune dysregulation and endothelial dysfunction in pulmonary arterial hypertension: a complex interplay[J]. Circulation, 2014, 129(12): 1332-1340. DOI:10.1161/CIRCULATIONAHA.113.004555 |
| [10] | Madonna R, Cocco N, De Caterina R. Pathways and drugs in pulmonary arterial hypertension-focus on the role of endothelin receptor antagonists[J]. Cardiovasc Drugs Ther, 2015, 29(5): 469-479. DOI:10.1007/s10557-015-6605-6 |
| [11] | Gao Y, Chen T, Raj JU. Endothelial and smooth muscle cell interactions in the pathobiology of pulmonary hypertension[J]. Am J Respir Cell Mol Biol, 2016, 54(4): 451-460. DOI:10.1165/rcmb.2015-0323TR |
| [12] | 黄昭, 陈裕胜, 杨自力, 等. 血管外肺水在脓毒症合并急性肺损伤/急性呼吸窘迫综合征患者中作用的研究[J]. 中华急诊医学杂志, 2012, 21(3): 244-248. DOI:10.3760/cma.j.issn.1671-0282.2012.03.004 |
| [13] | 郭玉红, 刘清泉. 脓毒症心肌功能障碍的研究进展[J]. 中华急诊医学杂志, 2017, 26(3): 361-366. DOI:10.3760/cma.j.issn.1671-0282.2017.03.029 |
| [14] | Paulus WJ, Tsch pe C, Sanderson JE, et al. How to diagnose diastolic heart failure:a consensus statement on the diagnosis of heart failure with normal left ventricular ejection fraction by the Heart Failure and Echocardiography Associations of the European Society of Cardiology[J]. Eur Heart J, 2007, 28(20): 2539-2550. DOI:10.1093/eurheartj/ehm412 |
| [15] | Corte T J, Mcdonagh T A, Wort S J. Pulmonary hypertension in left heart disease: a review[J]. Intern J Card, 2012, 156(3): 253-258. DOI:10.1016/j.ijcard.2011.06.013 |
 2018, Vol. 27
2018, Vol. 27




