间质性肺病(interstitial lung disease, ILD)是一组以肺泡单位的炎症和间质纤维化为基本病变的异质性非肿瘤和非感染性肺部疾病的总称[1]。间质性肺病的病因复杂多样,临床尤以特发性肺纤维化(idiopathic pulmonary fibrosis, IPF)为常见。尽管不同类型的ILD临床和组织病理学特点差别较大,但细胞外基质(extracellular matrix, ECM)的大量沉积在间质性肺病的发病机制中都起了重要作用,ECM主要由胶原、糖胺聚糖和纤维连接蛋白等成分组成,其中最丰富的成分是胶原[2]。本文将ECM血清检测指标包括层粘连蛋白(laminin, LN)、Ⅳ型胶原(type Ⅳ collagen, Ⅳ C)、Ⅲ型前胶原N端肽(type Ⅲ procollagen N-terminal peptide, P Ⅲ NP)和透明质酸(hyaluronic acid, HA)用于IPF临床检测,分析它们与IPF患者病情严重程度和预后的相关性,以探讨这四项指标在IPF临床检测中的应用价值。
1 资料与方法 1.1 一般资料回顾性分析上海市肺科医院从2015年2月至2016年7月收治的IPF患者160例,男性94例,女性66例,年龄(65±4)岁。该研究经上海市肺科医院伦理委员会批准(K13-108),IPF的诊断标准参照ATS/ERS 2013年修订的临床诊断标准[3];同时在本院健康体检人群中随机(随机数字法)选取与IPF患者年龄相当的正常对照组160例,其中男性90例,女性70例,年龄(62±3)岁。两组研究对象均无恶性肿瘤病史、无糖皮质激素/免疫抑制剂使用,无严重的其他系统疾病和脏器功能不全,160例IPF患者根据病情严重程度分为急性加重(acute exacerbation, AE)组和稳定组(stable),AE-IPF诊断标准[3]为患者在数天至数周内(通常小于30 d)气促症状持续加重,气体交换异常(PaO2/FIO2<225 mmHg;或PaO2下降 > 10 mmHg),胸部影像学阴影增加。急性加重组39例,稳定组121例。
1.2 纤维化四项指标检测IPF组患者入院后第2天清晨空腹抽取静脉血5 mL,正常对照组入选研究后第2天清晨空腹抽取静脉血5 mL,分离血清,3 000 r/min离心15 min,取上清液进行测定。仪器使用中国上海核所日环光电仪器有限公司生产的SN-695B型智能放免γ测量仪,放射免疫分析试剂盒由中国北京科美生物技术有限公司提供,操作步骤严格按照产品使用说明书进行,同时使用试剂盒所提供的质控物进行质量控制,其结果均在质控范围内。
1.3 胸部高分辨CT(high resolution computed tomography,HRCT)评分评分标准(表 1)参照文献[4]分别由1名影像科专业人员和2名临床医师各自进行评分,汇总后计算平均分。
| 严重度评分 | 范围评分 | ||
| 磨玻璃影 | 1 | 1~3肺段 | 1 |
| 胸膜边缘不规则 | 2 | ||
| 肺间隔和胸膜下条索片状影 | 3 | 4~9肺段 | 2 |
| 蜂窝样变 | 4 | ||
| 胸膜下囊泡 | 5 | > 9肺段 | 3 |
| 注:HRCT评分=严重度评分+范围评分(0~30) | |||
对IPF组患者行肺功能检测,主要分析用力肺活量占预计值百分比(FVC % pred)和一氧化碳弥散量占预计值百分比(DLCO % pred),分别反映患者肺通气功能和肺弥散功能变化,是学术界公认的评价间质性肺病肺功能变化的关键指标[5],急性加重39例因病情严重无法完成肺功能检测。
1.5 随访对160例IPF患者通过门诊或电话随访,以死亡作为观察终点事件,记录总病死率和1年内病死率,比较IPF组1年内死亡与存活患者之间纤维化四项指标的差异。所有患者随访截止日期2017年7月31日。
1.6 统计学方法使用SPSS 16.0进行统计,计量资料以均数±标准差(x±s)表示,组间比较成组t检验,对LN、Ⅳ C、P Ⅲ NP、HA与FVC % pred、DLCO % pred、胸部HRCT评分的关系用Bivariate Pearson法进行线性相关分析。以P < 0.05为差异有统计学意义。
2 结果 2.1 两组基本情况及血清LN、Ⅳ C、P Ⅲ NP、HA测定结果两组研究对象性别、年龄差异无统计学意义(P > 0.05),IPF组吸烟率明显高于正常对照组(P < 0.01;表 2)。IPF组血清LN、Ⅳ C、P Ⅲ NP、HA四项指标均明显高于正常对照组(P < 0.01;表 3)。
| 指标 | IPF组 (n=160) |
正常对照组 (n=160) |
P值 |
| 男/女(比例) | 94/66(1.42:1) | 90/70(1.29:1) | 0.523 |
| 年龄 | 65±4 | 62±3 | 0.093 |
| 吸烟史例数(%) | 136(85.0%) | 60(37.5%) | 0.001 |
| FVC (L)(n=121)a | 2.49±0.87 | - | - |
| FVC (% pred)(n=121)a | 69.54±16.42 | - | - |
| DLCO (% pred)(n=121)a | 52.34±21.49 | - | - |
| HRCT评分 | 17.48±7.32 | - | - |
| 急性加重a | 39 | - | - |
| 注:a160例IPF患者中,39例为IPF急性加重患者,无法完成肺功能检查 | |||
| 组别 | LN(ng/ml) | ⅣC(ng/ml) | PIIINP(ng/ml) | HA(ng/ml) |
| IPF组(n=160) | 111.07±46.98a | 95.11±35.46a | 7.34±2.75a | 196.85±72.43a |
| 正常对照组(n=160) | 90.98±47.48 | 75.47±31.54 | 4.79±0.71 | 71.12±34.72 |
| F值 | 0.034 | 3.220 | 11.810 | 33.208 |
| t值 | 2.984 | 3.713 | 10.851 | 18.450 |
| P值 | < 0.01 | < 0.01 | < 0.01 | < 0.01 |
| 注:与正常对照组相比, aP < 0.01 | ||||
IPF组患者血清LN、Ⅳ C、P Ⅲ NP、HA与肺功能用力肺活量占预计值百分比(FVC % pred)、一氧化碳弥散量占预计值百分比(DLCO % pred)均呈负相关关系(P < 0.05;表 4、图 1)。
| 指标 | LN | ⅣC | PIIINP | HA | ||||
| r值 | P值 | r值 | P值 | r值 | P值 | r值 | P值 | |
| FVC (%pred) | -0.391 | < 0.01 | -0.590 | < 0.01 | -0.536 | < 0.01 | -0.468 | < 0.01 |
| DLCO (%pred) | -0.232 | 0.01 | -0.603 | < 0.01 | -0.370 | < 0.01 | -0.196 | 0.03 |
| HRCT评分 | 0.479 | < 0.01 | 0.535 | < 0.01 | 0.406 | < 0.01 | 0.666 | < 0.01 |
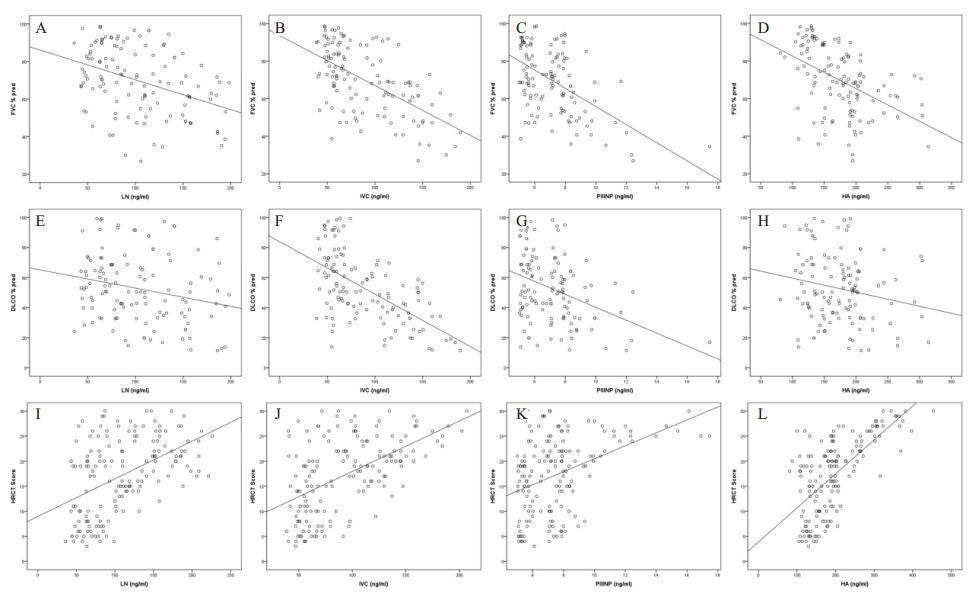
|
| 图 1 血清LN、Ⅳ C、P Ⅲ NP、HA与肺功能FVC % pred、DLCO % pred、胸部HRCT评分关系 Figure 1 Correlation of serum levels of LN, Ⅳ C, P Ⅲ NP, and HA to percentage of forced vital capacity in the prediction value, percentage of diffusing capacity of the lung for carbon monoxide in the prediction value, and HRCT score |
|
|
IPF组患者血清LN、Ⅳ C、P Ⅲ NP、HA与胸部HRCT评分呈正相关关系(P < 0.01;表 4、图 1)。
2.4 IPF稳定期患者和急性加重患者血清LN、Ⅳ C、P Ⅲ NP、HA测定结果IPF急性加重患者血清LN、Ⅳ C、P Ⅲ NP、HA明显高于IPF稳定期患者(P < 0.05;表 5)。
| 组别 | LN(ng/mL) | ⅣC(ng/mL) | P Ⅲ NP(ng/mL) | HA(ng/mL) |
| IPF稳定组(n=121) | 101.89±32.76 | 88.65±31.98 | 7.07±1.89 | 173.11±46.86 |
| IPF急性加重组(n=39) | 136.12±52.76a | 106.21±39.68 b | 8.91±2.85a | 271.02±92.44a |
| F值 | 4.603 | 0.616 | 11.028 | 30.393 |
| t值 | -3.553 | -2.562 | -3.426 | -6.268 |
| P值 | 0.001 | 0.011 | 0.001 | 0.000 |
| 注:与IPF稳定组相比, a P < 0.01; b P < 0.05 | ||||
160例IPF患者,随访4~120周,中位时间50周,死亡54例(总体病死率33.75%),1年内死亡24例(1年病死率15%);1年内死亡患者血清LN、Ⅳ C、P Ⅲ NP、HA明显高于1年内存活者(P < 0.01;表 6),提示血清LN、Ⅳ C、P Ⅲ NP、HA可能与疾病的转归密切相关,对患者的预后可能有预示作用。
| 组别 | LN(ng/mL) | ⅣC(ng/mL) | P Ⅲ NP(ng/mL) | HA(ng/mL) |
| IPF 1年内存活组(n=136) | 102.76±42.86 | 88.98±31.23 | 7.09±1.79 | 187.57±66.87 |
| IPF 1年内死亡组(n=24) | 153.07±50.22a | 114.14±44.97a | 9.65±3.61a | 250.07±84.78a |
| F值 | 1.062 | 3.357 | 24.045 | 3.224 |
| t值 | -5.173 | -3.223 | -3.386 | -3.983 |
| P值 | 0.000 | 0.002 | 0.002 | 0.000 |
| 注:与IPF 1年内存活组相比, a P < 0.01 | ||||
特发性肺纤维化(IPF)是一种病因不明的进行性发展的肺部疾病,病理过程为进展缓慢的弥漫性肺泡炎和(或)肺泡结构紊乱,最终导致肺泡结构破坏,形成肺纤维化和蜂窝肺。IPF预后差,大部分患者因肺纤维化导致肺动脉高压、肺源性心脏病和右心衰竭,存活时间仅3~5年[6]。各种类型的间质性肺病虽然有着巨大的异质性,但最终都是以肺组织的疤痕化为结局。其发病机制的共同特征是体内胶原代谢的失衡,即胶原合成超过分解,或胶原合成增加和(或)胶原分解减少而导致胶原过多地沉积在肺实质内。
本文主要检测四项与ECM相关的血清指标,层粘连蛋白(LN)是一种大分子非胶原糖蛋白,由一条重链和两条轻链借二硫键交联而成,主要存在于基底膜透明层中,能够诱导细胞黏着、生长与分化等,能吸引、黏附肺上皮细胞、成纤维细胞及炎性细胞,并刺激T淋巴细胞和巨噬细胞分泌淋巴因子而促进成纤维细胞和上皮细胞合成胶原[7]。Ⅳ型胶原(Ⅳ C)是由分子交联形成的一种网状结构,Ⅳ型胶原是肺组织内细胞外基质的重要成分,与LN构成基底膜的骨架结构[8]。Ⅲ型前胶原N端肽(P Ⅲ NP)是由Ⅲ型前胶原在细胞外沉积前,经氨基酸端肽酶裂解所产生的氨基端多肽,在此过程中P Ⅲ NP与Ⅲ型前胶原呈等分子浓度,并进入血液,血清P Ⅲ NP可反映Ⅲ型胶原合成情况,是表示结缔组织代谢的较好指标[9-10]。透明质酸(HA)是一种主要的大分子黏性糖胺聚糖.可由Ⅱ型肺上皮细胞、内皮细胞及肺成纤维细胞分泌,其中成纤维细胞可受致病因子(如氧自由基)的刺激合成大量HA。HA在肺组织主要分布于毛细血管和细支气管周围的间质中。广泛表达于细胞外基质,也可表达于细胞表面[11]。
血清LN、Ⅳ C、P Ⅲ NP、HA已被用于评价肝纤维化的严重度和预后[12-13]。胡迎春等[14]报道在铀矿粉尘所致的肺纤维化大鼠模型肺组织中Ⅰ型胶原(Type Ⅰ Collagen, ⅠC)和Ⅲ型胶原(Type Ⅲ Collagen, ⅢC)增生,LN过度表达。Teles-Grilo等[8]报道在博莱霉素所致肺纤维化大鼠模型肺组织中,ⅠC和Ⅳ C表达增加,并且在新的肺血管周围沉积。Bjermer等比较了22例IPF患者和21例正常对照组支气管镜肺泡灌洗液P Ⅲ NP、HA水平,IPF患者P Ⅲ NP、HA水平显著高于正常对照组,另外肺功能恶化和影像学进展的IPF患者P Ⅲ NP、HA水平显著高于稳定的IPF患者。Inokoshi等[11]报道间质性肺病患者血清HA显著高于正常对照组,在间质性肺病急性加重患者中血清HA更高。国内外相关研究证明肺纤维化患者血清LN、Ⅳ C、P Ⅲ NP、HA明显增高,但这些研究都仅是检测其中1~2项,并且样本量均较小。本研究首次将这四项血清指标同时用于IPF患者的临床检测,发现IPF患者血清LN、Ⅳ C、P Ⅲ NP、HA显著高于正常对照组。
IPF的胸部HRCT表现多样,可表现为磨玻璃影、胸膜边缘不规则、肺间隔和胸膜下条索片状影、蜂窝样变、胸膜下囊泡等,肺功能表现为限制性通气功能障碍、弥散功能下降。胸部影像学的表现及肺功能受损的严重程度与间质性肺病本身严重程度有较好的相关性,常用来评价疾病的转归[15-17]。本研究将IPF患者的血清LN、Ⅳ C、P Ⅲ NP、HA与肺功能FVC % pred、DLCO % pred以及胸部HRCT评分进行相关性分析,发现LN、Ⅳ C、P Ⅲ NP、HA与肺功能FVC % pred、DLCO % pred呈负相关,随着FVC % pred、DLCO % pred的下降,LN、Ⅳ C、P Ⅲ NP、HA呈增高趋势。并发现LN、Ⅳ C、P Ⅲ NP、HA与胸部HRCT评分呈正相关,随着胸部HRCT评分增高,LN、Ⅳ C、P Ⅲ NP、HA呈增高趋势。由此可见,血清LN、Ⅳ C、P Ⅲ NP、HA能较好地反映IPF的严重程度。
特发性肺纤维化患者死亡多因病情突然恶化所致,对于这种在病情相对稳定期突然出现的病情急剧恶化,故称之为“特发性肺纤维化急性加重(acute exacerbation of IPF, AE-IPF)”。AE-IPF可发生在IPF发展过程中的任何阶段,病情凶险,进展迅速,病死率高,预后极差[3]。Kubo等[18]报道大约57%的IPF患者3年内发生急性加重,病死率53%。Kim等[19]报道AE-IPF病死率达到78%。Song等[20]报道IPF患者急性加重发生率35.4%,住院病死率50%以上,1年生存率56%,3年生存率仅18.4%。另有报道呈急性加重后1年病死率几乎达100%[21]。可见AE-IPF的高发生率和高病死率是影响IPF患者生存率和生活质量的最主要原因。本文比较了稳定组和急性加重组IPF患者血清LN、Ⅳ C、P Ⅲ NP、HA的变化,发现急性加重组患者血清LN、Ⅳ C、P Ⅲ NP、HA相比稳定组患者明显增高。IPF患者随访发现1年内死亡组血清LN、Ⅳ C、P Ⅲ NP、HA显著高于1年内存活组,因此,这四项指标可能能够提示IPF患者的生存预后情况。
尽管本研究结果提示血清LN、Ⅳ C、P Ⅲ NP、HA水平能够较好反映IPF的严重程度和预后,但仍需要在IPF不同疾病阶段动态观察四项指标的变化情况来进一步验证,将在以后的研究中进一步观察。
综上所述,血清LN、Ⅳ C、P Ⅲ NP、HA在IPF患者中明显增高,能较好反映疾病的严重程度,与临床常用的检查手段有较好的相关性,在IPF急性加重患者中明显增高。IPF部分患者尤其是急性加重期患者,缺氧症状明显,无法完成胸部HRCT、肺功能等检查,血清LN、Ⅳ C、P Ⅲ NP、HA测定为判断IPF的严重程度及预后提供了一种无创、便捷、有效的检查手段。
| [1] | 李惠萍. 特发性肺纤维化的诊断和治疗[J]. 中华结核和呼吸杂志, 2014, 37(9): 647-647. DOI:10.3760/cma.j.issn.1001-0939.2014.09.004 |
| [2] | Lee R, Reese C, Bonner M, et al. Bleomycin delivery by osmotic minipump: similarity to human scleroderma interstitial lung disease[J]. Am J Physiol Lung Cell Mol Physiol, 2014, 306(8): L736-748. DOI:10.1152/ajplung.00210.2013 |
| [3] | Travis WD, Costabel U, Hansell DM, et al. An official American Thoracic Society/European Respiratory Society statement: Update of the international multidisciplinary classification of the idiopathic interstitial pneumonias[J]. Am J Respir Crit Care Med, 2013, 188(6): 733-748. DOI:10.1164/rccm.201308-1483ST |
| [4] | Warrick JH, Bhalla M, Schabel SI, et al. High resolution computed tomography in early scleroderma lung disease[J]. J Rheumatol, 1991, 18(10): 1520-1528. DOI:10.1093/rheumatology/ken271 |
| [5] | King TE Jr, Bradford WZ, Castro-Bernardini S, et al. A phase 3 trial of pirfenidone in patients with idiopathic pulmonary fibrosis[J]. N Engl J Med, 2014, 370(22): 2083-2092. DOI:10.1056/NEJMoa1402582 |
| [6] | Loomis-King H, Flaherty KR, Moore BB. Pathogenesis, current treatments and future directions for idiopathic pulmonary fibrosis[J]. Curr Opin Pharmacol, 2013, 13(3): 377-385. DOI:10.1016/j.coph.2013.03.015 |
| [7] | Morales-Nebreda LI, Rogel MR, Eisenberg JL, et al. Lung-specific loss of α3 laminin worsens bleomycin-induced pulmonary fibrosis[J]. Am J Respir Cell Mol Biol, 2015, 52(4): 503-512. DOI:10.1165/rcmb.2014-0057OC |
| [8] | Teles-Grilo ML, Leite-Almeida H, Martins dos Santos J, et al. Differential expression of collagens type Ⅰ and type Ⅳ in lymphangiogenesis during the angiogenic process associated with bleomycin-induced pulmonary fibrosis in rat[J]. Lymphology, 2005, 38(3): 130-135. |
| [9] | Heikkila HP, Krafft E, Jespers P, et al. Procollagen type Ⅲ amino terminal propeptide concentrations in dogs with idiopathic pulmonary fibrosis compared with chronic bronchitis and eosinophilic bronchopneumopathy[J]. Vet J, 2013, 196(1): 52-56. DOI:10.1016/j.tvjl.2012.07.023 |
| [10] | 方建江, 韩文文, 周挺, 等. ROCK抑制剂法舒地尔对百草枯中毒大鼠肺纤维化的干预研究[J]. 中华急诊医学杂志, 2017, 26(4): 386-391. DOI:10.3760/cma.j.issn.1671-0282.2017.04.006 |
| [11] | Inokoshi Y, Tanino Y, Wang X, et al. Clinical significance of serum hyaluronan in chronic fibrotic interstitial pneumonia[J]. Respirology, 2013, 18(8): 1236-1243. DOI:10.1111/resp.12144 |
| [12] | El-Mezayen HA, Habib S, Marzok HF, et al. Diagnostic performance of collagen Ⅳ and laminin for the prediction of fibrosis and cirrhosis in chronic hepatitis C patients: a multicenter study[J]. Eur J Gastroenterol Hepatol, 2015, 27(4): 378-385. DOI:10.1097/MEG.0000000000000298 |
| [13] | Neuman MG, Cohen LB, Nanau RM. Hyaluronic acid as a non-invasive biomarker of liver fibrosis[J]. Clin Biochem, 2016, 49(3): 302-315. DOI:10.1016/j.clinbiochem.2015.07.019 |
| [14] | 胡迎春, 罗振华, 袁新健, 等. 铀矿尘致大鼠肺纤维化过程中Ⅰ和Ⅲ型胶原及层粘连蛋白表达的变化[J]. 中华劳动卫生职业病杂志, 2011, 29(2): 103-107. DOI:10.3760/cma.j.issn.1001-9391.2011.02.006 |
| [15] | 姚冬, 奇李敏, 高恒波, 等. 长期存活急性百草枯中毒患者肺功能的随访研究[J]. 中华急诊医学杂志, 2016, 25(6): 792-796. DOI:10.3760/cma.j.issn.1671-0282.2016.06.021 |
| [16] | Johannson KA, de Boer K, Wolters PJ, et al. Diagnosis of idiopathic pulmonary fibrosis with high-resolution CT[J]. Lancet Respir Med, 2014, 2(5): e5. DOI:10.1016/S2213-2600(14)70075-X |
| [17] | Li X, Peng S, Wei L, et al. Relevance analysis of clinical and lung function parameters changing and prognosis of idiopathic pulmonary fibrosis[J]. Int J Clin Exp Med, 2014, 7(12): 4759-4769. |
| [18] | Kubo H, Nakayama K, Yanai M, et al. Anticoagulant therapy for idiopathic pulmonary fibrosis[J]. Chest, 2005, 128(3): 1475-1482. DOI:10.1378/chest.128.3.1475 |
| [19] | Kim DS, Park JH, Park BK, et al. Acute exacerbation of idiopathic pulmonary fibrosis: frequency and clinical features[J]. Eur Respir J, 2006, 27(1): 143-150. DOI:10.1183/00936.06.00114004 |
| [20] | Song JW, Hong SB, Lim CM, et al. Acute exacerbation of idiopathic pulmonary fibrosis: incidence, risk factors and outcome[J]. Eur Respir J, 2011, 37(2): 356-363. DOI:10.1183/09031936.00159709 |
| [21] | Agarwal R, Jindal SK. Acute exacerbation of idiopathic pulmonary fibrosis: a systematic review[J]. Eur J Intern Med, 2008, 19(4): 227-235. DOI:10.1016/j.ejim.2007.04.024 |
 2018, Vol. 27
2018, Vol. 27




