心搏骤停(CA)是成年人死亡主要原因之一,尤其是心脏病患者。近年来,尽管心肺复苏(CPR)取得重大进步,但是CA患者总存活率不超过10%[1]。对于CA后自主循环恢复(ROSC)患者,神经功能的恢复更不尽人意[2]。CPR成功患者中仅10%~30%患者神经功能是完好的[3]。目前临床上也缺少有效的药物改善CA后神经功能。
坏死性凋亡(necroptosis)是近十年来发现的一种新型细胞死亡方式,由死亡受体配体启动,通过死亡受体介导信号通路,执行程序性细胞坏死[4]。研究证实坏死性凋亡参与脑缺血缺氧后神经细胞损伤[5-7]。本课题组前期研究发现,骨髓间充质干细胞(MSCs)移植明显改善大鼠CA后神经功能[8],但是否与调控坏死性凋亡有关仍不明确,目前也未见相关研究报道。因此,本文探讨CA后大鼠脑组织中调控坏死性凋亡的关键分子即受体相互作用蛋白激酶1和3(RIP1和RIP3)的表达,并观察MSCs移植后对RIP1和RIP3表达的影响,初步了解MSCs改善神经功能的可能作用机制。
1 材料与方法 1.1 实验材料动物:4~5周龄SPF级雄性SD大鼠2只,体质量100~120 g;10周龄雄性SPF级SD大鼠24只,体质量350~450 g,均购自北京维通利华实验动物技术有限公司[合格证号:SCXK(京)2012-0001]。
试剂与药品:DMEM/F12培养基(Gibco,美国),10%胎牛血清(Hyclone,美国),0.25%胰酶(Gibco,美国),4', 6'二脒基-2-苯吲哚盐酸(DAPI,罗氏,美国),总蛋白抽提试剂盒(康成,上海),BCA蛋白定量试剂盒(康成,上海),兔抗RIP1和RIP3抗体(Abcam,美国),羊抗兔IgG-HRP(康成,上海)。
仪器:CO2培养箱(Sanyo,日本),荧光倒置显微镜(ZEISS公司,德国),14号套管(Abbocath-T,美国),23号PE-50聚乙烯管(晶泰,上海),冰冻切片机(雷卡,德国),BL-420S生物机能实验系统(泰盟,成都),小动物呼吸机(奥尔科特,上海)。
1.2 大鼠骨髓MSCs分离和培养麻醉并处死2只4~5周龄SD大鼠,基于本课题组前期研究[9]分离和培养骨髓MSCs。无菌条件下,分离其胫骨和股骨,用DMEM/F12培养基反复冲洗骨髓腔,获取细胞悬液,常温条件下1 500 r/min离心5 min。用含有10%胎牛血清的DMEM/F12培养基重悬细胞并接种于25 cm2培养瓶,在37 ℃、5%CO2以及饱和湿度下培养24 h,半量换液后再培养3 d,然后全量换液再培养7~9 d,待细胞生长到约90%融合时,以0.25%胰酶消化后按1:2比例进行第一次传代,此后以同样方法培养并传代,本实验采用P3代MSCs。用流式细胞仪鉴定MSCs,即CD45、CD11b阴性,CD29、CD44阳性[10]。移植前用DAPI标记P3代MSCs[11],用磷酸盐缓冲液(PBS)重悬细胞并调整细胞浓度为1×106/0.5 mL。
1.3 动物分组与干预10周龄SD大鼠,随机(随机数字法)分为sham组(n=8)、CA组(n=8)和MSCs组(n=8)。sham组:仅进行动静脉置管和气管插管等,未诱导CA。MSCs组:窒息法诱导CA,ROSC后1 h,通过尾静脉注射1×106/0.5 mL MSCs。CA组:ROSC后1 h,通过尾静脉注射等体积PBS。CPR后3 d处死大鼠,留取脑组织-80 ℃保存备用。
1.4 窒息法诱导心搏骤停及心肺复苏大鼠除饮水外禁食12 h。以45 mg/kg腹腔注射戊巴比妥麻醉。持14号套管直视下经口气管插管。暴露左股动脉,缓慢插入23号PE-50聚乙烯管至胸主动脉用于监测血压,导管充满5 U/mL肝素生理盐水。记录肢体Ⅱ导联心电图。数据记录在BL-420S生物机能实验系统。CA前常规机械通气,吸入氧体积分数为21%,潮气量为6.5 mL/kg体质量,呼吸频率100次/min。
基于前期文献[12],用维库溴铵(1 mg/kg)诱导呼吸停止。CA标准:主动脉血压失去波动波形且平均动脉血压(MAP)≤20 mmHg(1 mmHg=0.133 kPa),CA 6 min后,以频率200次/min进行体外心脏按压和100次/min机械通气,吸入氧体积分数21%,按压深度约为胸廓前后径的1/3以维持舒张压在(25±5)mmHg,按压2 min后按0.005 mg/kg给予最多3次肾上腺素。ROSC标准:恢复室上性心律,MAP≥60 mmHg持续5 min以上。按压4 min后若仍无ROSC,放弃CPR。ROSC后继续机械通气2 h,动物苏醒后拔除导管并回笼。
1.5 神经功能缺损评分(NDS)采用NDS[13]评估CPR后3 d神经功能。NDS评分包括觉醒、脑神经反射、运动功能、简单的行为反射等,得分从0~80分,脑死亡为0分,脑功能正常为80分。
1.6 脑组织病理检测CPR后3 d,取左侧脑组织,4%多聚甲醛固定24 h后,分别以20%和30%蔗糖梯度脱水,冰冻切片机行10 μm厚连续冠状切片,荧光显微镜下观察体内DAPI标记的MSCs。然后切片分别与苏木精和伊红染色,高倍镜下随机选择皮层10个非重复视野计数嗜曙红样神经元,计算皮层坏死神经元比例[14]。
1.7 Western Blot取右侧脑组织约50 mg,按试剂盒说明书提取总蛋白,以BCA法进行蛋白定量。将蛋白浓度调成3 μg/μL,样品按4:1加入5×上样缓冲液,配置10%分离胶和5%浓缩胶,进行十二烷基硫酸钠-聚丙烯酰胺凝胶(SDS-PAGE)电泳分离,蛋白电转移到PVDF膜上,用5%BSA溶液封闭1 h,分别与兔抗RIP1和RIP3抗体(1:1 000)4 ℃孵育过夜,洗膜,再分别与二抗(1:5 000)室温下孵育1 h,洗膜,ECL显色、曝光,用ImageJ分析软件扫描并分析。
1.8 统计学方法用SPSS 17.0统计软件进行分析。正态分布数据以均数±标准差(x±s)表示,偏态分布数据以中位数(四分位间距)[M(IQR)]表示。单因素方差分析(ANOVA)或Kruskal-Wallis H检验分析多组间数据,两两比较用Bonferronni' post hoc检验。以P < 0.05为差异有统计学意义。
2 结果 2.1 大鼠心搏骤停前基线指标sham组、CA组和MSCs组之间体质量、心率、平均血压及呼吸频率均差异无统计学意义(均P > 0.05)。见表 1。
| 指标 | sham组 | CA组 | MSCs组 |
| 体质量(g) | 407.0±22.9 | 398.0±28.9 | 410.0±78.5 |
| 心率(次/min) | 378.0±42.5 | 380.0±33.0 | 382.0±29.0 |
| 血压(mmHg) | 126.0±10.5 | 128.0±7.8 | 127.0±6.9 |
| 呼吸频率(次/min) | 82.0±9.4 | 83.0±10.9 | 78.0±7.4 |
| 注:sham,假手术;CA,心搏骤停;MSCs,骨髓间充质干细胞 | |||
Sham组大鼠神经功能正常(NDS为80分)。CPR后3 d,CA组大鼠存在明显神经功能缺损[NDS: 63.0(62.5, 64.1),Z=3.599, P=0.000],MSCs组NDS[72.5(71.5, 73.2)]明显高于CA组(Z=3.376, P=0.001),提示MSCs移植改善CPR后大鼠神经功能。
2.3 MSCs移植后在脑组织分布CPR后3 d,荧光显微镜下可见MSCs组DAPI标记的MSCs细胞核呈圆形或卵圆形,主要分布在皮层。CA组未见DAPI标记的MSCs。表明MSCs迁移到缺血损伤的脑组织。见图 1。

|
| 图 1 心肺复苏后3 d荧光显微镜下MSCs组大鼠DAPI标记的骨髓间充质干细胞在脑组织内分布(×200) Figure 1 DAPI-labeled MSCs in MSCs group at 3 d after cardiopulmonary resuscitation(×200) |
|
|
sham组HE染色显示皮层神经元正常,CA组观察到神经元细胞核固缩、多角,胞浆呈嗜曙红样改变,为坏死神经元的典型特征。MSCs组上述病理改变明显减轻。见图 2。
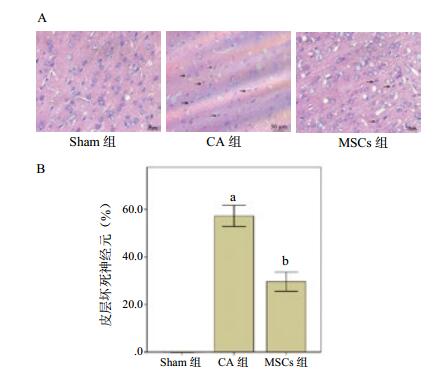
|
| (A)皮层HE染色比较。箭头为核固缩嗜曙红样坏死神经元。放大倍数:400倍;(B)皮层坏死神经元比较;与Sham组比较,aP=0.000;与CA组比较,bP=0.000;sham为假手术;CA为心搏骤停;MSCs为骨髓间充质干细胞 图 2 心肺复苏后3 d各组大鼠脑皮层病理变化 Figure 2 Pathological alterations in the cerebral cortex in different groups at 3 d after cardiopulmonary resuscitation |
|
|
心肺复苏后3 d,CA组大鼠脑组织RIP1和RIP3蛋白表达水平明显高于sham组(均P < 0.05),而MSCs组RIP1和RIP3蛋白表达水平明显低于CA组(均P < 0.05)。见图 3~4。
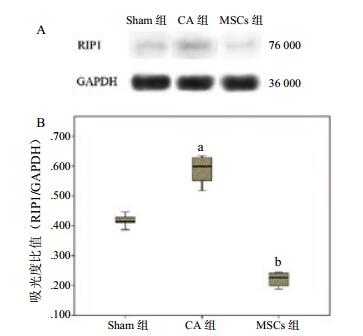
|
| (A)RIP1蛋白Western blot分析;(B)RIP1蛋白吸光度值分析。与sham组比较,aP=0.012;与CA组比较,bP=0.002;sham为假手术;CA为心搏骤停;MSCs为骨髓间充质干细胞 图 3 心肺复苏后3 d大鼠脑组织RIP1蛋白表达水平 Figure 3 Receptor-interacting protein kinase 1 (RIP1) expression in the rat brain at 3 d after cardiopulmonary resuscitation (CPR) |
|
|
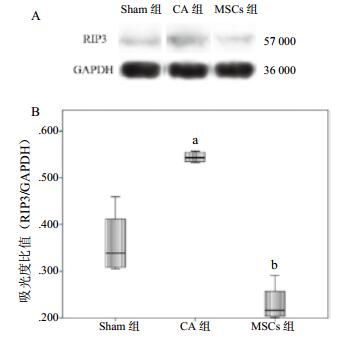
|
| (A)RIP3蛋白Western blot分析;(B)RIP3蛋白吸光度值分析。与sham组比较,aP=0.016;与CA组比较,bP=0.001;sham为假手术;CA为心搏骤停;MSCs为骨髓间充质干细胞 图 4 心肺复苏后3 d大鼠脑组织RIP3蛋白表达水平 Figure 4 Receptor-interacting protein kinase 3 (RIP3) expression in the rat brain at 3 d after cardiopulmonary resuscitation |
|
|
本研究发现MSCs移植明显减轻CA大鼠CPR后3 d皮层神经元坏死,同时改善其神经功能。另外,CA后脑组织RIP1和RIP3蛋白表达水平明显上调,而MSCs移植明显下调其表达水平,这暗示坏死性凋亡可能参与CA后全脑缺血-再灌注损伤,MSCs移植可能通过阻止坏死性凋亡发生从而减轻CA后脑损伤。
RIP1和RIP3是坏死性凋亡的关键分子,RIP1和RIP3相互磷酸化并形成坏死小体是坏死性凋亡的关键步骤[15]。多个研究显示,发生坏死性凋亡时,RIP1和RIP3表达上调[16-18]。Shen等[19]研究表明RIP1基因敲除可减轻颅内出血大鼠脑损伤。Vieira等[20]研究发现RIP3基因敲除抑制氧糖剥离诱导的坏死性凋亡,而过表达RIP1和RIP3加强海马神经元死亡。这些均表明RIP1和RIP3参与调控坏死性凋亡信号通路。与文献报道一致,本文显示CA诱导的全脑缺血-再灌注明显上调脑组织RIP1和RIP3,而MSCs移植治疗后RIP1和RIP3表达水平明显降低。但是,MSCs移植如何调控RIP1和RIP3表达目前仍不清楚。基于本课题组的前期研究成果[9],大鼠CA后脑组织肿瘤坏死因子-α(TNF-α)表达水平明显升高,MSCs移植可明显降低TNF-α表达水平。而且,现有研究已证实TNF-α/TNF-α受体1是坏死性凋亡发生的启动因子[15]。据此推测,MSCs移植可能通过下调脑组织TNF-α水平从而阻止全脑缺血-再灌注诱导的RIP1和RIP3上调。当然,确切的作用机制有待今后进一步实验证实。
目前,由于缺乏坏死性凋亡特异的标记物,鉴定体内发生坏死性凋亡尚无金标准。在本研究中,MSCs移植后主要分布在脑皮层,这与本课题组前期的研究结果一致[9]。因此本研究选择脑皮层进一步行HE病理分析,结果显示CA及后续CPR明显引起皮层神经元萎缩,核固缩、多角,胞浆呈嗜曙红样改变,这些改变与坏死性凋亡细胞死亡的形态特征类似。当然,如果能进一步通过透射电镜观察皮层神经元形态变化则更有说服力。
综上所述,本研究显示MSCs移植减轻大鼠CA后全脑缺血-再灌注损伤并改善神经功能,其作用机制可能通过阻止坏死性凋亡发生。
| [1] | Berdowski J, Berg RA, Tijssen JG, et al. Global incidences of out-of-hospital cardiac arrest and survival rates: systematic review of 67 prospective studies[J]. Resuscitation, 2010, 81(11): 1479-1487. DOI:10.1016/j.resuscitation.2010.08.006 |
| [2] | Caltekin I, Savrun A, Gokcen E, et al. Comparison of the factors affecting neurological outcome in out-of vs in-hospital cardiac arrest cases[J]. J Pak Med Assoc, 2016, 66(11): 1412-1417. |
| [3] | Ragoschke-Schumm A, Pfeifer R, Marx G, et al. Early evaluation of neurological prognosis and therapy after cardiopulmonary resuscitation: current opportunities and clinical implications[J]. Nervenarzt, 2007, 78(8): 937-943. DOI:10.1007/s00115-007-2286-0 |
| [4] | Kearney CJ, Martin SJ. An inflammatory perspective on necroptosis[J]. Mol Cell, 2017, 65(6): 965-973. DOI:10.1016/j.molcel.2017.02.024 |
| [5] | Xuan M, Okazaki M, Iwata N, et al. Chronic treatment with a water-soluble extract from the culture medium of ganoderma lucidum mycelia prevents apoptosis and necroptosis in hypoxia/ischemia-induced injury of type 2 diabetic mouse brain[J]. Evid Based Complement Alternat Med, 2015, 2015: 865986. DOI:10.1155/2015/865986 |
| [6] | Xu Y, Wang J, Song X, et al. RIP3 induces ischemic neuronal DNA degradation and programmed necrosis in rat via AIF[J]. Sci Rep, 2016, 6: 29362. DOI:10.1038/srep29362 |
| [7] | Ding W, Shang L, Huang JF, et al. Receptor interacting protein 3-induced RGC-5 cell necroptosis following oxygen glucose deprivation[J]. BMC Neurosci, 2015, 16: 49. DOI:10.1186/s12868-015-0187-x |
| [8] | 林庆明, 赵燊, 周莉莉, 等. 心肺复苏干细胞移植后肿瘤坏死因子α诱导蛋白6的表达[J]. 中华急诊医学杂志, 2014, 23(10): 1098-1104. DOI:10.3760/cma.j.issn.1671-0282.2014.10.007 |
| [9] | Lin QM, Zhao S, Zhou LL, et al. Mesenchymal stem cells transplantation suppresses inflammatory responses in global cerebral ischemia: contribution of TNF-α-induced protein 6[J]. Acta Pharmacol Sin, 2013, 34(6): 784-792. DOI:10.1038/aps.2012.199 |
| [10] | Wang T, Tang W, Sun S, et al. Mesenchymal stem cells improve outcomes of cardiopulmonary resuscitation in myocardial infarcted rats[J]. J Mol Cell Cardiol, 2009, 46(3): 378-384. DOI:10.1016/j.yjmcc.2008.11.014 |
| [11] | Castanheira P, Torquetti LT, Magalhãs DR, et al. DAPI diffusion after intravitreal injection of mesenchymal stem cells in the injured retina of rats[J]. Cell Transplant, 2009, 18(4): 423-431. DOI:10.3727/096368909788809811 |
| [12] | 朱军, 方向韶, 符岳, 等. 窒息法与室颤法心肺复苏动物模型的比较研究[J]. 中华急诊医学杂志, 2011, 20(1): 14-19. DOI:10.3760/cma.j.issn.1671-0282.2011.01.005 |
| [13] | Geocadin RG, Ghodadra R, Kimura T, et al. A novel quantitative EEG injury measure of global cerebral ischemia[J]. Clin Neurophysiol, 2000, 111(10): 1779-1787. DOI:10.1016/S1388-2457(00)00379-5 |
| [14] | Liang G, Shi B, Luo W, et al. The protective effect of caffeic acid on global cerebral ischemia-reperfusion injury in rats[J]. Behav Brain Funct, 2015, 11: 18. DOI:10.1186/s12993-015-0064-x |
| [15] | Newton K, Manning G. Necroptosis and inflammation[J]. Annu Rev Biochem, 2016, 85: 743-763. DOI:10.1146/annurev-biochem-060815-014830 |
| [16] | Ichiseki T, Ueda S, Ueda Y, et al. Involvement of necroptosis, a newly recognized cell death type, in steroid-induced osteonecrosis in a rabbit model[J]. Int J Med Sci, 2017, 14(2): 110-114. DOI:10.7150/ijms.17134 |
| [17] | Zhou Z, Lu B, Wang C, et al. RIP1 and RIP3 contribute to shikonin-induced DNA double-strand breaks in glioma cells via increase of intracellular reactive oxygen species[J]. Cancer Lett, 2017, 390: 77-90. DOI:10.1016/j.canlet.2017.01.004 |
| [18] | Xin J, You D, Breslin P, et al. Sensitizing acute myeloid leukemia cells to induced differentiation by inhibiting the RIP1/RIP3 pathway[J]. Leukemia, 2017, 31(5): 1154-1165. DOI:10.1038/leu.2016.287.DOI:10.1038/leu.2016.287 |
| [19] | Shen H, Liu C, Zhang D, et al. Role for RIP1 in mediating necroptosis in experimental intracerebral hemorrhage model both in vivo and in vitro[J]. Cell Death Dis, 2017, 8(3): e2641. DOI:10.1038/cddis.2017.58 |
| [20] | Vieira M, Fernandes J, Carreto L, et al. Ischemic insults induce necroptotic cell death in hippocampal neurons through the up-regulation of endogenous RIP3[J]. Neurobiol Dis, 2014, 68: 26-36. DOI:10.1016/j.nbd.2014.04.002 |
 2018, Vol. 27
2018, Vol. 27




