热射病是由于机体产生的热量超过了体温调节代谢散热的能力,致使核心体温急剧升高,以核心体温大于40 ℃、中枢神经系统功能异常以及多脏器功能损害为主要临床表现的临床急危重症[1]。随着人类对气候的影响,随之而来是热浪越来越频繁、越来越严重,热射病的发病率也逐年升高[2-3],并经常在急诊误诊[4],在过去的二十年里其死亡人数已超过龙卷风、飓风、地震、雷击等死亡人数的总和[5],约20%热射病患者遗留神经功能损害[1],已成为严重威胁公共健康的急重症疾病之一[6]。高热引起的炎性因子、细胞毒性、凝血障碍、自由基等多因素参与脑组织损害,其中血脑屏障(blood-brain barrier,BBB)破坏产生血管源性脑水肿可能是高热引起中枢神经系统损害的主要机制之一[7]。Occludin的正常表达是维持血脑屏障内皮细胞间紧密连接结构和功能正常的基础[8]。为此,本研究观察了高热打击后对大鼠血脑屏障的通透性及Occludin蛋白表达的影响,现报道如下。
1 材料与方法 1.1 实验材料SPF级雄性Wistar大鼠35只,体质量230~250 g,由山东大学实验动物中心提供。微电脑恒温恒湿控制气候舱由山东德州瑞科孵化设备有限公司提供,酶标分析仪由深圳雷杜生命科学股份有限公司提供,Evans Blue购于北京索莱宝科技有限公司,Occludin抗体购于abcam公司。
1.2 方法 1.2.1 分组造模大鼠随机分为正常对照组、热打击组,正常对照组大鼠始终置于温度(25.0±0.5)℃、相对湿度(35±5)%的环境下。参考文献[9-10]将气候舱舱内温度设置为(40.0±0.5)℃、相对湿度(60±5)%,待参数稳定后热打击组大鼠置于恒温恒湿气候舱内暴露100 min后测量大鼠直肠温度,直肠温度达40 ℃以上的大鼠用于实验,造模大鼠经检测直肠温度均达到40 ℃以上。
1.2.2 BBB通透性的测定热打击造模后即刻,随机选取正常对照组和热打击造模成功大鼠各5只,按0.4 mL/100 g剂量颈静脉注射2%伊文思蓝(Evans blue,EB),2 h后用10%水合氯醛腹腔注射麻醉大鼠,用生理盐水对大鼠进行心脏灌流后断头取脑并称重脑组织,随后将其浸入甲酰胺溶液于60 ℃水浴箱内孵育24 h,离心后取上清液并测量其在630 nm波长下的吸光度值,根据伊文思蓝的标准曲线计算出脑组织中伊文思蓝的含量。
1.2.3 脑组织含水量测定各组大鼠随机抽取3只于造模后腹腔麻醉快速断头取脑,立即称重脑组织,然后放入烤箱100 ℃烘干,取出称重直至两次称量差小于0.2 mg。脑组织含水量=(湿质量-干质量)/湿质量×100%。
1.2.4 电子显微镜观察各组大鼠随机选取3只大鼠于造模后麻醉,以4%多聚甲醛灌注,断头取脑,切取皮层薄片(小于1 mm),以戊二醛固定液固定,1%的饿酸后固定,常规脱水和塑料包埋,超薄切片,铅铀双染色,电镜下观察。
1.2.5 免疫荧光组化检测Occludin的表达及分布热打击造模后即刻,随机选取正常对照组和热打击造模成功大鼠各5只,麻醉后用4%多聚甲醛灌注,断头取脑,常规石蜡包埋切片,取相同层面切片脱蜡、水化,热修复抗原,滴加封闭液,滴加Anti-Occludin antibody(1∶ 50)4 ℃过夜,滴加DyLight 594标记的羊抗小鼠IgG抗体(1∶ 100)荧光二抗避光孵育,DAPI复染核,甘油封片,荧光显微镜下观察。
1.2.6 Western blot检测于热打击造模后即刻,将随机选取的正常对照组4只、热打击造模成功大鼠5只迅速断头取脑,采用BCA蛋白浓度测定试剂盒进行蛋白浓度的定量。蛋白样品于SDS-PAGE电泳结束后将蛋白转移至PVDF膜上,5%脱脂奶粉封闭2 h,将膜与1∶ 100稀释的Occludin抗体4 ℃孵育过夜,羊抗兔IgG二抗室温孵育2 h,用shinegene公司的化学发光试剂盒显影,对胶片进行扫描,然后用UVP凝胶图象处理系统Labworks4.6软件分析目的条带的灰度值,实验中以GAPDH为内参。
1.3 统计学方法所用计量资料均采用均数±标准差(x±s)表示,采用SAS8.1软件进行单因素方差分析,两组间比较采用成组t检验,以P<0.05为差异具有统计学意义。
2 结果 2.1 热打击后血脑屏障通透性的变化通过伊文思蓝漏入脑组织的含量检测,观察热打击后血脑屏障通透性变化。正常对照组依文思蓝漏出(2.76±0.23)μg/g,热打击组(8.32±0.35)μg/g,与正常对照组比较,差异有统计学意义(P<0.05)。
2.2 热打击后脑组织含水率的变化与正常对照组比较,热打击组大鼠脑组织含水率显著上升,正常对照组含水率(77.7±0.32)%,热打击组(78.8±0.28)%,与正常对照组比较,差异有统计学意义(P<0.05)。
2.3 热打击后脑组织超微结构损害电镜观察热打击后大鼠脑组织的超微结构显示,与正常对照组比较,热打击组大鼠脑组织血管周围出现很多空泡,胶质细胞终足肿胀(图 1),提示血管周围发生了结构损害。
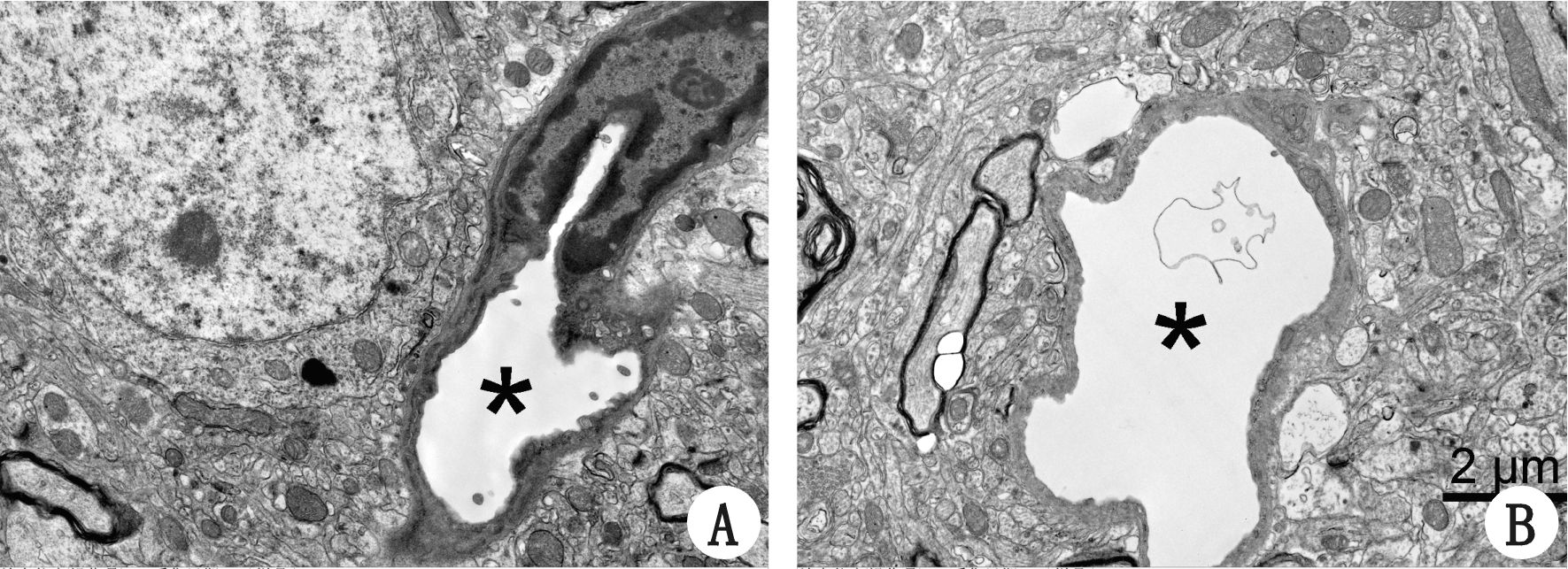
|
| A为对照组;B为热打击组;*表示血管,放大倍数均为15 000倍,图中标尺表示2 μm 图 1 大鼠脑组织超微结构 |
|
|
从荧光免疫组化染色结果显示,正常对照组脑组织Occludin蛋白呈强阳性表达,热打击后脑组织中的紧密连接蛋白荧光强度较正常对照组明显减弱,正常对照组Occludin相对积分吸光度值(IOD)为(1.00±0.13),热打击组为(0.68±0.15)(图 2)。Western blot检测结果显示,热打击组脑组织Occludin蛋白表达水平较正常对照组明显下降,正常对照组Occludin蛋白灰度比值(1.238±0.072),热打击组为(0.976±0.148)。两组比较差异有统计学意义(P<0.05),结果见图 3。
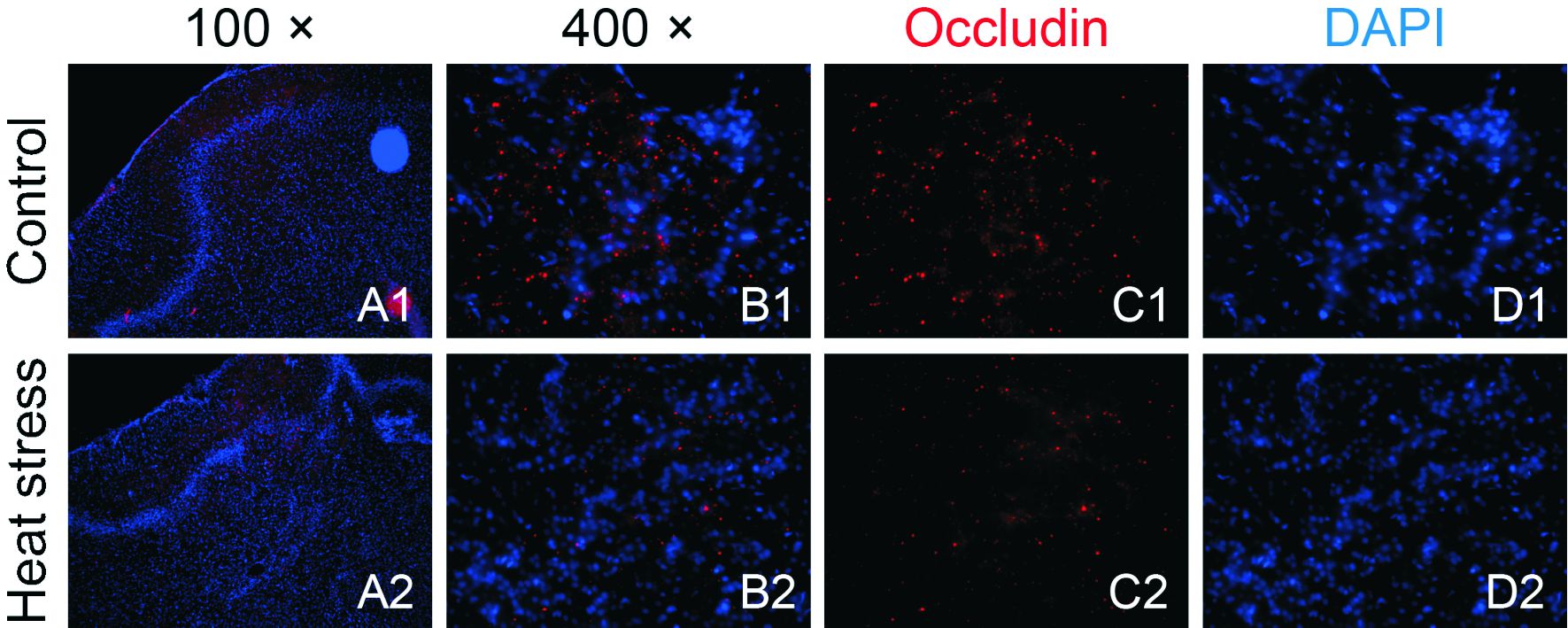
|
| A为100倍镜观察;B~D为400倍镜观察;B为Occludin和DAPI图像的拼合;1为对照组;2为热打击组 图 2 大鼠脑组织Occludin免疫荧光染色 |
|
|
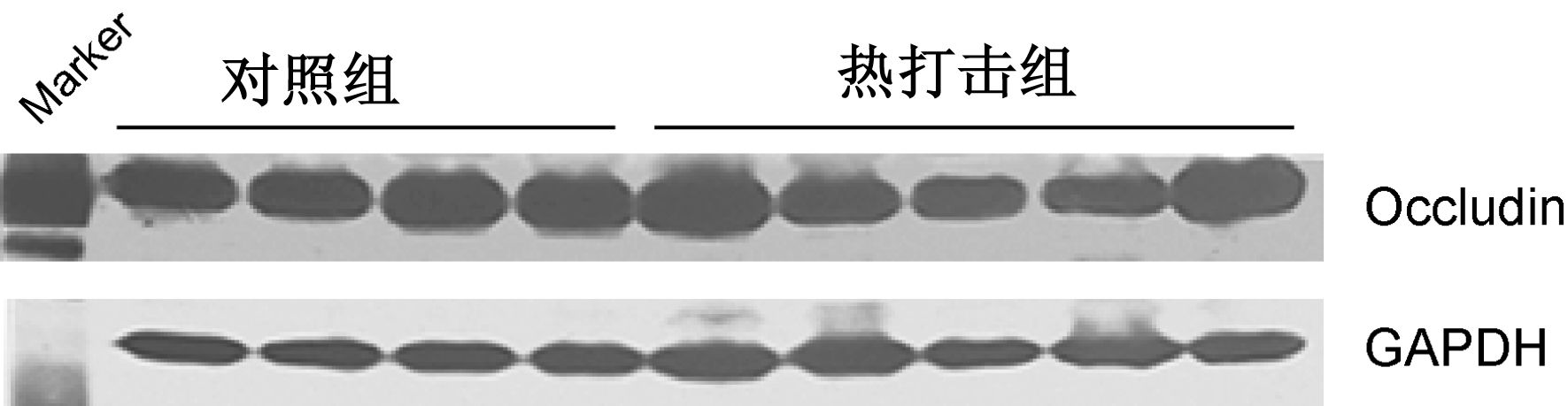
|
| 图 3 estern blot检测各组Occludin及内参照GAPHD蛋白 |
|
|
脑是热射病患者最易累及的器官之一[11],引起血脑屏障破坏、脑水肿、脑细胞变性、坏死及出血等[12],表现为易怒、行为异常、幻觉、谵妄、昏睡、昏迷、抽搐、下视性眼球震颤、斜视性眼阵挛、颅神经损害、癫痫、小脑功能失调等,存活患者中50%出现小脑综合征、多发性神经病和脑损害后遗症状[13-14]。由此可见,中枢神经系统病变在热射病过程中尤为突出和重要,脑水肿是其主要病理特点[15]。高温引起的细胞毒性、凝血、细胞因子介导的全身炎性反应综合征之间存在复杂的相互作用最终导致多器官衰竭[16],其增高的体温可损害血管内皮细胞、增加了血管渗透性是热射病脑损害的主要发病机制[17]。血脑屏障主要由内皮细胞、基膜及足突构成,脑毛细血管内皮细胞及其细胞间的紧密连接是构成血脑屏障的解剖学基础[18],对于维持脑内环境的动态平衡具有重要作用。血脑屏障被破坏后其通透性将增加,毛细血管内血浆蛋白与水分渗出而引起脑组织细胞外液增多,引起血管源性脑水肿[19]。在BBB损伤中,通透性变化是最基本的,也是最直接的损伤体现[20]。EB可以作为BBB通透性的指示剂,是研究BBB通透性比较成熟和常用的指标[21]。本研究结果显示热打击后大鼠脑组织含水率较正常对照组显著上升,其差异有统计学意义(P<0.05),说明热打击可引起脑组织水肿。热打击后大鼠脑组织中EB的漏出量较正常对照组明显增加,差异有统计学意义(P<0.05),表明热打击可引起血脑屏障通透性增加。可见,热打击破坏血脑屏障产生血管源性脑水肿在热射病继发中枢神经系统损害中起重要作用[22]。
本研究电镜观察热打击组大鼠脑组织的超微结构,结果显示热打击后大鼠脑组织血管周围出现很多空泡,胶质细胞终足肿胀(图 1),提示血管周围发生了结构损害。脑微血管内皮细胞及其间紧密连接(tight junction,TJ)是血脑屏障的核心结构[23]。脑血管通透性主要取决于内皮细胞紧密连接,TJ是由一系列跨膜蛋白和外周蛋白相互作用而形成的一个复杂的蛋白质体系,是保持BBB完整性的重要因素。Occludin直接参与了脑微血管内皮细胞中紧密连接的形成,是构成BBB紧密连接的关键成分,它的正常表达是紧密连接结构和功能稳定的前提[24],在维持BBB的结构完整与调节血脑屏障的通透性中有至关重要的作用。脑微血管内皮细胞间紧密连接相关蛋白表达水平的变化与BBB通透性的改变及脑水肿的程度密切相关,紧密连接蛋白Occludin的降解是血脑屏障破坏的决定因素,也是衡量TJ功能变化的重要指标之一。研究显示在各种因素导致的BBB通透性增加中均存在Occludin表达的下降[25],Occludin可以作为紧密连接敏感和稳定的标志物。本研究结果显示正常对照组脑组织Occludin蛋白呈强阳性表达,而热打击后脑组织中Occludin蛋白荧光强度较正常对照组明显减弱(图 2)。热打击组脑组织Occludin蛋白表达水平较正常对照组明显下降,两组比较差异有统计学意义(P<0.05),说明热打击可导致紧密连接蛋白Occludin表达降低,提示热打击能破坏Occludin蛋白,其血脑屏障的通透性增高与紧密连接Occludin的表达下调有关。
在热射病早期若能有效防治BBB的破坏,将缓解中枢神经系统损伤。本研究证明了热打击后血脑屏障的通透性增加,脑微血管内皮细胞的Occludin表达下降,说明Occludin可能参与了热打击对BBB的破坏及其通透性的增高,为热射病的防治提供了一定的理论基础。
| [1] | Jain RS, Kumar S, Agarwal R, et al. Acute Vertebrobasilar Territory Infarcts due to Heat Stroke[J]. J Stroke Cerebrovasc Dis , 2015, 24 (6) : 135-138 DOI:10.1016/j.jstrokecerebrovasdis.2015.02.001 |
| [2] | Casa DJ, Guskiewicz KM, Anderson SA, et al. National Athletic Trainers'Association position statement: preventing sudden death in sports[J]. J Athl Train , 2012, 47 (1) : 96-118 |
| [3] | Solomon SD, Qin M, Manning Z. Contribution of Working Group I to the Fourth Assessment Report of the International Panel on Climate Change [M]. London: Cambridge University Press, 2007 : 782 -789 . |
| [4] | Oberlin M, Tubery M, Cances-Lauwers V, et al. Heat-related illnesses during the 2003 heat wave in an emergency service[J]. Emerg Med J , 2010, 27 (4) : 297-299 DOI:10.1136/emj.2008.067934 |
| [5] | Rodriguez-Fernandez M, Grosman B, Yuraszeck TM, et al. Modeling the intra-and extracellular cytokine signaling pathway under heatstroke in the liver[J]. PLoS ONE , 2013, 8 (9) : e73393 DOI:10.1371/journal.pone.0073393 |
| [6] |
李慧敏, 陈晓娟, 陈芳, 等. 应用动物体温维持仪与仿真热气候动物舱建立大鼠经典型热射病模型的比较[J].
中华急诊医学杂志 , 2015, 24 (4) : 408-412 Li HM, Chen XJ, Chen F, et al. Comparison of application of animal body temperature and simulated hot climate animal cabin for rat classical heatstroke model[J]. Chin J Emerg Med , 2015, 24 (4) : 408-412 DOI:10.3760/cma.j.issn.1671-0282.2015.04.016 |
| [7] | Mahajan S, Schucany WG. Symmetric bilateral caudate, hippocampal, cerebellar,and subcortical white matter MRI abnormalities in an adult patient with heat stroke[J]. Proc (Bayl Univ Med Cent) , 2008, 21 (4) : 433-436 |
| [8] | Kniesel U, Wolburg H. Tight junctions of the blood-brain barrier[J]. Cell Mol Neurobiol , 2000, 20 (1) : 57-76 DOI:10.1023/A:1006995910836 |
| [9] | |
| [10] | Chen CM, Hou CC, Cheng KC, et al. Activated protein C therapy in a rat heat stroke model[J]. Crit Care Med , 2006, 34 (7) : 1960-1966 DOI:10.1097/01.CCM.0000224231.01533.B1. |
| [11] | Albukrek D, Bakon M, Moran DS, et al. Heatstroke-induced cerebellar atrophy: clinical course,CT and MRI findings[J]. Neuroradiology , 1997, 39 (3) : 195-197 DOI:10.1007/s002340050392 |
| [12] |
沈婷, 吴立峰, 吕建森. 劳力性热射病合并MODS的集束化治疗及预后分析[J].
中华急诊医学杂志 , 2013, 22 (4) : 423-426 Shen T, Wu LF, LV JS. Bundling treatment and prognosis of exertional heatstroke with MODS[J]. Chin J Emerg Med , 2013, 22 (4) : 423-426 DOI:10.3760/cma.j.issn.1671-0282.2013.04.020 |
| [13] | Rav-Acha M, Shuvy M, Hagag S, et al. Unique persistent neurological sequelae of heat stroke[J]. Mil Med , 2007, 172 (6) : 603-606 DOI:10.7205/MILMED.172.6.603 |
| [14] |
徐昌盛, 刘文革. 热射病研究进展[J].
中华急诊医学杂志 , 2005, 14 (7) : 609-611 Xu CS, Liu WG. Research progress of heat stroke[J]. Chin J Emerg Med , 2005, 14 (7) : 609-611 DOI:10.3760/j.issn.1671-0282.2005.07.031 |
| [15] |
周从阳, 杨继斌, 刘仁树. 重症中暑的临床特征及其昏迷机制[J].
中华急诊医学杂志 , 2004, 13 (4) : 273-274 Zhou CY, Yang JB, Liu RS, et al. The clinical features and coma mechanism of severe heat stroke[J]. Chin J Emerg Med , 2004, 13 (4) : 273-274 DOI:10.3760/j.issn.1671-0282.2004.04.021 |
| [16] | Leon LR, Helwig BG. Heat stroke: role of the systemic inflammatory response[J]. J Appl Physiol , 2010, 109 (6) : 1980-1988 DOI:10.1152/japplphysiol.00301.2010 |
| [17] | Epstein Y, Roberts WO. The pathopysiology of heat stroke: an integrative view of the final common pathway[J]. Scand J Med Sci Sports , 2011, 21 (6) : 742-748 DOI:10.1111/j.1600-0838.2011.01333.x |
| [18] |
石键, 张宏, 陈中华, 等. 兔脑激光间质热毁损及血脑屏障急性期改变[J].
中华急诊医学杂志 , 2009, 18 (12) : 1243-1247 Shi J, Zhang H, Chen ZH, et al. Observing thermal injury of rabbit brain in laser interstitial themotherapy and evaluating changed structure of mood brain barrier in acute stage[J]. Chin J Emerg Med , 2009, 18 (12) : 1243-1247 DOI:10.3760/cma.j.issn.1671-0282.2009.12.003. |
| [19] | Yang Y, Rosenberg GA. Blood-brain barrier breakdown in acute and chronic cerebrovascular disease[J]. Stroke , 2011, 42 (11) : 3323-3328 DOI:10.1161/STROKEAHA.110.608257 |
| [20] | Durukan A, Tatlisumak T. Acute ischemic stroke: overview of major experimental rodent models,pathophysiology,and therapy of focal cerebral ischemia[J]. Pharmacol Biochem Behav , 2007, 87 (1) : 179-197 DOI:10.1016/j.pbb.2007.04.015 |
| [21] |
余樱, 张兆辉, 杨波, 等. 溶血磷脂酸对血脑屏障通透性的影响及其机制[J].
中华急诊医学杂志 , 2006, 15 (12) : 1109-1112 Yu Y, Zhang ZH, Yang B, et al. Effect of lysophosphatidic acid on blood-brain barrier permeability and its mechanism[J]. Chin J Emerg Med , 2006, 15 (12) : 1109-1112 DOI:10.3760/j.issn.1671-0282.2006.12.013 |
| [22] | Sharma HS, Hoopes PJ. Hyperthermia induced pathophysiology of the central nervous system[J]. Int J Hyperthermia , 2003, 19 (3) : 325-354 DOI:10.1080/0265673021000054621 |
| [23] | Abbott NJ, Patabendige AA, Dolman DE, et al. Structure and function of the blood-brain barrier[J]. Neurobiol Dis , 2010, 37 (1) : 13-25 DOI:10.1016/j.nbd.2009.07.030 |
| [24] | Correale J, Villa A. Cellular elements of the blood-brain barrier[J]. Neurochem Res , 2009, 34 (12) : 2067-2077 DOI:10.1007/s11064-009-0081-y |
| [25] | Lin JL, Huang YH, Shen YC, et al. Ascorbic acid prevents blood-brain barrier disruption and sensory deficit caused by sustained compression of primary somatosensory cortex[J]. J Cereb Blood Flow Metab , 2010, 30 (6) : 1121-1136 DOI:10.1038/jcbfm.2009.277 |
 2016, Vol. 37
2016, Vol. 37




