210009 南京,东南大学附属中大医院重症医学科(贺宏丽、刘军、刘玲、杨毅、邱海波)
Department of Critical Care Medicine,Nanjing Zhongda Hospital of Southeast University, Nanjing 210009, China (He HL, Liu J, Liu L, Yang Y, Qiu HB)
急性肺损伤(acute lung injury,ALI)根本病因在于失控的炎症反应,明确ALI早期炎症反应的启动和调控机制,有助于从源头上阻断或减弱失控的炎症反应,突破ALI的治疗困境[1-2]。 前期研究表明ALI早期即存在肺常规树突细胞(conventional dendritic cells,cDCs)的聚集和活化[3],但其调控ALI早期炎症反应的具体机制尚不清楚[4-6]。中性粒细胞的呼吸爆发和Th免疫反应的失衡可能在ALI早期炎症的发生发展中发挥着至关重要的作用[7],而cDCs可影响中性粒细胞的趋化、迁移[7-8],也可活化并决定辅助性T细胞(Th)亚群(Th1/Th2)的漂移[4]。因此笔者假设ALI早期存在肺cDCs的聚集和活化,并通过影响中性粒细胞的浸润和Th1/Th2亚群的漂移参与启动和调节ALI早期炎症反应。本研究在FLT3 信号通路调控肺cDCs的数量和成熟的基础上,探索肺cDCs对ALI早期炎症反应的启动和调控机制。
1 材料与方法 1.1 实验动物及主要试剂SPF级4-6周龄C57BL/6雄性小鼠30只(北京军事医学科学院实验动物中心)。脂多糖(LPS)、Ⅴ型胶原酶及二甲基亚砜(DMSO)(美国Sigma-Aldrich公司)。FLT3-ligand(德国Miltenyi Biotec公司),来他替尼(美国LC laboratory)。亚美尼亚仓鼠抗小鼠单克隆抗体包括异硫氰酸荧光素(FITC)标记的CD11c及同型对照、别藻蓝蛋白(APC)标记的CD80及同型对照,大鼠抗小鼠单克隆抗体包括藻红蛋白(PE)标记的MHC class Ⅱ及同型对照、多甲藻素-叶绿素-花青甙5.5(Percp-Cy5.5)标记的CD11b及同型对照,大鼠抗小鼠单克隆封闭抗体CD16/32(美国eBioscience公司)。髓过氧化物酶(MPO)活性检测试剂盒(中国 南京建成生物工程研究所)。RNA抽提试剂盒、实时荧光定量聚合酶链反应(qRT-PCR)检测试剂盒(日本Takara公司)。IL-6、TNF-α、IFN-γ及IL-4的酶联免疫吸附法(ELISA)检测试剂盒(中国 上海依科赛生物制品有限公司)。
1.2 实验动物分组、处理及模型建立将小鼠随机(随机数字法)分为5组:正常对照组(A组),ALI组(B组),FLT3L预处理组(C组),来他替尼(lestaurtinib,FLT3信号通路高效特异阻断剂)预处理组(D组)以及DMSO对照组(E组)。ALI组小鼠麻醉后暴露颈前部气管,以微量进液器直视下向气道内注入浓度2 mg/mL的LPS 2 mg/kg建立LPS-ALI模型[18]。正常对照组小鼠则向气道内注入等体积的生理盐水。FLT3L预处理组小鼠予以皮下注射FLT3L 10 μg/d,持续5 d后复制LPS-ALI模型。来他替尼预处理组小鼠予以皮下注射来他替尼 40 mg/(kg·d),持续5 d后复制LPS-ALI模型,来他替尼以10%DMSO作为溶媒。DMSO对照组予以皮下注射等量的10% DMSO,持续5 d后复制LPS-ALI模型。造模成功后6 h及24 h以断头法处死小鼠,取出完整肺组织并称重记录。留取左肺,采用机械分离联合胶原酶消化法制备肺实质单个核细胞悬液,台盼蓝染色确认细胞活性大于95%。右肺组织以液氮快速冷冻后置于-80 ℃保存备用。
1.3 检测指标及方法 1.3.1 流式细胞术检测肺cDCs的数量及成熟程度肺单个核细胞悬液调整细胞浓度为1×106 /mL,分别加入单克隆抗体FITC-CD11c,Percp-Cy5.5-CD11b,PE-MHC Ⅱ及APC-CD80,室温下避光孵育30 min,PBS缓冲液洗涤后以1%多聚甲醛固定,4℃避光保存,24 h内上机检测。各样本均设相应的同型对照管。样本以流式细胞仪FASCanto(美国BD公司)进行检测,采用Cellquest软件(美国BD公司)获取分析细胞,以CD11c+CD11b+双阳性细胞占肺单个核细胞的百分比反映肺DCs的数量[6, 8],以MHC Ⅱ+或CD80+单阳性细胞占肺CD11c+CD11b+双阳性细胞的百分比反映肺DCs的成熟程度[6, 9]。
1.3.2 ELISA法检测肺炎症介质的水平取右肺中叶制备组织匀浆,检测各样品孔在450 nm处吸光度,依据标准曲线分别计算肺组织IL-6、TNF-α、IFN-γ及IL-4的浓度。
1.3.3 肺水肿及肺组织病理学检测计算肺湿质量/体质量比(LWW/BW)反映肺水肿[9]。取右肺上叶组织以10%中性甲醛固定后切片,行HE染色后,高倍镜(400×)下计算肺病理损伤评分(LIS)[10]。
1.3.4 比色法检测肺MPO活性取右肺中叶制备组织匀浆,检测各样本在460 nm处吸光度,依据下列公式计算MPO活性:MPO 活性(U/g肺组织)=(样本管460 nm吸光度-空白对照管460 nm吸光度)/肺组织质量×11.3[11]。
1.3.5 qRT-PCR检测转录因子T-bet以及GATA-3的表达取右肺下叶肺组织,提取总RNA反转录产生cDNA,通过ABI Prism 7300 型定量PCR仪(美国ABI公司)进行扩增。采用2-ΔΔCT法计算T-bet和GATA-3 mRNA的相对表达,选取 β-actin作为校正内参基因。PCR使用的引物序列如下:⑴ 小鼠T-bet:forward,5’ -ACC ACC TGT TGT GGT CCA AG-3’以及 reverse,5’-CAC CAA GAC CAC ATC CAC AA-3’; ⑵ 小鼠GATA-3:forward,5’ -ACC GGG TTC GGA TGT AAG TC-3’ 以及 reverse,5’ -AGG CAT TGC AAA GGT AGT GC-3’; ⑶ 小鼠β-actin:forward,5’ -CCT CTA TGC CAA CAC AGT GC-3’ 以及reverse,5’ -GTA CTC CTG CTT GCT GAT CC-3’。定量结果采用β-actin mRNA丰度进行校正,并针对对照组基因表达水平进行标化处理。
1.4 统计学方法采用SPSS 16.0统计学软件包进行统计学分析。计量资料以均数±标准差(x±s)表示。计量资料采用成组t检验、方差分析(ANOVA)或Mann- Whitney U检验进行组内、组间数据比较,计数资料采用χ2检验,以P<0.05为差异有统计学意义。
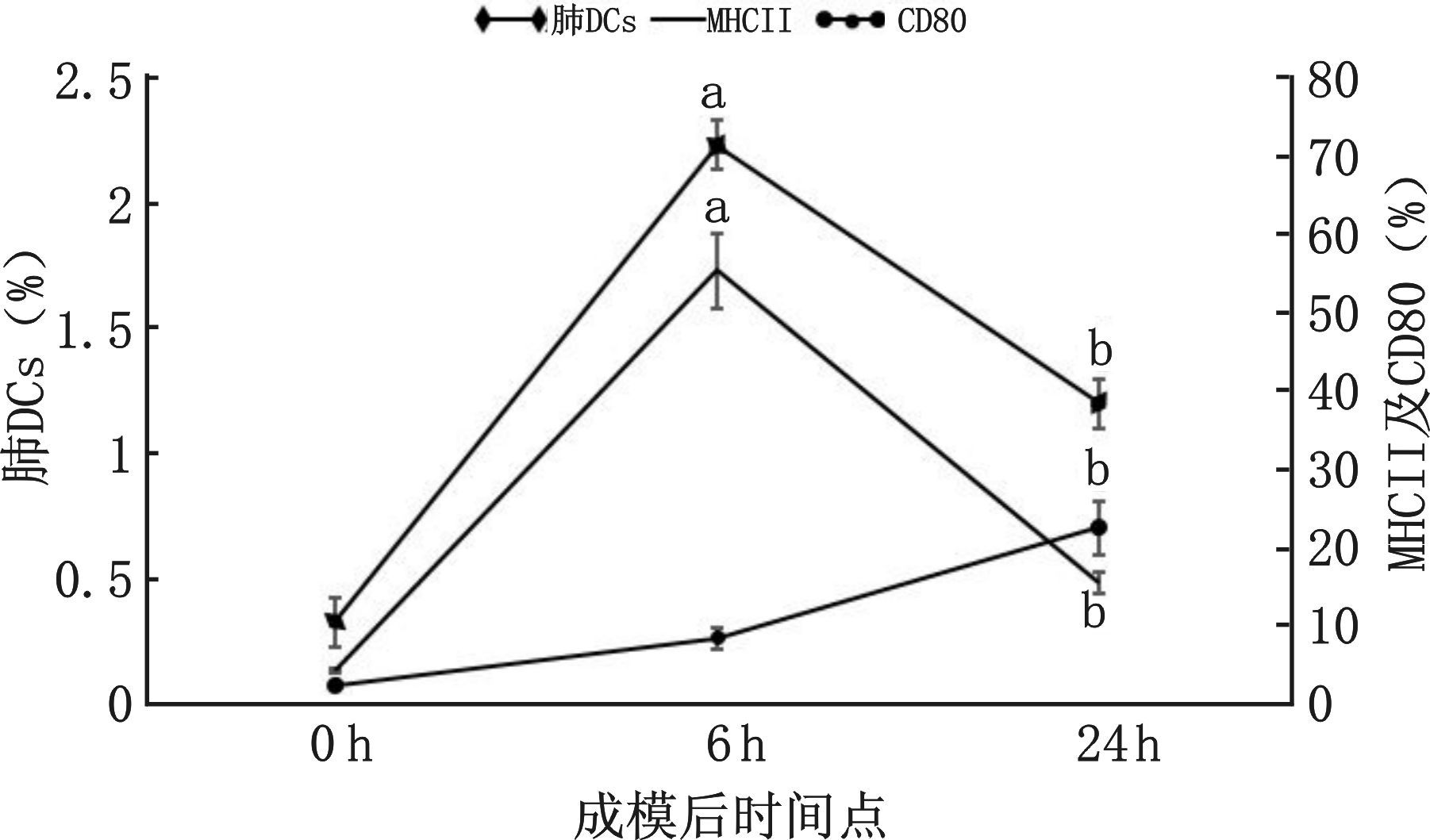
2 结果 2.1 肺cDCs的聚集和成熟状态在ALI成模后6 h达到高峰与0 h比较,ALI成模后6 h肺cDCs占肺单个核细胞的百分比显著增加,同时肺cDCs的MHC Ⅱ分子的表达亦较0 h显著增加。然而ALI成模后24 h,肺cDCs占肺单个核细胞的百分比及肺cDCs MHC Ⅱ分子的表达较成模后6 h显著降低。ALI成模后6 h组肺cDCs的CD80分子的表达与0 h比较差异无统计学意义,但ALI成模后24 h肺cDCs的CD80分子表达较成模后6 h显著增加,见图 1。
|
| 与0 h比较,aP<0.05;与6 h比较,bP<0.05 图 1 ALI成模后0 h、6 h及24 h肺cDCs数量、MHCⅡ及CD80表达的动态变化 Figure 1 ynamic changes of accumulation and expression of MHCⅡ and CD80 of cDCs at 0 h,6 h,24h after ALI |
|
|
ALI成模后6 h,FLT3L预处理组肺cDCs占肺单个核细胞的百分比及肺cDCs MHC Ⅱ分子的表达均较ALI组显著升高。与DMSO对照组比较,来他替尼预处理显著降低预处理组肺DCs占肺单个核细胞的百分比及肺cDCs MHC Ⅱ分子的表达。然而各实验组肺cDCs CD80分子的表达均差异无统计学意义,见表 1。
| 实验组 | 肺cDCs数量 (%) | MHCⅡ表达(%) | CD80表达(%) |
| A组 | 1.11±0.08 | 9.85±0.87 | 1.85±0.45 |
| B组 | 2.23±0.16a | 55.30±8.42a | 2.50±1.02 |
| C组 | 4.98±1.96b | 71.52±6.75b | 2.18±0.85 |
| D组 | 1.44±0.11c | 37.54±5.86c | 1.33±1.10 |
| E组 | 2.19±0.27 | 51.39±6.88 | 2.25±1.25 |
| 注: A组为正常对照组;B组为ALI组;C组为FLT3L预处理组;D组为来他替尼预处理组;E组为DMSO对照组;与A组比较,aP<0.05;与B组比较,bP<0.05;与E组比较,cP<0.05 | |||
ALI组成模后6 h肺TNF-α 和IL-6的表达较对照组显著增加。FLT3L预处理导致的肺cDCs数量增殖和成熟增加可进一步促进肺TNF-α 和IL-6的表达。与之相反,来他替尼预处理导致的肺cDCs数量减少和成熟抑制可显著下调肺TNF-α 和IL-6的表达,见表 2。
| 实验组 | IL-6 (pg/mg) | TNF-α (pg/mg) | MPO (U/g) | IFN-γ(pg/mg ) | IL-4(pg/mg) |
| A组 | 125.20±14.23 | 360.65±21.59 | 2.78±0.25 | 0.65±0.05 | 412.50±18.25 |
| B组 | 270.94±18.28a | 482.67±19.39a | 5.71±0.41a | 50.20±3.55a | 390.90±10.88 |
| C组 | 334.22±25.67b | 590.20±20.86b | 8.58±0.87b | 65.80±6.23b | 420.85±9.56 |
| D组 | 223.15±19.11c | 439.95±27.71c | 4.43±0.29c | 38.72±5.85c | 385.88±22.39 |
| E组 | 296.06±19.44 | 607.34±41.79 | 6.36±0.28 | 60.24±4.98 | 370.62±21.99 |
| 注: A组为正常对照组;B组为ALI组;C组为FLT3L预处理组;D组为来他替尼预处理组;E组为DMSO对照组;与A组比较,aP<0.05;与B组比较,bP<0.05;与E组比较,cP<0.05 | |||||
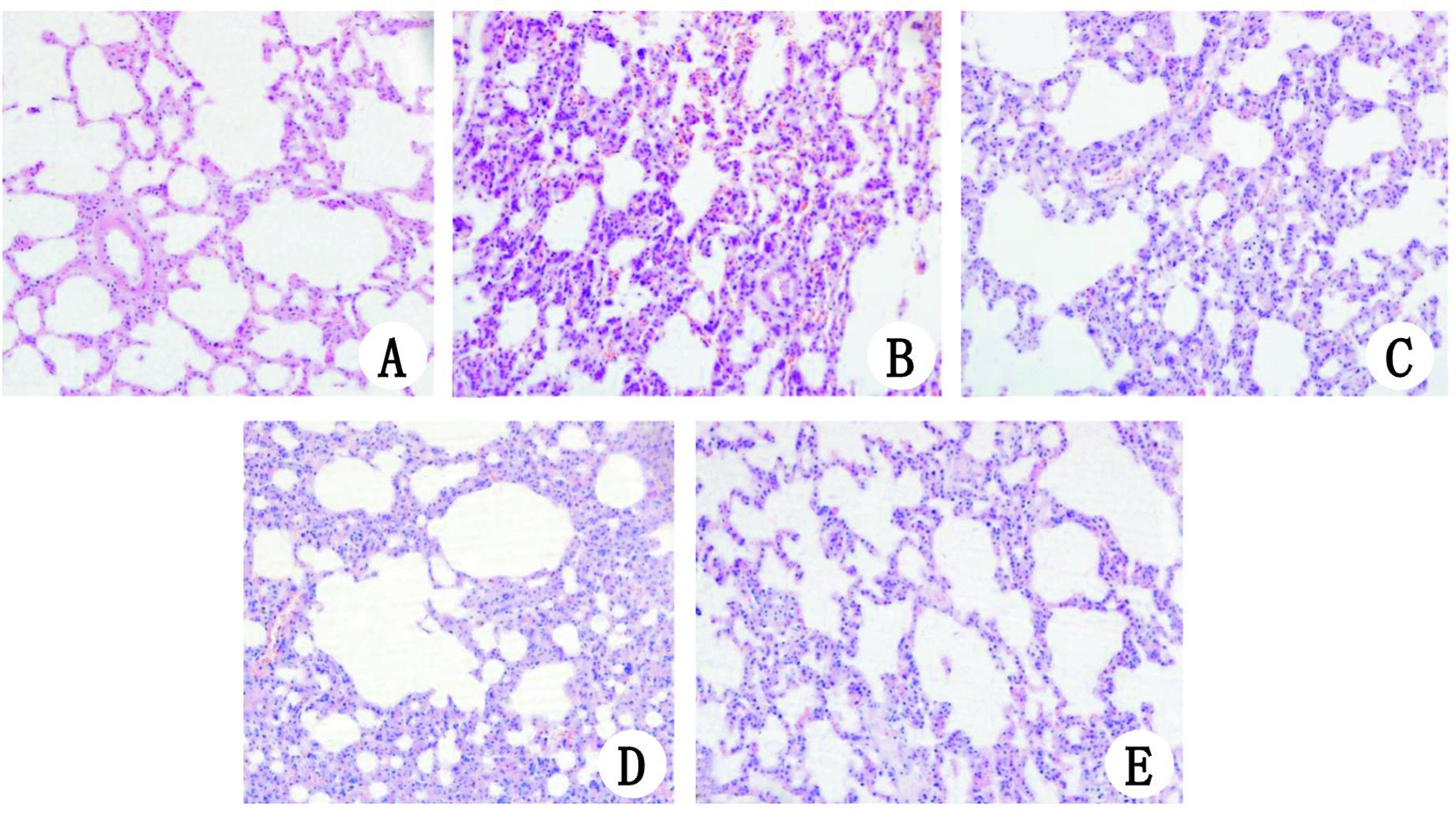
与正常对照组比较,ALI组小鼠肺组织存在广泛的肺泡及间质的水肿和出血,弥漫性的炎症细胞浸润,严重肺泡塌陷和肺泡结构破坏,其LIS和LWW/BW亦较对照组显著增高。FLT3L预处理可进一步加重上述的病理改变,其LIS和LWW/BW ratio 也进一步的升高。与DMSO对照组比较,来他替尼预处理可显著改善肺组织病理损伤的程度,其LIS和LWW/BW 也相应的改善,见图 2、表 3。
|
| A:正常对照组;B:ALI组;C:FLT3L预处理组;D:来他替尼预处理组;E:DMSO对照组 图 2 各实验组成模后6 h肺组织病理损伤比较(HE×400) Figure 2 Pathological changes in the lung tissue of each group(HE×400) |
|
|
| 实验组 | LWW/BW (%) | LIS评分 |
| A组 | 0.65±0.05 | 3.65±0.81 |
| B组 | 0.81±0.07a | 10.92±0.70a |
| C组 | 0.95±0.06b | 13.55±1.01b |
| D组 | 0.73±0.04c | 6.88±0.54c |
| E组 | 0.83±0.05 | 11.48±0.65 |
| 注: A组为正常对照组;B组为ALI组;C组为FLT3L预处理组;D组为来他替尼预处理组;E组为DMSO对照组;与A组比较,aP<0.05;与B组比较,bP<0.05;与E组比较,cP<0.05 | ||
ALI组肺MPO活性较正常对照组显著升高。FLT3L预处理可进一步增加肺MPO活性。与DMSO对照组比较,来他替尼预处理可显著抑制肺MPO的活性,见表 2。
2.6 肺cDCs对转录因子T-bet/GATA-3 mRNA表达比例的影响通过检测转录因子T-bet/GATA-3 mRNA的表达比例以反映肺DCs对Th1/Th2亚群的漂移影响[12]。ALI组T-bet mRNA的表达较对照组显著升高,FLT3L预处理可进一步增加T-bet mRNA的表达。与DMSO对照组比较,来他替尼预处理可显著抑制T-bet mRNA的表达。但各实验组GATA-3 mRNA表达并差异无统计学意义。ALI组T-bet/GATA-3 mRNA表达比例较对照组显著上升,而FLT3L预处理可进一步增加T-bet/GATA-3 mRNA表达比例;与之相反来他替尼预处理可显著降低T-bet/GATA-3 mRNA表达比例,见表 4。
| 实验组 | T-bet mRNA (与β-actin比较) | GATA-3 mRNA (与β-actin比较) | T-bet/GATA-3 mRNA |
| A组 | 1.00±0.15 | 0.98±0.18 | 1.10±0.08 |
| B组 | 2.85±0.33a | 1.34±0.33 | 2.15±0.15a |
| C组 | 3.98±0.45b | 1.05±0.15 | 5.98±0.94b |
| D组 | 2.55±0.30c | 1.10±0.22 | 1.96±0.10c |
| E组 | 3.40±0.40 | 1.28±0.25 | 3.88±0.40 |
| 注: A组为正常对照组;B组为ALI组;C组为FLT3L预处理组;D组为来他替尼预处理组;E组为DMSO对照组;与A组比较,aP<0.05;与B组比较,bP<0.05;与E组比较,cP<0.05 | |||
通过检测细胞因子IFN-γ和IL-4的表达以反映肺cDCs对Th1/Th2型细胞因子平衡的影响。ALI组IFN-γ的表达较对照组显著升高,FLT3L预处理可进一步增加IFN-γ的浓度。与DMSO对照组比较,来他替尼预处理可显著抑制IFN-γ的表达。但各实验组IL-4的浓度并差异无统计学意义,见表 2。
3 讨论目前认为ALI的本质是机体或肺部失控的炎症反应,而肺cDCs在ALI发病机制中的作用也日益受到关注[1, 3]。研究已经表明ALI早期的确存在肺cDCs的快速聚集和成熟[6, 13]。本研究进一步证明肺cDCs的聚集和成熟仅在ALI成模后6 h即可达到高峰,而在ALI成模后24 h肺cDCs的聚集和成熟程度已出现明显的下降。上述结果提示cDCs主要在ALI起病的早期阶段发挥作用[3]。与此同时,肺TNF-α和IL-6的水平持续升高,提示显著的肺部炎症反应。因此,本研究结果提示肺cDCs参与启动了ALI早期炎症反应。
本研究亦发现,肺cDCs的快速聚集和成熟可显著加剧肺部炎症反应和肺损伤程度,而抑制肺cDCs的聚集和成熟可显著减轻肺部炎症反应和肺损伤程度。上述结果提示肺cDCs能够调控ALI的早期炎症反应和肺损伤程度。
目前对于肺cDCs调控急性肺部炎症和肺损伤的机制尚不清楚。本研究结果表明,调控FLT3 信号通路可显著影响肺cDCs的聚集和成熟程度,继而导致辅助性T细胞Th1/Th2亚群的漂移和后续的抗炎/促炎性细胞因子平衡的改变,而既往研究已经证明FLT3信号通路对T细胞的增殖和活化并无影响[5]。因此本研究结果提示直接调控肺Th1/Th2型免疫应答的平衡及后续的Th1/Th2细胞因子的产生是肺cDCs调控ALI早期肺部炎症和肺损伤的重要机制。
本研究结果亦表明调控FLT3 信号通路可显著影响肺cDCs的聚集和成熟程度,进而可影响肺MPO活性,提示肺cDCs可以在体调节中性粒细胞的浸润从而影响ALI早期炎症反应和肺损伤。
ALI早期存在肺Th1/Th2型细胞因子的失衡,但其浓度水平却令人困惑,虽然各实验组成模后24hIFN-γ表达的差异与相应的转录因子T-bet的变化一致,但其浓度水平却徘廻在低值。既往研究表明,从外界侵袭发生到DCs向次级淋巴中的T细胞提呈抗原的高峰至少需要24 h[14],因此不难理解在ALI成模后24 h观察到较低的Th1型细胞因子浓度。但与IFN-γ不同,虽然成模后24 h各实验组IL-4表达并差异无统计学意义,但其浓度水平却大大高于IFN-γ的水平。既往研究表明,为了抵御外界无害性抗原可能导致的Th1型免疫反应所致的组织损伤,正常状态下肺内免疫微环境是向Th2型免疫反应漂移的[3],因此ALI早期肺组织较高的IL-4水平反映的是肺部固有的防御机制[15]。
本研究表明,肺cDCs可通过FLT3 信号通路影响肺部中性粒细胞的浸润和Th1/Th2型免疫反应平衡,进而启动和调节ALI早期炎症反应和肺损伤。通过调控ALI早期肺cDCs的数量和成熟程度进而影响肺部炎症反应可能为ALI防控提供新的思路。
| [1] |
董亮, 邱海波. 急性肺损伤的治疗进展[J].
中华急诊医学杂志 , 2012, 21 (3) : 235-238 Dong L, Qiu HB. Treatment progress of acute lung injury[J]. Chin J Emerg Med , 2012, 21 (3) : 235-238 DOI:10.3760/cma.j.issn.1671-0282.2012.03.002 |
| [2] | Villar J, Sulemanji D, Kacmarek RM, et al. The acute respiratory distress syndrome: incidence and mortality, has it changed[J]. Curr Opin Crit Care , 2014, 20 (1) : 3-9 DOI:10.1097/MCC.0000000000000057 |
| [3] |
董亮, 贺宏丽, 刘军, 等. 急性肺损伤早期肺常规树突状细胞的动态变化[J].
中华急诊医学杂志 , 2012, 21 (6) : 607-611 Dong L, He HL, Liu J, et al. The accumulation and maturation status of pulmonary conventional dendritic cells in the early phase of acute lung injury[J]. Chin J Emerg Med , 2012, 21 (6) : 607-611 DOI:10.3760/cma.j.issn.1671-0282.2012.06.012. |
| [4] | Lee IT, Yang CM. Inflammatory signalings involved in airway and pulmonary diseases[J]. Mediators Inflamm , 2013, 2013 : 791231 DOI:10.1155/2013/791231 |
| [5] | Ward PA, Fattahi F, Bosmann M, et al. New insights into molecular mechanisms of immune complex-induced injury in lung[J]. Front Immunol , 2016, 7 : 86 DOI:10.3389/fimmu.2016.00086 |
| [6] | Venet F, Huang X, Chung CS, et al. Plasmacytoid dendritic cells control lung inflammation and monocyte recruitment in indirect acute lung injury in mice[J]. Am J Pathol , 2010, 176 (2) : 764-773 DOI:10.2353/ajpath.2010.090765. |
| [7] | Riise RE, Bernson E, Aurelius J, et al. TLR-Stimulated neutrophils instruct NK cells to trigger dendritic cell maturation and promote adaptive T cell responses[J]. J Immunol , 2015, 195 (3) : 1121-1128 DOI:10.4049/jimmunol.1500709 |
| [8] | Wen H, Hogaboam CM, Gauldie J, et al. Severe sepsis exacerbates cell-mediated immunity in the lung due to an altered dendritic cell cytokine profile[J]. Am J Pathol , 2006, 168 (6) : 1940-1950 DOI:10.2353/ajpath.2006.051155 |
| [9] | Masten BJ, Lipscomb MF. Comparison of lung dendritic cells and B cells in stimulating naive antigen-specific T cells[J]. J Immunol , 1999, 162 (3) : 1310-1317 |
| [10] | Smith KM, Mrozek JD, Simonton SC, et al. Prolonged partial liquid ventilation using conventional and high-frequency ventilatory techniques: gas exchange and lung pathology in an animal model of respiratory distress syndrome[J]. Crit Care Med , 1997, 25 (11) : 1888-1897 DOI:10.1097/00003246-199711000-00030 |
| [11] | Mullane KM, Westlin W, Kraemer R. Activated neutrophils release mediators that may contribute to myocardial injury and dysfunction associated with ischemia and reperfusion[J]. Ann N Y Acad Sci , 1988, 524 : 103-121 DOI:10.1111/j.1749-6632.1988.tb38534.x |
| [12] | Tanriver Y, Diefenbach A. Transcription factors controlling development and function of innate lymphoid cells[J]. Int Immunol , 2014, 26 (3) : 119-128 DOI:10.1093/intimm/dxt063. |
| [13] | Dong L, He HL, Lu XM, et al. Modulation of FLT3 signaling targets conventional dendritic cells to attenuate acute lung injury[J]. APMIS , 2012, 120 (10) : 808-818 DOI:10.1111/j.1600-0463.2012.02906.x |
| [14] | Hua J, Stevenson W, Dohlman TH, et al. Graft site microenvironment determines dendritic cell trafficking through the CCR7-CCL19/21 axis[J]. Invest Ophthalmol Vis Sci , 2016, 57 (3) : 1457-1467 DOI:10.1167/iovs.15-17551 |
| [15] | Na H, Cho M, Chung Y. Regulation of Th2 cell immunity by dendritic cells[J]. Immune Netw , 2016, 16 (1) : 1-12 DOI:10.4110/in.2016.16.1.1 |
 2016, Vol. 37
2016, Vol. 37




