百草枯是发展中国家使用最为广泛的除草剂之一,中国疾病预防控制中心数据显示2002~2010年PQ中毒事件增加了47.35%,病死率可以达到33%~50%[1]。洗胃(gastric lavage,GL)是清除经消化道摄入毒物是重要的方式,但一直备受争议。美国临床毒理学会、欧洲毒物控制中心和欧洲临床毒理学会在1997年、2004年、2013年三次更新关于洗胃立场的文献,更推崇活性炭吸附治疗,对常规洗胃持慎重态度,因为洗胃存在如消化道穿孔、误吸、电解质紊乱等并发症,因此仅适用于剧毒物质、摄入时间<1 h的患者 (如缓释型药、患者胃排空慢、或易在胃部形成结石的药物,1 h的时间窗可适当延长) [2-3]。但是国外严格限制的洗胃适应证是否适应我国国情?在我国中毒治疗中仍存在过度洗胃、超长时间洗胃和重复洗胃等现象[4]。有报道指出,起始无症状型中毒患者,洗胃并未明显改善临床预后,建议对洗胃应持谨慎态度[5]。目前尚无高质量的临床实验来评价洗胃在中毒治疗的作用[6]。本文以百草枯灌胃的猪为动物模型,在不同时间点洗胃,旨在观察洗胃清除毒物的效果和对于血PQ浓度的影响。
1 材料与方法 1.1 实验材料实验动物及分组:健康雌性家猪17头(由江宁泉水街道养殖场提供,动物合格证号1324820),日龄65~70 d,体质量(28.8±4.59)kg,按随机数字表法分为PQ组(n=6)、PQ+1 h GL组(n=6)、PQ+6 h GL组(n=5)。
1.2 主要仪器及药品呼吸机(AVEA,美国VIASYS公司);气管插管(7.0~7.5 mm,美国柯惠医疗公司); 心电监护仪(Philip,荷兰飞利浦公司);血气分析仪(i-STAT300,美国雅培医疗有限公司);动脉穿刺导管穿刺包(6F,Cordis公司);自动洗胃机(SC-Ⅱ型,天津市同业科技发展有限公司);胃镜(Olympus GIF Q150,日本奥林巴斯公司);超高效液相色谱/四级杆静电场轨道阱高分辨质谱(Ultimate 3000/Q Exactive,ThermoFisher,美国);超高效液相色谱仪(Agilent1260,美国)。40% PQ 溶液(南京红太阳股份有限公司);丙泊酚注射液(商品名得普利麻,美国阿斯利康公司,进口药品注册号H20100648);顺苯磺酸阿曲库铵注射液(美国葛兰素史克公司,注册证号H20050516);枸橼酸舒芬太尼注射液(宜昌人福药业有限公司,国药准字H20054171);咪达唑仑(商品名力月西,江苏恩华药业股份有限公司,国药准字H19990027);盐酸赛拉嗪注射液[商品名陆眠宁,吉林省华牧动物保健品有限公司,兽药字(2015)070011777]。
1.3 操作过程动物术前禁食24 h,自由饮水,肌肉注射咪唑安定5 mg和盐酸赛拉嗪600 mg诱导麻醉,仰卧于实验台上,持续心电监护,耳缘静脉输注0.9%NaCl 3~5 mL/(kg·h),经口气管插管(7.0~7.5 mm)连接呼吸机辅助呼吸,参数设置:容量控制通气模式,潮气量(VT)10 mL/kg,呼吸频率(RR)15次/min,吸呼比(I∶ E)1∶ 2,吸入氧浓度(FiO2)0.21,呼气末正压(PEEP)4 cmH2O(1 cmH2O=0.098 kPa)。经股动脉置入6 F动脉导管,连接压力换能器持续监测动脉血压及心率。各实验组家猪均给予胃镜检查,评估胃排空情况。然后以60 mg/kg经胃管注入 40% PQ 原液,PQ+1 h GL组和PQ+6 h GL组分别在染毒后1 h和6 h经胃管给予20 L温水洗胃操作。整个过程中由耳缘静脉持续泵入丙泊酚1~4 mg/(kg·h),在穿刺血管、置入胃管等有创操作时给予芬太尼0.1 mg,实验开始6 h后给予顺苯磺酸阿曲库铵0.1 mg/(kg·h)维持肌松。24 h在深度麻醉及镇痛的条件下,给予10%氯化钾20 mL弹丸式推注,处死动物。本实验中动物处置方法符合动物伦理学标准。
1.4 监测项目 1.4.1 一般生命体征及呼吸力学参数每小时监测心率(HR)、平均动脉压(MAP)、氧饱和度(SpO2)、呼吸频率、气道峰压(Ppeak)。
1.4.2 血常规、生化功能、血气分析分别在0 h、24 h留取动脉血标本,送检化验室检查血常规、生化功能、血气分析。
1.4.3 血PQ浓度检测分别在0、2、4、6、8、12、24 h 留取血标本,肝素钠抗凝,3 000 r/min离心10 min,留取上层血浆,-80 ℃保存,使用高效液相色谱质谱联用法测量血浆百草枯浓度。
1.4.4 洗出液PQ浓度检测分别留取前10 L洗出液和后10 L洗出液标本各5 mL,-80 ℃保存,使用高效液相色谱法测量洗出液百草枯浓度。
1.5 统计学方法使用SPSS 17.0 软件进行数据分析。计量资料以均数±标准差(x±s)表示,采用单因素方差分析(ANVOA分析),组间两两比较采用LSD-t检验,以P<0.05 为差异具有统计学意义 。
2 结果 2.1 染毒前动物的基线资料家猪在百草枯灌胃前,常规记录生命体征,行动脉血气分析血常规与肝肾功能、电解质检查。染毒前动物的生命体征、电解质、肾功能均差异无统计学意义,但动脉血二氧化碳分压、谷丙转氨酶三组之间差异有统计学意义(P<0.05),见表 1。
| 指标 | PQ组(n=6) | PQ+1 h GL组(n=6) | PQ+6 h GL组(n=5) | P值 |
| 心率(次/min) | 75.83±24.79 | 70.83±21.48 | 57.80±6.91 | 0.34 |
| 呼吸频率(次/min) | 18.00±4.05 | 16.17±1.83 | 14.40±1.52 | 0.14 |
| 体温(℃) | 37.28±1.72 | 36.43±1.27 | 35.60±0.66 | 0.11 |
| 收缩压(mmHg) | 130.33±9.54 | 121.50±13.32 | 110.20±19.28 | 0.10 |
| 舒张压(mmHg) | 78.50±10.65 | 71.83±9.60 | 63.80±15.80 | 0.17 |
| 氧分压(mmHg) | 82.67±21.80 | 83.17±19.45 | 90.80±18.99 | 0.77 |
| 二氧化碳分压(mmHg) | 40.78±6.39 | 43.80±4.11 | 32.52±5.74 | 0.01 |
| 碱剩余(mmol/L) | 2.83±6.39 | 4.67±3.39 | -0.40±6.11 | 0.21 |
| 乳酸(mmol/L) | 1.37±1.66 | 0.74±0.21 | 3.63±4.01 | 0.15 |
| 白细胞(109/L) | 13.35±4.15 | 11.91±5.17 | 11.73±5.45 | 0.83 |
| 中性粒细胞百分比(%) | 31.98±15.88 | 34.63±19.69 | 42.44±15.59 | 0.60 |
| 血红蛋白(g/L) | 108.83±15.24 | 110.67±8.31 | 97.60±15.18 | 0.25 |
| 血小板(109/L) | 515.33±153.88 | 533.83±108.05 | 438.40±152.34 | 0.51 |
| 钾(mmol/L) | 4.15±0.70 | 3.75±0.36 | 3.49±0.28 | 0.12 |
| 钠(mmol/L) | 137.37±4.14 | 138.03±3.78 | 137.20±1.86 | 0.91 |
| 氯(mmol/L) | 97.07±2.16 | 98.05±2.73 | 98.18±1.89 | 0.68 |
| 谷草转氨酶(U/L) | 56.77±40.47 | 33.70±4.05 | 35.12±9.43 | 0.24 |
| 谷丙转氨酶(U/L) | 36.96±14.60 | 43.78±14.22 | 34.28±2.94 | 0.02 |
| 肌酐(μmol/L) | 89.15±13.34 | 86.55±13.73 | 95.84±14.94 | 0.97 |
| 尿素(mmol/L) | 3.28±0.70 | 3.43±1.21 | 3.40±0.32 | 0.06 |
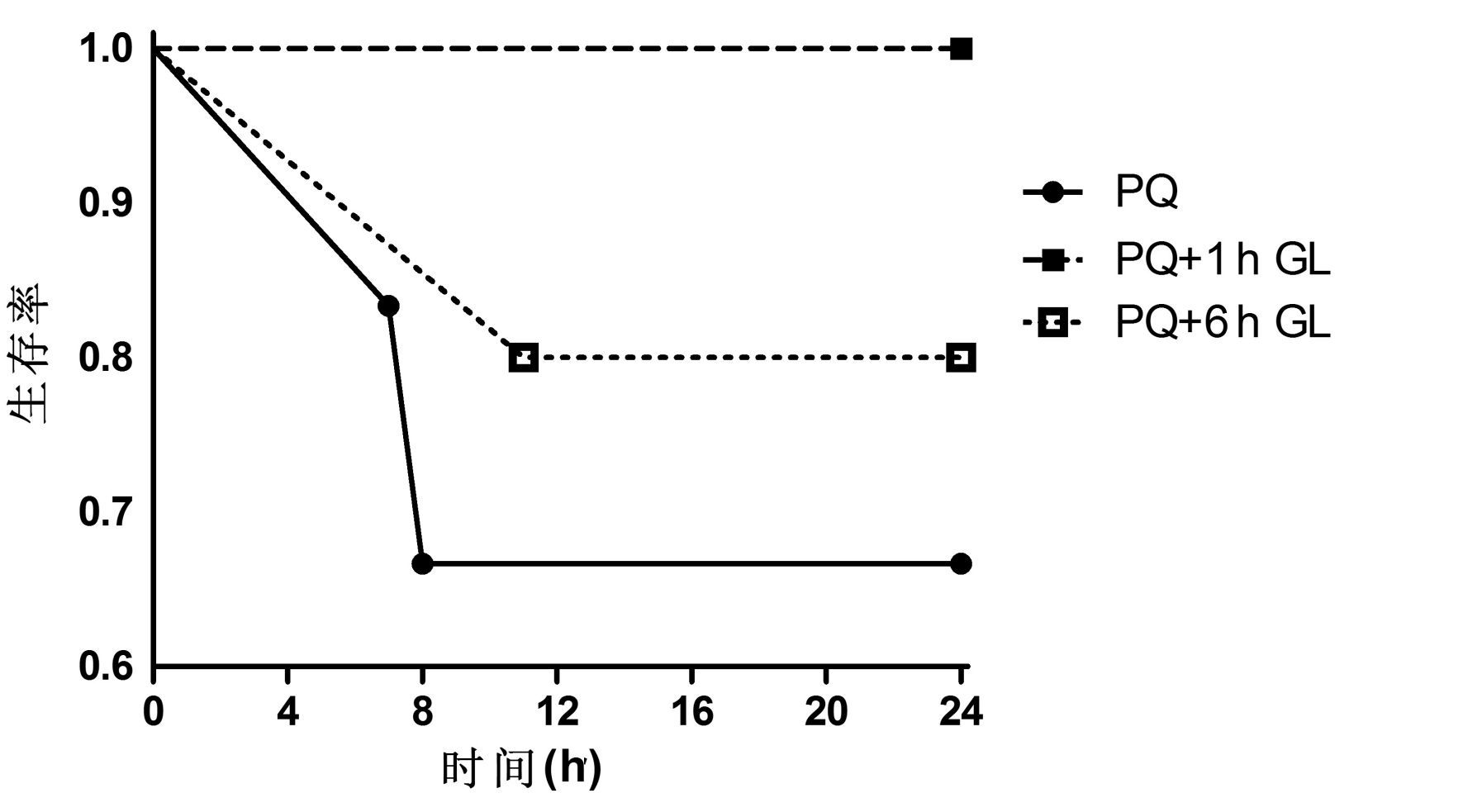
各组动物观察至24 h,其中PQ6头动物中2头动物在8 h内因循环衰竭死亡。6 h洗胃组的5头动物中,1头动物在11 h时因循环衰竭死亡。1 h洗胃组的6头动物全部存活。
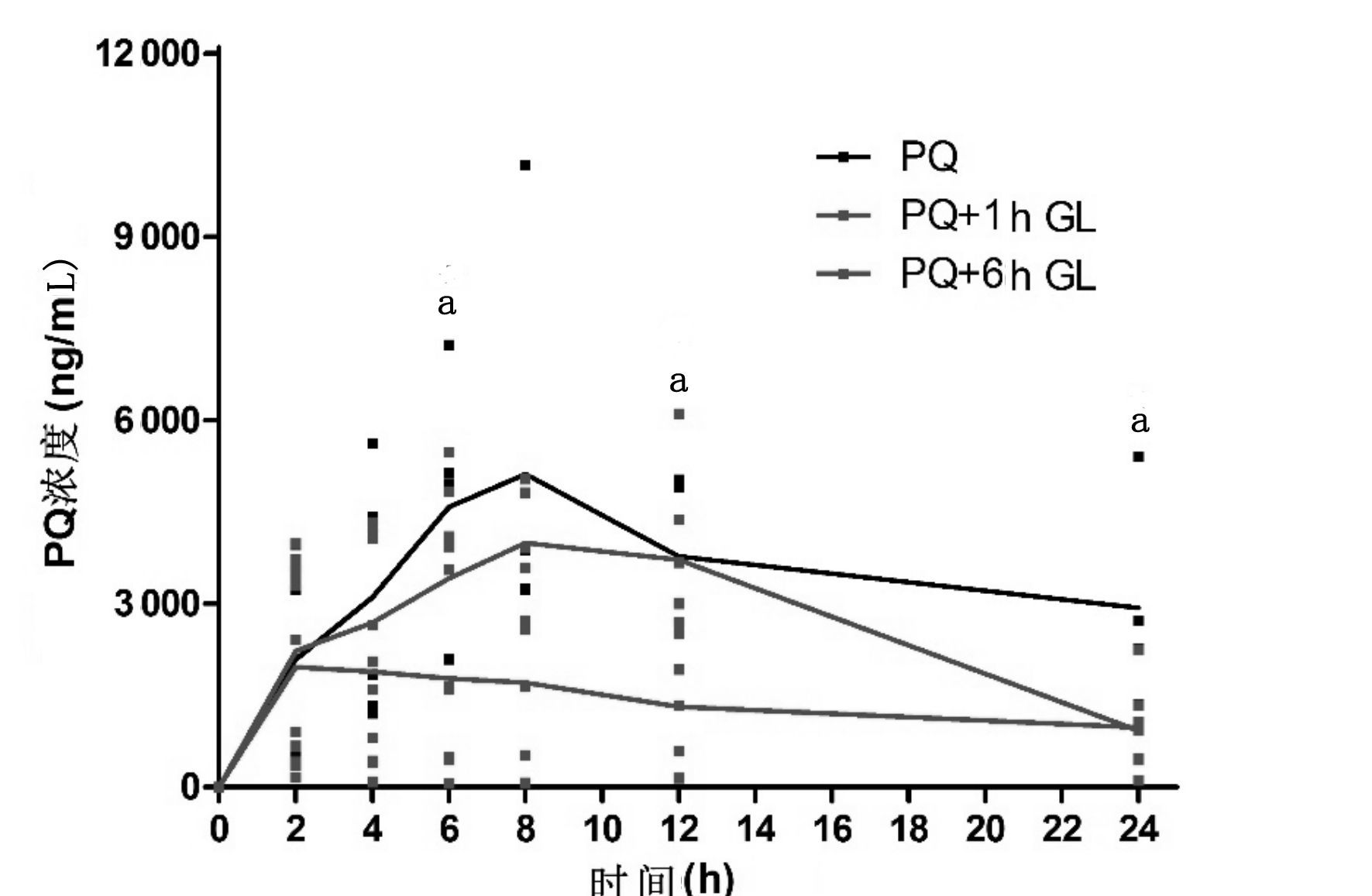
2.3 各组动物血PQ浓度分析PQ组(未洗胃组)与6 h洗胃组的血浓度均在8 h达峰,血药浓度分别为(5.12±3.38)μg/mL vs.(3.99±1.24)μg/mL,两组在24 h血药浓度分别降至(2.98±1.73)μg/mL(未洗胃组)和(0.92±0.35)μg/mL(6 h洗胃组);1 h洗胃组血浓度在2 h达峰(1.96±1.83)μg/mL,24 h时降至(0.98±0.73)μg/mL。3组动物各时间点血PQ浓度的比较:1 h洗胃组在6 h、12 h均明显低于未洗胃组和6 h洗胃组,差异有统计学意义(P<0.05);在24 h时间点,未洗胃组(2.98±1.73)μg/mL与两组洗胃组的血药浓度差异均有统计学意义(P<0.05),但两组洗胃组组间比较,血药浓度(0.98±0.73)μg/mL vs.(0.92±0.35)μg/mL,差异无统计学意义(P>0.05)。
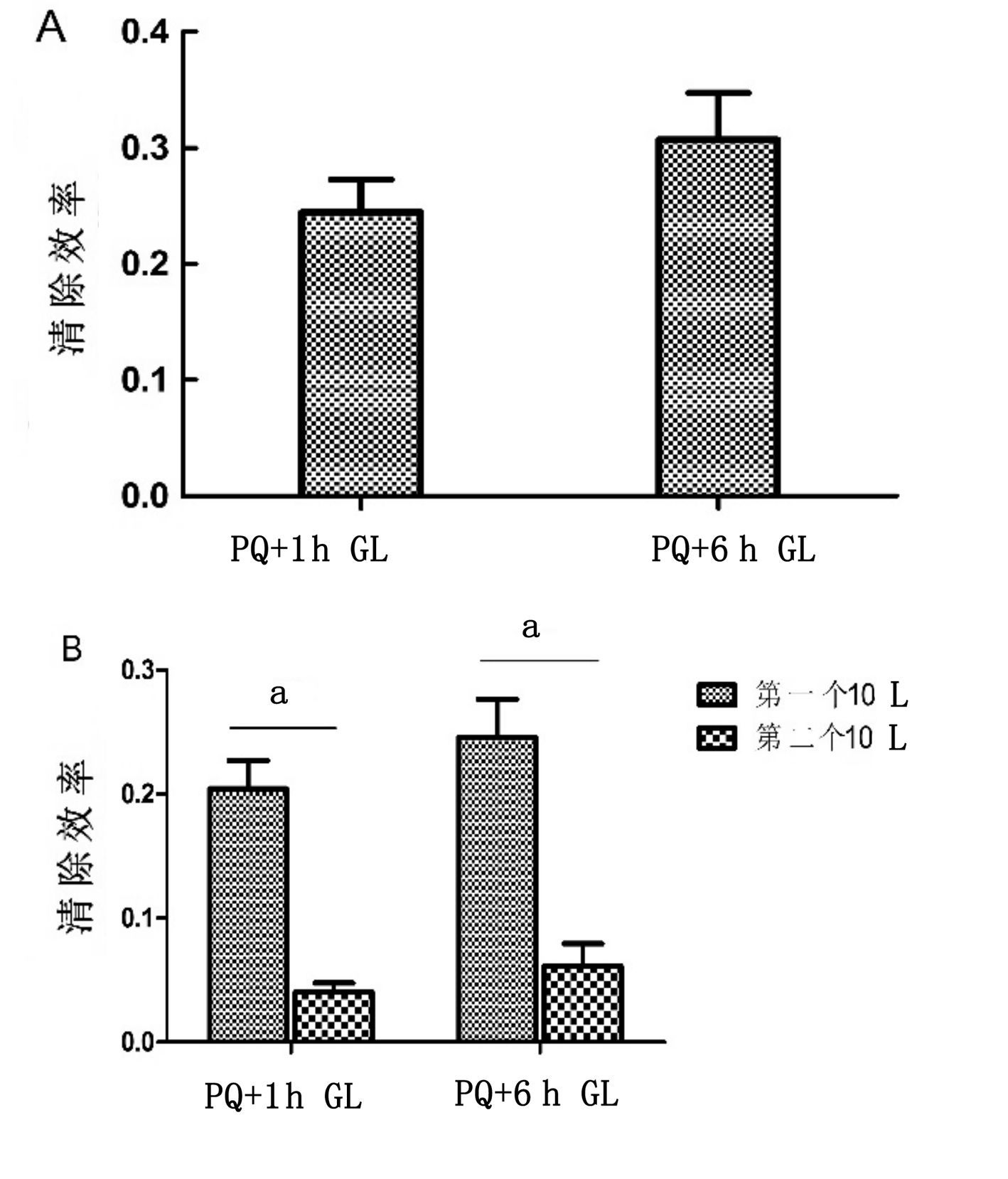
2.4 洗胃各组洗出液PQ浓度分析使用高效液相色谱法测量洗出液的百草枯的浓度,发现1 h洗胃组和6 h洗胃组通过洗胃清除的百草枯量占摄入总量的(24.46±6.49)% vs.(30.72±9.86)%,两者差异无统计学意义(P>0.05)。计算前1/2体积洗胃液(前10 L洗出液)和后1/2体积洗胃液(后10 L洗出液)中PQ洗出量分别占总摄入量的比例,1 h洗胃组(20.44±5.59)% vs.(4.02±1.82)%(P<0.01),6 h洗胃组为(26.17±7.19)% vs.(7.03±4.29)%(P<0.01)。
|
| 图 1 PQ组、PQ+1 h GL组和PQ+6 h GL组生存率比较(对数秩检验,χ2=2.355;P>0.05) Figure 1 Comparision of survival rate among PQ group,PQ+1 h GL group and PQ+6 h GL group (χ2=2.355;P>0.05) |
|
|
|
| 图 2 各组血液PQ浓度比较(aP<0.01) Figure 2 Comparison of PQ concentration between each group(aP<0.01) |
|
|
|
| 图 3 A:不同时间点洗胃液清除效率;B:同一时间点前1/2体积与后1/2体积洗胃液清除效率比较(aP<0.01) Figure 3 A:Comparison of the clearance efficiency of gastric lavage between different intervals; B: Comparison of the clearance efficiency between the first 10Land the second 10Lof stomach washing water(aP<0.01) |
|
|
PQ组、1 h洗胃组、6 h洗胃组的动物24 h血清钾离子、钠离子均在正常范围内,见表 2。一般生命体征、血常规及肝肾功能的变化差异均无统计学意义。
| 离子 | PQ组(n=6) | PQ+1 h GL组(n=6) | PQ+6 h GL组(n=5) | P值 |
| 钾离子(mmol/L) | 3.48±0.48 | 3.43±0.44 | 4.08±0.65 | 0.19 |
| 钠离子(mmol/L) | 133.18±4.32 | 136.20±5.03 | 134.55±6.19 | 0.68 |
| 氯离子(mmol/L) | 89.10±5.21 | 96.05±5.93 | 93.98±7.94 | 0.28 |
洗胃是传统的治疗经口摄入毒物的方法,我国和西方国家在把握洗胃指征上有很大的差异。自1997年美国实行的是严格的洗胃指征,但研究发现:美国加利福尼亚州毒物控制系统分析2009~2012年间全州共921例患者进行洗胃,其中41.2%的患者不符合洗胃指征,这些患者中有22.7%洗胃液中含有碎药片[7],因此严格的洗胃指征是值得商榷的[8]。其次由于地域及经济因素,各国的毒物谱有很大差异,美国以镇静催眠药/抗精神失常药、心血管药、阿片类药为三大主因,病死率为0.05%[2];我国导致患者死亡的毒种排在前三位的是农药、毒蘑菇、鼠药,病死率为2.06%。当面对没有特效治疗方法的剧毒、摄入超过致死剂量毒物,洗胃是能采取的一项治疗方法。因此有必要依据国情,进一步探讨洗胃的适应证和方式等。
本研究以染毒剂量为60 mg/kg的百草枯灌胃猪为动物模型,在1 h和6 h进行洗胃,发现洗出液中的百草枯含量均占总摄入量的25%~30%,提示洗胃操作可以有效清除胃内百草枯,而且前10 L的洗出液中百草枯浓度较后10 L明显增高,说明洗胃的最初阶段清除毒物效率较高,其后的效率则明显下降。因此经消化道摄入大量毒物时,就清除胃内的毒物而言,即使在6 h洗胃对于清除残留的毒物仍有作用。采用20 L的洗胃液进行洗胃可能是较为理想的方法,洗胃的早期阶段对于毒物清除的效率较高,因此临床上有使用胃镜辅助毒物清除的报道,洗胃量超过20 L,并不能相应地增加毒物的清除。既往很多研究认为洗胃存在着严重的致死性的并发症,但目前的数据表明洗胃的并发症的发生率为2%[7],本研究发现24 h各组实验动物的电解质(钾、钠离子)均在正常范围内,这也提示将洗胃液的量控制在一定范围内,不仅能减少严重电解质紊乱的风险,还可以节约时间进行下一步的治疗如血液净化等。
本研究中1 h洗胃组在2 h血浆PQ浓度达峰值,且各时间点的血药浓度较其他两组均明显降低。6 h洗胃组和GL组的峰浓度均出现在8 h左右,两者在2、4、6、8、12 h各点差异均无统计学意义,仅在24 h时6 h洗胃组的血浆PQ浓度低于PQ组。说明1 h洗胃可降低血浓度。但是滞后至6 h洗胃则不能有效降低染毒早期血PQ浓度,Hart等[9]依据血PQ浓度绘制的百草枯中毒生存曲线提示早期的血浓度的高低决定了患者的预后。因此6 h洗胃对于降低百草枯中毒的病死率价值较小。
本研究仍存在以下不足,第一:虽然为了保证同质性和减少偏差,本实验前期的6 h内未使用肌松药,以减少药物对胃肠道的蠕动的影响;动物灌胃前均进行了胃镜检查,以监测胃内是否有残存的食物,仍发现实验动物胃内均有较多的胃液和少量的食物残渣;笔者采用了40%浓度的百草枯原液,以避免市售的20%的百草枯农药中含有致吐剂易导致动物呕吐,造成总摄入量的差异,但实验过程中仍有部分动物发生了呕吐,以上的多种因素造成各组血PQ浓度变异较大。由于动物的个体差异较大,在基线资料中谷丙转氨酶和动脉血二氧化碳分压存在差异,因为尚在正常范围内,故予忽略。第二,本研究发现6 h洗胃虽然能清除毒物,但不降低中毒早期12 h内血中百草枯浓度。笔者未能对于洗胃的合理时间界限做更进一步的研究。因此仍需要大量的动物实验以及临床循证医学的证据进一步规范洗胃流程。
| [1] | Yin Y, Guo X, Zhang SL, et al. Analysis of paraquat intoxication epidemic (2002-2011) within China[J]. Biomed Environ Sci , 2013, 26 (6) : 509-512 DOI:10.3967/0895-3988.2013.06.014 |
| [2] | Benson BE, Hoppu K, Troutman WG, et al. Position paper update: gastric lavage for gastrointestinal decontamination[J]. Clin Toxicol (Phila) , 2013, 51 (3) : 140-146 DOI:10.3109/15563650.2013.770154 |
| [3] | Vale JA, Kulig K, American Academy of Clinical T, et al. Position paper: gastric lavage[J]. J Toxicol Clin Toxicol , 2004, 42 (7) : 933-943 DOI:10.1081/CLT-200045006 |
| [4] |
乔莉, 张劲松. 我国急性中毒临床救治的现状与思考[J].
中华急诊医学杂志 , 2015, 24 (11) : 1193-1196 Qiao L, Zhang JS. Current situation and thinking of clinical treatment of acute poisoning in China[J]. Chin J Emerg Med , 2015, 24 (11) : 1193-1196 DOI:10.3760/cma.j.issn.1671-0282.2015.11.001 |
| [5] |
徐腾达, 于学忠, 王厚力, 等. 胃肠道去污染对无起始症状型中毒患者预后的影响[J].
中华急诊医学杂志 , 2007, 16 (12) : 1293-1296 Xu TD, Yu XZ, Wang HL, et al. Influence of gastrointestinal decontamination on asymptomatic presentation poisoning patients[J]. Chin J Emerg Med , 2007, 16 (12) : 1293-1296 DOI:10.3760/j.issn.1671-0282.2007.12.014 |
| [6] | Li Y, Tse ML, Gawarammana I, et al. Systematic review of controlled clinical trials of gastric lavage in acute organophosphorus pesticide poisoning[J]. Clin Toxicol (Phila) , 2009, 47 (3) : 179-192 DOI:10.1080/15563650701846262 |
| [7] | Donkor J, Armenian P, Hartman IN, et al. Analysis of Gastric Lavage Reported toaStatewide Poison Control System[J]. J Emerg Med , 2016, 51 (4) : 394-400 DOI:10.1016/j.jemermed.2016.05.050 |
| [8] | Pitera A, Sarko J. Just say no: gastric aspiration and lavage rarely provide benefit[J]. Ann Emerg Med , 2010, 55 (4) : 365-366 DOI:10.1016/j.annemergmed.2009.10.016 |
| [9] | Hart TB, Nevitt A, Whitehead A. A new statistical approach to the prognostic significance of plasma paraquat concentrations[J]. Lancet , 1984, 2 (8413) : 1222-1223 DOI:10.1016/s0140-6736(84)92784-3 |
 2016, Vol. 25
2016, Vol. 25




