天门冬氨酸受体(N-Methyl-D-Aspartate receptor,NMDAR)是一种对Ca2+有高通透性的离子型谷氨酸受体,NMDAR也在心房肌、心室肌、传导系统、心脏内在神经纤维和神经节细胞等心脏部位上广泛分布[1, 2]。笔者先前的研究发现激活NMDAR会导致心脏结构和电生理异常,显著增加室性心律失常(ventricular arrhythmias,VAs)易感性[3, 4]。研究发现抑制NMDAR能够显著减少缺血-再灌注诱发的VAs,并能预防心肌病大鼠发生心脏性猝死(sudden cardiac death,SCD)[5, 6]。急性心肌梗死(简称心梗)是SCD最主要的病因,然而,抑制NMDAR是否对急性心肌梗死的进展有影响,以及具体机制如何,尚不清楚。为此,本研究试图探讨抑制NMDAR对急性心梗诱发的VAs和心梗面积的影响,为急性心肌梗死的临床防治提供实验依据。
1 材料与方法 1.1 实验动物和分组选用健康SPF级雄性成年Sprague-Dawley大鼠 (由武汉大学动物实验中心提供) 45只(280~300 g),进行1周适应性饲养后,随机(随机数字法)均分为三组:假手术组、心梗组和治疗组。治疗组动物在急性心梗模型制作前,按0.5 mg/(mL·kg)的浓度经腹腔给予MK801(NMDAR特异性抑制剂,Sigma公司,美国)连续治疗一周,另外两组动物均经腹腔给予等量的生理盐水1周。
1.2 急性心肌梗死模型制作经1%浓度的水合氯醛(0.3 mL/kg)行腹腔注射深度麻醉后,通过口腔气管插管,接小动物呼吸机(江西特力公司),予100%的O2通气。从左胸第三肋处开胸,暴露心脏,剥离心包,于左心耳和肺动脉圆锥左下缘2 mm处结扎冠状动脉左前降支(LAD)。假手术组只穿线,不结扎。以LAD灌注区域心肌变白和Ⅱ导联ECG的T波高尖、ST段抬高为心梗制作成功的标准。
1.3 ECG记录心梗制作过程中,按体表肢体Ⅱ导联记录心梗前和心梗后30 min的ECG;记录完成后,将遥测ECG记录仪(型号EA-F40,Data Science International公司,美国)植入动物体内,连续记录24 h,以记录VAs发生情况。本研究纳入的分析的VAs包括:(1)室速 连续3及以上的室性早搏;(2)室颤 QRS形态和频率不断变化,难以分辨,代之以形态不等、频率不规则的颤动样波。以VAs的个数、持续时间来比较各组VAs易感性。
1.4 病理学分析在心电图记录24 h后,迅速脱臼处死动物,取出心脏,分离左心室 (每组随机4只)。经过10%福尔马林固定、石蜡包埋、切片等步骤将标本切除5 μm的组织,将切片分为两份。一份予抗缝隙连接蛋白43(connexin43,Cx43)抗体(1∶ 500,Abcam公司,美国)孵育和荧光素标记。另一份采用细胞凋亡试剂盒(北京中杉金桥生物技术有限公司),运用末端脱氧核苷酸转移酶介导的缺口末端标记法(terminal deoxynucleotidyl transferase mediated dUTP nick-end-labelling,TUNEL)染色。将切片置于OLYMPUS BX51显微系统下拍摄,每个切片随机拍6张,再运用 Image-Pro Plus 6.0(Media Cybernetics公司,美国)图像分析系统计算阳性的染色组织。Cx43表达量以阳性染色面积除以总面积表示,凋亡指数以凋亡小体个数除以细胞核总个数表示。
同上步骤处死动物(每组随机4只),迅速取出心脏,经主动脉注入1%的伊文氏篮,剪去心房和右室,经二尖瓣乳头肌水平将组织切成2 mm的薄片,经氯化三苯四氮嘬磷酸缓冲液孵育30 min,再经10%福尔马林固定24 h。经过上述染色过程,正常心肌染为蓝色,缺血心肌染为红色,坏死心肌染为灰白色。按上述拍摄和计算过程,分析各区的面积,心梗面积=(缺血区+坏死区)/总面积×100%。
1.5 Western blot分析经上步骤处死动物(每组随机3只),迅速取出心脏,分离出左心室,置于-80 ℃冰箱保存备用。提取组织蛋白,BCA法定量,50 μg 样品上至10%聚丙烯酰胺凝胶电泳后,转膜至PVDF膜(Millipore公司,德国)上,置于5%脱脂奶粉封闭液中摇床封闭2 h,取出后加入一抗(anti-NR1,1∶ 100,Abcam公司,美国),4 ℃孵育10 h。取出后TBST洗液 洗涤3 次,加入1∶ 2 000 稀释的二抗(辣根过氧化物酶标记,Pierce公司,美国)中室温摇床孵育2h,再次用TBST 洗膜3次。暗室中将膜与ECL 反应2~8 min 后,压于X 线胶片上,后经显影、定影成像。以Actin作为内参,对蛋白定量。
1.6 统计学方法采用SPSS 19.0软件处理分析数据,计量资料用均数±标准差(x±s)或中位数表示,多组间比较采用LSD-t检验或Nemenys秩和检验;计数资料用比值表示,组间比较用χ2检验,以P<0.05为差异具有统计学意义。
2 结果 2.1 存活率比较心梗模型制作过程中,假手术组、心梗组和治疗组分别有1、2和1只大鼠死亡,其余大鼠心梗模型均制作成功,心梗的ECG表现如下图 1;此后24 h后,假手术组、心梗组和治疗组分别有0、1和0只大鼠死亡;三组分别有14、12和14只大鼠纳入最终分析;三组大鼠生存率相近(14/15 vs. 12/15 vs. 14/15),差异无统计学意义(χ2=1.80,P=0.41)。
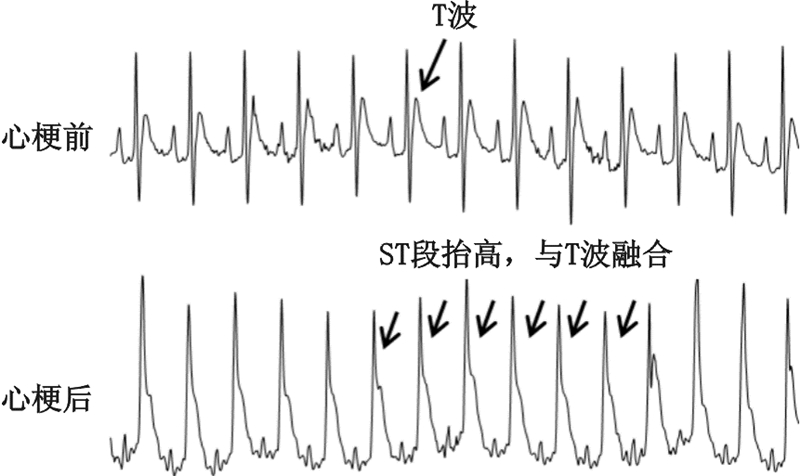
|
| 图 1 心梗前后Ⅱ导联ECG的变化 Fig.1 Changes in Ⅱ lead ECG before and after myocardial infarction |
急性心梗后30 min,心梗组发生VAs次数的中位数为12次,持续时间的中位数为17.53 s;与心梗组比较,治疗组VAs个数较少,持续时间较短;假手术只有偶发的VAs出现;三组间比较,差异均有统计学意义(P<0.01)。ECG遥测24 h,三组大鼠VAs易感性趋势未改变,心梗组最多,治疗组次之,假手术组最少,差异均有统计学意义(P<0.01)。见图 2。
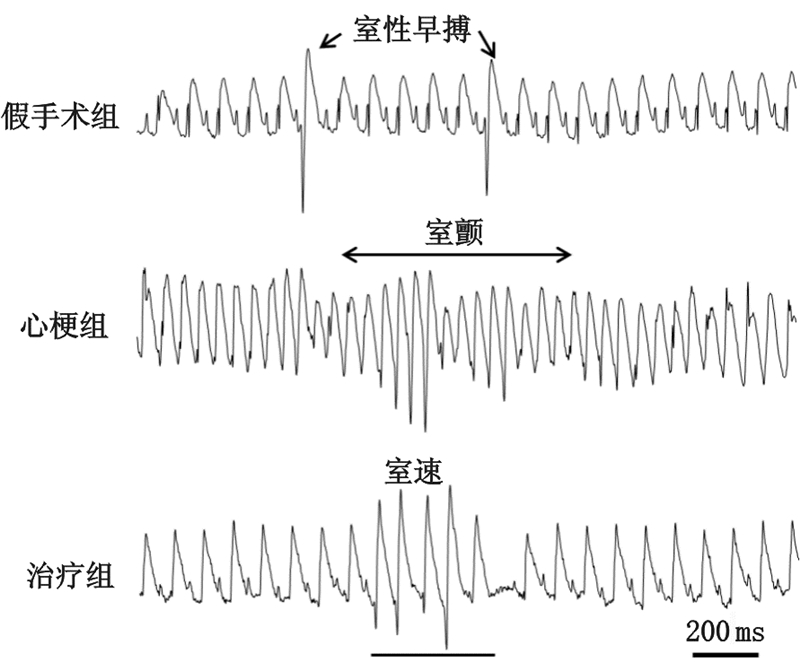
|
| 图 2 三组大鼠急性心梗后典型的室性心律失常表现 Fig.2 Typical VAs after myocardial infarction among three groups |
免疫组化染色结果显示,假手术组大鼠左心室Cx43分布均匀,表达丰富(2.53±0.41)%,主要在心肌连接处呈线状或点状排列;在心梗组表达显著下降(0.74±0.15)%,分布散乱;而治疗组表达较心梗组多(1.68±0.27)%,分布较均匀;差异具有统计学意义(P<0.01)。TUNEL染色结果显示,心梗组大鼠左心室有大量凋亡小体分布(32.53±7.21)%,治疗组较少(13.49±3.25)%,而假手术组最少(2.18±1.04)%,差异具有统计学意义(P<0.01)。治疗组大鼠左室心梗面积显著小于心梗组(36.58±2.57)% vs.(43.72±3.11)% ,P<0.01,见图 3。
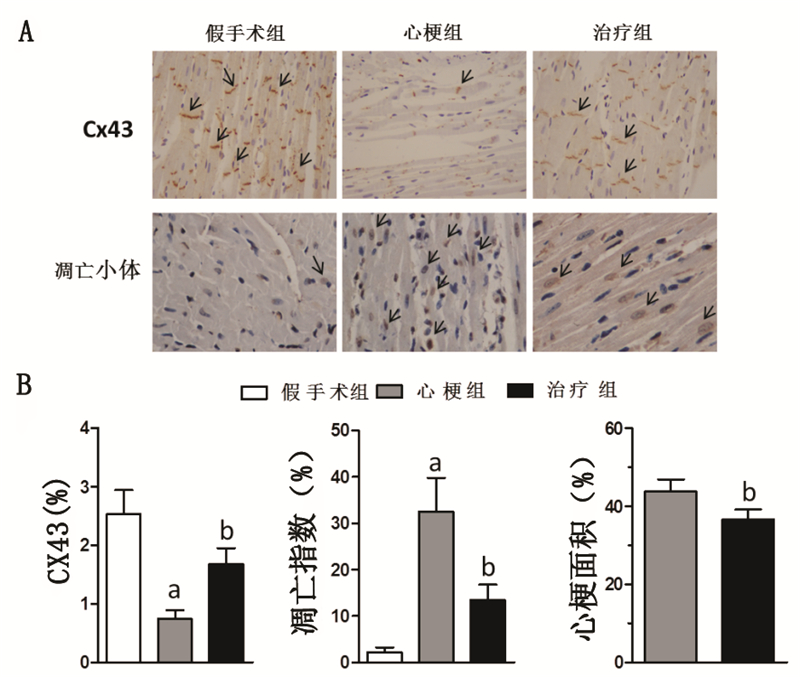
|
| A:三组大鼠心脏典型的Cx43免疫组化图(X200)和凋亡小体TUNEL图(X200);B:三组大鼠心脏Cx43表达量、凋亡指数、心梗面积的比较;箭头表示阳性染色区;与假手术组比较,aP<0.01;与心梗组比较,bP<0.01 图 3 三组大鼠心脏Cx43表达、凋亡指数和心梗面积的比较 Fig.3 Comparison of Cx43 expression,apoptosis index and infarction area among three groups |
与假手术组比较,心梗组大鼠左心室NMDAR1表达量显著增加(1.12±0.09)vs.(0.54±0.06),P<0.01;而治疗组大鼠左心室NMDAR1表达量显著低于心梗组(1.12±0.09)vs.(0.81±0.07),P<0.01,见图 4。
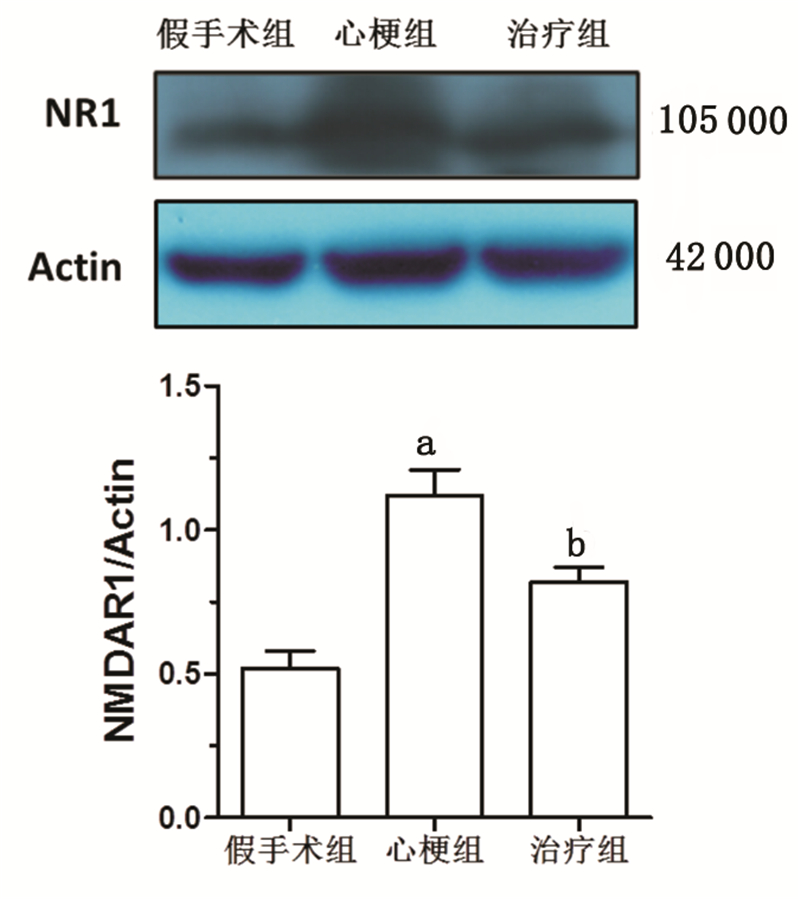
|
| 与假手术组比较,aP<0.01;与心梗组比较,bP<0.01 图 4 左心室NMDAR1表达量比较 Fig.4 Comparison of the NMDAR1 expression in left ventricle |
既往关于NMDAR的研究主要集中在中枢神经系统,作为谷氨酸信号通路的关键受体之一,NMDAR不仅参与调控神经突触的形成、学习和记忆等生理过程,而且在脑卒中、阿尔海默氏综合征等多种中枢神经系统疾病中发挥重要的作用[2, 7]。近来,发现NMDAR也广泛分布于人类、大鼠、小鼠、恒河猴等哺乳动物的心脏中,因此推测NMDAR与心脏的病理生理过程有密切联系[1]。笔者先前持续慢性激活NMDAR两周,使心室钾通道蛋白减少,心肌间质纤维化,显著增加室性心律失常的易感性[3]。另外,Sun等[6]研究发现抑制NMDAR受体能够显著减少缺血-再灌注引起的心律失常,然而其与急性心梗的关系还未得到研究。
本研究结果显示,心梗组大鼠NMDAR表达显著增加,提示NMDAR可能参与了急性心梗的病理过程中。MK801预治疗一周能够减少由心梗导致的Cx43降解,并显著降低超急性期(30 min)和亚急性期(24 h)室速和室颤的发生率,减少VAs的持续时间;还可抑制心肌凋亡过程,进而减少心梗面积。上述结果进一步提示NMDAR与急性心梗的发展密切相关,抑制NMDAR能够预防急性心梗进展和并发症。
VAs是急性心梗患者死亡的主要原因之一,约有20%的急性心梗患者将会发生致命性的室速或室颤,防治SCD是急性心梗重要的治疗目的[8, 9]。然而临床上仍有许多急性心梗患者死于SCD,这可能其复杂的机制有关。其中缝隙连接蛋白丢失、通道关闭是急性心梗的重要病理特征[10]。Cx43是主要的心室肌缝隙连接蛋白,它作为细胞间电信号和化学分子沟通的孔道,大大减少了心肌细胞间的阻力,让电化学信号在细胞间快速传播,使心室肌在功能上成为一个协调的整体[10]。急性心梗会导致大量的Cx43通道蛋白降解和关闭,一方面作为保护机制,使正常细胞免受酸性环境和毒性代谢产物的损害,另一方面阻滞了电冲动的传道,构成折返性通路,显著增加SCD的风险[11, 12]。本研究也证实,急性心梗后心室肌Cx43表达大量下降,分布不均匀,心肌端端连接缺失,而MK801预处理后Cx43表达下降相对较少,分布较均一,这将会大幅度减少电传导速度的异质性和阻滞的风险,进而减少室速或室颤的发生。
细胞凋亡是一种非能量消耗的程序性死亡,它在急性心梗病程中起着重要的作用。研究表明,凋亡是急性心梗心肌损伤的主要病理特征,凋亡有别于坏死,其高峰在心梗后4.5 h,而坏死在24 h,急性期凋亡程度是坏死的30倍,而心梗一周后凋亡过程仍然显著[13]。凋亡不仅在心梗急性期出现,在心肌修复、心脏重构起着关键作用,因此减少心肌细胞凋亡有望成为心梗治疗的一个靶点[14]。本研究发现,MK801显著抑制急性心梗后心肌凋亡,减少24 h的心梗面积,表明NMDAR与急性心梗后凋亡过程密切相关。既往研究证实,用NMDA(NMDAR激动剂)培养中枢神经细胞,显著增加细胞凋亡,呈浓度依赖性;而抑制NMDAR被证实能够有效地抑制脑卒中进展,减小脑梗死面积[15, 16]。本研究结果进一步提示,NMDAR也参与了急性心梗的病理过程,抑制NMDAR将有望成为一个治疗策略。
上述变化与NMDAR的功能特性有关,NMDAR是一种对Ca2+高通透的受体通道蛋白,心肌缺血时释放多种激活剂,如谷氨酸、同型半胱氨酸等,激活NMDAR,导致大量Ca2+内流[6]。Ca2+作为细胞电活动的离子,大量Ca2+内流将会导致心肌细胞Ca2+超载,使Ca2+操控紊乱,引起后除极、Ca2+活化等变化,最终导致心律失常的发生[17, 18]。另外,Ca2+作为细胞内重要的第二信使,介导多种信号通路,激活多种Ca2+依赖的蛋白酶,如钙调蛋白激酶、蛋白激酶A、蛋白激酶C、金属基质蛋白酶等,参与底物蛋白的修饰和信号传导;还会启动线粒体的凋亡途径,是多种心脏疾病的重要发生机制和干预靶点[19, 20]。MK801抑制NMDAR受体,减少Ca2+内流,大幅降低了Ca2+引起的系列变化。本研究发现治疗组Cx43表达增加,可能与金属基质蛋白降解Cx43减少有关;而凋亡减少可能与MK801抑制Ca2+超载有关。
综上所述,NMDAR受体与急性心梗病理变化密切相关,抑制NMDAR显著抑制Cx43降解和凋亡过程,进而减少心梗急性期VAs的发生,限制心梗面积,将来有望成为新的治疗手段。
| [1] | Gill S, Veinot J, Kavanagh M, et al. Human heart glutamate receptors - implications for toxicology, food safety, and drug discovery [J]. Toxicol Pathol, 2007, 35(3):411-417. |
| [2] | Flores-Soto ME, Chaparro-Huerta V, Escoto-Delgadillo M, et al. Structure and function of NMDA-type glutamate receptor subunits[J]. Neurologia, 2012,27(5):301-310. |
| [3] | Shi S, Liu T, Li Y, et al. Chronic N-Methyl-d-aspartate receptor activation induces cardiac electrical remodeling and increases susceptibility to ventricular arrhythmias[J]. Pacing Clin Electrophysiol,2014,37(10):1367-1377. |
| [4] | 石少波,刘韬,秦牧,等. 激活天门冬氨酸受体对大鼠心脏电整复性和室性心律失常的影响[J]. 武汉大学学报:医学版,2013,34(4): 490-493. |
| [5] | Matsuoka N, Kodama H, Arakawa H, et al. N-Methyl-D-aspartate receptor blockade by dizocilpine prevents stress-induced sudden death in cardiomyopathic hamsters [J]. Brain Res, 2002,944(1/2):200-204. |
| [6] | Sun X, Zhong J, Wang D, et al. Increasing glutamate promotes ischemia-reperfusion-induced ventricular arrhythmias in rats in vivo[J]. Pharmacology, 2014, 93(1/2):4-9. |
| [7] | Tsai GE. Editorial: Regulating the CNS grand regulator; N-methyl-D-aspartate receptor-mediated neurotransmission [J]. Curr Pharm Des, 2014, 20(32):5115-5117. |
| [8] | 中华医学会心血管病学分会,中华心血管病杂志编辑委员会. 急性ST段抬高型心肌梗死诊断和治疗指南[J]. 中华心血管病杂志,2010,38(8): 675-690. |
| [9] | John RM, Tedrow UB, Koplan BA, et al. Ventricular arrhythmias and sudden cardiac death[J]. Lancet, 2012, 380(9852):1520-1529. |
| [10] | Benova T, Viczenczova C, Radosinska J,et al. Melatonin attenuates hypertension-related proarrhythmic myocardial maladaptation of connexin-43 and propensity of the heart to lethal arrhythmias [J]. CanJPhysiol Pharmacol, 2013, 91(8): 633-639. |
| [11] | Maass K, Chase SE, Lin X, et al. Cx43 CT domain influences infarct size and susceptibility to ventricular tachyarrhythmias in acute myocardial infarction[J]. Cardiovasc Res, 2009, 84(3):361-367. |
| [12] | Anyukhovsky EP, Sosunov EA, Kryukova YN, et al. Expression of skeletal muscle sodium channel (Nav1.4) or connexin32 prevents reperfusion arrhythmias in murine heart [J]. Cardiovasc Res, 2011, 89(1):41-50. |
| [13] | Abbate A, Bussani R, Amin MS, et al. Acute myocardial infarction and heart failure: role of apoptosis[J]. IntJBiochem Cell Biol, 2006, 38(11):1834-1840. |
| [14] | 孙利强,李晶,法宪恩. 凋亡基因程序性死亡5基因在大鼠心肌梗死后表达的变化[J]. 中华实验外科杂志,2014,31(5): 1066-1068. |
| [15] | Wang JQ, Guo ML, Jin DZ, et al. Roles of subunit phosphorylation in regulating glutamate receptor function[J]. EurJPharmacol, 2014, 728:183-187. |
| [16] | Wang Y, Denisova JV, Kang KS, et al. Neuronal gap junctions are required for NMDA receptor-mediated excitotoxicity: implications in ischemic stroke[J].JNeurophysiol, 2010, 104 (6): 3551-3556. |
| [17] | McCauley MD,Wehrens XH. Ryanodine receptor phosphory-lation, calcium/calmodulin-dependent protein kinase Ⅱ, and life-threatening ventricular arrhythmias[J]. Trends Cardiovasc Med,2011,21(2): 48-51. |
| [18] | Yamada Y, Kinoshita H, Kuwahara K, et al. Inhibition of N-type Ca2+ channels ameliorates an imbalance in cardiac autonomic nerve activity and prevents lethal arrhythmias in mice with heart failure[J]. Cardiovasc Res, 2014, 104(1):183-193. |
| [19] | Fischer TH, Herting J, Tirilomis T, et al. Ca2+/calmodulin-dependent protein kinase Ⅱ and protein kinaseAdifferentially regulate sarcoplasmic reticulum Ca2+ leak in human cardiac pathology[J]. Circulation,2013,128(9): 970-981. |
| [20] | Sun GB, Sun H, Meng XB, et al. Aconitine-induced Ca2+ overload causes arrhythmia and triggers apoptosis through p38 MAPK signaling pathway in rats[J]. Toxicol Appl Pharmacol, 2014, 279(1):8-22. |
 2015, Vol. 24
2015, Vol. 24




