2. 华中科技大学同济医学院附属同济医院创伤外科,武汉 430030
2. Department of Traumatic Surgery, Tongji Hospital, Tongji Medical College, Huazhong University of Science and Technology, Wuhan 430030, China
脓毒症是由感染引发的全身炎症反应综合征,机体免疫系统在清除病原体时过度反应,导致多器官功能障碍,是常见危重症[1]。脓毒症进展迅速,若早期未控制可发展为严重脓毒症或休克,病死率高达20%~40%[2]。脓毒症预后与早期干预时机紧密相关,因此识别早期预后不良高风险人群至关重要,但现有临床评分系统对此存在局限[3]。因此,需探索敏感且特异的生物学标志物,进行个体化治疗,改善患者预后。
血清过氧化物酶体增殖物激活受体γ辅助激活因子-1α(peroxisome proliferator-activated receptor-gamma coactivator 1-alpha, PGC-1α)是线粒体生物发生的关键调控因子,参与细胞氧化应激防御,调控线粒体合成与能量代谢[4]。血管内皮钙黏蛋白(vascular endothelial-cadherin, VE-Cad)是血管内皮细胞间连接的关键蛋白,维持内皮屏障完整、调控血管通透性及炎症细胞跨内皮迁移[5]。研究表明,VE-Cad和PGC-1α分别从维护血管屏障和调控能量代谢角度参与脓毒症进展,共同反映内皮损伤和代谢紊乱的复杂病理网络,提示联合靶向治疗前景[6]。鉴于此,本研究着重分析脓毒症患者早期PGC-1α、VE-Cad的表达情况,并基于此构建决策树模型预测其预后不良的价值。
1 资料与方法 1.1 研究对象本研究采用前瞻性队列研究设计。以2020年8月至2024年4月期间华中科技大学同济医学院附属同济医院创伤中心收治的、符合纳入排除标准的脓毒症患者作为研究对象。纳入标准:(1)符合脓毒症诊断标准[7];(2)年龄≥18岁;(3)住院时间 > 24 h;(4)患者及家属签署知情同意书。排除标准:(1)合并恶性肿瘤者;(2)严重血液系统、免疫缺陷疾病者;(3)严重肝、肾等重要脏器功能不全者;(4)近期接受化疗、免疫抑制剂治疗者;(5)长期使用激素治疗者;(6)重大手术、严重烧伤者;(7)妊娠期、哺乳期患者。
本研究通过华中科技大学同济医学院附属同济医院医学伦理委员会审批(TJIRB20200720),治疗及检测均获得患者或家属的知情同意。
1.2 资料收集收集患者年龄、性别、体质指数、高血压、糖尿病、慢性阻塞性肺病、脓毒症分级、感染部位、机械通气、急性生理与慢性健康评分Ⅱ(acute physiology and chronic health evaluation Ⅱ, APACHE Ⅱ)[8](包括年龄、急性生理学、慢性健康3个维度,总分71分,分越高预后越差)、序贯器官衰竭估计评分(sequential organ failure assessment, SOFA)[9](总分24分,分数越高病情越重)。
1.3 血清PGC-1α、VE-Cad水平及实验室指标收集入院24 h内,采集患者空腹静脉血5 mL,离心获取血清,保存于-80 ℃冰箱中待检测。采用全自动酶标仪F.A.M.E. 16/20(Hamilton Bonaduz AG,国械注进20162224218),应用酶联免疫吸附测定法检测血清PGC-1α、VE-Cad水平,试剂盒来自上海初态生物科技有限公司。记录入组患者入院首日的降钙素原(procalcitonin, PCT)、血常规、血生化、C-反应蛋白(C-reactive protein, CRP)的检验结果。
1.4 不同严重程度、预后情况判定及分组方法按照脓毒症分级标准[7]将患者分为脓毒症组及脓毒症休克组。随访所有患者入院后28 d的存活情况,根据28 d存活情况将脓毒症患者分为死亡组及存活组。
1.5 统计学方法用SPSS25.0软件处理数据,计量资料用Shapiro-Wilk检验正态性,符合正态分布以均数±标准差(x±s)表示,两组间比较用独立样本t检验,偏态分布以中位数(四分位数间距)M[(Q1, Q3)]表示,两组间比较用非参数Mann-Whitney U检验;例数(%)表示计数资料,用χ2检验比较。用Cox回归检验各因素对脓毒症患者预后不良的影响。采用决策树模型分析脓毒症患者预后不良的影响因素,参数设定:(1)以基尼系数当作分类依据,(2)父节点最小个案数为10;(3)树的最大深度是5;(4)子节点最小个案数为5。绘制受试者工作特征(receiver operator characteristic, ROC)曲线,检验模型的预测价值。以P < 0.05为差异有统计学意义。
2 结果 2.1 脓毒症患者一般情况本研究共纳入142例患者。根据病情严重程度,分为脓毒症组(84例,59.15%)与脓毒症休克组(58例,40.85%);根据28 d随访结局,分为存活组(99例,69.72%)与死亡组(43例,30.28%)。死亡组的脓毒症休克比率、机械通气比率、血尿素氮(blood urea nitrogen, BUN)、白细胞计数(white blood cell count, WBC)、PCT、APACHEⅡ评分、SOFA评分高于存活组(均P < 0.05);两组其他资料对比差异无统计学意义(P > 0.05)。见表 1。
| 变量 | 死亡组(n=43) | 存活组(n=99) | U/t/χ2值 | P值 |
| 年龄(岁)a | 62.23±8.54 | 60.52±8.14 | 1.133 | 0.259 |
| 性别(男/女,例) | 23/20 | 55/44 | 0.052 | 0.820 |
| 体质指数(kg/m2)a | 23.54±1.25 | 23.87±1.32 | 1.391 | 0.167 |
| 高血压b | 17(39.53) | 42(42.42) | 0.103 | 0.748 |
| 糖尿病b | 11(25.58) | 20(20.20) | 0.508 | 0.476 |
| 慢性阻塞性肺病b | 13(30.23) | 26(26.26) | 0.237 | 0.626 |
| 脓毒症休克b | 29(67.44) | 29(29.29) | 18.057 | < 0.001 |
| 感染部位b | 1.132 | 0.769 | ||
| 腹腔 | 10(23.26) | 26(26.26) | ||
| 泌尿系统 | 14(32.56) | 35(35.35) | ||
| 血液系统感染 | 12(27.91) | 28(28.28) | ||
| 其他 | 7(16.28) | 10(10.10) | ||
| 机械通气b | 33(76.74) | 45(45.45) | 11.856 | 0.001 |
| BUN(mmol/L)a | 9.22±1.76 | 7.78±1.49 | 4.992 | < 0.001 |
| PLT(×109/L)a | 168.32±18.66 | 172.25±18.69 | 1.152 | 0.251 |
| WBC(×109/L)a | 18.56±4.38 | 14.78±4.17 | 4.901 | < 0.001 |
| CRP(mg/L)a | 114.57±22.64 | 107.54±20.38 | 1.826 | 0.070 |
| PCT(ng/mL)a | 10.68±1.17 | 9.54±1.15 | 5.416 | < 0.001 |
| APACHEⅡ评分a(分) | 22.37±5.28 | 16.96±5.24 | 5.626 | < 0.001 |
| SOFA评分(分)c | 10.00(10.00, 12.00) | 9.00(8.00, 10.00) | 5.447 | < 0.001 |
| 注:APACHEⅡ评分为急性生理与慢性健康评分Ⅱ;SOFA评分为序贯器官衰竭评分,BUN为血尿素氮,PLT为血小板,WBC为白细胞计数,CRP为C-反应蛋白,PCT为降钙素原;a为x±s,b为(例,%),c为M(Q1,Q3) | ||||
脓毒症组PGC-1α水平高于脓毒症休克组,VE-Cad水平低于脓毒症休克组(P < 0.05)。见表 2。
| 组别 | PGC-1α | VE-Cad |
| 脓毒症组(n=84) | 2.38±0.99 | 3.44±0.53 |
| 脓毒症休克组(n=58) | 1.61±0.69 | 3.94±0.75 |
| t值 | 5.124 | 4.843 |
| P值 | < 0.001 | < 0.001 |
| 注:PGC-1α为血清过氧化物酶体增殖物激活受体γ辅助激活因子-1α,VE-Cad为血管内皮钙黏蛋白 | ||
死亡组PGC-1α水平低于存活组,VE-Cad水平高于存活组(P < 0.05)。见表 3。
| 组别 | PGC-1α | VE-Cad |
| 死亡组(n=43) | 1.44±0.51 | 4.01±0.66 |
| 存活组(n=99) | 2.41±0.97 | 3.35±0.58 |
| U/t值 | 6.204 | 5.975 |
| P值 | < 0.001 | < 0.001 |
| 注:PGC-1α为血清过氧化物酶体增殖物激活受体γ辅助激活因子-1α,VE-Cad为血管内皮钙黏蛋白 | ||
将脓毒症患者的预后情况作为因变量(“0”=存活组,“1”=死亡组),表 1、3中有差异有统计学意义的变量(分类变量:脓毒症休克:“0”=非脓毒症休克,“1”=脓毒症休克,机械通气:“0”=无,“1”=有,连续变量:PGC-1α、VE-Cad、WBC、APACHEⅡ评分、SOFA评分)为自变量。
经Cox回归分析显示,脓毒症休克以及VE-Cad、APACHEⅡ评分、SOFA评分的高表达是脓毒症患者预后不良的危险因素;PGC-1α高表达是其保护因素。见表 4。
| 指标 | B | SE | Wald | P | HR | 95%CI |
| PGC-1α | -0.912 | 0.246 | 13.789 | < 0.001 | 0.402 | 0.248~0.650 |
| VE-Cad | 1.098 | 0.315 | 12.153 | < 0.001 | 2.999 | 1.617~5.561 |
| 脓毒症休克 | 1.028 | 0.344 | 8.954 | 0.003 | 2.797 | 1.426~5.485 |
| 机械通气 | 0.102 | 0.403 | 0.064 | 0.800 | 1.108 | 0.503~2.441 |
| BUN | 0.210 | 0.095 | 4.854 | 0.078 | 1.233 | 0.723~1.486 |
| WBC | 0.050 | 0.040 | 1.541 | 0.214 | 1.051 | 0.971~1.138 |
| PCT | 0.310 | 0.131 | 5.610 | 0.088 | 1.363 | 0.855~1.761 |
| APACHEⅡ评分 | 0.079 | 0.030 | 6.706 | 0.010 | 1.082 | 1.019~1.149 |
| SOFA评分 | 0.190 | 0.096 | 3.894 | 0.048 | 1.209 | 1.001~1.459 |
| 注:PGC-1α为血清过氧化物酶体增殖物激活受体γ辅助激活因子-1α,VE-Cad为血管内皮钙黏蛋白,BUN为血尿素氮,WBC为白细胞计数,PCT为降钙素原,APACHEⅡ评分为急性生理与慢性健康评分Ⅱ,SOFA评分为序贯器官衰竭评分 | ||||||
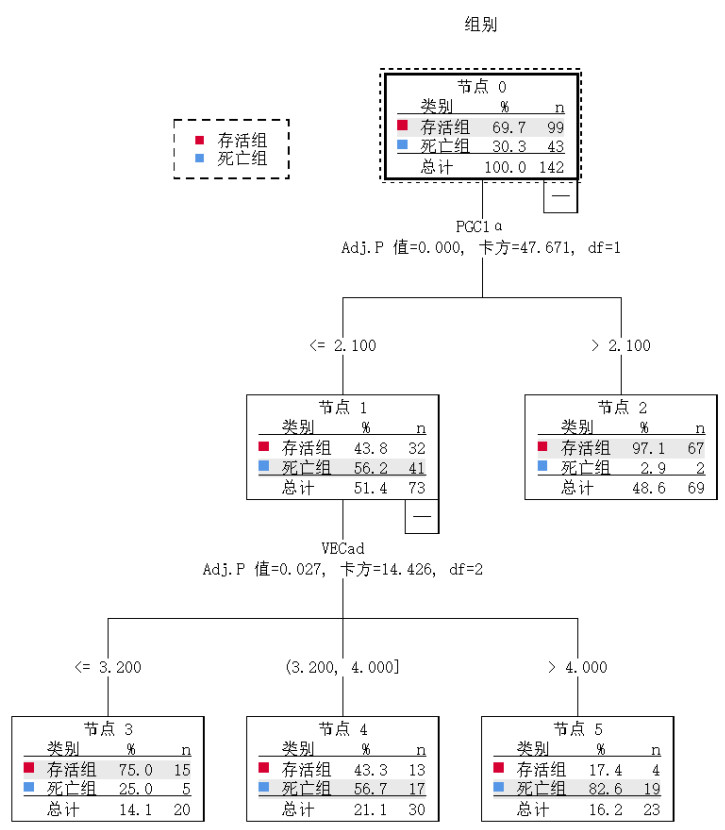
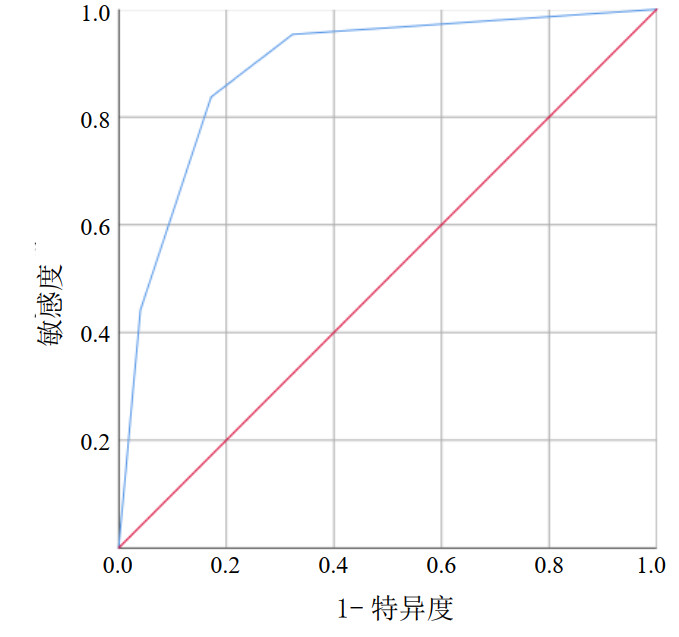
将PGC-1α、VE-Cad作为临床变量纳入,生成决策树模型(见图 1),本研究决策树共筛选出2个解释变量,即PGC-1α、VE-Cad,其中PGC-1α是最重要的根节点变量,也是最重要的预测因子。该决策树预测模型的AUC为0.890(95%CI: 0.832~0.948,P < 0.001),敏感度为83.7%,特异度为82.8%,约登指数为0.665,具有良好的应用价值。见图 2。
|
| 图 1 PGC-1α、VE-Cad影响脓毒症患者预后不良的决策树模型 Fig 1 Decision tree model for predicting poor prognosis in sepsis patients based on PGC-1α and VE-Cad |
|
|
|
| 图 2 决策树模型预测脓毒症患者预后不良情况的ROC曲线 Fig 2 ROC curve of the decision tree model for predicting poor prognosis in sepsis patients |
|
|
脓毒症病情发展迅猛,不仅会造成多器官衰竭,直接威胁生命,还可能导致长期免疫功能紊乱和慢性器官损伤,幸存者也常遗留认知功能障碍、肌肉萎缩等后遗症,显著降低生存质量并增加再入院风险[10]。本研究结果显示,142例脓毒症患者中有43例在28 d内死亡,病死率为30.28%,表明脓毒症患者的病死率较高,因此寻找脓毒症预后相关的影响因素,早期识别高危患者,进行个体化治疗,对改善患者预后有重要意义。
脓毒症预后不良与多种因素密切相关,既往脓毒症预后的评估主要依赖临床评分系统,如APACHEⅡ评分、SOFA评分,以及常规的生物标志物,然而这些指标存在一定不足和局限性,难以在疾病早期识别高危患者。由于传统指标的不足,亟需发现更具特异度和敏感度的标志物。VE-Cad特异性表达于血管内皮细胞间的黏附连接处,通过钙离子依赖性黏附维持血管屏障完整性,调控内皮通透性,防止血浆蛋白和液体外渗,同时还可以与血管内皮生长因子受体2等相互作用,调节血管稳态和炎症反应[11]。本研究结果显示,脓毒症组VE-Cad水平低于脓毒症休克组,提示脓毒症休克患者血管内皮屏障明显受损。随着脓毒症患者病情进展,在氧化应激以及炎症反应的刺激下,诱导连环蛋白和VE-Cad胞内区尾部磷酸化,细胞连接遭到破坏,增加血管通透性,导致内皮屏障受损。本研究经Cox回归分析显示,脓毒症休克以及VE-Cad、APACHEⅡ评分、SOFA评分的高表达是脓毒症患者预后不良的危险因素;PGC-1α高表达是其保护因素,并经决策树分析显示,血清PGC-1α、VE-Cad表达是脓毒症患者预后不良最重要的影响因子。
VE-Cad的高表达是内皮屏障破坏的核心环节。其大量合成会加剧内皮细胞连接解体,导致大量富含蛋白的液体渗漏至组织间隙,引发肺水肿并损害气体交换功能[5]。同时,VE-Cad高表达也预示着内皮细胞凋亡,可进一步激活凝血系统,促使微循环血栓形成与血管渗漏,最终引发组织水肿、器官灌注不足及多器官功能障碍,增加预后不良风险[12]。此外,严重血管屏障损伤会导致脓毒症患者体内液体正平衡,增加心脏负荷。与乳酸、PCT等常规指标相比,VE-Cad水平能更早期、特异地提示内皮损伤,因此对评估脓毒症患者内皮屏障完整性及预后转归具有重要意义。
PGC-1α作为线粒体生物合成与能量代谢的核心调控因子,在心、肾、骨骼肌等高耗能器官中广泛表达,参与调控能量代谢、线粒体生物合成、抗氧化防御及适应性产热等关键生理过程[13]。脓毒症引发的全身炎症反应与氧化应激会显著抑制PGC-1α表达,导致线粒体生成减少与功能障碍,使细胞无法通过氧化磷酸化有效生成三磷酸腺苷,最终造成器官能量耗竭[14]。尤为关键的是,心脏泵血、肝脏解毒及肾脏滤过功能高度依赖线粒体供能,PGC-1α缺失会直接导致心功能不全并加剧肝损伤,进而影响整体预后。此外,PGC-1α还通过抑制核转录因子-κB信号通路减少促炎因子释放;当其水平下降时,通路过度活化可引发细胞因子风暴,导致多器官损伤,显著增加死亡风险[14]。
值得深入探讨的是,PGC-1α与VE-Cad在脓毒症病理进程中并非孤立存在,而是构成了相互加剧的恶性循环。一方面,PGC-1α表达下降导致的线粒体功能障碍与能量危机,会使内皮细胞无法维持正常的屏障功能和修复能力,从而加剧了VE-Cad介导的血管渗漏[12]。另一方面,VE-Cad高表达所引发的严重血管渗漏、组织水肿及微循环障碍,会进一步恶化组织细胞的氧气和营养供应,加重氧化应激,从而更深层次地抑制PGC-1α的表达与功能[14]。这种“能量代谢紊乱-内皮屏障损伤”的协同破坏作用,共同推动了脓毒症向多器官功能障碍的发展。基于上述机制,VE-Cad与PGC-1α为脓毒症的精准治疗提供了潜在靶点。在临床上,动态监测二者水平不仅可评估内皮修复状态与线粒体功能,还可用于识别不同表型的患者,从而指导个体化治疗。例如,针对VE-Cad持续高表达的患者,可考虑采用内皮保护策略;而对于PGC-1α显著低下的患者,则可能从改善线粒体功能的治疗中获益。
本研究采用ROC曲线对决策树模型进行验证,AUC为0.890,敏感度为83.7%,特异度为82.8%,约登指数为0.665,说明该模型具有较好的预测价值。当然,本研究仍存在一定局限性,如单中心设计导致的样本量有限,且未对VE-Cad与PGC-1α在病程中的动态变化进行探索。未来需要开展多中心、大样本的前瞻性研究,并深入探索其相互调控的具体分子通路,以进一步验证本模型的临床应用价值,并为其靶向治疗提供更坚实的理论依据。
利益冲突 所有作者声明无利益冲突
作者贡献声明 张峻菠、何睿、唐勇:实验操作、论文撰写;罗家柳、顾帅鹏、陈顺尧、林智强、董黎明:数据收集及整理、统计学分析;张聪:研究设计、论文修改
| [1] | Chen PL, Ge Y, Sheng HQ, et al. The role of early changes in routine coagulation tests in predicting the occurrence and prognosis of sepsis[J]. World J Emerg Med, 2025, 16(2): 136-143. DOI:10.5847/wjem.j.1920-8642.2025.036 |
| [2] | Rababa M, Bani Hamad D, Hayajneh AA. Sepsis assessment and management in critically Ill adults: a systematic review[J]. PLoS One, 2022, 17(7): e0270711. DOI:10.1371/journal.pone.0270711 |
| [3] | Hu H, Jiang JY, Yao N. Comparison of different versions of the quick sequential organ failure assessment for predicting in-hospital mortality of sepsis patients: a retrospective observational study[J]. World J Emerg Med, 2022, 13(2): 114-119. DOI:10.5847/wjem.j.1920-8642.2022.027 |
| [4] | Liu YQ, Yang H, Luo NB, et al. An Fgr kinase inhibitor attenuates sepsis-associated encephalopathy by ameliorating mitochondrial dysfunction, oxidative stress, and neuroinflammation via the SIRT1/PGC-1α signaling pathway[J]. J Transl Med, 2023, 21(1): 486. DOI:10.1186/s12967-023-04345-7 |
| [5] | Tang JS, Kang YY, Zhou YJ, et al. TIMP2 ameliorates blood-brain barrier disruption in traumatic brain injury by inhibiting Src-dependent VE-cadherin internalization[J]. J Clin Invest, 2023, 134(3): e164199. DOI:10.1172/JCI164199 |
| [6] | Xiong SQ, Hong ZG, Huang LS, et al. IL-1β suppression of VE-cadherin transcription underlies sepsis-induced inflammatory lung injury[J]. J Clin Invest, 2023, 133(5): e169500. DOI:10.1172/JCI169500 |
| [7] | 刘辉, 童森, 姚咏明. 脓毒症亚型研究的现状与展望[J]. 中华急诊医学杂志, 2025, 34(2): 129-132. DOI:10.3760/cma.j.issn.1671-0282.2025.02.001 |
| [8] | Kahraman F, Yılmaz AS, Ersoy İ, et al. Predictive outcomes of APACHE Ⅱ and expanded SAPS Ⅱ mortality scoring systems in coronary care unit[J]. Int J Cardiol, 2023, 371: 427-431. DOI:10.1016/j.ijcard.2022.09.065 |
| [9] | Lambden S, Laterre PF, Levy MM, et al. The SOFA score-development, utility and challenges of accurate assessment in clinical trials[J]. Crit Care, 2019, 23(1): 374. DOI:10.1186/s13054-019-2663-7 |
| [10] | Srdić T, Đurašević S, Lakić I, et al. From molecular mechanisms to clinical therapy: understanding sepsis-induced multiple organ dysfunction[J]. Int J Mol Sci, 2024, 25(14): 7770. DOI:10.3390/ijms25147770 |
| [11] | Delgado-Bellido D, Oliver FJ, Vargas Padilla MV, et al. VE-cadherin in cancer-associated angiogenesis: a deceptive strategy of blood vessel formation[J]. Int J Mol Sci, 2023, 24(11): 9343. DOI:10.3390/ijms24119343 |
| [12] | Mapunda JA, Pareja J, Vladymyrov M, et al. VE-cadherin in arachnoid and Pia mater cells serves as a suitable landmark for in vivo imaging of CNS immune surveillance and inflammation[J]. Nat Commun, 2023, 14(1): 5837. DOI:10.1038/s41467-023-41580-4 |
| [13] | Abu Shelbayeh O, Arroum T, Morris S, et al. PGC-1α is a master regulator of mitochondrial lifecycle and ROS stress response[J]. Antioxidants, 2023, 12(5): 1075. DOI:10.3390/antiox12051075 |
| [14] | Peng YW, Mei SY, Qi XH, et al. PGC-1α mediates migrasome secretion accelerating macrophage-myofibroblast transition and contributing to sepsis-associated pulmonary fibrosis[J]. Exp Mol Med, 2025, 57(4): 759-774. DOI:10.1038/s12276-025-01426-z |
 2026, Vol. 35
2026, Vol. 35