2. 复旦大学附属中山医院急诊科,上海 200032
2. Department of Emergency Medicine, Zhongshan Hospital, Fudan University, Shanghai 200032, China
肺栓塞(pulmonary embolism, PE)作为急诊科的高危疾病,其早期识别面临双重挑战:一方面,其临床表现隐匿且异质性显著,未经治疗的PE患者漏诊致死率高达30%以上[1];另一方面,作为确诊PE的“金标准”,过度依赖CT肺动脉造影(CT pulmonary angiography, CTPA)造成近90%的疑似PE患者接受不必要的辐射与造影剂暴露,加剧医疗资源负担[2]。这一矛盾的本质在于如何协同保障诊断安全性与检查效率。
临床决策评分被视为破解矛盾的关键工具。现有主流评分(如WELLS评分[3]、YEARS评分[4]等)在大量的研究中被证明其具有一定的安全性和有效性,但在临床实践中仍面临两大局限:(1)标准异质性:各评分指标数量(WELLS评分7项vs. YEARS评分3项)及D-二聚体阈值(0.5 mg/L vs. 1.0 mg/L)差异导致决策一致性降低;(2)不同评分在适用人群、敏感度及特异度方面存在差异,误用可能引发漏诊或过度检查。为突破此瓶颈,4级肺栓塞临床概率评分(4-Level Pulmonary Embolism Prognostic Score, 4PEPS)[5]通过贝叶斯分析法整合既往指标,在欧美大型队列中展现出优于传统策略的影像学节约能力,但其在急诊场景中的验证证据仍严重匮乏。
基于以上背景,本研究通过单中心3 706例急诊疑似PE患者的大样本数据,旨在系统比较WELLS、YEARS及4PEPS评分的诊断效能差异(包括敏感度、特异度及阴性预测值等),量化评估各评分优化CTPA检查效能与安全性。
1 资料与方法 1.1 研究对象本研究为单中心回顾性队列研究,纳入复旦大学附属中山医院急诊科2019年1月1日至12月31日接诊的疑似PE患者。
纳入标准:(1)临床疑似PE:年龄≥18岁,急诊就诊时患者伴有不同程度的乏力、胸闷、气短、咳嗽、咳血和呼吸困难等临床症状表现。(2)数据完整性:完成CTPA检查或有≥6个月完整随访记录(电话/病历确认);(3)具备基本临床资料(症状记录、D-二聚体值、至少一项评分结果)。排除标准:(1)经影像学或实验室检查已确诊为主动脉夹层、心肌梗死、肺炎等可完全解释症状的疾病;(2)数据缺失:关键变量(症状、评分、D-二聚体)缺失或失访。
研究方案经复旦大学附属中山医院伦理委员会批准(批号:B2021-759R),严格遵循《赫尔辛基宣言》及《涉及人的生物医学研究伦理审查办法》。
1.2 数据采集与分组由两名研究者独立提取数据并计算评分:性别、年龄、临床症状(胸痛、呼吸困难、咯血、晕厥等)、生命体征(血氧饱和度、心率)、既往史(过去4周内有手术或制动史、恶性肿瘤活动期、慢性呼吸道疾病史等)、用药史(雌激素应用史)等。根据患者的一般资料及CTPA结果,将所有入组患者分为PE组及非PE组。
1.3 评分系统与诊断策略使用WELLS评分[3](附表1)、YEARS评分[4](附表2)和4PEPS评分[5](附表3)对所有受试者进行评估,根据分值将其分为不同的风险组,并进一步评估下一步是否行CTPA检查。
1.4 临床决策评分系统诊断效能通过计算每种评分的敏感度、特异度、阴性预测值(negative predictive value, NPV)和阳性预测值(positive predictive value, PPV)来评估诊断效能。采用受试者工作特征(receiver operating characteristic, ROC)曲线及曲线下面积(area under the ROC curve, AUC)分析各策略的准确性。采用Delong检验对不同临床决策规则之间的AUC进行比较。
1.5 临床决策评分系统优化CTPA检查的能力及安全性本研究以WELLS评分为参照标准,计算其他评分相较于WELLS评分的CTPA检查率(需行CTPA患者数/总研究人群×100%)减少百分比以量化CTPA检查的优化能力。安全性评估采用国际血栓与止血学会(International Society on Thrombosis and Haemostasis, ISTH)推荐公式设定假阴性率安全阈值:1.82 + (0.00528×PE患病率)[6]。假阴性率被定义为漏诊病例(临床决策评分判定“无需CTPA”患者,其初诊的诊断为PE,或在随访期间被诊断为PE)占临床决策评分判定“无需CTPA”的所有患者总数的比例,若该值低于ISTH阈值则判定策略安全。对漏诊病例通过≥6个月电话及电子病历随访排除PE相关死亡或再发事件,同时记录其临床症状、高危因素(如恶性肿瘤、术后状态)及D-二聚体水平以分析漏诊特征。PE相关死亡指在确诊后6个月的随访期内,由PE直接导致的死亡。所有死亡事件均通过查阅死亡证明、电子病历及电话随访进行核实与判定。
1.6 统计学方法本研究采用SPSS统计学软件(版本25.0;IBM Corp, Armonk, NY, USA)进行数据处理与分析。对所有纳入的连续变量进行正态性检验(Shapiro-Wilk检验)。符合正态分布的计量资料以均数±标准差(x±s)描述,组间比较采用独立样本t检验;不符合正态分布的计量资料则以中位数(四分位数)[M(Q1, Q3)]描述,组间比较采用Mann-Whitney U检验。计数资料以例数(%)描述,组间比较采用χ2检验或Fisher精确检验(当理论频数 < 5时)。所有统计分析均为双侧检验,以P < 0.05为差异具有统计学意义。
2 结果 2.1 研究人群与基线特征本研究共筛查4 729例急诊疑似PE患者,排除气胸(8例)、急性冠脉综合征(964例)及主动脉夹层(51例)后,最终纳入3 706例分析对象。其中确诊PE患者296例(8.0%),非PE患者3 410例(92.0%)。确诊PE组患者年龄为68(61, 77)岁,高于非PE组的65(60, 72)岁(P < 0.01),性别分布差异无统计学意义(男性占比41.6% vs. 47.4%,P=0.055)。临床表现方面,PE组呼吸困难(60.8% vs. 10.7%)、咯血(9.5% vs. 0.3%)及晕厥(8.4% vs. 1.8%)、近期手术/制动史(16.2% vs. 0.2%)、恶性肿瘤活动期(25.3% vs. 4.6%)及既往PE或DVT病史(9.5% vs.0.6%)比例均高于非PE组(均P < 0.01)。且PE组D-二聚体达4.28(2.04, 10.68)mg/L,高于非PE组的0.26(0.16, 0.48)mg/L(P < 0.01)。WELLS、YEARS及4PEPS评分的不同风险分级与PE患病率的整体分布差异均具有统计学意义(均P < 0.01)。见表 1。
| 指标 | 研究人群(n=3 706) | PE组(n=296) | 非PE组(n=3 410) | Ζ/χ2值 | P值 |
| 人口学特征 | |||||
| 年龄(岁)a | 65(60, 72) | 68(61, 77) | 65(60, 72) | -3.796 | < 0.001 |
| 男性b | 1 738(46.9) | 123(41.6) | 1 615(47.4) | 3.687 | 0.055 |
| 临床症状b | |||||
| 胸痛 | 3 392(91.5) | 103(34.8) | 3 289(96.5) | 1 335.036 | < 0.001 |
| 呼吸困难 | 546(14.7) | 180(60.8) | 366(10.7) | 543.701 | < 0.001 |
| 咯血 | 37(1.0) | 28(9.5) | 9(0.3) | 233.000 | < 0.001 |
| 晕厥 | 88(2.4) | 25(8.4) | 63(1.8) | 51.154 | < 0.001 |
| 既往史 | |||||
| 过去4周内有手术或制动史b | 55(1.5) | 48(16.2) | 7(0.2) | 477.541 | < 0.001 |
| 既往PE、DVT病史b | 47(1.3) | 28(9.5) | 19(0.6) | 172.383 | < 0.001 |
| 恶性肿瘤活动期b | 233(6.3) | 75(25.3) | 158(4.6) | 198.160 | < 0.001 |
| 实验室检查 | |||||
| 首次D-二聚体值(mg/L)a | 0.28(0.17, 0.60) | 4.28(2.04, 10.68) | 0.26(0.16, 0.48) | -27.066 | < 0.001 |
| 评分系统b | |||||
| WELLS评分 | 1 877.270 | < 0.001 | |||
| 低风险 | 3 505(94.6) | 118(39.9) | 3 387(99.3) | ||
| 高风险 | 201(5.4) | 178(60.1) | 23(0.7) | ||
| YEARS评分 | 2 773.430 | < 0.001 | |||
| 低风险 | 3 326(89.7) | 2(0.7) | 3324(97.5) | ||
| 高风险 | 380(10.3) | 294(99.3) | 86(2.5) | ||
| 4PEPS评分 | 1 178.199 | < 0.001 | |||
| 极低风险 | 1 051(28.4) | 0 | 1 051(30.8) | ||
| 低风险 | 2 379(64.2) | 69(23.3) | 2 310(67.7) | ||
| 中等风险 | 254(6.8) | 206(69.6) | 48(1.4) | ||
| 高风险 | 22(0.6) | 21(7.1) | 1(0.03) | ||
| 注:PE为肺栓塞,DVT为深静脉血栓形成;WELLS评分低风险为0~4分,高风险为 > 4分;YEARS评分低风险为0分,高风险为≥1分;4PEPS评分极低风险为 < 0分,低风险为0~5分,中等风险为6~12分,高风险为 > 12分;a为M(Q1,Q3),b为例数(%) | |||||
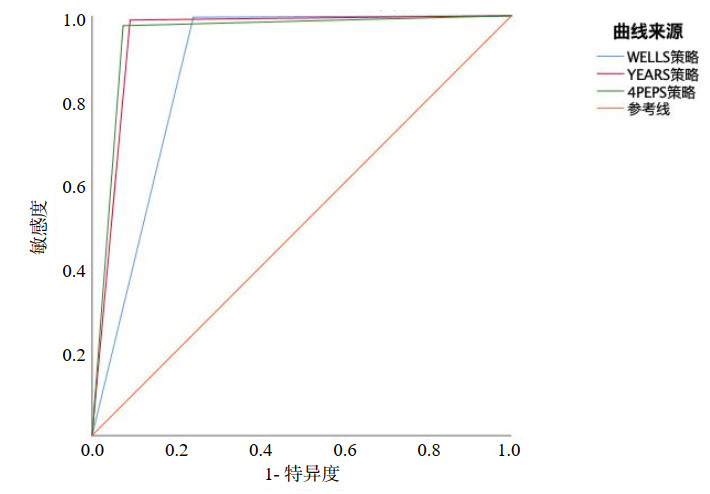
如表 2及图 1所示,WELLs评分敏感度99.7%(95%CI: 98.1%~100.0%)、特异度75.9%(95%CI: 74.4%~77.3%)、NPV为100.0%(95%CI: 99.8%~100.0%)、假阴性率0.03%(1例)、AUC值0.878。YEARS评分敏感度99%(95%CI: 97.1%~99.8%)、特异度90.9%(95%CI: 89.9%~91.9%)、NPV为99.9%(95%CI: 99.7%~100.0%)、假阴性率0.09%(3例)、AUC值0.950、CTPA检查率降低14.0%。4PEPS评分敏感度97.6%(95%CI: 95.2%~99.0%)、特异度92.6%(95%CI: 91.7%~93.5%)、NPV为99.8%(95%CI: 99.5%~99.9%)、假阴性率0.20%(7例)、AUC值0.951、CTPA检查率降低15.6%。
| 指标 | 敏感度(%, 95%CI) | 特异度(%, 95%CI) | NPV(%, 95%CI) | PPV(%, 95%CI) | 假阴性率(%) | AUC值 | 减少CTPA检查率 |
| WELLS评分 | 99.7(98.1~100.0) | 75.9(74.4~77.3) | 100.0(99.8~100.0) | 26.4(23.8~29.1) | 0.03 | 0.878 | / |
| YEARS评分 | 99.0(97.1~99.8) | 90.9(89.9~91.9) | 99.9(99.7~100.0) | 48.7(44.6~52.7) | 0.09 | 0.950 | 14.0 |
| 4PEPS评分 | 97.6(95.2~99.0) | 92.6(91.7~93.5) | 99.8(99.5~99.9) | 53.4(49.1~57.7) | 0.20 | 0.951 | 15.6 |
|
| 图 1 不同评分系统的ROC曲线 Fig 1 ROC curves of different clinical decision rules |
|
|
Delong检验显示,YEARS评分与4PEPS评分的AUC均高于WELLS评分(均P < 0.001),而YEARS评分与4PEPS评分之间的AUC差异无统计学意义(P=0.721)(表 3)。
| 比较组 | Ζ值 | P值 |
| YEARS评分vs. WELLS评分 | -18.541 | < 0.001 |
| 4PEPS评分vs. WELLS评分 | -14.148 | < 0.001 |
| 4PEPS评分vs. YEARS评分 | -0.375 | 0.721 |
本研究队列中PE的最终患病率为8%,因此通过公式可得该队列能接受的假阴性率上限为1.86%。WELLS、YEARS及4PEPS评分的假阴性率分别为0.03%、0.09%及0.20%,均低于预设的安全性上限。漏诊病例分析(表 4)显示,4PEPS漏诊患者中有2例为恶性肿瘤患者,且D-二聚体水平较高(中位数0.86 mg/L)。YEARS漏诊病例为老年恶性肿瘤患者及术后近期制动患者,D-二聚体水平接近阈值。WELLS漏诊病例为1例年轻恶性肿瘤患者,首次D-二聚体水平低于阈值。所有漏诊患者经过6个月的随访均未发生PE相关死亡事件。
| 指标 | WELLS评分 (n=1) |
YEARS评分 (n=3) |
4PEPS评分 (n=7) |
| 人口学特征 | |||
| 年龄中位数(岁) | 30 | 63 | 58 |
| 男性(例) | 0 | 2 | 3 |
| 临床症状(例) | |||
| 胸痛 | 0 | 1 | 3 |
| 呼吸困难 | 1 | 3 | 6 |
| 咯血 | 0 | 1 | 0 |
| 既往史 | |||
| 过去4周内有手术或制动史(例) | 0 | 1 | 1 |
| 恶性肿瘤活动期(例) | 1 | 1 | 2 |
| 实验室检查 | |||
| 首次D-二聚体值中位数(mg/L) | 0.27 | 0.27 | 0.86 |
| PE相关死亡(例) | 0 | 0 | 0 |
| 注:PE为肺栓塞;PE相关死亡指在确诊后6个月的随访期内,由PE直接导致的死亡。所有死亡事件均通过查阅死亡证明、电子病历及电话随访进行核实与判定 | |||
PE的早期识别与影像学检查策略的优化,是急诊医学领域面临的重要挑战之一。本研究基于单中心的回顾性数据,系统的比较了YEARS、4PEPS及WELLS评分在急诊疑似PE患者中的诊断效能与优化CTPA检查效能,以期为临床实践提供帮助。
在诊断效能方面,本研究发现YEARS评分展现出良好的排除能力,其NPV(99.9%)和敏感度(99.0%)均高于其他评分,且其假阴性率低于ISTH推荐的安全阈值,该结果与多项前瞻性多中心研究结果一致[4, 7]。其核心优势在于通过整合临床概率并采用较高的D-二聚体阈值,有效平衡了诊断安全性与检查效率。值得注意的是,本研究中被YEARS评分漏诊的3例患者均为高龄、近期制动或合并恶性肿瘤,其D-二聚体水平(中位数0.27 mg/L)均未达到该评分设定的诊断阈值。这一现象提示,在此类特定人群中,微血栓形成或局部高凝状态可能未充分激活系统性纤溶反应,D-二聚体水平相对较低,从而增加了漏诊的风险[8]。
在优化CTPA检查效能方面,4PEPS评分显示出最好的CTPA节约潜力(15.6%),略优于YEARS评分(14.0%),且其特异度(92.6%)显著高于WELLS评分(75.9%)。这表明4PEPS在识别真正低危、无需CTPA检查的患者方面具有优势[5]。4PEPS评分极低风险组中无PE患者进一步验证了这一优势,与Stals等[9]的回顾性研究结果相符。其高效性可能源于其融合了简化版PE排除标准(PERC评分)理念[10]以识别极低危患者、采用年龄调整的D-二聚体阈值[11]以提升特异度,并构建了细致的四层风险分层体系。然而,需关注的是,在本研究4PEPS漏诊的7例患者中,2例(28.6%)为活动性恶性肿瘤患者,且其D-二聚体中位数(0.86 mg/L)低于该评分用于低危患者的诊断阈值(1.0 mg/L)。这一结果提示,4PEPS对低危患者的D-二聚体阈值设定可能存在不足,对于恶性肿瘤等隐匿高凝状态人群,该阈值可能导致漏诊风险增加,未来研究需探索基于更精准风险分层的阈值优化策略。
WELLS评分在本队列中表现出良好的敏感度(99.7%),但其较低的特异度(75.9%)及PPV(26.4%)是其明显的局限,这意味着将有较多的非PE患者需接受不必要的CTPA检查。近期前瞻性真实世界研究表明,将WELLS评分中传统的固定D-二聚体阈值(0.5 mg/L)调整为年龄校正阈值[年龄(岁)×0.01 mg/L],可在维持高安全性的前提下显著减少约20%的CTPA检查[12]。本研究中发现一例WELLS评分低风险的年轻(32岁)恶性肿瘤患者,其首次D-二聚体水平仅为0.27 mg/L,最终确诊PE。再次强调了恶性肿瘤患者PE风险的复杂性,即使评分低风险且D-二聚体阴性,仍需保持高度警惕。
本研究所有漏诊患者在随访期间均未发生PE相关死亡,这可能与栓塞面积相对较小或后续及时的抗凝治疗干预有关。然而,必须警惕的是,各项评分漏诊的病例均集中于恶性肿瘤、近期手术/制动等具有固有高再发栓塞风险的人群。对这些特殊人群的漏诊可能导致治疗时机的延误。因此,本研究结果提示:对于临床评估存在活动性恶性肿瘤、近期重大手术/制动、高龄(> 80岁)等高危因素的患者,即使临床决策规则评估为低风险且D-二聚体未达相应诊断阈值,也应将其视为潜在高风险群体,并采取更为审慎的监测策略,例如,可在24~48 h内重复D-二聚体检测以观察其动态变化,并结合床旁心脏超声评估右心室功能,从而最大限度降低延迟诊断带来的风险。
本研究利用了一个大样本的急诊疑似PE队列(n=3 706),系统性比较了YEARS、4PEPS及WELLS评分的诊断效能及CTPA优化效能。首次证实了4PEPS评分在中国急诊疑似PE人群的诊断效能及优化CTPA价值,并据此提出了有针对性的建议。当然本研究也存在一定的局限性:首先这是一个单中心回顾性研究,其次纳入的病例均为急诊患者,因此研究结论是否可推广至其他中心以及门诊患者,尚待进一步开展多中心研究探讨。
综上所述,本研究提示,在急诊疑似PE患者中,YEARS评分是确保诊断安全性的最可靠工具,可有效排除PE;而4PEPS评分在减少不必要CTPA检查方面能力最优。对于合并恶性肿瘤活动期、近期制动或高龄等高危因素的患者,即使评估为低风险,仍需谨慎对待。
利益冲突 所有作者声明无利益冲突
作者贡献声明 蔡灿光:论文撰写;蔡灿光、陈东旭、俞尧、廖凤卿、周燕南:数据收集及整理、统计学分析;顾国嵘、姚晨玲:研究设计、论文修改
本文附表请登陆中华急诊网(www.cem.org.cn)浏览(Html格式全文)
| [1] | Daoud RM, Mohamed AM, Almajthoob MS, et al. Is CT pulmonary angiography overutilized in the evaluation of patients with suspected pulmonary embolism? A retrospective study[J]. Can J Respir Ther, 2025, 61: 127660. DOI:10.29390/001c.127660 |
| [2] | Aksu EA, Uzun O, Işıksungur İ, et al. Overuse of computed tomography pulmonary angiography in the diagnosis of pulmonary thromboembolism "real-life data"[J]. Int J Gen Med, 2025, 18: 1103-1109. DOI:10.2147/IJGM.S499926 |
| [3] | Wells PS, Anderson DR, Rodger M, et al. Derivation of a simple clinical model to categorize patients probability of pulmonary embolism: increasing the models utility with the SimpliRED D-dimer[J]. Thromb Haemost, 2000, 83(3): 416-420. |
| [4] | van der Hulle T, Cheung WY, Kooij S, et al. Simplified diagnostic management of suspected pulmonary embolism (the YEARS study): a prospective, multicentre, cohort study[J]. Lancet, 2017, 390(10091): 289-297. DOI:10.1016/S0140-6736(17)30885-1 |
| [5] | Roy PM, Friou E, Germeau B, et al. Derivation and validation of a 4-level clinical pretest probability score for suspected pulmonary embolism to safely decrease imaging testing[J]. JAMA Cardiol, 2021, 6(6): 669-677. DOI:10.1001/jamacardio.2021.0064 |
| [6] | Dronkers CEA, van der Hulle T, Gal GL, et al. Towards a tailored diagnostic standard for future diagnostic studies in pulmonary embolism: communication from the SSC of the ISTH[J]. J Thromb Haemost, 2017, 15(5): 1040-1043. DOI:10.1111/jth.13654 |
| [7] | Kabrhel C, Van Hylckama Vlieg A, Muzikanski A, et al. Multicenter evaluation of the YEARS criteria in emergency department patients evaluated for pulmonary embolism[J]. Acad Emerg Med, 2018, 25(9): 987-994. DOI:10.1111/acem.13417 |
| [8] | Konstantinides SV, Meyer G, Becattini C, et al. 2019 ESC Guidelines for the diagnosis and management of acute pulmonary embolism developed in collaboration with the European Respiratory Society (ERS): The Task Force for the diagnosis and management of acute pulmonary embolism of the European Society of Cardiology (ESC)[J]. Eur Respir J, 2019, 54(3). DOI:10.1183/13993003.01647-2019 |
| [9] | Stals MAM, Beenen LFM, Coppens M, et al. Performance of the 4-Level Pulmonary Embolism Clinical Probability Score (4PEPS) in the diagnostic management of pulmonary embolism: an external validation study[J]. Thromb Res, 2023, 231: 65-75. DOI:10.1016/j.thromres.2023.09.010 |
| [10] | Freund Y, Cachanado M, Aubry A, et al. Effect of the pulmonary embolism rule-out criteria on subsequent thromboembolic events among low-risk emergency department patients: the PROPER randomized clinical trial[J]. JAMA, 2018, 319(6): 559-566. DOI:10.1001/jama.2017.21904 |
| [11] | Righini M, Van Es J, Den Exter PL, et al. Age-adjusted D-dimer cutoff levels to rule out pulmonary embolism: the ADJUST-PE study[J]. JAMA, 2014, 311(11): 1117-1124. DOI:10.1001/jama.2014.2135 |
| [12] | Robert-Ebadi H, Robin P, Hugli O, et al. Impact of the age-adjusted D-dimer cutoff to exclude pulmonary embolism: a multinational prospective real-life study (the RELAX-PE study)[J]. Circulation, 2021, 143(18): 1828-1830. DOI:10.1161/CIRCULATIONAHA.120.052780 |
 2026, Vol. 35
2026, Vol. 35