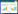2. 海军军医大学第二附属医院急诊与危重症医学科,上海 200003
2. Department of Emergency and Critical Care Medicine, The Second Affiliated Hospital of Naval Medical University, Shanghai 200003, China
心脏骤停(cardiac arrest, CA)是致命的临床急症,即使自主循环恢复(return of spontaneous circulation, ROSC),约60%~70%的患者面临心脏骤停后综合征(post-cardiac arrest syndrome, PCAS)的严重威胁[1]。肠道作为全身缺血-再灌注损伤(ischemia-reperfusion, I/R)最敏感的器官之一,被认为是复苏后多器官功能障碍的“启动因子”,缺氧所致肠黏膜损伤始于I/R诱导的上皮细胞死亡与屏障功能丧失,随后,微生物多样性下降与“肠漏”形成导致细菌及毒力因子易位,进入体循环并引发剧烈的炎症因子风暴,最终可进展为多器官功能障碍综合征(multiple organ dysfunction syndrome, MODS)[2-3]。肠道功能紊乱的患者在ICU住院期间器官衰竭评分较高[4-5],且与患者病死率呈正相关[6]。
近年的研究发现,重症疾病的发展与肠道微生物多样性的丧失和致病微生物丰度增加相关[7]。短链脂肪酸(short-chain fatty acids, SCFAs)是胃肠道内膳食纤维微生物发酵产生的产物,对消化道具有重要的保护作用,能缓解氧化应激所导致的肠道的结构和功能损伤[8],此外,肠道来源的SCFAs可直接或间接调节肠外器官(如肝、肺、生殖道、脑)的免疫,并与肠道炎症、自身免疫、过敏反应甚至肿瘤等多种疾病相关[9-10]。丁酸钠是丁酸的钠盐形式,具有稳定的抗炎与免疫调节能力,半衰期长,具有持久的全身性效应[11-13]。目前SCFAs的研究多聚焦于菌群移植对宿主的影响,实际应用中,仍存在菌群定植效率不稳定、个体间存在显著的异质性以及特异性反应不一致等情况,直接验证SCFAs作为介导因子的研究较少。
本研究旨在探讨丁酸钠对心脏骤停/心肺复苏(cardiac arrest/cardiopulmonary resuscitation, CA/CPR)后大鼠肠道稳态、神经炎症及神经行为学表现的改善作用。通过整合病理学评估、16S rDNA测序及免疫学检测技术,重点分析丁酸钠对肠道屏障功能、菌群结构、神经炎症及神经行为学预后的影响及调控机制,从微生物-肠-脑轴视角揭示其在PCAS中的病理生理学意义,为临床治疗提供新思路。
1 材料与方法 1.1 实验动物实验采用6~8周龄、体重(300±20)g的雄性SPF级SD大鼠[购自上海必凯科翼生物科技有限公司,许可证号SCXK(沪)2023-0009]。所有大鼠饲养于海军军医大学实验动物中心的标准环境中[12/12 h光暗循环,温度(23±2)℃,湿度60%],自由摄食饮水。经过1周的适应性饲养后,在建立CA/CPR模型前12 h实施禁食(不禁水)。
本研究所有动物实验操作均遵循相关伦理规范,并已通过医学伦理委员会批准(批准号:2025Q043)。
1.2 药物与仪器本研究使用的药物包括:戊巴比妥钠粉剂丁酸钠(上海士锋生物科技有限公司,中国),盐酸肾上腺素注射液(广东天丰药业有限公司,中国),戊巴比妥钠粉剂(中国医药集团上海化学试剂公司,中国),5%碳酸氢钠注射液(回音必集团江西东亚制药有限公司,中国),灭菌注射用水(大冢制药有限公司,中国),10%氯化钾注射液(大冢制药有限公司,中国),大鼠白细胞介素(interleukin, IL)-1α、IL-6、IL-10及核苷酸结合寡聚化结构域样受体蛋白3(Nucleotide-binding oligomerization domain-like receptor protein 3, NLRP3)酶联免疫吸附法(enzyme-linked immunosorbent assay, ELISA)试剂盒(上海西唐生物科技有限公司,中国),苏木精-伊红(HE)染色液(上海佐诚生物科技有限公司,中国),磁珠法粪便基因组DNA提取试剂盒(北京百泰克生物技术有限公司,中国),AMPure XT beads核酸纯化试剂盒(Beckman Coulter Genomics,美国),Illumina文库定量试剂盒(Kapa Biosciences,美国),NovaSeq 6000 SP ReagentKit(Illumina,美国)。
本研究使用的仪器包括:ALCBioMPA2000多导生物分析系统(上海奥尔科特生物科技有限公司,中国),ALC-V8D小动物呼吸机(上海奥尔科特生物科技有限公司,中国),14G带芯气管套管(南京华朵医药科技有限公司,中国),PE50聚乙烯导管(Becton-Dickinson,美国),X3智能可视内窥镜[黑蜂智造(深圳)科技有限公司,中国],LC-LCE-05常温低速离心机(上海力辰仪器科技有限公司,中国),DENLEY DRAGON Wellscan MK 3酶标仪(Thermo,美国),NanoZoomer S210数字切片扫描仪(滨松光子学株式会社,日本),TalosL 120C(120 KV)透射电镜(Thermo Fisher Scientific,美国),Qubit核酸定量仪(Invitrogen,美国),Agilent 2100生物分析仪(Agilent,美国),NovaSeq 6000测序仪(Illumina,美国)。
1.3 分组与给药SD大鼠按随机数表法随机分为假手术组、单纯心肺复苏组、丁酸钠预处理组,每组6只,所有大鼠复苏失败或在标本取材前死亡的,进行补充实验至每组6只。
假手术组行外科准备:腹腔麻醉、气管插管和动静脉置管操作。
单纯心肺复苏组行外科准备(腹腔麻醉、气管插管和动静脉置管操作)后采用窒息联合氯化钾注射的方式建立6 min CA模型,随后立即行人工心肺复苏术。
丁酸钠组建模同心肺复苏组,ROSC后,按50 mg/100 g的剂量灌胃丁酸钠无菌溶液(3 mL),每6 h一次,共给药3次。
丁酸钠粉末按50 mg/100 g(大鼠体重)称重后溶于3 mL灭菌注射用水,配置成丁酸钠无菌溶液。
1.4 CA/CPR建模大鼠称重后腹腔注射5%戊巴比妥钠(45 mg/kg)麻醉,仰卧位固定并置入14G气管插管连接呼吸机(潮气量0.65 mL/100 g、频率80次/min、FiO2 21%),同步建立生理监测系统:四肢导联监测Ⅱ导联心电图,左股动脉导管监测平均动脉压(mean arterial pressure, MAP),同侧股静脉置管用于给药。手术稳定30 min后,夹闭气管导管诱导窒息性CA,撤除呼吸机后观察自主呼吸消失,经静脉推注10%氯化钾(0.12 mL/100 g)至收缩压≤25 mmHg(1 mmHg=0.133 kPa)确认心脏停搏。停搏6 min行剑突上胸外按压(160次/min,幅度为胸廓1/3深度),同步机械通气(参数同前,按压-通气比2∶1),即刻静脉注射肾上腺素(10 μg/kg)及5%碳酸氢钠(1.5 mL)。ROSC标准为自主心律恢复且收缩压≥60 mmHg持续10 min,记录复苏时间;持续12 min未恢复者判定失败。ROSC后待自主呼吸恢复后撤机拔管,单笼饲养自由活动。本实验严格遵循Utstein模式进行参数设计与数据记录。
1.5 标本采集与检测 1.5.1 基线水平采集记录外科手术前各组大鼠体重、外科手术时间;记录外科手术后30 min后大鼠心率(heart rate, HR)及MAP;记录大鼠CA/CPR模型的制备过程中各组大鼠从开始窒息到CA时间(Tca),心肺复苏时间(Tcpr)及复苏结果;记录成功复苏大鼠在ROSC后30 min时HR(aHR)及MAP(aMAP)。
1.5.2 神经行为学评估复苏成功且存活24 h大鼠采用LONGA评分[14]进行神经行为学评估,将大鼠置于开阔区域,观察其运动和行为,并根据观察结果记录相应分数。
1.5.3 脑组织取样及细胞炎症因子检测方法采用过量麻醉法处死实验大鼠,行无菌开颅术取全脑组织,冰上剥离脑膜及血管,称重后加入预冷PBS(含1%蛋白酶抑制剂)制备脑匀浆液,4℃条件下15 000 g离心30 min取上清液,分装冻存于-80℃直至检测。参照双抗体夹心法ELISA试剂盒说明书(按标准流程进行检测:依次加样、洗板、孵育一抗及酶标抗体、显色终止,使用DENLEYDRAGON Wellscan MK 3酶标仪于显色终止后30 min内测定450 nm波长吸光度值,通过标准曲线定量计算各因子浓度)测定脑组织匀浆液中炎症因子(IL-1α、IL-6、IL-10)及NLRP3浓度。
1.5.4 脑组织病理学观察剥离脑组织周围的肌肉和结缔组织,用弯头眼科镊结合眼科剪剪断视神经等结缔组织,轻拨出整个脑组织;生理盐水冲洗后将新鲜脑组织浸入4%多聚甲醛固定24 h,经梯度乙醇脱水(80%~100%)、二甲苯透明、石蜡包埋后制备4 μm厚切片,行HE染色标准化流程(烤片60℃×60 min,二甲苯脱蜡15 min×3,梯度乙醇水化,苏木素染色5 min,盐酸酒精分化5 s,伊红复染1 min,乙醇脱水,二甲苯透明,中性树胶封片),染色切片经NanoZoomer S210全自动数字扫描后由双盲病理医师进行海马CA1区形态学观察。
1.5.5 回肠上皮组织形态学观察行无菌腹腔解剖,于回盲部近2 cm处截2 cm回肠组织,生理盐水冲洗后分两部分处理:(1)将新鲜回肠样本浸入4%多聚甲醛固定24 h,经梯度乙醇脱水(80%~100%)、二甲苯透明、石蜡包埋后制备4 μm厚切片,行HE染色标准化流程(烤片60℃×60 min,二甲苯脱蜡15 min×3,梯度乙醇水化,苏木素染色5 min,盐酸酒精分化5 s,伊红复染1 min,乙醇脱水,二甲苯透明,中性树胶封片),染色切片经NanoZoomer S210全自动数字扫描后由双盲病理医师进行肠黏膜损伤评价。(2)取新鲜回肠组织修剪为1 mm3样本块,经2.5%戊二醛(磷酸缓冲液pH 7.4配制)固定2 h后,采用0.1 M磷酸缓冲液漂洗3次(15 min/次),随后以1%锇酸二次固定2 h并重复漂洗;梯度丙酮脱水(100%丙酮室温处理15 min×3)后,依次进行丙酮-包埋液(1∶2比例)浸透(室温过夜)及37℃烘箱固化(24 h)。采用超薄切片机制备70 nm厚度切片,经3%醋酸铀-枸橼酸铅双染色后,使用Thermo Fisher Talos L120C透射电镜(加速电压120 kV)观察肠上皮细胞间紧密连接复合体超微结构。
1.5.6 回肠粪便取材及检测无菌截取回盲部近端2 cm回肠段,纵向剖开刮取黏膜表面粪便样本(约200 mg),液氮速冻后-80℃保存。通过扩增16S rDNA基因V3-V4区分析细菌分类群。采用磁珠法提取粪便微生物总DNA,使用V3-V4区通用引物(341F/805R)进行PCR扩增,产物经磁珠纯化后定量。构建文库后经Illumina NovaSeq 6000平台进行双端测序。原始数据经bcl2fastq转换后,依次进行数据拆分,采用DADA2算法去噪生成ASV特征表,基于ASV进行α多样性和β多样性分析。使用SILVA 138.1和NT-16S数据库进行物种分类统计。
1.6 统计学方法本研究数据分析使用SPSS 26.0完成,图形通过Origin 2021和R语言(4.1.3)导出。符合正态分布的计量资料以均值±标准差(x±s)呈现,多组间差异分析采用单因素方差分析(ANOVA);两组间差异分析采用独立样本t检验,方差齐性采用LSD法,非齐性采用Games-Howell校正。16S rDNA数据分析基于QIIME2平台:α多样性(Shannon、Chao1指数)及β多样性(Weighted UniFrac距离)组间比较使用Wilcoxon秩和检验,物种组成通过分类阶元相对丰度评估。以P < 0.05为差异有统计学意义。
2 结果 2.1 各组大鼠基线水平比较如表 1所示,本研究共纳入SD大鼠37只(含补充实验样本),各组大鼠基线指标:体重、外科手术时间,外科手术完成后30 min HR及MAP比较,差异无统计学意义(均P > 0.05)。
| 组别 | 体重 (g) |
HR (次/min) |
MAP (mmHg) |
手术时间 (min) |
| 假手术组 | 307.50±8.22 | 427.67±26.63 | 150.06±13.21 | 44.13±5.88 |
| 单纯心肺复苏组 | 307.33±13.21 | 449.13±36.53 | 154.51±14.93 | 43.21±8.39 |
| 丁酸钠组 | 305.00±7.96 | 463.94±37.37 | 156.63±14.91 | 41.33±7.86 |
| F值 | 0.235 | 2.345 | 0.483 | 0.370 |
| P值 | 0.792 | 0.111 | 0.649 | 0.693 |
| 注:HR为心率,MAP为平均动脉压 | ||||
补充实验后,单纯心肺复苏组共计15只大鼠,成功复苏6只;丁酸钠组共计16只大鼠,成功复苏6只。复苏成功大鼠中,丁酸钠组大鼠复苏后24 h LONGA评分明显降低(0.33±0.52 vs. 2.00±0.00, P=0.002)。两组大鼠Tca、Tcpr、ROSC后30 min aHR及aMAP均差异统计学意义(均P > 0.05)。见表 2。
| 组别 | Tca (s) |
Tcpr (min) |
aMAP (mmHg) |
aHR (次/min) |
LONGA 评分 |
| 单纯心肺复苏组 | 67.83±3.31 | 6.70±2.14 | 108.67±17.20 | 317.33±43.92 | 2.00±0.00 |
| 丁酸钠组 | 67.50±8.19 | 7.96±2.22 | 103.16±14.17 | 354.50±65.06 | 0.33±0.52 |
| t值 | 0.090 | -0.786 | 0.604 | -1.160 | 7.906 |
| P值 | 0.928 | 0.450 | 0.559 | 0.273 | 0.001 |
| 注:Tca为大鼠从开始窒息到CA时间,Tcpr为心肺复苏时间,aHR、aMAP分别为大鼠ROSC后30 min时心率及平均动脉压 | |||||
与单纯心肺复苏组相比,丁酸钠组大鼠心肺复苏后24 h脑组织IL-1α [(32.10±13.32) pg/mL vs. (64.84±17.28) pg/ml, P=0.011]及NLRP3炎症小体[(0.79±0.05) ng/mL vs. (1.51±0.43) ng/mL, P=0.021]水平降低;两组大鼠脑组织IL-1α及IL-6水平差异无统计学意义。见3。
| 组别 | IL-1α (pg/mL) |
IL-6 (pg/mL) |
IL-10 (pg/mL) |
NLRP3 (ng/mL) |
| 单纯心肺复苏组 | 64.84±17.28 | 443.38±175.31 | 76.40±24.76 | 1.51±0.43 |
| 丁酸钠组 | 32.10 ±13.32 | 389.03±65.12 | 65.82±11.75 | 0.79±0.05 |
| t值 | 3.356 | 0.703 | 0.871 | 3.620 |
| P值 | 0.010 | 0.506 | 0.406 | 0.021 |
| 注:IL为白细胞介素,NLRP3为核苷酸结合寡聚化结构域样受体蛋白3 | ||||
光镜下各组大鼠回肠上皮结构如图 1所示,图 1A为假手术组光镜下回肠组织结构。单纯心肺复苏组大鼠小肠组织肠黏膜显示黏膜结构严重紊乱,上皮细胞大面积剥离,固有层暴露伴显著水肿和炎性细胞浸润,可见绒毛缩短、倒伏甚至脱落并出现Gruenhagen间隙(箭头所示)(图 1B);丁酸钠组大鼠回肠绒毛高度部分恢复,排列较整齐,上皮连续性基本保留,仅局部轻微脱落,固有层水肿和炎症浸润减轻(图 1C)。电镜下,单纯心肺复苏组大鼠回肠上皮细胞间紧密连接出现间隙增宽(图 1E箭头所示),丁酸盐组则没有观察到此类现象(图 1F)。
|
| 注:图A~C分别为光镜下假手术组、单纯心肺复苏组及丁酸钠组回肠上皮组织情况(×200);图D~F分别为电镜下假手术组、单纯心肺复苏组及丁酸钠组回肠上皮组织情况(×50 000) 图 1 各组大鼠回肠上皮病理学评估 Fig 1 Pathological evaluation of ileal epithelium of rats in each group |
|
|
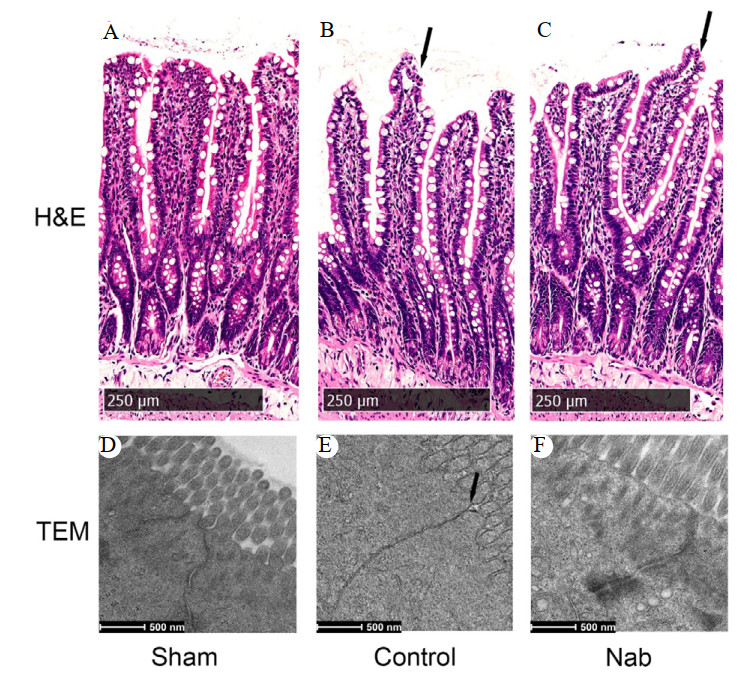
光镜下各组大鼠海马CA1区形态学如图 2所示,图 2A为假手术组光镜下海马CA1区形态结构,锥体细胞层结构完整,神经元形态正常,多呈圆形或椭圆形,边界清晰。单纯心肺复苏组大鼠海马CA1区锥体细胞层结构遭到严重破坏,细胞大量丢失,排列极度稀疏紊乱,神经元细胞核出现核碎裂和核溶解等坏死的标志性改变,视野中可见大量“鬼影”细胞(图 2B);丁酸钠组大鼠ROSC后24 h海马CA1区锥体细胞层结构轻微松散,细胞排列出现少量紊乱,极性部分消失,神经元坏死细胞数量较单纯心肺复苏组减少(图 2C)。
|
| 注:图A~C分别为光镜下假手术组、单纯心肺复苏组及丁酸钠组海马CA1区组织情况(×600) 图 2 各组大鼠脑组织CA1区形态学观察 Fig 2 Morphological observation of the CA1 region of rats from each group |
|
|
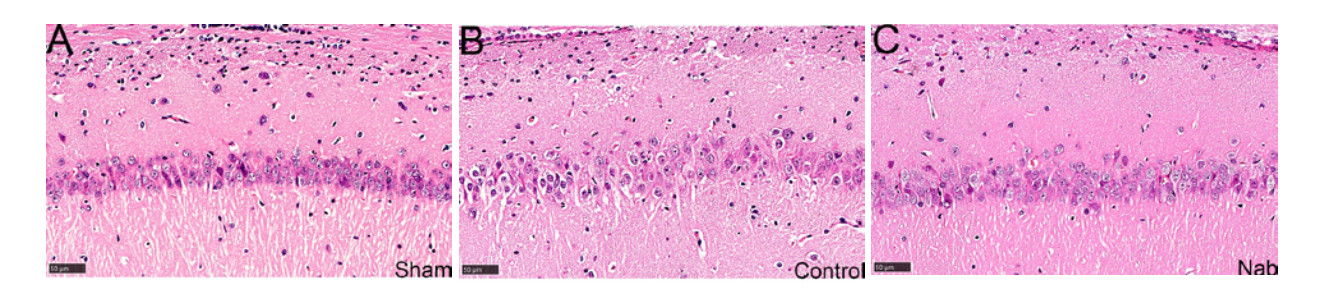
本研究通过16S rDNA扩增子测序分析假手术组、单纯心肺复苏组和丁酸钠组大鼠回肠菌群特征(n=6/组)。图 3A结果显示:三组共有核心操作分类单元(operational taxonomic units, OUTs)仅126个(占4.4%),表明心肺复苏后回肠菌群呈现显著异质性。对照组独有OUTs较假手术组显著减少(204 vs. 512),提示心肺复苏改变肠道菌群。丁酸钠组独有ASV数目较其余两组明显增多,提示丁酸钠对复苏后回肠菌群具有显著影响。Alpha多样性分析显示(图 3B、C),与假手术组相比,复苏后单纯心肺复苏组大鼠回肠Chao1指数升高,而Shannon指数显著降低(均P < 0.05),提示复苏后大鼠回肠微生物群落丰度升高,但多样性降低,丁酸钠处理能改善复苏后大鼠多样性降低(P < 0.05),符合本实验预期。基于Weighted_Unifrac距离的PCoA分析显示三组菌群存在空间分离,PERMANOVA分析结果提示R2=0.4518,P < 0.05(PCoA1解释度49%,PCoA2解释度30%,图 3D),提示心肺复苏是菌群差异的主要因素,丁酸钠处理为次要因素。门水平Top 20菌种分析显示单纯心肺复苏组以厚壁菌门(Firmicutes)丰度显著降低,属水平Top 20菌种分析显示单纯心肺复苏组致病性大肠杆菌-志贺氏菌属(Escherichia-Shigella)丰度显著升高,而丁酸钠显著降低致病性大肠杆菌-志贺氏菌属(Escherichia-Shigella)相对丰度,并提升产SCFAs的罗姆布茨菌(Romboutsia)、颤螺菌属(Oscillibacter)、毛螺菌(Lachnospiraceae)的相对丰度(图 3E、F)。
|
| 注:A为三组大鼠OUTs韦恩图;B为Alpha多样性分析——chao1指数小提琴图;C为Alpha多样性分析——Shannon指数小提琴图;D为Beta多样性分析——基于Weighted_Unifrac距离的PCoA分析图;E为门水平微生物组成的相对丰度柱状堆叠图;F为属水平微生物组成的相对丰度柱状堆叠图;Sham为对照组,Control为单纯心肺复苏组,Nab为丁酸钠组 图 3 各组大鼠回肠菌群分析 Fig 3 Analysis of ileal microbiota of rats from each group |
|
|
维持生命健康的一个重要环节是肠道共生微生物及致病微生物的动态平衡,肠道作为全身I/R损伤最敏感的靶器官之一,历经心肺复苏的致命打击后可触发全身炎症反应及多器官衰竭,此外,肠道I/R损伤会导致肠道菌群结构紊乱、致病菌相对丰度增加及菌群移位,进一步加剧全身脏器损伤[5, 15-16]。有研究认为SCFAs作为微生物-肠-脑轴通讯的关键信使,可能对PCAS具有潜在的治疗作用[13, 17],动物实验层面,产SCFAs菌群粪便移植可以有效减少脑缺血区域体积和相关的脑水肿及神经和行为学结果[18];向肠道微生物群受到破坏并小鼠补充SCFAs会增加肠道T细胞向大脑的运输,并增加大脑中Treg细胞的数量,Treg细胞分泌IL-10抑制了IL-17的γ δT细胞[19],恢复小胶质细胞稳态[20],但动物实验条件下菌群定植效率、动物异质性及特异性应答反应各不相同,故直接将SCFAs作为介导因子具有实际的临床意义。
本研究通过窒息联合静脉注射氯化钾构建CA/CPR大鼠模型,构建了一个高度可重复的稳定心肺复苏动物模型,与其他建模方法相比,该方法可导致显著的脑损伤,利于复苏后神经功能研究[21]。研究结果显示:经历CA/CPR后大鼠回肠微生物多样性下降,厚壁菌门相对丰度降低,大肠杆菌-志贺菌属丰度显著上升,这与经历过脑缺血性损伤患者临床观察研究具有相似性[22];丁酸钠干预后,大鼠回肠微生物多样性得到明显改善,并能降低大肠杆菌-志贺菌属相对丰度,富集产SCFAs菌属(罗姆布茨菌、颤螺菌属、毛螺菌)相对丰度,有研究认为产SCFAs菌群能够维持机体免疫稳态[23],并能预防致病因素导致的肠道紊乱和帮助受损肠道功能恢复稳态[24-25]。在肠道屏障方面,光镜和电镜下回肠组织病理学评价结果一致,丁酸钠干预可以改善心肺复苏所致的回肠上皮损伤,保护回肠上皮紧密连接复合体的完整性,有研究表明丁酸钠通过调节紧密连接蛋白的表达来增强肠道屏障功能,这种作用可能是由AMP活化蛋白激酶[26]的激活或紧密连接蛋白2(阳离子选择性孔)[27]的表达下调介导的。丁酸钠作为常见的畜禽饲料添加剂,当剂量为450~1 000 mg/kg时,可缓解I/R相关的肠道损伤并调节畜禽肠道菌群[8, 28],在炎症性肠病动物模型中表现出诱导调节性T细胞产生,维持免疫平衡,减少过度炎症反应并调节肠道免微环境、保护肠道屏障的巨大潜力[26, 29-31];另外,产SCFAs菌属通过发酵作用,降低了肠道pH值,并通过竞争营养和定植位点抑制致病菌(如大肠杆菌、致病性梭杆菌)的繁殖,起到维持肠道稳态的重要作用[24-25, 32]。在神经行为学及组织病理学层面,本实验观察到丁酸钠干预后大鼠海马CA1区神经元坏死细胞数量减少且神经行为学评分得到改善[14]。在机制探索层面,大鼠复苏24 h后脑组织IL-1α及NLRP3水平降低(均P < 0.05)。NLRP3炎症小体是一种重要的细胞内多蛋白复合物,是先天免疫系统中的重要传感器,不仅可以识别外源性病原体的入侵,还可以感知内源性细胞损伤,可诱导细胞焦亡和促炎细胞因子释放,导致进一步的神经元损伤和功能损伤,不仅诱导局部炎症反应,还可能通过血流影响其他器官,进一步加剧全身性炎症[33-34]。有研究认为IL-1α与院外CA患者全因病死率显著相关[35],选用NLRP3炎症小体抑制剂来减少NLRP3炎症小体导致的小胶质细胞的活化能够减轻神经炎症反应并提高复苏率[36-37],本实验结果与上述相关研究具有相似性。
然而,本研究仍存在以下局限,需在未来工作中重点突破:(1)研究所用窒息联合氯化钾诱导的CA模型虽重复性好,但与临床常见的室颤所致CA在病理生理上存在差异,且丁酸钠的给药剂量、时机及长期安全性暂无统一定论,需在更接近临床的大动物模型(如猪)或人源化模型中进行剂量效应与时效关系的系统性评价。(2)尽管发现丁酸钠可降低脑组织中IL-1α/NLRP3水平,但缺乏对该通路的直接调控证据(如通过抑制剂干预或基因敲除手段验证因果关联),仍需结合免疫组化、原位探针等多技术进一步阐明。(3)可借助宏基因组/代谢组学联用技术,及细胞示踪技术进一步验证是否由菌群代谢产物(如丁酸本身)或免疫细胞(如肠源性巨噬细胞)的跨器官迁移作为“肠-脑”桥梁。
本研究基于“微生物—肠—脑轴”理论,发现丁酸钠能改善CA/CPR后大鼠的肠道菌群结构(提升产SCFAs菌属丰度、抑制大肠杆菌-志贺菌属丰度),保护肠道屏障完整性,并可能通过抑制脑内IL-1α/NLRP3炎症小体轴,减轻神经炎症,最终改善神经行为学预后。这些结果从肠脑交互视角揭示了丁酸钠在PCAS中的多器官保护作用,为靶向肠道微环境以干预脑损伤的治疗策略提供了新的思路。
利益冲突 所有作者声明无利益冲突
作者贡献声明 张浩峻:实验操作、论文撰写;张浩峻、朱雨锋、徐天鹏:数据收集及整理、统计学分析;陈羲、石容怡:技术或材料支持、论文修改;单怡、张浩峻:研究设计、论文修改;单怡:研究指导、提供研究经费
| [1] | Perkins GD, Callaway CW, Haywood K, et al. Brain injury after cardiac arrest[J]. Lancet, 2021, 398(10307): 1269-1278. DOI:10.1016/S0140-6736(21)00953-3 |
| [2] | Borges A, Bento L. Organ crosstalk and dysfunction in sepsis[J]. Ann Intensive Care, 2024, 14(1): 147. DOI:10.1186/s13613-024-01377-0 |
| [3] | Soranno DE, Coopersmith CM, Brinkworth JF, et al. A review of gut failure as a cause and consequence of critical illness[J]. Crit Care, 2025, 29(1): 91. DOI:10.1186/s13054-025-05309-7 |
| [4] | Qian J, Yang ZF, Cahoon J, et al. Post-resuscitation intestinal microcirculation: its relationship with sublingual microcirculation and the severity of post-resuscitation syndrome[J]. Resuscitation, 2014, 85(6): 833-839. DOI:10.1016/j.resuscitation.2014.02.019 |
| [5] | Grimaldi D, Legriel S, Pichon N, et al. Ischemic injury of the upper gastrointestinal tract after out-of-hospital cardiac arrest: a prospective, multicenter study[J]. Crit Care, 2022, 26(1): 59. DOI:10.1186/s13054-022-03939-9 |
| [6] | Yao Z, Zhao YR, Lu LP, et al. Extracerebral multiple organ dysfunction and interactions with brain injury after cardiac arrest[J]. Resusc Plus, 2024, 19: 100719. DOI:10.1016/j.resplu.2024.100719 |
| [7] | Wozniak H, Beckmann TS, Fröhlich L, et al. The central and biodynamic role of gut microbiota in critically ill patients[J]. Crit Care, 2022, 26(1): 250. DOI:10.1186/s13054-022-04127-5 |
| [8] | Sarker MT, Wang SL, Wang S, et al. Sodium butyrate alleviates high ambient temperature-induced oxidative stress, intestinal structural disruption, and barrier integrity for growth and production in growing layer chickens[J]. BMC Vet Res, 2025, 21(1): 131. DOI:10.1186/s12917-025-04583-5 |
| [9] | Mann ER, Lam YK, Uhlig HH. Short-chain fatty acids: linking diet, the microbiome and immunity[J]. Nat Rev Immunol, 2024, 24(8): 577-595. DOI:10.1038/s41577-024-01014-8 |
| [10] | Juul FE, Garborg K, Bretthauer M, et al. Fecal microbiota transplantation for primary Clostridium difficile infection[J]. N Engl J Med, 2018, 378(26): 2535-2536. DOI:10.1056/NEJMc1803103 |
| [11] | Martin-Gallausiaux C, Marinelli L, Blottière HM, et al. SCFA: mechanisms and functional importance in the gut[J]. Proc Nutr Soc, 2021, 80(1): 37-49. DOI:10.1017/S0029665120006916 |
| [12] | Corrêa-Oliveira R, Fachi JL, Vieira A, et al. Regulation of immune cell function by short-chain fatty acids[J]. Clin Transl Immunology, 2016, 5(4): e73. DOI:10.1038/cti.2016.17 |
| [13] | Silva YP, Bernardi A, Frozza RL. The role of short-chain fatty acids from gut microbiota in gut-brain communication[J]. Front Endocrinol, 2020, 11: 25. DOI:10.3389/fendo.2020.00025 |
| [14] | Longa EZ, Weinstein PR, Carlson S, et al. Reversible middle cerebral artery occlusion without craniectomy in rats[J]. Stroke, 1989, 20(1): 84-91. DOI:10.1161/01.str.20.1.84 |
| [15] | Hoftun Farbu B, Langeland H, Ueland T, et al. Intestinal injury in cardiac arrest is associated with multiple organ dysfunction: a prospective cohort study[J]. Resuscitation, 2023, 185: 109748. DOI:10.1016/j.resuscitation.2023.109748 |
| [16] | Piton G, Belin N, Barrot L, et al. Enterocyte damage: a piece in the puzzle of post-cardiac arrest syndrome[J]. Shock, 2015, 44(5): 438-444. DOI:10.1097/SHK.0000000000000440 |
| [17] | Sadler R, Cramer JV, Heindl S, et al. Short-chain fatty acids improve poststroke recovery via immunological mechanisms[J]. J Neurosci, 2020, 40(5): 1162-1173. DOI:10.1523/JNEUROSCI.1359-19.2019 |
| [18] | Pasokh A, Farzipour M, Mahmoudi J, et al. The effect of fecal microbiota transplantation on stroke outcomes: a systematic review[J]. J Stroke Cerebrovasc Dis, 2022, 31(11): 106727. DOI:10.1016/j.jstrokecerebrovasdis.2022.106727 |
| [19] | Benakis C, Liesz A. The gut-brain axis in ischemic stroke: its relevance in pathology and as a therapeutic target[J]. Neurol Res Pract, 2022, 4(1): 57. DOI:10.1186/s42466-022-00222-8 |
| [20] | Celorrio M, Shumilov K, Ni A, et al. Short-chain fatty acids are a key mediator of gut microbial regulation of T cell trafficking and differentiation after traumatic brain injury[J]. Exp Neurol, 2025, 392: 115349. DOI:10.1016/j.expneurol.2025.115349 |
| [21] | 杨小庆, 张思森. 大鼠心搏骤停-心肺复苏模型研究进展[J]. 中华危重病急救医学, 2024, 36(9): 1001-1004. DOI:10.3760/cma.j.cn121430-20240304-00188 |
| [22] | Ling Y, Gong TY, Zhang JM, et al. Gut microbiome signatures are biomarkers for cognitive impairment in patients with ischemic stroke[J]. Front Aging Neurosci, 2020, 12: 511562. DOI:10.3389/fnagi.2020.511562 |
| [23] | Rivière A, Gagnon M, Weckx S, et al. Mutual Cross-Feeding Interactions between Bifidobacterium longum subsp. longum NCC2705 and Eubacterium rectale ATCC 33656 Explain the Bifidogenic and Butyrogenic Effects of Arabinoxylan Oligosaccharides[J]. Appl Environ Microbiol, 2015, 81(22): 7767-7781. DOI:10.1128/AEM.02089-15 |
| [24] | Velasquez-Manoff M. Gut microbiome: the peacekeepers[J]. Nature, 2015, 518(7540): S3-S11. DOI:10.1038/518S3a |
| [25] | Rivière A, Selak M, Lantin D, et al. Bifidobacteria and butyrate-producing colon bacteria: importance and strategies for their stimulation in the human gut[J]. Front Microbiol, 2016, 7: 979. DOI:10.3389/fmicb.2016.00979 |
| [26] | Peng LY, Li ZR, Green RS, et al. Butyrate enhances the intestinal barrier by facilitating tight junction assembly via activation of AMP-activated protein kinase in Caco-2 cell monolayers[J]. J Nutr, 2009, 139(9): 1619-1625. DOI:10.3945/jn.109.104638 |
| [27] | Daly K, Shirazi-Beechey SP. Microarray analysis of butyrate regulated genes in colonic epithelial cells[J]. DNA Cell Biol, 2006, 25(1): 49-62. DOI:10.1089/dna.2006.25.49 |
| [28] | Lin FH, Li X, Wen JS, et al. Effects of coated sodium butyrate on performance, diarrhea, intestinal microflora and barrier function of pigs during the first 2-week post-weaning[J]. Anim Feed Sci Technol, 2020, 263: 114464. DOI:10.1016/j.anifeedsci.2020.114464 |
| [29] | Recharla N, Geesala R, Shi XZ. Gut microbial metabolite butyrate and its therapeutic role in inflammatory bowel disease: a literature review[J]. Nutrients, 2023, 15(10): 2275. DOI:10.3390/nu15102275 |
| [30] | Liang LP, Liu L, Zhou WY, et al. Gut microbiota-derived butyrate regulates gut mucus barrier repair by activating the macrophage/WNT/ERK signaling pathway[J]. Clin Sci, 2022, 136(4): 291-307. DOI:10.1042/CS20210778 |
| [31] | Arpaia N, Campbell C, Fan XY, et al. Metabolites produced by commensal bacteria promote peripheral regulatory T-cell generation[J]. Nature, 2013, 504(7480): 451-455. DOI:10.1038/nature12726 |
| [32] | 张浩峻, 敬梅, 朱雨锋, 等. 微生物-肠-脑通讯对心脏骤停后脑损伤神经炎症的影响[J]. 实用医学杂志, 2025, 41(6): 911-915. DOI:10.3969/j.issn.1006-5725.2025.06.021 |
| [33] | Xu W, Huang Y, Zhou RB. NLRP3 inflammasome in neuroinflammation and central nervous system diseases[J]. Cell Mol Immunol, 2025, 22(4): 341-355. DOI:10.1038/s41423-025-01275-w |
| [34] | Fu JN, Wu H. Structural mechanisms of NLRP3 inflammasome assembly and activation[J]. Annu Rev Immunol, 2023, 41: 301-316. DOI:10.1146/annurev-immunol-081022-021207 |
| [35] | Zelniker TA, Kaya Z, Gamerdinger E, et al. Relationship between markers of inflammation and hemodynamic stress and death in patients with out-of-hospital cardiac arrest[J]. Sci Rep, 2021, 11(1): 9954. DOI:10.1038/s41598-021-88474-3 |
| [36] | Wang ML, Pan W, Xu Y, et al. Microglia-mediated neuroinflammation: a potential target for the treatment of cardiovascular diseases[J]. J Inflamm Res, 2022, 15: 3083-3094. DOI:10.2147/JIR.S350109 |
| [37] | Zheng GH, He FL, Xu J, et al. The selective NLRP3-inflammasome inhibitor MCC950 mitigates post-resuscitation myocardial dysfunction and improves survival in a rat model of cardiac arrest and resuscitation[J]. Cardiovasc Drugs Ther, 2023, 37(3): 423-433. DOI:10.1007/s10557-021-07282-z |
 2026, Vol. 35
2026, Vol. 35