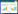2. 宁夏医科大学总医院重症医学科,银川 750004;
3. 定边县中医院放射科,定边 718600
2. Department of Critical Care Medicine, General Hospital of Ningxia Medical University, Yinchuan 750004, China;
3. Department of Radiology, Dingbian Hospital of Traditional Chinese Medicine, Dingbian 718600, China
急性呼吸窘迫综合征(acute respiratory distress syndrome, ARDS)在临床表现和生物学特征方面均表现出显著的异质性[1]。通过表型分类可以实现更精确的ARDS临床干预与治疗方案制定。基于生理指标、临床表现、影像学特征以及生物学标志物等多维度数据,已建立了多种ARDS的分型方法[2-3]。通过对ARDS大规模临床试验数据的回顾性二次分析成功识别出高炎症与低炎症两种亚型。研究显示,这两种亚型患者对辛伐他汀治疗、呼气末正压通气以及液体管理策略均表现出显著的疗效差异[4-7]。ARDS患者的液体管理需要在保障充分氧供与防止肺水肿恶化之间取得平衡[8]。尽管多项研究支持维持负平衡的液体管理方案,但由于ARDS患者常伴发血流动力学不稳定及循环功能障碍,限制性液体管理策略仍面临诸多临床挑战[9-10]。
肺水肿放射学评分(radiographic assessment of lung edema, RALE)作为一种半定量化指标,能够有效衡量肺水肿的严重程度[11]。研究表明,该评分与ARDS患者的病情进展、肺部损伤程度及临床预后具有显著相关性[12-13]。鉴于当前ARDS亚表型分类体系中缺少可在床旁快速评估的临床参数及肺水肿相关指标,本研究通过整合临床实践中易于获取的临床指标及RALE评分结果,采用潜在类别分析法对ARDS进行亚表型划分。通过对比不同亚型的临床特征,并分析各亚型患者在不同时间节点的累积液体平衡状态与其28 d预后的关联性,为ARDS患者的个体化液体治疗方案提供科学依据。
1 资料与方法 1.1 研究对象本研究为回顾性队列研究,收集2020年8月至2025年2月期间宁夏医科大学总医院重症医学科确诊ARDS患者的临床数据。纳入标准:(1)年龄≥18周岁;(2)符合2012年柏林定义ARDS诊断标准[14];(3)临床资料完整。排除标准:(1)入住ICU时间 < 48 h;(2)严重免疫缺陷及严重传染病患者;(3)妊娠期妇女及产妇。
本研究方案已通过宁夏医科大学总医院伦理委员会审查批准,审批编号:KYLL-2024-1072。
1.2 RALE评分方法收集确诊ARDS患者当天的X线胸片,肺部X线胸片根据脊椎和左主支气管划分为4个象限,分别采用面积评分和密度评分两个指标对每个象限进行评估。面积评分基于肺部混浊面积的比例,分值为0~4分(0分:无;1分:< 25%;2分:25%~50%;3分:50%~75%;4分:≥75%)。密度评分根据肺泡混浊度进行评定,分值为1~3分(1分:朦胧;2分:中等;3分:致密)。面积评分与密度评分的乘积为该象限的得分,最后将4个象限的评分相加得到RALE总评分,总分值范围为0~48分,评分越高表示肺部病变越严重[15]。评分由一名影像科医师和一名重症医学科医师(两位医师的工作年限均超过5年,且均未参与所有患者的诊疗过程)独立完成,取两名医师评分的平均值作为最终的RALE评分结果。
1.3 数据收集及数据预处理收集患者确诊ARDS后的一般资料、临床指标及RALE评分。对于数据收集中缺失率超过20%的变量予以直接排除,缺失率低于20%的变量则采用多重插补法进行处理。
累积液体平衡(mL/kg)=(累积入量-累积出量)/体重(kg)。计算3 d、5 d和7 d的累积液体平衡时,分别用3 d、5 d和7 d的累积液体总量除以体重(kg)。
1.4 潜在类别分析法的亚表型构建使用18个临床指标作为外显变量,配性检验从潜类别数目为1的基准模型开始,依次增加潜类别的数目,探索2~4个潜类别模型的适配指标,以赤池信息准则(Akaike information criterion, AIC)、贝叶斯信息准则(Bayesian information criterion, BIC)和熵(Entropy)作为模型适配度比较的指标进行假设模型间的适配检验。
1.5 统计学方法采用以下统计学方法对数据进行分析。符合正态分布的计量资料以均数±标准差(x±s)表示,组间比较采用独立样本t检验;非正态分布的计量资料以中位数(四分位数间距)[M(Q1, Q3)]表示,组间比较采用Mann-Whitney U检验;计数资料以例数(百分比)表示,组间比较采用卡方检验或Fisher精确检验。采用Kaplan-Meier法绘制28 d生存曲线,并应用Log-rank检验进行差异比较。为进一步探究累积液体平衡与预后的关系,采用限制性立方样条(restricted cubic spline, RCS)回归模型分析两组亚表型患者在第3、5、7天的累积液体平衡与28 d生存率之间的非线性关联,模型节点数设定为4。最后,通过绘制受试者工作特征(receiver operating characteristic, ROC)曲线并计算曲线下面积(area under the curve, AUC),评估不同时间点累积液体平衡对两组亚表型患者28 d生存结局的预测效能。以P < 0.05为差异具有统计学意义。
2 结果 2.1 潜类别分析建模构建不同ARDS患者的亚表型本研究共纳入218例ARDS患者。使用18个临床指标作为外显变量,适配检验后最终确定最佳模型为2类别模型见表 1,在此模型下亚表型1组的ARDS患者为148例,亚表型2组的ARDS患者为70例,两组亚表型患者的临床特征差异有统计学意义。与亚表型1组相比,亚表型2组的ARDS患者表现出炎症指标降钙素原、白介素-6(interleukin-6, IL-6)升高,去甲肾上腺素使用剂量更高,乳酸、中心静脉压及RALE评分升高;氧合指数、碳酸氢根、平均动脉压降低。见图 1。
| 潜在类别数目 | AIC | BIC | 熵 | 每个潜在类别的患者人数 | P值 | ||||
| 1 | 2 | 3 | 4 | 5 | |||||
| 1 | 4908.336 | 4969.257 | - | 218 | |||||
| 2 | 4745.084 | 4870.310 | 0.755 | 148 | 70 | < 0.001 | |||
| 3 | 4693.281 | 4882.813 | 0.730 | 86 | 62 | 70 | < 0.001 | ||
| 4 | 4678.760 | 4932.597 | 0.774 | 58 | 34 | 73 | 53 | 0.020 | |
| 注:AIC为赤池信息准则;BIC为贝叶斯信息准则 | |||||||||
|
| 注:IL-6为白介素6,RALE评分为肺水肿放射学评分,BMI为体重指数,PEEP为呼气末正压,MAP为平均动脉压;条件概率为该坐标值显示了不同亚表型(表型1和表型2)的患者拥有某个指标特定特征的可能性 图 1 不同临床亚表型的ARDS患者的临床特征 Fig 1 Comparison of clinical characteristics across ARDS subphenotypes |
|
|
比较两组不同亚表型ARDS患者入组后的基线资料和临床指标,发现亚表型2组患者的心率、红细胞压积、肌酐、IL-6、降钙素原(procalcitonin, PCT)、PaCO2、呼气末正压(positive end-expiratory pressure, PEEP)、乳酸、去甲肾上腺素剂量、序贯器官衰竭评分、急性生理学与慢性健康状况评分Ⅱ、RALE高于亚表型1组(均P < 0.05);亚表型2组患者的平均动脉压、pH、氧合指数、碳酸氢盐低于亚表型1组(均P < 0.05)。见表 2。
| 指标 | 表型1组(n=148) | 表型2组(n=70) | t/χ2/Z值 | P值 |
| 一般资料 | ||||
| 年龄(岁)a | 59.84 ± 16.78 | 59.93 ± 15.06 | -0.038 | 0.969 |
| 女性b | 53.00(34.80) | 19.00(27.10) | 1.614 | 0.264 |
| BMI(kg/m2)c | 24.31(22.59, 6.06) | 24.59(22.86, 26.13) | -0.862 | 0.380 |
| 生命体征 | ||||
| 体温(℃)a | 37.70 ± 0.90 | 37.92 ± 1.13 | -1.393 | 0.132 |
| 心率(次/分)a | 100.18 ± 16.73 | 125.10±20.95 | -9.448 | < 0.001 |
| 呼吸频率(次/min)c | 15.00(15.00, 20.75) | 19.00(15.00, 29.90) | -0.526 | 0.346 |
| MAP(mmHg)c | 76.00(64.25, 100.00) | 56.00(51.75, 65.00) | -7.652 | < 0.001 |
| 实验室检验指标 | ||||
| 白细胞计数(×109/L)c | 10.15(7.24, 14.98) | 11.86(6.78, 17.53) | -1.372 | 0.137 |
| 血小板(×109/L)c | 137.50(77.25, 194.50) | 118.50(76.25, 216.25) | -0.797 | 0.325 |
| 红细胞压积(%)c | 31.45(26.03, 38.20) | 39.40(28.23, 45.03) | -3.746 | 0.024 |
| 肌酐(µmol/L)c | 77.10(58.25, 130.83) | 121.50(79.88, 196.93) | -3.863 | 0.039 |
| 白蛋白(g/L)c | 27.59(24.70, 30.00) | 24.95(21.85, 29.65) | -2.884 | 0.053 |
| 总胆红素(umol/L)c | 21.10(13.00, 34.60) | 29.38(15.18, 59.35) | -2.590 | 0.085 |
| 炎症标志物 | ||||
| IL-6(pg/mL)c | 69.85(17.20, 180.50) | 393.00(112.00, 3638.50) | -6.864 | < 0.001 |
| C反应蛋白(mg/L)a | 120.89 ± 84.87 | 118.36 ± 72.47 | 0.215 | 0.830 |
| PCT(ng/mL)c | 1.85(0.45, 7.18) | 7.10(3.20, 21.00) | -5.207 | 0.013 |
| 血气分析指标 | ||||
| pHa | 7.37 ± 0.10 | 7.29 ± 0.13 | 4.920 | < 0.001 |
| 氧合指数a | 153.34 ± 60.37 | 121.90 ± 65.09 | 3.501 | 0.001 |
| PaO2(mmHg)a | 82.63 ± 27.46 | 75.83 ± 28.94 | 1.677 | 0.095 |
| PaCO2(mmHg)c | 39.75(34.03, 46.68) | 40.25(34.75, 53.48) | -1.264 | 0.049 |
| 乳酸(mmol/L)c | 1.40(1.00, 1.90) | 3.55(2.00, 5.78) | -8.567 | < 0.001 |
| HCO3-(mmol/L)a | 23.77 ± 5.39 | 21.36 ± 5.60 | 3.036 | 0.003 |
| 呼吸机参数 | ||||
| 潮气量(mL)c | 450.00(450.00, 477.50) | 450.00(420.00, 480.00) | -1.527 | 0.184 |
| PEEP(cmH2O)a | 8.22 ± 3.38 | 9.94 ± 3.73 | -3.404 | 0.001 |
| 血管活性药物 | ||||
| 去甲肾上腺素剂量[µg/(kg·min)]c | 0.00(0.00, 0.50) | 1.50(0.80, 2.50) | -9.796 | < 0.001 |
| 疾病严重程度评分 | ||||
| SOFA评分(分)c | 9.00(5.00, 11.75) | 12.00(10.00, 15.00) | -5.994 | < 0.001 |
| APACHEⅡ评分(分)a | 20.30 ± 7.17 | 26.44 ± 8.63 | -5.526 | < 0.001 |
| RALE评分(分)a | 21.73 ± 12.14 | 25.89 ± 14.03 | -2.243 | 0.026 |
| 注:BMI为体重指数,MAP为平均动脉压,PT为凝血酶原时间,APTT为活化部分凝血活酶时间,FIB为纤维蛋白原,IL-6为白细胞介素6,PCT为降钙素原,pH为酸碱度,PaO2为动脉血氧分压,PaCO2为动脉血二氧化碳分压,PEEP为呼气末正压,SOFA评分为序贯器官衰竭评分,APACHEⅡ评分为急性生理学与慢性健康状况评分Ⅱ,RALE评分为肺水肿放射学评分;a为x±s,b为(例, %),c为M(Q1, Q3) | ||||
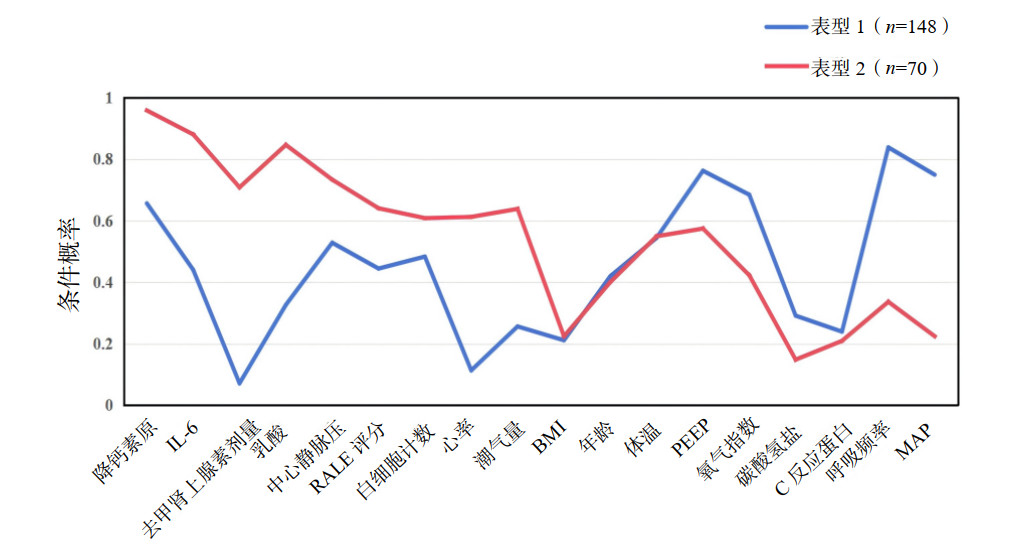
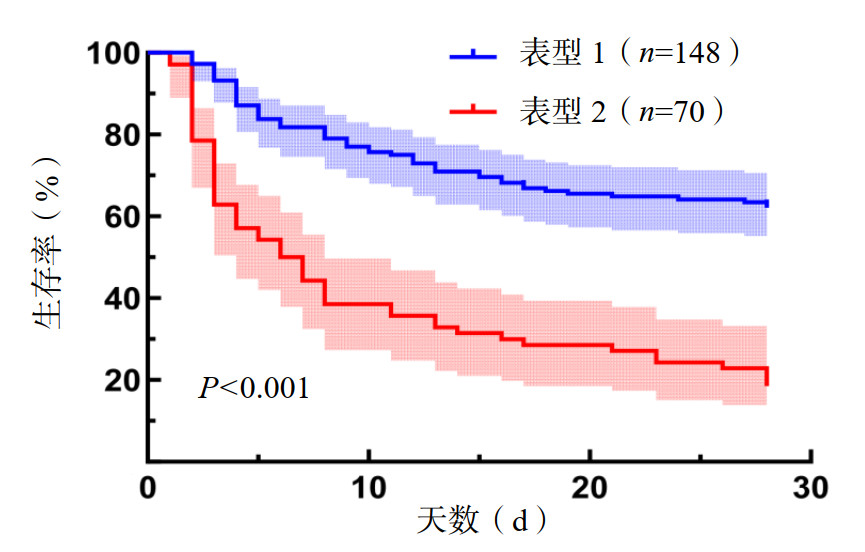
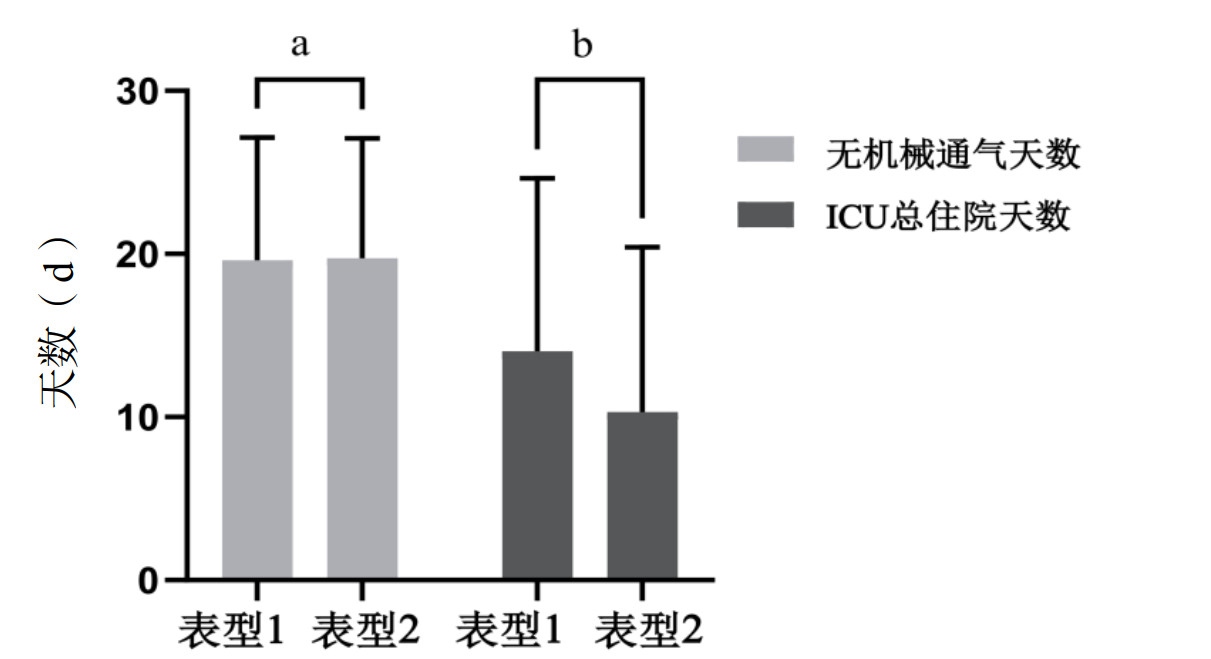
比较两组亚表型ARDS患者的28 d生存天数,结果显示亚表型2组的28 d生存天数少于亚表型1组(P < 0.001),见图 2。亚表型2组的28 d病死率高于亚表型1组(P < 0.001)。亚表型2组的总住院天数也低于亚表型1组(P=0.014)。对比两组患者的28 d无机械通气天数差异无统计学意义(P=0.911)。见图 3,表 3。
|
| 图 2 不同ARDS亚表型患者的28 d存活天数 Fig 2 Kaplan-Meier curves for 28-day survival of different ARDS subphenotypes |
|
|
|
| 注:a为P > 0.05,b为P < 0.05 图 3 不同ARDS亚表型患者的28 d无机械通气天数和ICU总住院时间 Fig 3 Ventilator-free days and ICU length of stay across ARDS subphenotypes |
|
|
| 指标 | 表型1组(n=148) | 表型2组(n=70) | 统计值 | P值 |
| 28 d死亡a | 56.00(37.80) | 57.00(81.40) | 36.169 | < 0.001 |
| 28 d无机械通气天数(d)b | 21.50(15.00, 25.00) | 22.00(14, 25, 25.00) | -0.012 | 0.911 |
| ICU总住院时间(d)b | 11.00(6.00, 19.00) | 7.00(3.00, 14.00) | -3.434 | 0.014 |
| 注:a为(例, %),b为M(Q1, Q3) | ||||
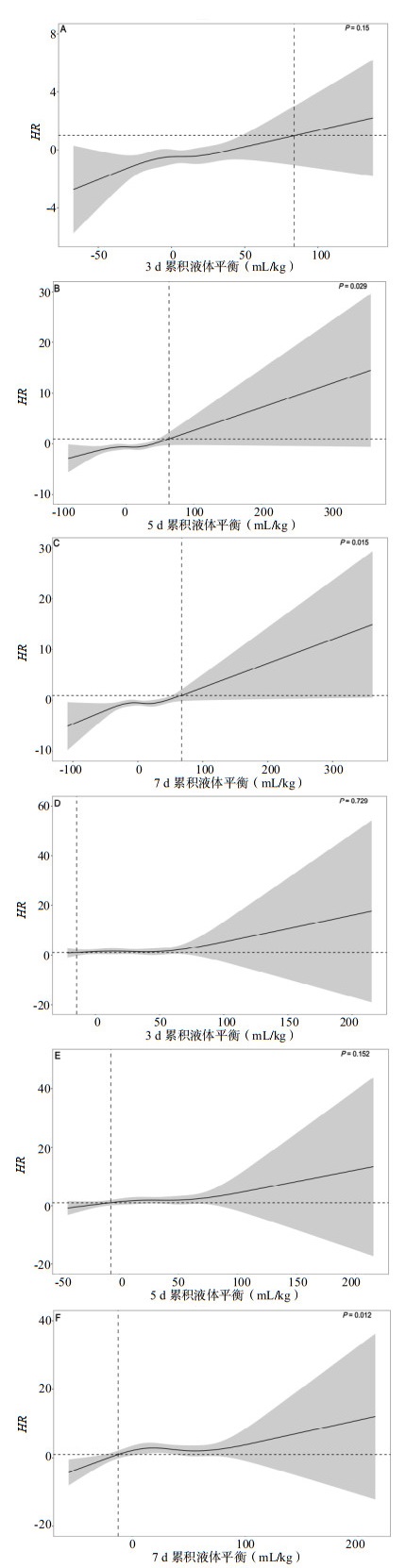
对比不同ARDS亚表型患者的3 d、5 d、7 d累积液体平衡与死亡风险的关系,结果显示:亚表型1组3 d、5 d和7 d的累积液体平衡最低风险比(subdistribution hazard ratio, SHR)分别高于83.798 mL/kg、63.527 mL/kg和67.301 mL/kg时患者死亡风险显著增加;亚表型2组3 d、5 d和7 d的累积液体平衡SHR分别高于-14.693 mL/kg、-7.160 mL/kg和-12.321 mL/kg时患者死亡风险显著增加。在亚表型1组患者中,5 d和7 d的累积液体平衡对生存率有显著影响(P=0.029,P=0.015)。在亚表型2组患者中,7 d的累积液体平衡对生存率有显著影响(P=0.012)。见图 4。
|
| 注:图A~C为表型1,图D~F为表型2;阴影带表示95%CI,水平虚线代表风险比为1.0,SHR为最低风险比,是垂直虚线代表的曲线最低点 图 4 不同亚表型ARDS患者不同时间点累积液体平衡与28 d病死率之间关系的RCS曲线 Fig 4 RCS curves of cumulative fluid balance and 28-day mortality by subphenotype |
|
|
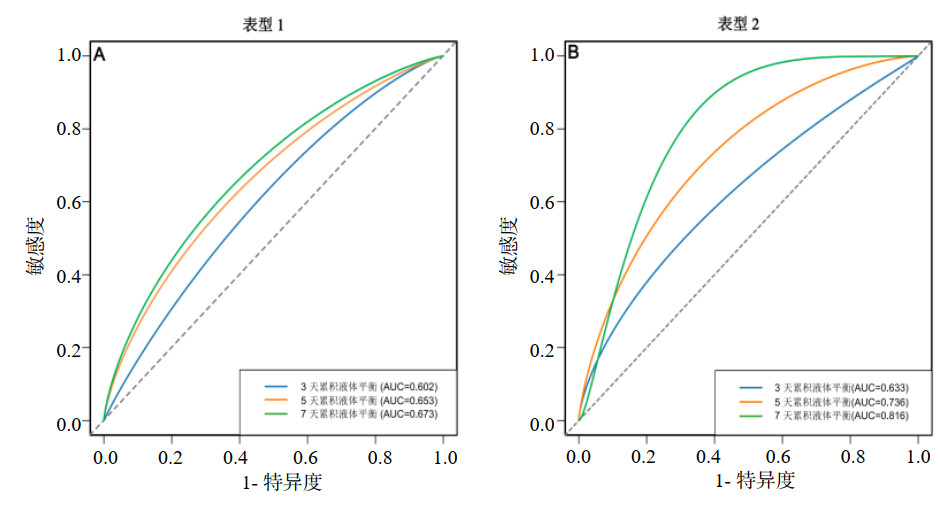
通过ROC曲线评估了ARDS不同临床亚表型不同时间累积液体平衡对患者结局的预测价值。结果显示亚表型1组ARDS患者的3 d、5 d、7 d累积液体平衡对28 d预后的预测AUC分别为0.602(95%CI: 0.516~0.683,P=0.036)、0.653(95%CI: 0.569~0.731,P=0.001)、0.673(95%CI: 0.589~0.749,P < 0.001)。亚表型2组ARDS患者的3 d、5 d、7 d累积液体平衡对28 d预后的AUC分别为0.633(95%CI: 0.504~0.749,P=0.250)、0.736(95%CI: 0.612~0.837,P=0.004)、0.816(95%CI: 0.701~0.902,P < 0.001)。亚表型2组的3 d、5 d和7 d的累积液体平衡对ARDS结局的预测价值均高于亚表型1组,亚表型2组7 d的累积液体平衡作为预测指标对患者生存结局的区分度最高(AUC=0.816,95%CI: 0.701~0.902,P < 0.001)。见图 5、表 4。
|
| 注:A图为亚表型2组ARDS患者不同时间累积液体平衡与28 d病死率的ROC曲线;B图为亚表型2组ARDS患者不同时间累积液体平衡与28 d病死率的ROC曲线 图 5 不同亚表型ARDS患者不同时间累积液体平衡与28 d病死率关系的ROC曲线 Fig 5 Predictive performance of cumulative fluid balance for 28-day mortality in ARDS subphenotypes by ROC analysis |
|
|
| 变量 | AUC | 95%CI | 敏感度(%) | 特异度(%) | P值 | 组内AUC比较P值 |
| 表型1组 | ||||||
| 3 d | 0.602 | 0.516~0.683 | 71.70 | 48.31 | 0.036 | 0.101(vs. 5 d) |
| 5 d | 0.653 | 0.569~0.731 | 83.02 | 46.07 | 0.001 | 0.361(vs. 7 d) |
| 7 d | 0.673 | 0.589~0.749 | 79.25 | 48.31 | < 0.001 | 0.061(vs. 3 d) |
| 表型2组 | ||||||
| 3 d | 0.633 | 0.504~0.749 | 70.37 | 54.55 | 0.250 | 0.126(vs. 5 d) |
| 5 d | 0.736 | 0.612~0.837 | 75.93 | 63.64 | 0.004 | 0.089(vs. 7 d) |
| 7 d | 0.816 | 0.701~0.902 | 100.00 | 54.55 | < 0.001 | 0.034(vs. 3 d) |
ARDS亚表型是根据患者不同的临床特征的差异进行个体化区分,目的是实现临床精准化治疗[16]。本研究纳入了与肺水肿相关的RALE评分及快速获取的临床指标,构建了ARDS的两种亚表型。分析表明,相较于亚表型1组,亚表型2组患者呈现更显著的炎症反应、更严重的肺水肿及低灌注现象。这种高炎症状态直接损害肺泡-毛细血管屏障,导致肺血管通透性升高,大量富含蛋白渗出液渗入肺间质和肺泡腔从而加重肺水肿,同时肺泡上皮细胞损伤破坏,也减弱了肺泡液体清除功能[17]。大量液体集聚肺部导致有效循环血容量集聚减少,组织出现低灌注,而高炎症、严重肺水肿和低灌注三者相互促进,形成恶性循环[18],加剧了病情的发生发展。因此这一病理生理特征导致亚表型2组ARDS患者对常规治疗反应不佳,疾病进展迅速,本研究进一步证实亚表型2组患者的28 d生存率较低,临床早期识别具有高炎症和高死亡风险的ARDS亚表型患者,对于实施早期目标导向治疗,如强化抗感染策略、肺保护性通气、循环支持、液体管理及精准预后评估具有重要意义。
液体复苏是ARDS早期治疗的关键环节,其目标在于确保血管内容量稳定的同时减少肺泡内液体滞留[8]。急性呼吸衰竭的液体管理需要在液体复苏与液体过负荷之间取得平衡,避免低血压和低氧血症的发生[19]。ARDS患者采用限制性液体管理方法可有效维持整体液体平衡,减少无机械通气时间及呼吸机使用天数,但其对患者病死率的影响尚待进一步验证[20-21]。本研究通过探究不同亚表型ARDS患者在3 d、5 d和7 d的液体总平衡与生存预后的关联性,结果表明亚表型1组患者的累积5 d和7 d液体平衡对其生存具有统计学意义,提示亚表型1组患者需在临床中后期实施更精细化的液体管理以防止超出安全范围,而亚表型2组患者的生存主要受到累积7 d液体平衡的影响,提示亚表型2组患者则需在整个临床治疗过程中持续监测以保持适宜的负平衡状态,因此基于亚表型特征制定个体化的液体管理策略,可显著提升ARDS患者28 d生存率。
通过进一步对ARDS患者不同时间点累积液体平衡的预测价值分析,发现亚表型2组的7 d液体总量指标在生存结局预测方面具有显著优势。这表明对于亚表型2组的ARDS患者,液体平衡可能是一个更重要的预测因子。该亚型患者表现出感染严重、肺水肿程度高、低灌注,其液体平衡状况会对转归产生显著影响。亚表型2组的5 d液体总平衡的AUC值开始升高,提示该亚型患者有必要优化特定时间节点的液体管理方案,并维持负平衡状态。
本研究受限于单中心回顾性研究设计,其结论的外推性需通过多中心前瞻性研究进一步证实。此外,潜在类别分析后亚表型2组的样本规模相对不足,需在后续前瞻性研究中扩充总体样本量以增强统计效能。
利益冲突 所有作者声明无利益冲突
作者贡献声明 陈燕妮、白吉佳:采集数据、统计学分许、文章撰写;安星、黄玉芳:分析数据、RALE评分;周文艳:数据整理、统计分析;马希刚:研究设计、论文修改
| [1] | Sinha P, Meyer NJ, Calfee CS. Biological phenotyping in sepsis and acute respiratory distress syndrome[J]. Annu Rev Med, 2023, 74: 457-471. DOI:10.1146/annurev-med-043021-014005 |
| [2] | Villar J, Szakmany T, Grasselli G, et al. Redefining ARDS: a paradigm shift[J]. Crit Care, 2023, 27(1): 416. DOI:10.1186/s13054-023-04699-w |
| [3] | Wösten-van Asperen R, Bos LD. Inflammatory ARDS subphenotypes are generalisable across the age spectrum[J]. Thorax, 2024, 79(2): 108-109. DOI:10.1136/thorax-2023-221015 |
| [4] | Sinha P, Delucchi KL, Thompson BT, et al. Latent class analysis of ARDS subphenotypes: a secondary analysis of the statins for acutely injured lungs from sepsis (SAILS) study[J]. Intensive Care Med, 2018, 44(11): 1859-1869. DOI:10.1007/s00134-018-5378-3 |
| [5] | Calfee CS, Delucchi KL, Sinha P, et al. Acute respiratory distress syndrome subphenotypes and differential response to simvastatin: secondary analysis of a randomised controlled trial[J]. Lancet Respir Med, 2018, 6(9): 691-698. DOI:10.1016/S2213-2600(18)30177-2 |
| [6] | Famous KR, Delucchi K, Ware LB, et al. Acute respiratory distress syndrome subphenotypes respond differently to randomized fluid management strategy[J]. Am J Respir Crit Care Med, 2017, 195(3): 331-338. DOI:10.1164/rccm.201603-0645OC |
| [7] | Calfee CS, Delucchi K, Parsons PE, et al. Subphenotypes in acute respiratory distress syndrome: latent class analysis of data from two randomised controlled trials[J]. Lancet Respir Med, 2014, 2(8): 611-620. DOI:10.1016/S2213-2600(14)70097-9 |
| [8] | Vignon P, Evrard B, Asfar P, et al. Fluid administration and monitoring in ARDS: which management?[J]. Intensive Care Med, 2020, 46(12): 2252-2264. DOI:10.1007/s00134-020-06310-0 |
| [9] | 李小舟, 尹倩倩, 赵广阔. 住院期间入出液体量差对老年脓毒性休克患者预后评估价值[J]. 中华急诊医学杂志, 2025, 34(5): 656-661. DOI:10.3760/cma.j.issn.1671-0282.2025.05.008 |
| [10] | 党红星, 许峰. 儿童急性呼吸窘迫综合征的液体复苏和平衡管理策略[J]. 中国小儿急救医学, 2025, 32(1): 1-7. DOI:10.3760/cma.j.issn.1673-4912.2025.01.001 |
| [11] | Filippini DFL, Hagens LA, Heijnen NFL, et al. Prognostic value of the radiographic assessment of lung edema score in mechanically ventilated ICU patients[J]. J Clin Med, 2023, 12(4): 1252. DOI:10.3390/jcm12041252 |
| [12] | 田李均, 曹志龙, 林金锋, 等. 肺水肿放射学评分对急性呼吸窘迫综合征患者病情严重程度及预后的评估价值[J]. 中华危重病急救医学, 2021, 33(5): 557-562. DOI:10.3760/cma.j.cn121430-20201231-00780 |
| [13] | Han CH, Park M, Kim H, et al. Radiologic assessment of lung edema score as a predictor of clinical outcome in children with acute respiratory distress syndrome[J]. Yonsei Med J, 2023, 64(6): 384-394. DOI:10.3349/ymj.2022.0653 |
| [14] | ARDS Definition Task Force, Ranieri VM, Rubenfeld GD, et al. Acute respiratory distress syndrome: the Berlin Definition[J]. JAMA, 2012, 307(23): 2526-2533. DOI:10.1001/jama.2012.5669 |
| [15] | Warren MA, Zhao Z, Koyama T, et al. Severity scoring of lung oedema on the chest radiograph is associated with clinical outcomes in ARDS[J]. Thorax, 2018, 73(9): 840-846. DOI:10.1136/thoraxjnl-2017-211280 |
| [16] | Grasselli G, Calfee CS, Camporota L, et al. ESICM guidelines on acute respiratory distress syndrome: definition, phenotyping and respiratory support strategies[J]. Intensive Care Med, 2023, 49(7): 727-759. DOI:10.1007/s00134-023-07050-7 |
| [17] | 迟骋, 李雯莉, 陆玉成, 等. 基于细胞通讯探讨免疫细胞分化相关肺泡—毛细血管屏障损伤对脓毒性ARDS的影响[J]. 中华急诊医学杂志, 2024, 33(8): 1117-1127. DOI:10.3760/cma.j.issn.1671-0282.2024.08.008 |
| [18] | 王仁女, 汪洁, 毛宝杰, 等. 全身免疫炎症指数对急性呼吸窘迫综合征预后的评估[J]. 中华急诊医学杂志, 2023, 32(8): 1061-1065. DOI:10.3760/cma.j.issn.1671-0282.2023.08.009 |
| [19] | Shen YF, Cai GL, Yan J. Fluid intake, fluid output or fluid balance, which one matters in ARDS[J]. Crit Care, 2022, 26(1): 352. DOI:10.1186/s13054-022-04188-6 |
| [20] | Ziaka M, Exadaktylos A. Fluid management strategies in critically ill patients with ARDS: a narrative review[J]. Eur J Med Res, 2025, 30(1): 401. DOI:10.1186/s40001-025-02661-w |
| [21] | Yang P, Sjoding MW. Acute respiratory distress syndrome: definition, diagnosis, and routine management[J]. Crit Care Clin, 2024, 40(2): 309-327. DOI:10.1016/j.ccc.2023.12.003 |
 2026, Vol. 35
2026, Vol. 35