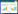2. 浙江大学医学院附属第二医院重症医学科,杭州 310009
2. Intensive Care Unit, The Second Affiliated Hospital of Zhejiang University School of Medicine, Hangzhou 310009, China
急性呼吸窘迫综合征(acute respiratory distress syndrome, ARDS)是指一种急性弥漫性炎性肺损伤,主要表现为进行性加重的呼吸困难和低氧血症[1-3]。国内外研究显示重度ARDS的死亡率分别高达56.2%、46.1%[4-5]。ARDS患者实施肺保护性通气、高呼气末正压(positive end-expiratory pressure, PEEP)以及挽救性的体外膜肺氧合(extracorporeal membrane oxygenation, ECMO)等支持策略,旨在改善氧合的基础上进一步限制肺损伤[2, 6-8]。重度ARDS患者高病死率持续存在,存活者常伴有长期功能损害[7]。近年来,多项指南均建议对符合指征的患者早期启动ECMO[9-10]。
ECMO是一种基于体外循环技术的高级生命支持手段[11]。于1972年首次应用于成人ARDS患者[12],近些年来越来越多地应用于重度ARDS患者的治疗中[13-14]。多项研究(如EOLIA实验、CESAR试验)及ELSO指南均表明,ECMO可以改善重度ARDS患者的生存率与器官功能的转归[15-17]。
尽管ECMO技术已有显著进展,但其适应证/ 禁忌证和启动时间仍有很多争议,且伴随着并发症高发生率及较高的死亡风险,研究报道其死亡率通常在40%~60%之间[10, 18]。鉴于ECMO治疗成本高、部分患者预后不佳,需综合评估患者基础疾病、治疗目标等因素,以筛选最大获益人群。目前已有ECMO协作网评分(ECMOnet)、ECMO支持的呼吸系统疾病生存率预测评分(Respiratory Extracorporeal-membrane-oxygenation Survival Prediction, RESP)、ECMO支持的重度ARDS病死率预测评分(PRedicting dEath for SEvere ARDS on VVECMO, PRESERVE)、ROCH等相关预后评分工具[19-22]。然而,这些评分均存在一定的缺陷:(1)如ECMOnet评分专注于H1N1患者群体,ROCH评分主要为拟转诊至ECMO中心的严重ARDS患者预后;(2)不同ECMO中心的数据差异影响了模型的构建和预测能力,导致RESP和PRESERVE评分预测效能有限[10, 23]。且基于中国人群的ECMO预测模型较为缺乏,目前大多数研究仅关注使用静脉-静脉ECMO(veno-venous ECMO, V-V ECMO)单一模式。因此,开展更深入、更具普适性的临床研究显得格外重要。
本研究回顾性收集符合纳入标准患者临床数据,筛选影响28 d预后的预测因子,据此构建新型预测模型工具并评估其效能。
1 资料与方法 1.1 研究对象本研究为回顾性队列研究,选择2018年5月至2025年5月期间就诊于郑州大学附属郑州中心医院重症医学科接受ECMO治疗的重度ARDS患者为研究对象。纳入标准:重度ARDS其定义符合2023年ARDS的全球新定义中的重度ARDS诊断标准[3];排除标准:(1)临床资料不完全,无法获得ECMO辅助支持后28 d生存结局患者;(2)孕妇;(3)接受ECMO治疗时长小于72 h;(4)年龄小于18周岁。
本研究符合医学伦理学要求,并通过郑州大学附属郑州中心医院医学伦理委员会审批(审批号:202408)。
1.2 观察指标通过回顾电子病历及护理记录收集患者的一般资料,包括:ECMO的模式、年龄、性别、体重指数、基础疾病、合并慢性免疫抑制状态(主要包括血液系统恶性肿瘤、接受放疗/化疗的实体肿瘤患者、接受器官移植患者、需要长期使用免疫抑制剂治疗患者)、重度ARDS病因。
收集ECMO置管前24 h内实验室指标,包括心率、呼吸频率、平均动脉压、白细胞、淋巴细胞、血小板、C-反应蛋白、血肌酐(serum creatinine, SCr)、降钙素原、凝血酶原时间(prothrombin time, PT)、pH、动脉氧分压、动脉CO2分压等;ECMO前呼吸机设置:潮气量(tidal volume, VT)、呼吸频率、吸气峰压、驱动压(driving pressure, ΔP)[24]、PEEP。
收集ECMO置管前6 h内危重症评分,包括急性生理与慢性健康Ⅱ(acute physiology and chronic health evaluation Ⅱ, APACHEⅡ)评分、序贯器官衰竭(sequential organ failure assessment, SOFA)评分。
收集启动ECMO前后其他治疗:ECMO前有创机械通气时间、ECMO前是否应用血管活性药物、ECMO期间是否俯卧位通气、ECMO期间是否发生相关并发症、ECMO期间是否行连续性肾脏替代治疗、诊断重度ARDS到启动ECMO时间、启动ECMO前住院时长(指入住普通病房和ICU住院总时长)、ECMO辅助治疗总时长。
本研究以28 d生存情况为观察终点,依据ECMO治疗28 d生存情况分为生存组和死亡组。
1.3 ECMO模式的选择及上机指征当重度ARDS患者只存在单纯呼吸衰竭而心功能正常时,在ECMO模式的选择上首选V-V ECMO模式;当患者出现合并休克并且出现左室衰竭或者双室衰竭时则需要选择静脉-动脉(veno-arterial, V-A)ECMO模式,或者转换为静脉-动脉-静脉(veno-arterial-venous, V-A-V)ECMO模式,以同时提供心肺功能的支持。本研究中重度ARDS患者在ECMO模式的选择由ECMO专业诊疗团队根据患者病情综合评估选择。
上机指征[17]:(1)使用机械通气时间 < 7 d;(2)氧合指数 < 50 mmHg(1 mmHg=0.133 kPa)超过3 h或氧合指数 < 80 mmHg超过6 h;(3)呼吸频率上升至35次/min,保持平台压≤32 cmH2O(1 cmH2O=0.098 kPa)条件下调整机械通气设置,动脉血pH值仍 < 7.25且伴有动脉血CO2分压 > 60 mmHg超过6 h。
1.4 主要仪器和设备采用ECMO系统套件包,MAQUET公司套包为整体体外循环套包,包括离心泵、氧合器及其连接管路;索林套包为索林的Rotaflow泵头、膜式氧合器及人工心肺机体外循环管道(成人E型),插管均为MAQUET公司的体外循环插管及穿刺附件。行ECMO辅助的患者均使用同型号ECMO机器、ECMO套包及膜氧合器。
1.5 统计学方法本研究采用R4.3.0软件进行数据处理和绘图。符合正态分布的计量资料以均数±标准差(x±s)表示,组间差异采用独立样本t检验;不符合正态分布的计量资料以中位数(四分位间距)[M(Q1, Q3)]表达,采取Mann-Whitney U检验。计数资料以例(%)表示,组间差异采用χ2检验。采用Logistic回归(向前逐步法)筛选预测因素,构建相关预测模型并绘制列线图模型,基于Bootstrap(1 000次)法进行模型内部验证,绘制受试者工作(receiver operator characteristic, ROC)曲线评价列线图模型的预测价值,同时绘制校准曲线及决策曲线评价该模型的预测效能和临床应用价值。以P < 0.05为差异具有统计学意义。
2 结果 2.1 研究对象临床资料比较本研究共纳入患者共123例,其中男性84例,女性39例,平均年龄59岁。ECMO模式的选择V-V模式100例(81.3%),V-A模式14例(11.4%),V-A-V模式9例(7.3%),两组间ECMO模式差异无统计学意义(P > 0.05)。死亡组与生存组患者年龄、合并慢性免疫抑制状态、SOFA评分、ΔP、SCr、心率、PT、ECMO前机械通气时间、诊断重度ARDS到启动ECMO时间、启动ECMO前住院时间差异均有统计学意义(均P < 0.05)。见表 1。
| 指标 | 生存组(n=51) | 死亡组(n=72) | χ2/t/Z值 | P值 |
| 一般情况 | ||||
| 男性a | 32(62.7) | 52(72.2) | 1.238 | 0.360 |
| 年龄(岁)b | 57.00(45.00, 63.50) | 65.50(55.00, 73.50) | -3.870 | < 0.001 |
| BMI > 30 a | 2(3.9) | 10(13.9) | 2.332 | 0.127 |
| 基础疾病a | ||||
| 高血压 | 12(23.5) | 29(40.3) | 3.052 | 0.081 |
| 糖尿病 | 9(17.6) | 24(33.3) | 2.985 | 0.084 |
| 冠状动脉粥样硬化性心脏病 | 11(21.6) | 17(23.6) | 0.002 | 0.962 |
| 慢性肺部疾病 | 4(7.8) | 12(16.7) | 1.348 | 0.246 |
| 慢性免疫抑制状态a | 6(11.8) | 22(30.6) | 4.974 | 0.026 |
| ARDS病因a | 3.247 | 0.197 | ||
| 原发性肺部感染 | 37(72.5) | 53(73.6) | ||
| 细菌性肺炎 | 22(43.1) | 34(47.2) | ||
| 病毒性肺炎 | 10(19.6) | 13(18.1) | ||
| 其他致病菌 | 5(9.8) | 6(8.3) | ||
| 肺外脓毒症 | 6(11.8) | 14(19.4) | ||
| 手术/创伤 | 8(15.7) | 5(6.9) | ||
| 危重症评分b | ||||
| SOFA评分 | 9(6, 12) | 12(8, 13) | -2.695 | 0.007 |
| APACHEⅡ评分 | 18(15, 22) | 19(15, 24) | -0.788 | 0.432 |
| ECMO模式a | 4.525 | 0.104 | ||
| V-V ECMO | 40(78.4) | 60(83.3) | ||
| V-A ECMO | 9(17.6) | 5(6.9) | ||
| V-A-V ECMO | 2(3.9) | 7(9.7) | ||
| ECMO前生命体征 | ||||
| 心率(次/min)b | 120.00(110.00, 132.50) | 128.00(120.00, 136.00) | -2.219 | 0.027 |
| 呼吸频率(次/min)c | 34.60±75.41 | 35.26±4.80 | -0.569 | 0.520 |
| MAP/(mmHg)b | 73.00(60.00, 86.50) | 65.00(59.50, 83.50) | -1.012 | 0.313 |
| ECMO前生化检验指标 | ||||
| 白细胞计数b | 11.60(6.54, 15.10) | 12.57(9.69, 16.76) | -1.527 | 0.127 |
| 淋巴细胞计数b | 0.62(0.35, 1.48) | 0.55(0.28, 1.12) | -1.630 | 0.103 |
| 降钙素原(ng/mL)b | 2.60(0.52, 17.26) | 1.55(0.48, 7.55) | -0.896 | 0.372 |
| 血小板计数(109/L)b | 155.00(100.50, 22.00) | 130.50(56.50, 231.50) | -0.880 | 0.38 |
| C-反应蛋白(mg/L)b | 82.59(13.88, 144.15) | 79.37(36.45, 196.47) | -1.111 | 0.267 |
| SCr(µmol/L)b | 69.40(53.15, 90.55) | 81.50(63.05, 133.10) | -2.495 | 0.013 |
| PT(s)b | 13.00(11.30, 15.60) | 14.85(12.60, 18.30) | -2.136 | 0.033 |
| 活化部分凝血活酶时间(s)b | 39.40(27.60, 70.40) | 48.90(33.60, 80.53) | -1.432 | 0.152 |
| pH b | 7.29(7.20, 7.37) | 7.25(7.20, 7.32) | -0.915 | 0.362 |
| PaO2(mmHg)b | 60.40(43.40, 75.00) | 57.70(45.30, 75.83) | -0.038 | 0.702 |
| PaCO2(mmHg)b | 52.30(48.30, 58.05) | 51.50(46.90, 58.65) | -0.015 | 0.990 |
| 乳酸(mmol/L)b | 5.20(1.70, 8.50) | 4.60(2.12, 8.73) | -1.335 | 0.182 |
| ECMO前呼吸机参数 | ||||
| VT(mL)b | 425.00(392.50, 450.00) | 450.00(380.00, 480.00) | -0.825 | 0.411 |
| PaO2/FiO2 c | 63.67±10.78 | 60.71±7.70 | -1.841 | 0.097 |
| 吸气峰压(cmH2O)b | 24(20, 27) | 24(22, 27) | -0.417 | 0.678 |
| PEEP(cmH2O)b | 10.00(6.50, 12.00) | 8.00(6.00, 10.00) | -1.225 | 0.221 |
| ΔP(cmH2O)b | 14(12, 15) | 15(13, 18) | -3.836 | < 0.001 |
| 机械通气时长(h)b | 7.00(4.00, 14.50) | 17.00(6.50, 38.00) | -3.496 | < 0.001 |
| 其他治疗措施a | ||||
| 俯卧位 | 35(68.6) | 45(62.5) | 0.260 | 0.610 |
| 血管活性药物 | 33(64.7) | 44(61.1) | -0.404 | 0.828 |
| 连续性肾脏替代治疗 | 31(60.8) | 42(58.3) | 0.007 | 0.931 |
| 预后指标 | ||||
| ECMO相关并发症a | 20(39.2) | 40(55.6) | -2.570 | 0.109 |
| 诊断重度ARDS到ECMO启动时间(h)b | 4(2, 6) | 11(5, 18) | -5.996 | < 0.001 |
| ECMO启动前住院时间(h)b | 12(5, 24) | 36(19, 96) | -4.384 | < 0.001 |
| ECMO辅助治疗总时长(h)b | 144(100, 192) | 144(96, 192) | -0.841 | 0.400 |
| 注:BMI为体重指数,ARDS为急性呼吸窘迫综合征,SOFA为序贯器官衰竭评分,APACHE Ⅱ评分为急性生理与慢性健康状况评分系统Ⅱ,ECMO为体外膜肺氧合,MAP为平均动脉压,SCr为血肌酐,PT为凝血酶原时间,PaO2为动脉氧分压,PaCO2为动脉二氧化碳分压,VT为潮气量,PEEP为呼气末正压,ΔP为驱动压;a为例(%),b为M(Q1, Q3),c为x±s | ||||
将表 1中P < 0.05的候选变量进行单因素Logistic回归分析,显示年龄、慢性免疫抑制状态、SOFA评分、ΔP、SCr、ECMO前机械通气时长、诊断重度ARDS到ECMO启动时间及启动ECMO前住院时长指标,在生存组与死亡组之间差异有统计学意义(均P < 0.05)。多因素Logistic回归分析最终得出年龄(OR=1.04,95%CI: 1.00~1.07)、慢性免疫缺陷状态(OR=4.38,95%CI: 1.15~16.72)、SOFA评分(OR=1.19,95%CI: 1.02~1.38)、ΔP(OR=1.26,95%CI: 1.07~1.48)、诊断重度ARDS到ECMO启动时间(OR=1.24,95%CI: 1.07~1.43)是影响患者28 d死亡的预测因素,见表 2。列线图见图 1。
| 指标 | 单因素分析 | 多因素分析 | ||||||
| OR(95% CI) | P | OR(95% CI) | P | β | SE | Waldχ2 | ||
| 年龄(岁) | 1.04(1.02~1.07) | < 0.001 | 1.04(1.00~1.07) | 0.035 | 0.036 | 0.017 | 4.462 | |
| 心率(次/min) | 1.02(1.00~1.04) | 1.000 | ||||||
| 慢性免疫抑制状态 | 3.30(1.23~8.87) | 0.018 | 4.38(1.15~16.72) | 0.031 | 1.476 | 0.684 | 4.662 | |
| SOFA评分 | 1.17(1.05~1.31) | 0.018 | 1.19(1.02~1.38) | 0.031 | 0.170 | 0.079 | 4.646 | |
| ΔP(cmH2O) | 1.31(1.13~1.15) | < 0.001 | 1.26(1.07~1.48) | 0.007 | 0.229 | 0.084 | 7.389 | |
| SCr(µmol/L) | 1.01(1.00~1.02) | 0.015 | 1.01(0.99~1.02) | 0.286 | 0.006 | 0.006 | 1.136 | |
| PT(s) | 1.00(0.96~1.04) | 0.926 | ||||||
| 机械通气时长(h) | 1.04(1.01~1.06) | 0.003 | 1.00(0.98~1.03) | 0.698 | 0.005 | 0.012 | 0.150 | |
| 诊断重度ARDS到ECMO启动时间(h) | 1.28(1.15~1.43) | < 0.001 | 1.24(1.07~1.43) | 0.004 | 0.212 | 0.073 | 8.411 | |
| ECMO启动前住院时长(h) | 1.01(1.00~1.02) | 0.009 | 1.00(0.99~1.01) | 0.523 | 0.003 | 0.005 | 0.408 | |
| 注:SOFA为序贯器官衰竭评分,ΔP为驱动压,SCr为血肌酐,PT为凝血酶原时间,ARDS为急性呼吸窘迫综合征,ECMO为体外膜肺氧合 | ||||||||
|
| 注:SOFA为序贯器官衰竭评分,ΔP为驱动压,ARDS为急性呼吸窘迫综合征,ECMO为体外膜肺氧合 图 1 预测ECMO治疗重度ARDS患者死亡风险模型的列线图 Fig 1 Nomogram of the prediction model for mortality risk in ECMO-treated severe ARDS patients |
|
|
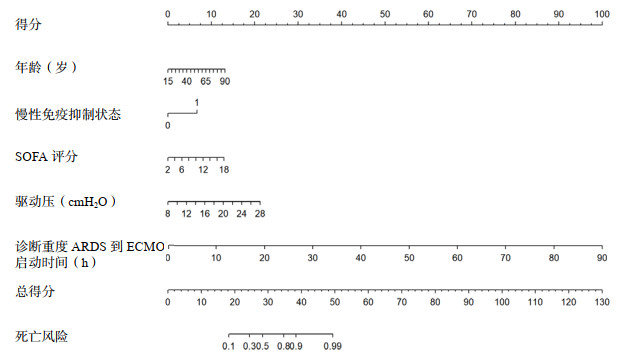
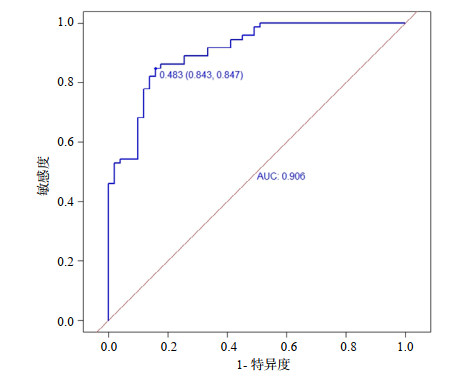
分别绘制ROC曲线、校准曲线以及临床决策曲线(见图 2、3、4)。ROC曲线下面积(area under the curve, AUC)为0.906(95%CI: 0.855~0.957),在最佳截断值时该模型的特异度为0.843,敏感度为0.847,表明该模型具有较为出色的判别能力。校准曲线Hosmer-Lemeshow检验结果,χ2=13.924, P=0.084,显示该模型的预测值接近于实测值,说明该模型所预测出的结局事件发生概率与实际概率具有良好的一致性。临床决策曲线显示出较好的临床净获益。为了验证模型的稳健性,通过Bootstrap重抽样法(见图 5)对原始数据进行1 000次重复可放回的抽样,得到1 000个内部验证队列的数据集,经重抽样后对模型内部验证,发现该模型AUC为0.915(95%CI: 0.863~0.962)。
|
| 图 2 列线图模型的ROC曲线 Fig 2 The ROC curve of the nomogram model |
|
|
|
| 图 3 列线图模型的校准曲线 Fig 3 The calibration plot for the nomogram model |
|
|
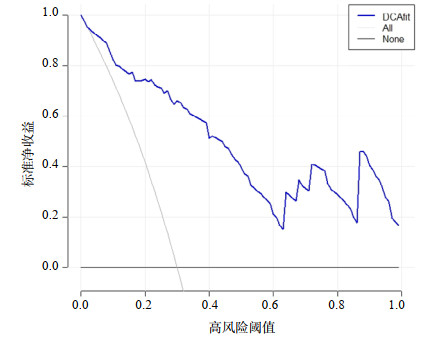
|
| 图 4 列线图模型的决策曲线分析 Fig 4 Decision curve analysis of nomogram model |
|
|
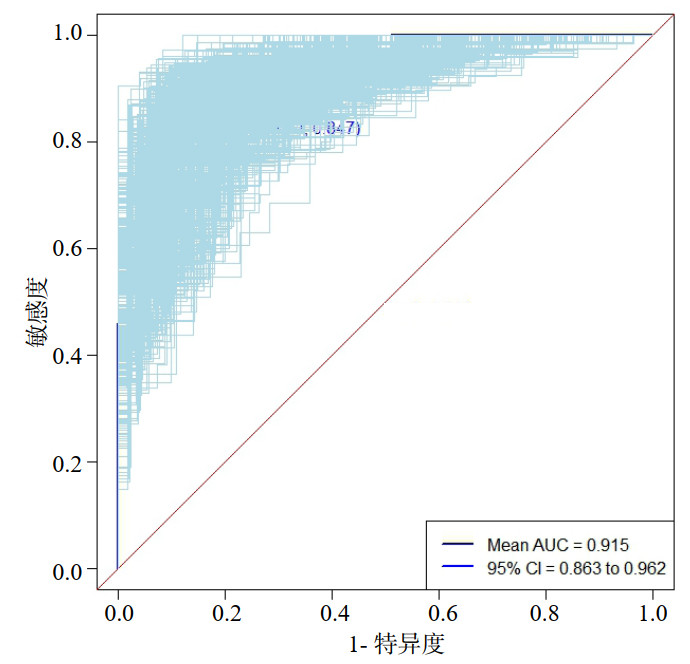
|
| 图 5 基于Bootstrap内部验证绘制ROC曲线 Fig 5 ROC curve based on internal Bootstrap validation |
|
|
将本研究开发的新模型与RESP评分及PRESERVE评分模型进行预测价值的比较(表 3、图 6),AUC分别为0.906、0.759和0.766,使用Delong检验对三条曲线进行比较,结果显示新模型与另外两种评分AUC相比,差异有统计学意义(Model vs. PRESERVE评分,P=0.001;Model vs. RESP评分,P=0.002),结果显示本研究模型评分判别能力优于上述两种预测评分工具。
| 指标 | AUC | 95%CI | 敏感度 | 特异度 |
| 列线图 | 0.906 | 0.855~0.957 | 0.847 | 0.843 |
| PRESERVE评分 | 0.759 | 0.676~0.841 | 0.569 | 0.882 |
| RESP评分 | 0.766 | 0.684~0.848 | 0.569 | 0.922 |
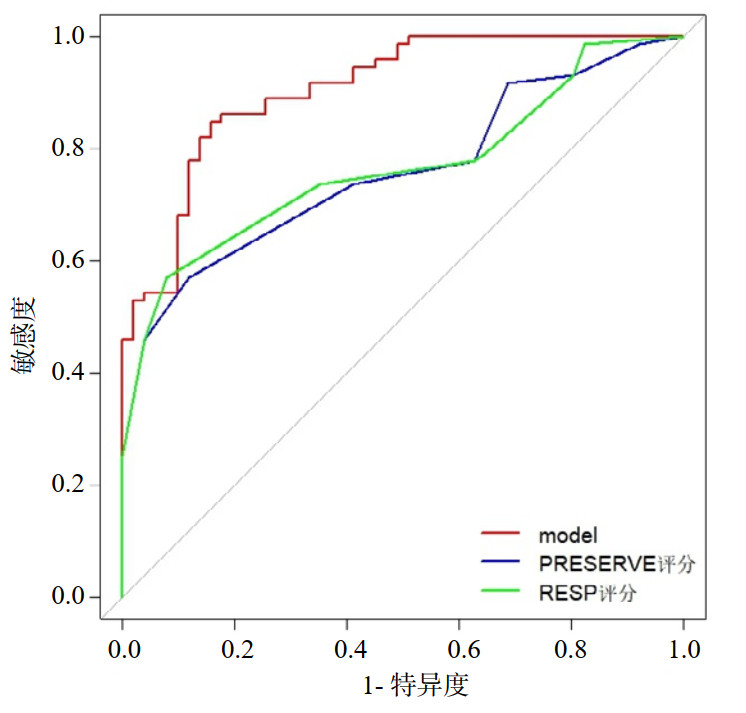
|
| 图 6 三种评分工具的ROC曲线比较 Fig 6 Comparison of ROC curves of the three scoring tools |
|
|
ARDS是一种严重的、弥漫性的肺实质炎性损伤,属于ICU内常见急危重症[1, 8]。ECMO作为重度ARDS患者的终极支持手段,其实际疗效及患者获益性往往难以准确评估。尽管已有若干预测模型辅助临床决策,但是由于地区、医疗条件差异以及ECMO技术管理仍在不断优化,现有的模型在实际应用中存在一定的局限性[23]。因此,为了进一步筛选能从ECMO治疗中获益的人群,通过分析患者临床资料及实验室指标,构建了一个以年龄、慢性免疫抑制状态、SOFA评分、ΔP、诊断重度ARDS到ECMO启动时间为预测因子的新型预测模型。
本研究中年龄是影响ECMO治疗重度ARDS患者预后的独立预测因子,与PRESERVE和RESP评分中年龄大于55或60岁死亡风险明显增加的结论一致[19-20]。高龄常伴随生理储备下降、免疫功能减弱及多器官功能减退,这些因素可能共同削弱患者对ECMO所致应激的代偿能力。多因素分析虽未显示合并症及ECMO并发症有差异,但是死亡组高龄和合并症较多的趋势仍提示应慎重评估老年患者行ECMO的适应证。因此,针对老年患者应全面评估其基础状态与预期获益后审慎决策,并加强并发症防治与长期生活质量监测。
本研究发现慢性免疫抑制状态是患者死亡风险增加的强预测因子。一项国际多中心研究证明,ARDS患者从诊断免疫缺陷到ICU入院时间间隔越短(< 30 d)其预后越好,此外接受ECMO治疗的合并慢性免疫缺陷的ARDS患者中,6个月总体存活率仅为30%[25],Schmidt等[19]的研究中也证实了慢性免疫抑制状态是反映经ECMO治疗的重度ARDS患者预后的有效指标。当重度ARDS患者合并慢性免疫抑制疾病时会引起炎症反应失调、继发感染风险增加等多方面不良影响,从而产生较差的预后。因此,临床治疗中应全面评估此类患者的整体状况,对于如何筛选可能获益者以及如何优化管理改善预后在未来仍需要进一步的研究。
ECMO前器官功能障碍的数量是重要的预测因素,SOFA评分被用作器官衰竭的替代指标。本研究显示生存组与死亡组患者SOFA评分均值分别为9、12分,差异具有统计学意义;与Schmidt等[20]关于ECMO前的SOFA评分 > 12分时患者病死率增加一致。濮尊国等[26]研究也发现APACHEⅡ评分联合SOFA评分对重度ARDS患者预后有重要的预测价值。因此可以根据ECMO前的SOFA评分评估建立器官支持是否合适的决策。然而受高剂量镇静剂影响,使用格拉斯哥昏迷量表评估的ECMO前意识状态在这些患者中往往难以精准评估,这使得SOFA评分的意识状态部分的可靠性值得怀疑[18],因此该预测因子的可靠性仍需更大样本和更长随访时间进一步验证。
ARDS患者的病死率在很大程度上受到呼吸机相关肺损伤的影响,接受ECMO治疗的重度ARDS患者采取小VT、低ΔP及合适的PEEP值等保护性通气策略有助于改善预后[6, 27-28]。过高的ΔP会加重肺损伤,相关研究证实了其对于预后的重要性[20]。本研究中,生存组启动ECMO前的VT与ΔP均值较死亡组低,与既往研究相符[20, 27],并最终证实ΔP是影响ECMO治疗重度ARDS患者重要因素。ECMO支持前过高的ΔP预示死亡风险增加,在评估ECMO期间,可积极采用镇痛深镇静与神经肌肉阻滞剂、俯卧位等辅助治疗减少肺损伤(降低ΔP)[2],如果ECMO前达到上机指征,但较高ΔP维持时间过长,则需要谨慎评估ECMO治疗的适用性与潜在获益。因此,对可能获益的患者应尽早启动ECMO治疗,减少长时间高ΔP所致继发肺损伤。
此外,本研究明确了诊断重度ARDS至ECMO启动时间是影响预后一项风险因素。相关研究较少,这一动态指标强化了早期干预的重要性。随着ECMO技术和安全性的提升,越来越多的证据证明早期ECMO有助于避免严重肺损伤和连续器官衰竭的恶化,可以改善患者预后[29]。EOLIA研究表明,早期ECMO可降低60 d病死率(35% vs. 46%)[16],在Brunet等[30]关于RESP和PRESERVE评分的外部验证中也证实早期ECMO对预后的有利作用。本研究进一步证实了延迟启动将显著增加死亡风险OR=1.24(95%CI: 1.07~1.43)。因此,对符合ECMO上机指征的重度ARDS患者,尽早启动ECMO治疗,以最大限度改善预后、降低死亡风险。
PRESERVE和RESP评分均指出ECMO启动前机械通气时间过长(> 7 d)是预后不良的独立危险因素,而缩短至48 h内可显著改善结局[19-20]。本研究中ECMO前机械通气时长单因素分析与生存结局相关(P < 0.001),但在多因素分析后最终被排除,这与相关研究存在偏差。这种不一致可能与变量间的共线性有关,需要更大的样本量进一步验证。值得注意的是,延迟启动ECMO可加剧肺损伤(如肺顺应性下降、纤维化加重),并诱发全身炎症反应以及多器官功能衰竭,从而恶化预后[27]。因此,对于应用最优的机械通气策略效果不佳的重度ARDS患者,应严格评估指征并及时启用ECMO,避免延误治疗。
本研究使用年龄、慢性免疫抑制状态、SOFA评分、ΔP、诊断重度ARDS到ECMO启动时间构建列线图模型,其AUC=0.906(95%CI: 0.855~0.957),高于现有多种预测工具(如RESP评分AUC=0.766,PRESERVE评分AUC=0.759),说明其具有更卓越的判别能力。该工具有助于识别可能从ECMO中获益更多的患者、进一步优化临床管理与决策,提高应用ECMO治疗的成本效益。此外,本研究纳入的重度ARDS患者,包含合并难治性脓毒性休克的患者,ECMO模式包含V-V ECMO、V-A ECMO、V-A-V ECMO式,ECMO不同模式的结局差异无统计学意义,可能与本研究纳入样本量较少有关,需要进一步开展大样本多中心的临床研究。
本研究具有一定的局限性:本研究为单中心回顾性研究,可能存在选择偏倚和信息偏倚;研究纳入的样本量相对偏少,结果存在一定的局限性;只进行了内部验证,模型缺乏外部验证或者多中心验证,在一定程度上影响了模型的适用范围;研究目标预测ECMO上机后28 d病死率,没有进行关于长期生存率、生活质量或永久性残疾的延长随访。
综上所述,本研究建立了ECMO治疗重度ARDS患者28 d死亡风险的预测模型。可以辅助临床评估病情、筛选ECMO治疗可能获益的人群,进一步优化临床管理,为临床决策提供了一个有用的工具。
利益冲突 所有作者均声明无利益冲突
作者贡献声明 常乐乐:研究设计、收集数据、统计学分析、论文撰写;李双凤、李晓燕:研究设计、论文修改;董睿、张瑞霞:收集数据、统计学分析;张根生:论文指导;高延秋:研究指导、统计学分析、论文修改
| [1] | ARDS Definition Task Force, Ranieri VM, Rubenfeld GD, et al. Acute respiratory distress syndrome: the Berlin Definition[J]. JAMA, 2012, 307(23): 2526-2533. DOI:10.1001/jama.2012.5669 |
| [2] | 中国研究型医院学会危重医学专委会, 宁波诺丁汉大学GRADE中心. 中国成人急性呼吸窘迫综合征(ARDS)诊断与非机械通气治疗指南(2023)[J]. 中华急诊医学杂志, 2023, 32(10): 1304-1318. DOI:10.3760/cma.j.issn.1671-0282.2023.10.004 |
| [3] | Matthay MA, Arabi Y, Arroliga AC, et al. A new global definition of acute respiratory distress syndrome[J]. Am J Respir Crit Care Med, 2024, 209(1): 37-47. DOI:10.1164/rccm.202303-0558ws |
| [4] | Bellani G, Laffey JG, Pham T, et al. Epidemiology, patterns of care, and mortality for patients with acute respiratory distress syndrome in intensive care units in 50 countries[J]. JAMA, 2016, 315(8): 788-800. DOI:10.1001/jama.2016.0291 |
| [5] | Huang X, Zhang RY, Fan GH, et al. Incidence and outcomes of acute respiratory distress syndrome in intensive care units of mainland China: a multicentre prospective longitudinal study[J]. Crit Care, 2020, 24(1): 515. DOI:10.1186/s13054-020-03112-0 |
| [6] | Qadir N, Sahetya S, Munshi L, et al. An update on management of adult patients with acute respiratory distress syndrome: an official American thoracic society clinical practice guideline[J]. Am J Respir Crit Care Med, 2024, 209(1): 24-36. DOI:10.1164/rccm.202311-2011ST |
| [7] | Gorman EA, O'Kane CM, McAuley DF. Acute respiratory distress syndrome in adults: diagnosis, outcomes, long-term sequelae, and management[J]. Lancet, 2022, 400(10358): 1157-1170. DOI:10.1016/S0140-6736(22)01439-8 |
| [8] | Meyer NJ, Gattinoni L, Calfee CS. Acute respiratory distress syndrome[J]. Lancet, 2021, 398(10300): 622-637. DOI:10.1016/S0140-6736(21)00439-6 |
| [9] | Chandel A, Fabyan KD, Mendelsohn S, et al. Prevalence and survival of prolonged venovenous extracorporeal membrane oxygenation for acute respiratory distress syndrome: an analysis of the extracorporeal life support organization registry[J]. Crit Care Med, 2024, 52(6): 869-877. DOI:10.1097/CCM.0000000000006200 |
| [10] | 高汉铭, 卢俊宇. 体外膜肺氧合患者预后预测模型的研究进展[J]. 中华危重病急救医学, 2024, 36(12): 1334-1339. DOI:10.3760/cma.j.cn121430-20240715-00598 |
| [11] | Hadaya J, Benharash P. Extracorporeal membrane oxygenation[J]. Jama, 2020, 323(24): 2536. DOI:10.1001/jama.2020.9148 |
| [12] | Hill JD, O'Brien TG, Murray JJ, et al. Prolonged extracorporeal oxygenation for acute post-traumatic respiratory failure (shock-lung syndrome). Use of the Bramson membrane lung[J]. N Engl J Med, 1972, 286(12): 629-634. DOI:10.1056/NEJM197203232861204 |
| [13] | Hajage D, Combes A, Guervilly C, et al. Extracorporeal membrane oxygenation for severe acute respiratory distress syndrome associated with COVID-19: an emulated target trial analysis[J]. Am J Respir Crit Care Med, 2022, 206(3): 281-294. DOI:10.1164/rccm.202111-2495OC |
| [14] | Combes A, Schmidt M, Hodgson CL, et al. Extracorporeal life support for adults with acute respiratory distress syndrome[J]. Intensive Care Med, 2020, 46(12): 2464-2476. DOI:10.1007/s00134-020-06290-1 |
| [15] | Peek GJ, Mugford M, Tiruvoipati R, et al. Efficacy and economic assessment of conventional ventilatory support versus extracorporeal membrane oxygenation for severe adult respiratory failure (CESAR): a multicentre randomised controlled trial[J]. Lancet, 2009, 374(9698): 1351-1363. DOI:10.1016/S0140-6736(09)61069-2 |
| [16] | Combes A, Hajage D, Capellier G, et al. Extracorporeal membrane oxygenation for severe acute respiratory distress syndrome[J]. N Engl J Med, 2018, 378(21): 1965-1975. DOI:10.1056/NEJMoa1800385 |
| [17] | Tonna JE, Abrams D, Brodie D, et al. Management of adult patients supported with venovenous extracorporeal membrane oxygenation (VV ECMO): guideline from the extracorporeal life support organization (ELSO)[J]. ASAIO J, 2021, 67(6): 601-610. DOI:10.1097/MAT.0000000000001432 |
| [18] | Rozencwajg S, Pilcher D, Combes A, et al. Outcomes and survival prediction models for severe adult acute respiratory distress syndrome treated with extracorporeal membrane oxygenation[J]. Crit Care, 2016, 20(1): 392. DOI:10.1186/s13054-016-1568-y |
| [19] | Schmidt M, Bailey M, Sheldrake J, et al. Predicting survival after extracorporeal membrane oxygenation for severe acute respiratory failure. the respiratory extracorporeal membrane oxygenation survival prediction (RESP) score[J]. Am J Respir Crit Care Med, 2014, 189(11): 1374-1382. DOI:10.1164/rccm.201311-2023oc |
| [20] | Schmidt M, Zogheib E, Rozé H, et al. The PRESERVE mortality risk score and analysis of long-term outcomes after extracorporeal membrane oxygenation for severe acute respiratory distress syndrome[J]. Intensive Care Med, 2013, 39(10): 1704-1713. DOI:10.1007/s00134-013-3037-2 |
| [21] | Pappalardo F, Pieri M, Greco T, et al. Predicting mortality risk in patients undergoing venovenous ECMO for ARDS due to influenza A (H1N1) pneumonia: the ECMOnet score[J]. Intensive Care Med, 2013, 39(2): 275-281. DOI:10.1007/s00134-012-2747-1 |
| [22] | Roch A, Hraiech S, Masson E, et al. Outcome of acute respiratory distress syndrome patients treated with extracorporeal membrane oxygenation and brought to a referral center[J]. Intensive Care Med, 2014, 40(1): 74-83. DOI:10.1007/s00134-013-3135-1 |
| [23] | 马娜, 陈旭峰, 季学丽, 等. 体外膜肺氧合治疗呼吸系统疾病患者预后预测模型研究进展[J]. 中华急诊医学杂志, 2022, 31(6): 835-839. DOI:10.3760/cma.j.issn.1671-0282.2022.06.026 |
| [24] | 周游, 郭翠苹, 刘玉兰, 等. 驱动压和跨肺压优化肺保护性通气的研究进展[J]. 临床急诊杂志, 2023, 24(7): 382-386. DOI:10.13201/j.issn.1009-5918.2023.07.010 |
| [25] | Schmidt M, Schellongowski P, Patroniti N, et al. Six-month outcome of immunocompromised patients with severe acute respiratory distress syndrome rescued by extracorporeal membrane oxygenation. an international multicenter retrospective study[J]. Am J Respir Crit Care Med, 2018, 197(10): 1297-1307. DOI:10.1164/rccm.201708-1761OC |
| [26] | 濮尊国, 周亚清, 刘爱明. 早期APACHEⅡ评分及SOFA评分对急性呼吸窘迫综合征患者预后评估的价值[J]. 交通医学, 2021, 35(5): 468-470. DOI:10.19767/j.cnki.32-1412.2021.05.010 |
| [27] | Abrams D, Schmidt M, Pham T, et al. Mechanical ventilation for acute respiratory distress syndrome during extracorporeal life support. research and practice[J]. Am J Respir Crit Care Med, 2020, 201(5): 514-525. DOI:10.1164/rccm.201907-1283CI |
| [28] | Boesing C, Rocco PRM, Luecke T, et al. Positive end-expiratory pressure management in patients with severe ARDS: implications of prone positioning and extracorporeal membrane oxygenation[J]. Crit Care, 2024, 28(1): 277. DOI:10.1186/s13054-024-05059-y |
| [29] | Combes A, Peek GJ, Hajage D, et al. ECMO for severe ARDS: systematic review and individual patient data meta-analysis[J]. Intensive Care Med, 2020, 46(11): 2048-2057. DOI:10.1007/s00134-020-06248-3 |
| [30] | Brunet J, Valette X, Buklas D, et al. Predicting survival after extracorporeal membrane oxygenation for ARDS: an external validation of RESP and PRESERVE scores[J]. Respir Care, 2017, 62(7): 912-919. DOI:10.4187/respcare.05098 |
 2026, Vol. 35
2026, Vol. 35