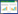脓毒症(sepsis)是重症监护病房常见的危重症之一,2016年,脓毒症3.0被定义为机体对感染反应失调引起的多器官功能障碍综合征[1],其特征是病死率高,疾病负担重。2017年一项流行病学研究对全球脓毒症负担进行了统计分析,报告称在全球范围内,有1?100万例脓毒症相关死亡病例,占全球死亡人数的19.7%,还有4?890万新病例[2]。虽然近年来脓毒症的治疗手段不断更新,但其发病率仍处于上升状态,并给全球医疗保健系统带来沉重的医疗负担[3]。因此,基于脓毒症发病机制进行预防和治疗仍非常重要。
铁死亡(ferroptosis)是2012年新发现的细胞死亡方式,它是依赖于铁的脂质过氧化性细胞死亡[4],过氧化物产生和抗氧化防御失衡已成为脓毒症器官损伤的关键因素。不同于凋亡等其他死亡方式,铁死亡有着特征性的形态学改变,即线粒体明显收缩,膜密度增加,线粒体棘突减少或消失[5]。此外,氨基酸代谢、铁代谢和脂质代谢共同构成铁死亡的三大主要机制通路。铁积累增加和脂质过氧化过度是铁死亡的核心触发因素,过量铁的螯合和谷胱甘肽过氧化物酶4(glutathione peroxidase 4, GPX4)依赖性和非依赖性抗氧化途径的激活是对抗铁死亡的抑制机制[6]。铁死亡直接加剧或促进了脓毒症诱导的脏器损伤,因此阻断铁死亡途径以减轻疾病的进展,已成为脓毒症研究和治疗的热点和重点。
缺氧诱导因子-1α(hypoxia inducible factor-1α, HIF-1α)是细胞适应缺氧环境的关键调节因子,具有调节代谢、氧输送、炎症、细胞存活等功能[7]。血红素加氧酶-1(heme oxygenase 1, HO-1)是HIF-1α的下游效应分子之一,在缺氧条件下受HIF-1α调控[8]。缺氧和氧化应激将脓毒症和铁死亡与HIF-1α/HO-1信号通路联系在一起。在脓毒症中,炎症反应增强会增加血管通透性,导致急性肺水肿,随后发展为急性呼吸窘迫综合征,此外,血管内皮损伤、细胞功能障碍和凝血系统的激活都将导致器官组织无效灌注,而灌注不足会加剧缺氧并损害细胞氧的利用[9]。在脓毒症引发的全身性炎症与多器官功能障碍中,HIF-1α/HO-1信号通路与铁死亡的交互作用,已成为揭示器官损伤与细胞命运调控的核心病理机制。因此,HIF-1α/HO-1信号通路或许是调节铁死亡治疗脓毒症相关脏器损伤的潜在靶点。
本综述旨在探讨HIF-1α/HO-1信号通路对铁死亡的双重调节功能,并讨论其对脓毒症的特异性作用和潜在分子机制,以期为脓毒症的治疗提供清晰的理论依据和实践指导。
2 铁死亡相关机制铁死亡主要是由细胞内活性氧(reactive oxygen species, ROS)的产生和降解之间的不平衡引起的,与多个信号分子和通路密切相关,见图 1。
|
| 注:ferroptosis为铁死亡;ROS为活性氧;Fe3+为三价铁;Fe2+为二价铁;TFR1为转铁蛋白受体1;STEAP3为前列腺六跨膜上皮抗原3;DMT1为二价金属转运蛋白1;endosome为内体;LIP为不稳定铁池;ferritin为铁蛋白;FPN为铁转运蛋白1;PUFA为多不饱和脂肪酸;ACSL4为酰基辅酶A合成酶长链家族成员4;PUFA-CoA为多不饱和脂肪酰基辅酶A;LPCAT3为溶血磷脂酰胆碱酰基转移酶3;PUFA-PE为多不饱和脂肪酸-磷脂酰乙醇胺;LOX为脂氧合酶;System Xc-为胱氨酸/谷氨酸逆向转运体;SLC7A11为溶质载体家族7成员11;SLC3A2为溶质载体家族3成员2;GSH为谷胱甘肽;GPX4为谷胱甘肽过氧化物酶4;FSP1为铁死亡抑制蛋白1;NADPH为烟酰胺腺嘌呤二核苷酸磷酸;CoQ为泛醌;CoQH2为二氢泛醌;GCH1为GTP环水解酶1;GTP为三磷酸鸟苷;BH4为四氢生物蝶呤;DHODH为二氢乳清酸脱氢酶;“→”代表促进,“?”代表抑制;本图使用Figdraw绘制 图 1 铁死亡的机制 |
|
|
铁是人体中参与血红蛋白合成和氧转运不可缺少的微量元素,机体内铁代谢过程主要包括摄取、储存、利用、排出等,铁稳态对维持机体各项功能十分重要[10]。循环转铁蛋白(transferrin, TF)募集细胞外三价铁(Ferric, Fe3+)并与细胞膜上转铁蛋白受体1(membrane protein transferrin receptor 1, TFR1)特异性结合,将Fe3+以内吞的形式摄取到胞内。金属还原酶即前列腺六跨膜上皮抗原3(six-transmembrane epithelial antigen of prostate 3, STEAP3)可以在内体中将Fe3+还原为二价铁(Ferrous, Fe2+),在这之后,内体顶端的二价金属转运蛋白1(divalent metal ion transporter-1, DMT1)释放Fe2+到胞浆,并储存在不稳定铁池(labileironpool, LIP)中,其余Fe2+以铁蛋白(ferritin)的形式储存或通过铁转运蛋白1(ferroportin-1, FPN)排出细胞。在铁过载的情况下,芬顿反应(Fenton reaction)被激活,产生羟基自由基并促进ROS的产生,从而导致脂质过氧化物的积累并破坏细胞中的氧化还原平衡,促进铁死亡[11]。因此,通过使用铁螯合剂等降低胞浆游离铁的含量或调控铁代谢过程中的相关靶基因,可调节细胞对铁死亡的敏感性从而影响铁死亡。
2.1.2 脂质代谢酰基辅酶A合成酶长链家族成员4(acyl-CoA synthetase long-chain family member 4, ACSL4)催化细胞膜上大量磷脂酯化的多不饱和脂肪酸(polyunsaturated fatty acids,PUFA)与辅酶A(coenzyme A, CoA)反应,转化为多不饱和脂肪酰基辅酶A(polyunsaturated fatty acyl-coenzyme A, PUFA-CoA)。紧接着,磷脂酰胆碱和PUFA-CoA之间发生酯化反应,使得多不饱和脂肪酸-磷脂酰乙醇胺(polyunsaturated fatty acid-phosphatidylethanolamine, PUFA-PE)生成,这一步是溶血磷脂酰胆碱酰基转移酶3(lysophosphatidyl choline acyltransferase 3, LPCAT3)催化完成的。最后,PUFA-PE在脂氧合酶(lipoxygenase, LOX)作用下发生脂质过氧化并诱导铁死亡[12]。因此,ACSL4和LPCAT3在促进铁死亡中发挥重要作用,而用抑制剂降低这两个酶活性或敲除基因下调表达都可减少过氧化脂质的产生,从而抑制铁死亡[13]。
2.2 抑制铁死亡的通路 2.2.1 氨基酸代谢胱氨酸/谷氨酸逆向转运体(System Xc-)是由亚基溶质载体家族7成员11(solute carrier family 7 member 11,SLC7A11,也称为xCT)和溶质载体家族3成员2(solute carrier family 3 member 2, SLC3A2)构成的异二聚体。该转运体是机体抗氧化系统的重要组成部分,胱氨酸和谷氨酸通过它以1∶1的比例跨细胞膜交换,胱氨酸被转运到细胞中后立即被还原为半胱氨酸,并以后者为原料生成一种重要的自由基清除剂和抗氧化剂谷胱甘肽(glutathione, GSH)[14]。GPX4是一种硒蛋白,通过利用GSH将细胞代谢产生的脂质过氧化物还原为脂肪醇,从而消除脂质过氧化物,这一过程可以防止ROS积累,因此,GPX4是铁死亡的典型核心靶标[14]。据报道,失活GPX4可诱导脂质过氧化积累和铁死亡[15]。此外,抑制系统Xc-可导致细胞摄取胱氨酸减少和合成GSH减少,从而导致ROS积累和铁死亡[16]。
2.2.2 FSP1/CoQH2通路铁死亡抑制蛋白1(ferroptosis suppressor protein 1, FSP1)是最近发现除GPX4之外的另一个主要的铁死亡调节因子,它能够清除细胞内的活性氧和脂质自由基,抑制铁死亡的发生。FSP1是位于脂滴和质膜中的烟酰胺腺嘌呤二核苷酸磷酸(nicotinamide adenine dinucleotide phosphate, NADPH)依赖性氧化还原酶,通过其N-末端肉豆蔻酰化序列锚定在脂质双分子层中,氧化NADPH,同时将泛醌(也称辅酶Q10,coenzyme Q10,CoQ10)还原为二氢泛醌(reduced coenzyme Q10, CoQH2),CoQH2可以捕获自由基,防止脂质过氧化,从而抑制铁死亡[17]。FSP1/CoQH2通路揭示了细胞死亡背后的复杂分子机制,为保护细胞免受铁死亡侵害提供了新思路。
2.2.3 GCH1/BH4通路四氢生物蝶呤(tetrahydrobiopterin, BH4)可以捕获并清除脂质过氧化自由基,GTP环水解酶1(GTP cyclohydrolase 1, GCH1)是介导BH4生物合成途径中的限速酶。GCH1/BH4通路是参与各种关键细胞代谢过程的胞内酶通路,可以调节氧化还原反应,从而保护细胞免受氧化应激的影响[18]。已经揭示,GCH1通过产生BH4作为自由基清除抗氧化剂以及通过GCH1介导合成产生的CoQH2来保护细胞免受铁死亡[19]。这一发现为治疗铁死亡提供了新的视角和方法,但是其复杂的调控机制仍需进一步研究。
2.2.4 DHODH/CoQH2通路二氢乳清酸脱氢酶(dihydroorotate dehydrogenase, DHODH)在多种代谢通路中发挥重要作用[20]。DHODH通路可以通过多种机制保护细胞免受氧化应激和线粒体损伤,包括下调ROS水平、维持线粒体膜电位和抑制细胞凋亡[21]。DHODH可在线粒体内膜中将泛醌CoQ还原为CoQH2,另外,线粒体GPX4和DHODH相互补偿以控制线粒体脂质过氧化的水平,即DHODH作用的前提是线粒体GPX4低表达,当GPX4失活时,DHODH活性和表达急剧增加,导致更多CoQH2产生以中和脂质过氧化[22]。因此DHODH/CoQH2通路可能是拮抗铁死亡进而治疗疾病的新型干预靶点。
3 铁死亡与脓毒症多器官功能障碍是脓毒症进展最严重的结局,与较差的预后高度相关,早期发现和干预对改善脓毒症临床结果至关重要[23],而在脓毒症病理生理过程中,铁死亡是导致炎症反应和器官损伤的关键机制之一。据报道,在用脂多糖(lipopolysaccharide, LPS)处理的脓毒症小鼠模型中发现了铁死亡相关标志物的失调,例如GSH耗竭、GPX4表达下调和铁过载等,而铁死亡加剧了脓毒症小鼠心肌细胞受损和心功能不全,但是这种失调可以被铁死亡抑制剂铁抑素-1(ferrostatin-1, Fer-1)逆转[24]。LPS诱导的脓毒症小鼠的研究证实了铁死亡参与脓毒症诱导的脏器损伤。
许多研究报道了可以通过抑制铁死亡从而减轻脓毒症脏器损伤的方法。金丝桃苷[25]和环丙酚[26]通过(Nuclear respiratory factor 2, Nrf2)介导的信号通路抑制铁死亡,对脓毒症诱导的急性肺损伤表现出治疗作用。体内体外实验证明,右美托咪定可通过激活Nrf2/SLC7A11/FSP1/CoQ10通路减轻铁死亡并减轻脓毒症相关急性肾损伤[27]。维生素D通过抑制组蛋白诱导铁死亡,减轻脓毒症相关神经变性,从而对脓毒症发挥神经保护作用[28]。
除了上述这些治疗外,已经确定了用于治疗脓毒症相关脏器损伤的铁死亡相关靶点。Xie等[29]发现过表达Polo样激酶2(Polo-like kinase 2, PLK2)可以抑制铁死亡,减轻在脓毒症小鼠的心肌细胞炎症和细胞损伤,而PLK2沉默则结果相反。此外,PRD1-BF1-RIZ1同源结构域蛋白16(PRD1-BF1-RIZ1 homeodomain protein 16, PRDM16)在LPS诱导的脓毒症小鼠中通过Nrf2/GPX4轴抑制铁死亡,以防止脓毒症诱导的多器官损伤[30]。综上,这些发现凸显了铁死亡在脓毒症发病机制及疾病进展的重要性,而选择性和精细地靶向铁死亡可能是预防和治疗脓毒症相关脏器损伤的新策略。
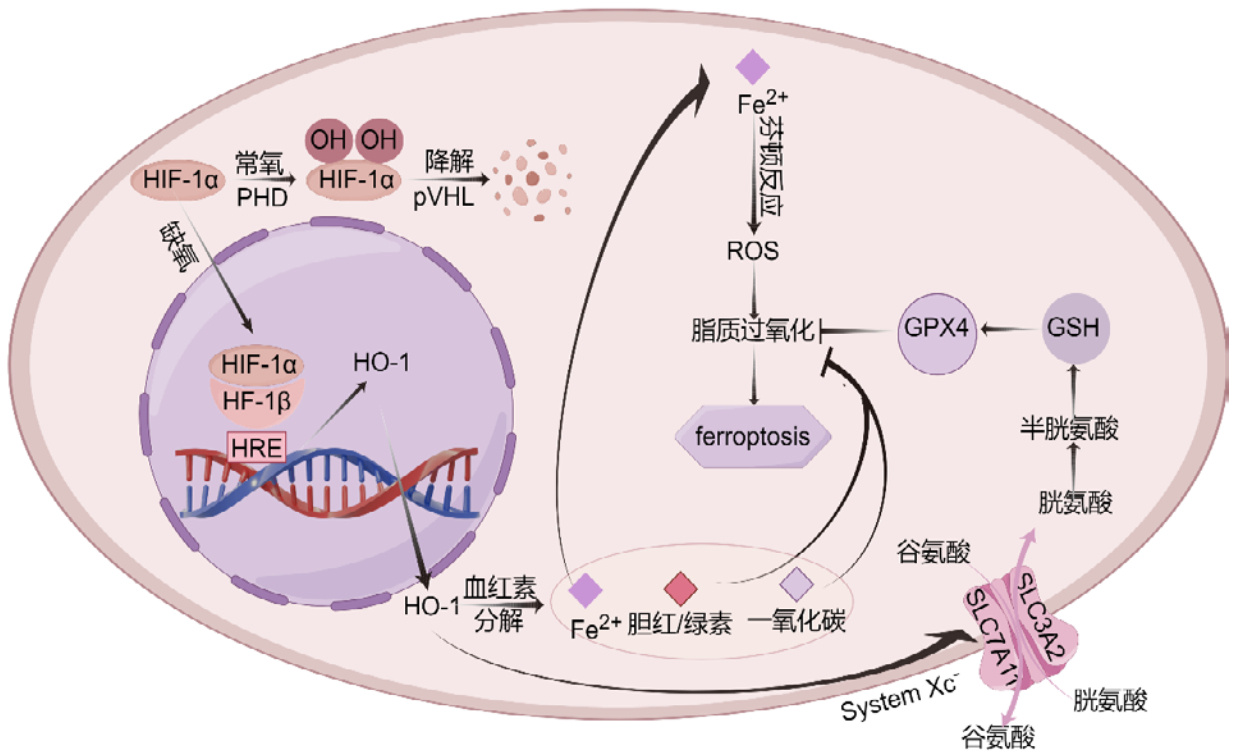
4 HIF-1α/HO-1信号通路对脓毒症和铁死亡的影响 4.1 HIF-1α/HO-1信号通路缺氧诱导因子-1(hypoxia inducible factor-1, HIF-1)是一种异二聚体,由HIF-1α和缺氧诱导因子-1β(hypoxia inducible factor-1β, HIF-1β)亚基组成,其中HIF-1α是调节缺氧信号的主要组分,在缺氧细胞中被诱导表达,HIF-1α作为氧稳态的主要调节因子,而HIF-1β是组成型表达的[31]。HIF-1α蛋白包含一个氧依赖性降解结构域,在常氧条件下,氧依赖性脯氨酸羟化酶家族(prolyl hydroxylase, PHD)识别结构域上两个脯氨酸位点并将其羟基化[32],以抑制转录共激活因子的募集,而后肿瘤抑制蛋白(von Hippel–Lindau protein, pVHL)识别并结合HIF-1α羟基化位点,迅速降解HIF-1α[33]。但是在缺氧条件下,PHD的酶活性受到抑制,阻止了HIF-1α降解[34],导致HIF-1α在细胞质内积累并易位到细胞核,随后,HIF-1α与HIF-1β结合,形成能够启动转录的活性HIF复合体,该复合体在细胞核内与缺氧反应基因(如血管内皮生长因子、促红细胞生成素等)的缺氧反应元件(hypoxia response elements, HRE)结合,以募集其他转录因子,触发一系列缺氧耐受适应性反应[35]。
HO-1是HIF-1α的下游靶基因之一。HO-1是由人类血红素加氧酶1(heme oxygenase 1, HMOX1)基因编码的应激诱导亚型,在脾脏和肝脏中表达最为丰富[36]。HMOX1基因跨度约为13 148 bp,包含5个外显子和4个内含子,以及3个调节区,调节区域包含许多转录因子结合位点(如HIF-1α),这些调节元件促进HMOX-1基因对各种氧化和炎症刺激的转录反应[37]。HO-1分解血红素,可以在炎症微环境中通过其产物胆绿素、亚铁离子、一氧化碳和胆绿素/胆红素等发挥抗氧化活性,从而表现出抗炎、抗凋亡、抗焦亡作用[38]。
HIF-1α/HO-1信号通路参与各种细胞过程的调节,这对于细胞适应不断变化的环境和协调炎症反应至关重要。
4.2 HIF-1α/HO-1信号通路与铁死亡HIF-1α作为调节人体缺氧反应的关键因素,在生理条件下表达量极低或检测不到。当细胞暴露于缺血和缺氧状态时,HIF-1α会应激性增加,调节细胞能量代谢、细胞凋亡和其他过程,以适应缺氧环境并减轻缺血和缺氧损伤[39]。现有证据表明,HIF-1α在不同疾病或细胞中介导铁死亡的方式不一样。见图 2。
|
| 注:HIF-1α为缺氧诱导因子-1α;HIF-1β为缺氧诱导因子-1β;PHD为脯氨酸羟化酶;pVHL为肿瘤抑制蛋白;HO-1为血红素加氧酶-1;HRE为缺氧反应元件。“→”代表促进,“?”代表抑制;本图使用Figdraw绘制 图 2 HIF-1α/HO-1信号通路调控铁死亡的机制 |
|
|
在缺血性再灌注损伤中,HIF-1α/HO-1通路作为细胞应对缺氧和氧化应激的防御性机制,更多的发挥保护性作用。在缺血缺氧状态下,细胞会因再灌注而发生进一步的病理变化,主要包括Ca2+过载、线粒体能量代谢紊乱、氧化应激、炎症和铁死亡等。HIF-1α能增强FPN1的转录活性降低铁积累、诱导SLC7A11和GPX4的表达并激活Nrf2/HO-1通路,减少炎症和脂质过氧化水平,抑制铁死亡,从而改善脑神经元[40]和心肌[41]缺血性再灌注损伤。而在一些神经系统疾病中也发现了该通路的保护作用,比如周围神经损伤[42]、创伤后脑损伤[43]和急性一氧化碳中毒迟发性脑损伤[44]。另外,研究发现抑制HIF-1α将激活肝星状细胞铁死亡以缓解缺氧性肝纤维化[45],而激活HIF-1α可以通过抑制铁死亡减轻大鼠慢性肾病相关肌肉萎缩[46]。在炎症性疾病中,HIF-1α作为铁死亡的负向调节因子,能通过抑制铁死亡从而减轻肠上皮细胞的炎症反应并调节肠道细胞屏障功能以溃疡性结肠炎[47]。龙胆酸[48]和壳聚糖寡糖[49]都具有抗炎的作用,它们可以上调HO-1的表达并抑制铁死亡,减轻氧化应激和炎症,从而改善疾病转归。在感染性疾病中也有人发现提高HO-1的表达,能够显著降低炎症反应和铁死亡,并阻止LPS诱导的急性肺损伤[50]和急性重症胰腺炎大鼠心脏组织损伤[51]。
HIF-1α/HO-1信号通路对抑制铁死亡的作用重要且不可忽视,一方面该通路可以上调抑制铁死亡分子的表达(SLC7A11、GPX4等),一方面HO-1的分解产物胆红素/胆绿素和CO作为内源性抗氧化剂,能够直接中断脂质过氧化,最终表现出抑制铁死亡的作用。但其最终效应取决于细胞的代谢状态、应激强度和通路激活的持续时间。
4.2.2 促进铁死亡在大多数情况下,尤其在肿瘤生物学研究中,HIF-1α/HO-1信号通路的激活是铁死亡的催化剂和放大器。研究发现,黄芪-姜黄合剂能激活HIF-1α,导致HO-1过表达,加速游离铁释放和ROS积累,抑制GPX4活性,引发铁依赖性脂质过氧化,从而介导抗肝细胞癌作用[52]。紫草素同样通过类似的机制促进铁死亡以有效抑制骨肉瘤的生长[53]。长期的高血糖会诱发缺氧微环境,导致HIF-1α的过度表达,刺激下游靶标HO-1表达,导致脂质过氧化、ROS、亚铁积累、MDA和铁死亡标志物增加,而GSH/GSSG水平降低,抑制该通路或许能改善胰岛素抵抗[54]和糖尿病相关病变[55]。在癫痫中,缺血和缺氧是常见的病理和生理改变,可导致神经元的神经变性和坏死细胞死亡,癫痫小鼠中的体内实验证明,海马组织中HO-1的上调导致铁过载,同时存在铁蛋白和转铁蛋白水平升高,进一步增强铁的积累,加剧Fenton反应,积累ROS,并最终导致铁死亡的发生[56],而下调HO-1的表达可能通过抑制铁死亡从而减轻癫痫[57]。在同种疾病中,HIF-1α/HO-1信号通路对铁死亡的作用不一定相同,一项实验发现在重症胰腺炎小鼠中HIF-1α表达水平升高, 当应用HIF-1α的抑制剂PX478后,胰腺和相关肺肾损伤减轻,并且HIF-1α、ACSL4的表达水平下调,而GPX4、SLC7A11表达水平升高,铁死亡逆转[58]。
血红素铁是体内铁的主要来源,约占全身铁的67%[59],因此,血红素代谢的增强,自然会导致体内铁水平的变化,一方面游离铁增加会加剧氧化应激,另一方面HO-1还可以调节铁代谢相关蛋白,进一步破坏铁稳态。尽管HIF-1α的表达在缺氧条件下至关重要,但它可能对缺血后的血管反应、炎症过程和氧化应激水平产生不利影响。
4.2.3 结论HIF-1α/HO-1信号通路对铁死亡作用的“双刃剑”特性并非随机发生,在一定条件下可从“抑制铁死亡”向“促进铁死亡”转换。当疾病刺激程度较轻时,该通路直接或间接产生的抗氧化和抗炎效应是直接、快速且作用广泛的;而在疾病晚期、极端且持续的应激下,HO-1被过度诱导,其产生的铁多到压倒细胞的所有抗氧化储备和铁储存能力,导致天平向“促进铁死亡”方向倾斜。所以,在一些严重病理条件下,HIF-1α/HO-1信号通路的过度激活可能会加剧氧化应激导致铁死亡,反而促进疾病的发生发展。造成这种差异的原因可能与细胞特异性基因调控、信号通路差异以及复杂的细胞微环境有关。需要进一步的研究来充分了解其复杂的调控机制,对该通路的多功能性和复杂性的理解为开发针对该途径治疗相关疾病的治疗策略提供了宝贵的见解。
4.3 HIF-1α/HO-1信号通路对脓毒症铁死亡的作用HIF-1α响应感染而升高的潜在机制多样,组织炎症诱导的局部组织缺氧、不同的细菌成分、免疫细胞感染后释放的细胞因子,均可导致HIF-1α表达增加[9]。
HIF-1α/HO-1信号通路作为内源性抗氧化系统,而且HO-1还被认为是炎症细胞和组织损伤的关键介质,其在脓毒症的发生和进展中起着关键作用。研究发现,抑制HIF-1α降解[60]或诱导HIF-1α合成[61]能改善脓毒症诱导的肺损伤,而上调HO-1表达也能起类似作用[62]。有报道称HIF-1α/HO-1信号通路的激活通过增加高尔基体结构相关蛋白的表达、抑制高尔基体应激以及减少炎症和氧化应激来防止肺损伤,在缓解脓毒症诱导的急性肺损伤中起关键作用[63]。此外,在LPS诱导的脓毒症小鼠中,右美托咪定预处理改善线粒体功能进而缓解肺损伤,这一过程同时伴有HIF-1α和HO-1表达的上调[64]。这些结果提示HIF-1α/HO-1通路参与改善脓毒症相关脏器损伤。
更为直接的证据显示,铁死亡可能是HIF-1α/HO-1通路与脓毒症之间调控的桥梁。Shi等[7]证明可以通过增加HIF-1α/HO-1通路的表达来抑制铁死亡介导的脂质过氧化,并发挥抗炎作用,对脓毒症相关脏器损伤具有积极意义。此外,丹参酮IIA[65]、褪黑素[66]、异丙酚[67]和川陈皮素[68]通过激活HO-1通路可以减轻铁死亡,发挥其抗氧化作用,从而改善脓毒症诱导的脑损伤和抑郁样行为以及急性肝损伤。调节HIF-1α/HO-1信号通路从而拮抗铁死亡最终达到治疗脓毒症相关脏器损伤目的的想法得到一定验证,但这之中的具体机制仍需进一步探究。
综上所述,生理情况下,HIF-1α和HO-1的表达较低,当组织细胞受到脓毒症诱导的缺氧和炎症刺激而处于应激状态时,HIF-1α/HO-1信号通路被激活,进而上调SLC7A11、GPX4的表达,增加半胱氨酸和GSH的含量,减少ROS和过氧化脂质的生成,从而抑制铁死亡的发生,最终改善脓毒症相关脏器损伤。
有趣的是,也有研究持相反的结论,认为过度炎症会诱发缺氧微环境,导致HIF-1α及其下游标靶HO-1过表达,致使全身炎症和多器官衰竭的进展。据报道,在LPS诱导的巨噬细胞和脓毒症小鼠肺中,鞘氨醇激酶1(sphingosine kinase 1, SphK1)/鞘氨醇-1-磷酸受体3(sphingosine-1-phosphate receptor 3, S1PR3)轴上调,并级联激活HIF-1α等促糖酵解信号,而靶向该轴可通过协调巨噬细胞极化和抑制糖酵解,从而减轻脓毒症过度炎症和多器官衰竭[69]。类似的,HIF-1α的激活通过促进铁死亡而显著加重脓毒症相关心肌结构和功能障碍[70]和急性肾损伤[71]。然而,抑制HIF-1α的表达将会减少相关炎症因子的产生、抑制氧化应激并维持线粒体稳态,从而减轻脓毒症小鼠的肺损伤[72]和脑内皮细胞损伤[73]。体外和体内实验发现,人参皂甙Rb1显著降低HO-1表达,抑制脓毒症小鼠肺、肠道组织和THP-1细胞的铁死亡,并改善肺和肠道损伤,这可能与HO-1过表达导致的铁过载有关[74]。据前所述,HO-1分解血红素产生Fe2+,所以当受到脓毒症缺氧刺激时,HIF-1α调控HO-1大量生成,而过多的HO-1使得Fe2+蓄积,并通过芬顿反应产生大量ROS,导致细胞氧化还原系统失衡,诱发铁死亡,加重脓毒症相关脏器损伤。
HIF-1α/HO-1信号通路如何在铁死亡中发挥作用从而影响脓毒症的机制目前尚不清楚,但不可否认该通路作为脓毒症和铁死亡的潜在治疗靶点具有相当的可行性,因此,未来的研究可以探索脓毒症铁死亡中HIF-1α/HO-1信号通路的分子机制和通路,有可能揭示脓毒症早期诊断和治疗的新靶点和策略。
5 总结与展望本综述深入探讨了HIF-1α/HO-1信号通路与铁死亡和脓毒症之间复杂双向的调控关系,这意味着该通路作为脓毒症治疗靶点的巨大潜力与挑战。未来的研究不应简单的激活或抑制该通路,而应着眼于“精准调控”,从而改善脓毒症器官功能和预后。实现这一目标需从不同层面研究:首先,深入挖掘HIF-1α/HO-1信号通路调节铁死亡影响脓毒症的分子机制以及决定其双向调节的关键分子开关;其次,开发能选择性抑制其促损伤(如阻断铁释放)而保留其保护功能的新型干预手段;最后,聚焦临床转化,寻找提示该通路驱动铁死亡的临床标志物以指导更精准的治疗。这些研究方案旨在将“双刃剑”转化为“精准武器”,最终为脓毒症患者带来突破性的治疗新策略。
利益冲突 所有作者声明无利益冲突
| [1] | Singer M, Deutschman CS, Seymour CW, et al. The third international consensus definitions for sepsis and septic shock (sepsis-3)[J]. JAMA, 2016, 315(8): 801-810. DOI:10.1001/jama.2016.0287 |
| [2] | Rudd KE, Johnson SC, Agesa KM, et al. Global, regional, and national sepsis incidence and mortality, 1990-2017: analysis for the Global Burden of Disease Study[J]. Lancet, 2020, 395(10219): 200-211. DOI:10.1016/S0140-6736(19)32989-7 |
| [3] | Rello J, Valenzuela-Sánchez F, Ruiz-Rodriguez M, et al. Sepsis: a review of advances in management[J]. Adv Ther, 2017, 34(11): 2393-2411. DOI:10.1007/s12325-017-0622-8 |
| [4] | Dixon SJ, Lemberg KM, Lamprecht MR, et al. Ferroptosis: an iron-dependent form of nonapoptotic cell death[J]. Cell, 2012, 149(5): 1060-1072. DOI:10.1016/j.cell.2012.03.042 |
| [5] | Xie Y, Hou W, Song X, et al. Ferroptosis: process and function[J]. Cell Death Differ, 2016, 23(3): 369-379. DOI:10.1038/cdd.2015.158 |
| [6] | Chen FQ, Kang R, Tang DL, et al. Ferroptosis: principles and significance in health and disease[J]. J Hematol Oncol, 2024, 17(1): 41. DOI:10.1186/s13045-024-01564-3 |
| [7] | Shi JY, Song S, Wang YJ, et al. Esketamine alleviates ferroptosis-mediated acute lung injury by modulating the HIF-1α/HO-1 pathway[J]. Int Immunopharmacol, 2024, 142(Pt A): 113065. DOI:10.1016/j.intimp.2024.113065 |
| [8] | Chillappagari S, Venkatesan S, Garapati V, et al. Impaired TLR4 and HIF expression in cystic fibrosis bronchial epithelial cells downregulates hemeoxygenase-1 and alters iron homeostasis in vitro[J]. Am J Physiol Lung Cell Mol Physiol, 2014, 307(10): L791-L799. DOI:10.1152/ajplung.00167.2014 |
| [9] | Ruan H, Zhang Q, Zhang YP, et al. Unraveling the role of HIF-1α in sepsis: from pathophysiology to potential therapeutics-a narrative review[J]. Crit Care, 2024, 28(1): 100. DOI:10.1186/s13054-024-04885-4 |
| [10] | Silva B, Faustino P. An overview of molecular basis of iron metabolism regulation and the associated pathologies[J]. Biochim Biophys Acta, 2015, 1852(7): 1347-1359. DOI:10.1016/j.bbadis.2015.03.011 |
| [11] | Zheng JS, Conrad M. The metabolic underpinnings of ferroptosis[J]. Cell Metab, 2020, 32(6): 920-937. DOI:10.1016/j.cmet.2020.10.011 |
| [12] | Zeng F, Lan YP, Wang N, et al. Ferroptosis: a new therapeutic target for bladder cancer[J]. Front Pharmacol, 2022, 13: 1043283. DOI:10.3389/fphar.2022.1043283 |
| [13] | Wu XG, Li Y, Zhang SC, et al. Ferroptosis as a novel therapeutic target for cardiovascular disease[J]. Theranostics, 2021, 11(7): 3052-3059. DOI:10.7150/thno.54113 |
| [14] | Zhou XP, Wang H, Yan B, et al. Ferroptosis in cardiovascular diseases and ferroptosis-related intervention approaches[J]. Cardiovasc Drugs Ther, 2024. DOI:10.1007/s10557-024-07642-5 |
| [15] | Ursini F, Maiorino M. Lipid peroxidation and ferroptosis: the role of GSH and GPx4[J]. Free Radic Biol Med, 2020, 152: 175-185. DOI:10.1016/j.freeradbiomed.2020.02.027 |
| [16] | Su ZY, Liu YQ, Wang L, et al. Regulation of SLC7A11 as an unconventional checkpoint in tumorigenesis through ferroptosis[J]. Genes Dis, 2024, 12(1): 101254. DOI:10.1016/j.gendis.2024.101254 |
| [17] | Roh JL. Targeting ferroptosis suppressor protein 1 in cancer therapy: Implications and perspectives, with emphasis on head and neck cancer[J]. Crit Rev Oncol Hematol, 2024, 202: 104440. DOI:10.1016/j.critrevonc.2024.104440 |
| [18] | Liu YE, Lu SP, Wu LL, et al. The diversified role of mitochondria in ferroptosis in cancer[J]. Cell Death Dis, 2023, 14(8): 519. DOI:10.1038/s41419-023-06045-y |
| [19] | Kraft VAN, Bezjian CT, Pfeiffer S, et al. GTP cyclohydrolase 1/tetrahydrobiopterin counteract ferroptosis through lipid remodeling[J]. ACS Cent Sci, 2020, 6(1): 41-53. DOI:10.1021/acscentsci.9b01063 |
| [20] | Ge AQ, He Q, Zhao D, et al. Mechanism of ferroptosis in breast cancer and research progress of natural compounds regulating ferroptosis[J]. J Cell Mol Med, 2024, 28(1): e18044. DOI:10.1111/jcmm.18044 |
| [21] | Long ZY, Luo YF, Yu M, et al. Targeting ferroptosis: a new therapeutic opportunity for kidney diseases[J]. Front Immunol, 2024, 15: 1435139. DOI:10.3389/fimmu.2024.1435139 |
| [22] | Mao C, Liu XG, Zhang YL, et al. DHODH-mediated ferroptosis defence is a targetable vulnerability in cancer[J]. Nature, 2021, 593(7860): 586-590. DOI:10.1038/s41586-021-03539-7 |
| [23] | Ji JL, Wang Q, Wang K, et al. Development and validation of a Nomogram for the prediction of patients with sepsis-induced multiple organ dysfunction syndrome[J]. Pak J Med Sci, 2025, 41(4): 1036-1046. DOI:10.12669/pjms.41.4.10421 |
| [24] | Hu K, Jiang P, Hu JX, et al. Dapagliflozin attenuates LPS-induced myocardial injury by reducing ferroptosis[J]. J Bioenerg Biomembr, 2024, 56(4): 361-371. DOI:10.1007/s10863-024-10020-3 |
| [25] | Chen KD, Lu SP, Shi K, et al. Hyperoside attenuates sepsis-induced acute lung injury by Nrf2 activation and ferroptosis inhibition[J]. Int Immunopharmacol, 2025, 145: 113734. DOI:10.1016/j.intimp.2024.113734 |
| [26] | Zhao Q, Kong C, Wu XY, et al. Ciprofol prevents ferroptosis in LPS induced acute lung injury by activating the Nrf2 signaling pathway[J]. BMC Pulm Med, 2024, 24(1): 591. DOI:10.1186/s12890-024-03415-w |
| [27] | Huang J, Zhao Y, Luo X, et al. Dexmedetomidine inhibits ferroptosis and attenuates sepsis-induced acute kidney injury via activating the Nrf2/SLC7A11/FSP1/CoQ10 pathway[J]. Redox Rep, 2024, 29(1): 2430929. DOI:10.1080/13510002.2024.2430929 |
| [28] | Sun YB, Pu ZN, Zhao HL, et al. Vitamin D can mitigate sepsis-associated neurodegeneration by inhibiting exogenous histone-induced pyroptosis and ferroptosis: Implications for brain protection and cognitive preservation[J]. Brain Behav Immun, 2025, 124: 40-54. DOI:10.1016/j.bbi.2024.11.019 |
| [29] | Xie B, Li FF, Yan J, et al. Polo-like kinase 2 ameliorates lipopolysaccharide-induced cardiac injury by blocking cardiomyocyte ferroptosis[J]. Am J Hypertens, 2025, 38(11): 938-946. DOI:10.1093/ajh/hpaf001 |
| [30] | Zheng Q, Xing JH, Li XZ, et al. PRDM16 suppresses ferroptosis to protect against sepsis-associated acute kidney injury by targeting the NRF2/GPX4 axis[J]. Redox Biol, 2024, 78: 103417. DOI:10.1016/j.redox.2024.103417 |
| [31] | Semenza GL. HIF-1 and mechanisms of hypoxia sensing[J]. Curr Opin Cell Biol, 2001, 13(2): 167-171. DOI:10.1016/s0955-0674(00)00194-0 |
| [32] | Luo Z, Tian MF, Yang G, et al. Hypoxia signaling in human health and diseases: implications and prospects for therapeutics[J]. Signal Transduct Target Ther, 2022, 7(1): 218. DOI:10.1038/s41392-022-01080-1 |
| [33] | Maxwell PH, Wiesener MS, Chang GW, et al. The tumour suppressor protein VHL targets hypoxia-inducible factors for oxygen-dependent proteolysis[J]. Nature, 1999, 399(6733): 271-275. DOI:10.1038/20459 |
| [34] | Salceda S, Caro J. Hypoxia-inducible factor 1alpha (HIF-1alpha) protein is rapidly degraded by the ubiquitin-proteasome system under normoxic conditions. Its stabilization by hypoxia depends on redox-induced change[J]. J Biol Chem, 1997, 272(36): 22642-22647. DOI:10.1074/jbc.272.36.22642 |
| [35] | Ke F, Xu MZ, Ma L, et al. Progress and perspectives on BMP9-ID1 activation of HIF-1α and VEGFA to promote angiogenesis in hepatic alveolar echinococcosis[J]. Front Oncol, 2024, 14: 1480683. DOI:10.3389/fonc.2024.1480683 |
| [36] | Consonni FM, Incerti M, Bertolotti M, et al. Heme catabolism and heme oxygenase-1-expressing myeloid cells in pathophysiology[J]. Front Immunol, 2024, 15: 1433113. DOI:10.3389/fimmu.2024.1433113 |
| [37] | Li N, Hao LY, Li SH, et al. The NRF-2/HO-1 signaling pathway: a promising therapeutic target for metabolic dysfunction-associated steatotic liver disease[J]. J Inflamm Res, 2024, 17: 8061-8083. DOI:10.2147/JIR.S490418 |
| [38] | Lv WW, Hu SC, Yang F, et al. Heme oxygenase-1: potential therapeutic targets for periodontitis[J]. PeerJ, 2024, 12: e18237. DOI:10.7717/peerj.18237 |
| [39] | Tao XR, Zhao MN, Gao K, et al. Wedelolactone ameliorates ischemic stroke by inhibiting oxidative damage and ferroptosis via HIF-1α/SLC7A11/GPX4 signaling[J]. Drug Des Devel Ther, 2025, 19: 6849-6868. DOI:10.2147/DDDT.S528831 |
| [40] | Yao HQ, Tian JN, Cheng S, et al. The mechanism of hypoxia-inducible factor-1α enhancing the transcriptional activity of transferrin ferroportin 1 and regulating the Nrf2/HO-1 pathway in ferroptosis after cerebral ischemic injury[J]. Neuroscience, 2024, 559: 26-38. DOI:10.1016/j.neuroscience.2024.08.025 |
| [41] | Ge CW, Peng YQ, Li JC, et al. Hydroxysafflor yellow A alleviates acute myocardial ischemia/reperfusion injury in mice by inhibiting ferroptosis via the activation of the HIF-1α/SLC7A11/GPX4 signaling pathway[J]. Nutrients, 2023, 15(15): 3411. DOI:10.3390/nu15153411 |
| [42] | An S, Shi JF, Huang J, et al. HIF-1α induced by hypoxia promotes peripheral nerve injury recovery through regulating ferroptosis in DRG neuron[J]. Mol Neurobiol, 2024, 61(9): 6300-6311. DOI:10.1007/s12035-024-03964-5 |
| [43] | Qian WQ, Chen XJ, Gu LQ, et al. Herbacetin alleviates ferroptosis via Hif-1α/SLC7A11/GPX4 axis in traumatic brain injury[J]. Free Radic Biol Med, 2025, 238: 179-193. DOI:10.1016/j.freeradbiomed.2025.06.030 |
| [44] | Liu ZL, Sun LY, Gao N, et al. Reciprocal regulation of GPNMB/HIF-1α for Inhibition of neuronal ferroptosis in delayed encephalopathy after acute carbon monoxide poisoning[J]. Acta Neuropathol Commun, 2025, 13(1): 154. DOI:10.1186/s40478-025-02069-x |
| [45] | Liu MX, Cai YT, Wang RJ, et al. Aggregation-induced emission CN-based nanoparticles to alleviate hypoxic liver fibrosis via triggering HSC ferroptosis and enhancing photodynamic therapy[J]. ACS Appl Mater Interfaces, 2024, 16(26): 33021-33037. DOI:10.1021/acsami.4c04361 |
| [46] | Ju LL, Diao JX, Zhang JX, et al. Shenshuai Yingyang Jiaonang ameliorates chronic kidney disease-associated muscle atrophy in rats by inhibiting ferroptosis mediated by the HIF-1α/SLC7A11 pathway[J]. Heliyon, 2024, 10(8): e29093. DOI:10.1016/j.heliyon.2024.e29093 |
| [47] | Hu WT, Cai YL, Cai DX, et al. HIF-1α alleviates ferroptosis in ulcerative colitis by regulation of GPX4[J]. Cell Death Dis, 2025, 16(1): 542. DOI:10.1038/s41419-025-07883-8 |
| [48] | Abdelmawgood IA, Kotb MA, Hassan HS, et al. Gentisic acid attenuates ovalbumin-induced airway inflammation, oxidative stress, and ferroptosis through the modulation of Nrf2/HO-1 and NF-κB signaling pathways[J]. Int Immunopharmacol, 2025, 146: 113764. DOI:10.1016/j.intimp.2024.113764 |
| [49] | Liu MJ, Li ZL, Li J, et al. Chitosan oligosaccharide alleviates DON-induced liver injury via suppressing ferroptosis in mice[J]. Ecotoxicol Environ Saf, 2025, 290: 117530. DOI:10.1016/j.ecoenv.2024.117530 |
| [50] | Ding R, Zhong SY, Deng LY, et al. Fucoxanthin prevents lipopolysaccharide-induced acute lung injury by inhibiting ferroptosis via Nrf2/STAT3 and glutathione pathways[J]. Am J Chin Med, 2024, 52(6): 1773-1794. DOI:10.1142/S0192415X24500691 |
| [51] | Cui QR, Wang W, Shi JH, et al. Glycyrrhizin ameliorates cardiac injury in rats with severe acute pancreatitis by inhibiting ferroptosis via the Keap1/Nrf2/HO-1 pathway[J]. Dig Dis Sci, 2024, 69(7): 2477-2487. DOI:10.1007/s10620-024-08398-6 |
| [52] | Wang C, Shi CH, Bai HY, et al. Astragali Radix - Curcumae rhizoma herb pair suppresses hepatocellular carcinoma through EGFR/AKT/mTOR pathway and induces lipid peroxidation-related ferroptosis via HIF-1α/HO-1/GPX4 axis[J]. J Ethnopharmacol, 2025, 348: 119912. DOI:10.1016/j.jep.2025.119912 |
| [53] | Lu CC, Zhang Z, Fan YH, et al. Shikonin induces ferroptosis in osteosarcomas through the mitochondrial ROS-regulated HIF-1α/HO-1 axis[J]. Phytomedicine, 2024, 135: 156139. DOI:10.1016/j.phymed.2024.156139 |
| [54] | Meng JY, Hu CL, Qian Z, et al. Isoquercitrin inhibits ferroptosis and ameliorates insulin resistance: Evidence from network pharmacology and in vitro studies[J]. Biochem Biophys Res Commun, 2025, 781: 152500. DOI:10.1016/j.bbrc.2025.152500 |
| [55] | Yang ZX, Yan YY, Wang LS, et al. PCBP1 modulates cellular iron homeostasis via targeting HIF-1α/HO-1 pathway and alleviates high-glucose-induced ferroptosis in HRMECs[J]. Exp Eye Res, 2025, 259: 110576. DOI:10.1016/j.exer.2025.110576 |
| [56] | Liang Z, Zheng ZS, Guo Q, et al. The role of HIF-1α/HO-1 pathway in hippocampal neuronal ferroptosis in epilepsy[J]. iScience, 2023, 26(11): 108098. DOI:10.1016/j.isci.2023.108098 |
| [57] | Hou BH, Li L, Wang F, et al. Effect of the DPP4 inhibitor sitagliptin on ferroptosis in epilepsy[J]. J Integr Neurosci, 2025, 24(8): 39469. DOI:10.31083/JIN39469 |
| [58] | Liu YN, Cui HN, Mei CP, et al. Sirtuin4 alleviates severe acute pancreatitis by regulating HIF-1α/HO-1 mediated ferroptosis[J]. Cell Death Dis, 2023, 14(10): 694. DOI:10.1038/s41419-023-06216-x |
| [59] | Lawen A, Lane DJR. Mammalian iron homeostasis in health and disease: uptake, storage, transport, and molecular mechanisms of action[J]. Antioxid Redox Signal, 2013, 18(18): 2473-2507. DOI:10.1089/ars.2011.4271 |
| [60] | Han F, Wu GF, Han SC, et al. Hypoxia-inducible factor prolyl-hydroxylase inhibitor roxadustat (FG-4592) alleviates sepsis-induced acute lung injury[J]. Respir Physiol Neurobiol, 2020, 281: 103506. DOI:10.1016/j.resp.2020.103506 |
| [61] | Evans CE, Peng Y, Zhu MM, et al. Rabeprazole promotes vascular repair and resolution of sepsis-induced inflammatory lung injury through HIF-1α[J]. Cells, 2022, 11(9): 1425. DOI:10.3390/cells11091425 |
| [62] | Liu XL, Su SS, Xia LJ, et al. Lysophosphatidylcholine 14: 0 alleviates lipopolysaccharide-induced acute lung injury via protecting alveolar epithelial barrier by activation of Nrf2/HO-1 pathway[J]. J Inflamm Res, 2024, 17: 10533-10546. DOI:10.2147/JIR.S495227 |
| [63] | Li XY, Yu JB, Gong LR, et al. Heme oxygenase-1(HO-1) regulates Golgi stress and attenuates endotoxin-induced acute lung injury through hypoxia inducible factor-1α (HIF-1α)/HO-1 signaling pathway[J]. Free Radic Biol Med, 2021, 165: 243-253. DOI:10.1016/j.freeradbiomed.2021.01.028 |
| [64] | Shi J, Yu TX, Song K, et al. Dexmedetomidine ameliorates endotoxin-induced acute lung injury in vivo and in vitro by preserving mitochondrial dynamic equilibrium through the HIF-1a/HO-1 signaling pathway[J]. Redox Biol, 2021, 41: 101954. DOI:10.1016/j.redox.2021.101954 |
| [65] | Tian WC, Song P, Zang JH, et al. Tanshinone IIA, a component of Salvia miltiorrhiza Bunge, attenuated sepsis-induced liver injury via the SIRT1/Sestrin2/HO-1 signaling pathway[J]. J Ethnopharmacol, 2025, 340: 119169. DOI:10.1016/j.jep.2024.119169 |
| [66] | Su WJ, Deng J, Yang LN, et al. Melatonin alleviates LPS-induced depression-like behavior in mice by inhibiting ferroptosis by regulating RNA methylation-mediated SIRT6/Nrf2/HO-1 pathway[J]. Eur J Nutr, 2024, 63(8): 3133-3148. DOI:10.1007/s00394-024-03495-8 |
| [67] | Zhou Y, Yang YL, Yi L, et al. Propofol mitigates sepsis-induced brain injury by inhibiting ferroptosis via activation of the Nrf2/HO-1axis[J]. Neurochem Res, 2024, 49(8): 2131-2147. DOI:10.1007/s11064-024-04163-3 |
| [68] | Huang W, Chen H, He Q, et al. Nobiletin protects against ferroptosis to alleviate sepsis-associated acute liver injury by modulating the gut microbiota[J]. Food Funct, 2023, 14(16): 7692-7704. DOI:10.1039/d3fo01684f |
| [69] | Wang D, Bi XW, Zhao L, et al. Targeting SphK1/S1PR3 axis ameliorates sepsis-induced multiple organ injury via orchestration of macrophage polarization and glycolysis[J]. Biochim Biophys Acta Mol Cell Res, 2025, 1872(1): 119877. DOI:10.1016/j.bbamcr.2024.119877 |
| [70] | Wang XY, Li JZ, Zhang YX, et al. HIF1A/BNIP3 pathway affects ferroptosis in sepsis-induced cardiomyopathy through binding to BCL-2[J]. Redox Rep, 2025, 30(1): 2544412. DOI:10.1080/13510002.2025.2544412 |
| [71] | Yang LJ, Xiao JJ, Zhang L, et al. Methionine sulfoxide reductase A deficiency aggravated ferroptosis in LPS-induced acute kidney injury by inhibiting the AMPK/NRF2 axis and activating the CaMKII/HIF-1α pathway[J]. Free Radic Biol Med, 2025, 234: 248-263. DOI:10.1016/j.freeradbiomed.2025.04.040 |
| [72] | Zheng LZ, Hu XY. Effects of shikonin on HIF-1α/VEGF signaling pathway in mice with acute lung injury caused by sepsis[J]. J Vis Exp, 2025(220). DOI:10.3791/68085 |
| [73] | 李蓉, 吴越, 朱文选, 等. 基于网络药理学和实验验证白藜芦醇通过HIF-1α通路减轻脓毒症脑病血管内皮损伤[J]. 中国中药杂志, 2025, 50(4): 1087-1097. DOI:10.19540/j.cnki.cjcmm.20241012.301 |
| [74] | He SS, Ye HR, Wang Q, et al. Ginsenoside Rb1 targets to HO-1 to improve sepsis by inhibiting ferroptosis[J]. Free Radic Biol Med, 2025, 226: 13-28. DOI:10.1016/j.freeradbiomed.2024.11.007 |
 2025, Vol. 34
2025, Vol. 34