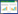电阻抗成像技术(electrical impedance tomography, EIT)作为一种基于组织电导率变化的非侵入性医学成像技术,近年来在临床实践及科学研究中备受关注[1]。其通过检测体表电信号变化重构内部阻抗分布,可实时反映肺部通气与血流动力学状态,具有无创、动态监测及高敏感度的优势,为肺部疾病(如肺炎、气胸、肺栓塞等)的早期识别提供了新视角[2]。
在急危重症领域,EIT的价值尤为突出。其可对急性呼吸窘迫综合征(acute respiratory distress syndrome, ARDS)、肺栓塞、气胸等急危重症患者开展床旁实时监测,为个体化呼吸支持策略的制定提供指导,同时实现对患者循环功能的动态评估。本文系统综述EIT在急危重症中的循证应用进展,探讨其在优化临床决策中的潜力,并针对技术瓶颈与转化路径提出展望。
2 EIT技术原理1978年,Henderson等[3]首次采用初代EIT技术对局部通气进行无创测量,然而受限于过低的分辨率与不足的机械精密度,当时EIT未能在临床中大规模推广应用。经过研究人员的不断研发改进,EIT的临床应用不断丰富,更多的中英文专家共识、指南被提出,以指导临床[1, 4]。
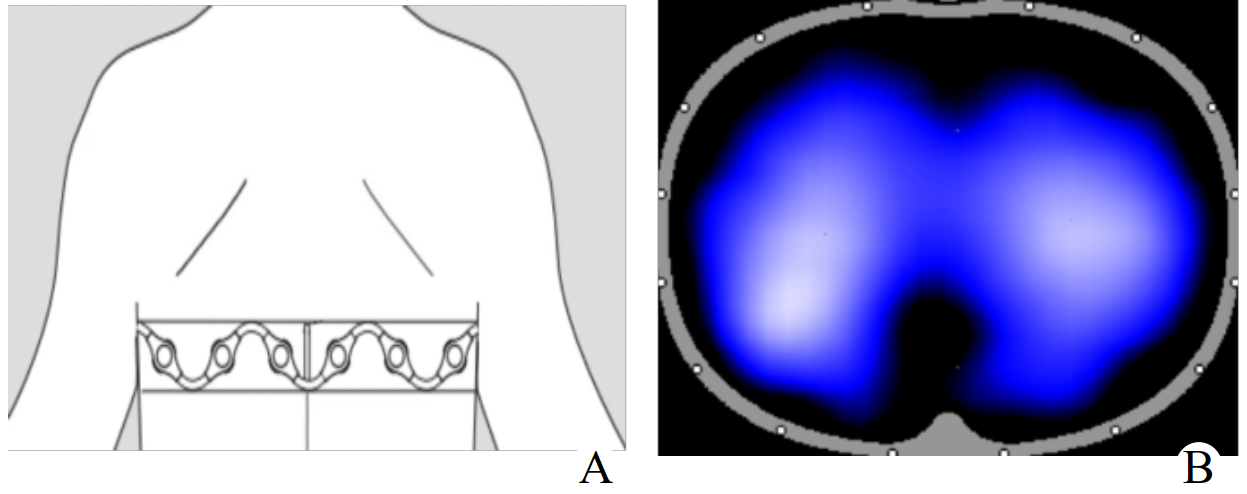
EIT是一种基于电抗变化的非侵入性医学成像技术,其核心原理基于生物组织的导电性差异,推断组织的电导率分布,从而反映组织的生理状态[5]。通过环绕胸部的多电极阵列(通常为16或32电极)施加安全交变电流,检测体表电压变化,利用逆问题算法重建胸腔横断面的阻抗分布图像。肺组织因通气与血流变化引起局部电导率改变,EIT可据此动态捕捉通气不均、肺泡塌陷或过度膨胀等病理状态[6],研究人员可依据获取的数据,借助相关数学算法进行图像重建,进而提供肺部功能与结构的相关信息;经过进一步数据处理,还能实时观察患者肺部的通气及血流情况[7-8]。
|
| 注:A为将一条含16/32个电极的电极缚带缠缚到胸壁上,将另一端的参比电极连接到身体中央部位,电极持续注入安全电流;B为按照欧姆定律,根据已知电流和测得的电压判定通电电极和测量电极对之间的生物电阻抗 图 1 EIT测量技术原理 |
|
|
ARDS以弥漫性肺泡损伤和严重低氧血症为特征,近年来EIT在ARDS的临床应用中广为关注。首先,EIT在评估肺通气量方面具有显著优势。通过测量肺部电导率的变化,EIT可以实时监测肺部的通气量,从而帮助医生快速判断患者的通气状态。例如,Bachmann等[9]研究指出,EIT能够准确反映肺部通气量的变化,且其敏感度和特异性均优于传统的肺部影像学方法。此外,EIT还能提供肺部组织的电抗分布信息,有助于识别肺部病变区域,为ARDS精准治疗提供依据。其次,EIT引导的正压通气下PEEP滴定是一个重要的研究方向。PEEP是治疗ARDS的核心技术之一,但调节PEEP存在个体化需求,传统方法依赖于经验判断,容易导致肺损伤或通气不足。Songsangvorn等[10]的研究通过结合EIT,提出了一种基于EIT调节PEEP的方法,该方法通过实时监测肺部通气量和肺顺应性,减少了机械功的消耗,相比High-PEEP/FiO2的治疗方法降低了肺损伤的发生率。Jimenez等[11]进一步验证了这种方法在随机交叉对照试验中的有效性,表明EIT-guided PEEP能够显著改善ARDS患者的肺功能。在ARDS患者中,肺部组织的弹性(即肺顺应性)通常降低,这可能导致通气模式的改变,他们通过EIT监测了ARDS患者在不同通气模式下的肺顺应性变化[12],发现EIT能够有效反映肺部功能状态的变化,为通气模式的选择提供了依据。Yuan等[13]近期研究纳入了大量老年中重度ADRS患者,通过联合灌注成像实验,他们发现与Low-PEEP/FiO2相比,EIT-guided PEEP可降低V/Q不匹配;与High-PEEP/FiO2相比,EIT-guided PEEP可改善呼吸力学且不恶化V/Q匹配,其可最大化生理获益。Li等[14]进一步研究了EIT作为评估工具,能够实时监测肺通气量、肺顺应性和肺泡形态的变化,为评估通气效果提供了非侵入式的实时反馈,为优化通气管理策略提供了科学依据。同时,有研究提出将盐水灌注成像与肺通气监测相结合以评估ARDS患者预后的思路,结果显示肺灌注与肺通气不匹配百分比可作为独立预测因子,用于预测患者的病死率及预后情况[15]。
EIT利用其在可视化通气方面的优势,通过评估肺通气量、正压通气下PEEP调定、监测肺顺应性以及评估患者预后,在临床中充分指导ARDS的个体化治疗,为ARDS患者的通气管理提供了新的思路和工具。
3.2 慢性阻塞性肺疾病(chronic obstructive pulmonary disease, COPD)COPD的治疗中,最为常见及重要的莫过于无创通气。EIT在PEEP调定中的应用为COPD患者的通气管理提供了新的思路。通过结合EIT,医生可以更精准地优化PEEP压力,以减少机械功的消耗并降低肺损伤的发生率。Liu、既往研究针对COPD合并ARDS患者,提出了基于EIT的PEEP调节方法[16-17]。该方法通过实时监测肺通气量与肺顺应性,实现了PEEP压力调节的优化,使患者在通气比率、机械功率、心脏指数及氧输送方面均获得显著改善,且对血流动力学的不良影响较小。研究发现,EIT能够实时监测COPD患者肺部的通气不均匀性,并揭示了其随时间的变化特征。通气不均匀性可能与肺部组织功能状态、通气模式以及肺部病理生理变化密切相关,为优化通气管理提供了新的科学依据。
EIT通过其在实时成像的显著优势,可以实时获取到肺部结构和功能,帮助医生对COPD进行诊治,指导个体化的治疗策略,从药物治疗、到物理治疗以及肺功能的康复等[18]。
3.3 气胸气胸作为急诊及ICU中常见疾病,EIT的应用为其诊断及治疗提供了更多的帮助。EIT可以快速反映肺部通气状态的变化,从而实现对气胸的诊断以及实时监测。Costa等[19]通过动物实验,深入探讨了EIT在气胸实时检测中的应用价值。研究表明,该技术可检测出体积小至20 mL的气胸,且敏感度达100%,同时还能在一定程度上判断气胸的位置。EIT能够快速检测气胸并区分正常肺部通气状态,为气胸的辅助诊断提供了一定依据。Preis等[20]对一项动物实验中的死亡病例开展了回顾性分析,在分析过程中意外发现,EIT可在临床操作场景下动态监测肺通气情况,进而实现对气胸的及时诊断与实时监测。同时,在进行肺复张的患者中,自发性气胸经常因操作不当而出现,Gao等[21]、Morais等[22]针对EIT如何监测行肺复张患者自发性气胸的发生展开研究,同时探讨了EIT对机械通气状态下自发性气胸动态变化的监测能力。研究提示,EIT可用于监测机械通气患者自发性气胸的发生、发展过程及治疗效果,进而为进一步挖掘其在气胸管理中的潜在应用价值提供依据。此外,EIT还被用于气胸的早期诊断。在机械通气的ICU环境中,床边应用的EIT能够快速评估患者的肺功能状态,从而早期发现气胸的可能性。通过回顾ICU环境下的EIT应用,发现EIT在机械通气患者中能够早期发现气胸,为气胸的干预提供及时反馈,操作的简便性及患者的舒适度得到了提升[23]。然而该技术目前仍存在者明显局限性,EIT不能测量绝对阻抗,而只能测量阻抗的变化[19],因此在监测气胸时需要标准的基线,或在已知气胸出现的情况下,动态监测气胸变化情况。
3.4 肺血栓栓塞症(Pulmonary thromboembolism, PTE)肺栓塞是指由各种内源性及外源性栓子阻塞肺动脉或其分支,进而引发循环系统障碍的一组疾病或临床综合征的总称。其中,PTE最为常见,它是仅次于心肌梗死与脑卒中的常见急性心肺血管疾病,也是心血管疾病中最常见的死亡原因之一[24]。EIT在肺通气有着显著的优势,同时EIT联合高渗盐水可完成肺灌注的显像,通过结合肺灌注和肺通气的数据,EIT可以计算并评估患者的通气/血流比,进而辅助诊断肺栓塞[8, 25]。近些年发表了较多的此类病案报道,其中有1例癌症术后患者经EIT监测发现肺部病变部位存在充盈缺损后,进一步接受CTPA检查得以确诊,随后接受了溶栓治疗。研究发现,患者肺栓塞病变部位的电阻值显著升高,这一结果CTPA成像结果高度一致[26]。Kuk和Wright[27],Prins等[28]团队均采用EIT技术,对肺栓塞患者治疗前后的情况进行了详细对比分析,结果显示,患者治疗后的灌注分布均得到显著改善。同时,EIT可以在监测肺栓塞的同时,在多种病理生理条件下动态监测肺动脉压的变化,结果显示与经胸超声心动图测算的肺动脉压力具有很好的一致性,验证了EIT监测肺动脉压的可行性[29]。
EIT作为肺栓塞的诊断工具是一项很有前途的新技术,其无创、实时、动态监测的优点对急危重症患者尤其有意义,但其临床应用还处于起步阶段,仍需要大样本的临床研究进一步验证[30]。此外,目前采用EIT诊断肺栓塞的主流方法仍是高渗盐水灌注成像,但在该方法的具体操作与结果分析过程中,仍缺乏规范、统一的操作及分析标准。
3.5 气道梗阻在急诊室,气道梗阻是经常遇到的情况,而严重的气道梗阻引起的窒息会严重危及患者的生命。在这种情况下,需要紧急维持气道通畅,否则出现严重的后遗症,甚至患者可能会死亡。在这种情况下,通常会进行气管插管、环甲膜切开术或气管切开术以防止窒息[31]。然而,这些技术存在潜在的医院感染以及效果评估困难的问题。传统评估方法如计算机断层扫描(CT)和X射线虽然能提供形态学信息,但在动态评估气道通畅性和功能性变化方面存在局限性。近期研究相关研究中[32],研究人员首次将EIT技术应用于肺移植患者的气道梗阻评估,通过实时监测气道内流体的电阻特性,并结合肺功能测试与CT成像结果,综合评估气道梗阻的严重程度。结果显示,EIT评估的气道通畅性与CT成像结果高度一致,且能够更准确地反映气道内流体的动力学特性。特别是在评估气道吻合瘢痕的狭窄程度时,EIT提供了更详细的功能性信息,为临床医生提供了更全面的评估依据。此外,EIT还能够动态监测气道通畅性在不同呼吸阶段的变化,帮助医生了解病情的变化趋势。
EIT的可视化、动态化以及无创化为气道梗阻,尤其是上气道梗阻患者动态评估提供了新的方案,虽然目前国内外关于EIT在气道梗阻中的相关研究较少,但EIT监测气道梗阻的诊断及治疗,其应用必将日益广泛而深入。
3.6 急诊围手术期呼吸管理围手术期呼吸管理是手术麻醉管理领域中备受关注的内容,对于需接受急诊手术的危重症患者而言,如何快速、全面、实时地监测与管理其肺部情况,显得尤为重要[33]。EIT技术能够应用于术前、麻醉诱导、术中以及术后等阶段,提供连续、无创的肺通气功能评估。对于慢性阻塞性肺疾病和哮喘患者可以在术前应用EIT,从而动态评估呼气流速受限的严重程度和支气管扩张剂的疗效,来指导围术期的用药情况[4]。对于术中的患者,EIT可以实时监测手术患者在术中肺通气的状态,从而优化通气模式,同时进行最优PEEP选择,有助于避免肺塌陷、改善氧合、降低驱动压,甚至在一定程度可以降低术后肺部并发症发生率[34-35]。
EIT技术在围手术期呼吸管理中的研究已经日益成熟,对于急诊的危重症手术患者,EIT的使用无疑提供了一种更为方便、快捷的诊断治疗方法,有望成为急诊危重症手术患者围手术期呼吸管理中的标准工具之一。
3.7 新生儿及婴儿肺功能的实时评估新生儿及婴儿的呼吸系统与成年人不尽相同,更易出现呼吸窘迫和最终衰竭,因此对急危重症新生儿和婴儿呼吸功能进行实时、全面评估有助于优化肺扩张,同时避免过度充气,预防该过程中支气管肺发育不良和脑室内出血等并发症[36]。Frerichs和Becher[37]确定了一些EIT在新生儿及婴儿中的监测指标,包括总体不均匀性指数、腹背侧通气、安静空间(低潮变化区)和呼气末肺阻抗的变化,从而实现足够和安全的通气来最大限度地减少呼吸机相关肺损伤。然而在部分研究中,由于长时间使用EIT绑带,部分患儿出现了轻微皮肤发红的不良反应。尽管研究得出结论:采用电极带可安全、可靠地获取新生儿EIT测量结果[38-39],但对于其可能引发的不良反应,仍需采取措施避免。如何使用更加安全、适用的EIT束带,是今后EIT在新生儿研究方向的必然趋势。
4 展望本文简要介绍了EIT在急危重症中目前的应用方向,EIT在癫痫、脑水肿、脑血管病和其他脑部甚至腹部疾病可能还有更多的前景[40],因临床应用的不完善,本文暂不赘述,相信在不久的将来,EIT可以应用于临床的方方面面。
EIT作为一种无创、实时、动态、无辐射的床旁成像和监测工具。越来越多地被证明在临床上有着极其广泛的用途。虽然利用EIT进行诊疗已相对成熟,但由于EIT高度依赖于组织的电导率而产生了低分辨率、低信噪比和数据处理纷繁复杂等一系列问题,因此在一些病因的详细诊断上仍然缺乏特异性。目前,EIT的设备成本、单次使用价格仍较高,在一些程度上这些因素限制了该技术在基层医院的推广和广泛应用[41]。此外,国际上EIT仍缺乏统一的图像解读标准与操作规范,同时缺少大规模临床研究来完成多中心RCT验证临床效益[4, 42]。
展望未来,国内发布了多项旨在促进标准化的国家指导方针及实践方法,为未来的规范化应用打下了坚实基础。3D-EIT已在临床上首次得以运用,通过提供更多通气信息,可能有助于临床的个体化治疗[43]。目前火热的人工智能,在未来可能足以克服当前测量误差、处理伪影数据、提高图像重建质量[44]。希望随着器械硬件的更新和算法的优化,以及大规模临床试验、人工智能的结合,EIT可以成为急危重症呼吸与循环管理的核心工具,推动精准医疗的深化实践。
利益冲突 所有作者声明无利益冲突
| [1] | Frerichs I, Amato MBP, van Kaam AH, et al. Chest electrical impedance tomography examination, data analysis, terminology, clinical use and recommendations: consensus statement of the TRanslational EIT developmeNt stuDy group[J]. Thorax, 2017, 72(1): 83-93. DOI:10.1136/thoraxjnl-2016-208357 |
| [2] | Gong B, Krueger-Ziolek S, Moeller K, et al. Electrical impedance tomography: functional lung imaging on its way to clinical practice?[J]. Expert Rev Respir Med, 2015, 9(6): 721-737. DOI:10.1586/17476348.2015.1103650 |
| [3] | Henderson RP, Webster JG. An impedance camera for spatially specific measurements of the Thorax[J]. IEEE Trans Biomed Eng, 1978, 25(3): 250-254. DOI:10.1109/TBME.1978.326329 |
| [4] | 中国卫生信息与健康医疗大数据学会重症医学分会标准委员会, 北京肿瘤学会重症医学专业委员会, 中国重症肺电阻抗工作组. 肺电阻抗成像技术在重症呼吸管理中的临床应用中国专家共识[J]. 中华医学杂志, 2022, 102(9): 615-628. DOI:10.3760/cma.j.cn112137-20211201-02680 |
| [5] | Mueller JL. Evaluation of pulmonary structure and function in patients with cystic fibrosis from electrical impedance tomography data[J]. Methods Mol Biol, 2022, 2393: 733-750. DOI:10.1007/978-1-0716-1803-5_39 |
| [6] | 杨佳诺, 刘春丽. 电阻抗成像在呼吸疾病中的应用进展[J/OL]. 中国医学前沿杂志(电子版), 2024, 16(7): 126. DOI: 10.12037/YXQY.2024.07-17. |
| [7] | Xu MR, He HW, Long Y. Lung perfusion assessment by bedside electrical impedance tomography in critically ill patients[J]. Front Physiol, 2021, 12: 748724. DOI:10.3389/fphys.2021.748724 |
| [8] | Bluth T, Kiss T, Kircher M, et al. Measurement of relative lung perfusion with electrical impedance and positron emission tomography: an experimental comparative study in pigs[J]. Br J Anaesth, 2019, 123(2): 246-254. DOI:10.1016/j.bja.2019.04.056 |
| [9] | Bachmann MC, Morais C, Bugedo G, et al. Electrical impedance tomography in acute respiratory distress syndrome[J]. Crit Care, 2018, 22(1): 263. DOI:10.1186/s13054-018-2195-6 |
| [10] | Songsangvorn N, Xu YH, Lu C, et al. Electrical impedance tomography-guided positive end-expiratory pressure titration in ARDS: a systematic review and meta-analysis[J]. Intensive Care Med, 2024, 50(5): 617-631. DOI:10.1007/s00134-024-07362-2 |
| [11] | Jimenez JV, Weirauch AJ, Culter CA, et al. Electrical impedance tomography in acute respiratory distress syndrome management[J]. Crit Care Med, 2022, 50(8): 1210-1223. DOI:10.1097/CCM.0000000000005582 |
| [12] | Jimenez JV, Munroe E, Weirauch AJ, et al. Electric impedance tomography-guided PEEP titration reduces mechanical power in ARDS: a randomized crossover pilot trial[J]. Crit Care, 2023, 27(1): 21. DOI:10.1186/s13054-023-04315-x |
| [13] | Yuan XY, Chen DY, Chao YL, et al. Effect of individualized positive end-expiratory pressure titrated by electrical impedance tomography in patients with acute respiratory distress syndrome[J]. Am J Respir Crit Care Med, 2025, 211(3): 418-421. DOI:10.1164/rccm.202411-2112RL |
| [14] | Li RT, Wu YR, Zhang HL, et al. Effects of airway pressure release ventilation on lung physiology assessed by electrical impedance tomography in patients with early moderate-to-severe ARDS[J]. Crit Care, 2023, 27(1): 178. DOI:10.1186/s13054-023-04469-8 |
| [15] | Spinelli E, Kircher M, Stender B, et al. Unmatched ventilation and perfusion measured by electrical impedance tomography predicts the outcome of ARDS[J]. Crit Care, 2021, 25(1): 192. DOI:10.1186/s13054-021-03615-4 |
| [16] | Liu XS, Liu X, Meng J, et al. Electrical impedance tomography for titration of positive end-expiratory pressure in acute respiratory distress syndrome patients with chronic obstructive pulmonary disease[J]. Crit Care, 2022, 26(1): 339. DOI:10.1186/s13054-022-04201-y |
| [17] | Kostakou E, Barrett N, Camporota L. Electrical impedance tomography to determine optimal positive end-expiratory pressure in severe chronic obstructive pulmonary disease[J]. Crit Care, 2016, 20(1): 295. DOI:10.1186/s13054-016-1475-2 |
| [18] | 宋雨佳, 崔馨月, 王静, 等. 电阻抗断层成像在急危重症医学研究热点与发展方向[J]. 机械制造与自动化, 2024, 53(4): 1-6. DOI:10.19344/j.cnki.issn1671-5276.2024.04.001 |
| [19] | Costa ELV, Chaves CN, Gomes S, et al. Real-time detection of pneumothorax using electrical impedance tomography[J]. Crit Care Med, 2008, 36(4): 1230-1238. DOI:10.1097/CCM.0b013e31816a0380 |
| [20] | Preis C, Luepschen H, Leonhardt S, et al. Experimental case report: development of a pneumothorax monitored by electrical impedance tomography[J]. Clin Physiol Funct Imaging, 2009, 29(3): 159-162. DOI:10.1111/j.1475-097X.2008.00855.x |
| [21] | Gao ZJ, Yang L, Zhao ZQ, et al. Monitoring of spontaneous pneumothorax using electrical impedance tomography: a case report[J]. Heliyon, 2024, 10(3): e25405. DOI:10.1016/j.heliyon.2024.e25405 |
| [22] | Morais CCA, De Santis Santiago RR, Filho JR, et al. Monitoring of pneumothorax appearance with electrical impedance tomography during recruitment maneuvers[J]. Am J Respir Crit Care Med, 2017, 195(8): 1070-1073. DOI:10.1164/rccm.201609-1780LE |
| [23] | Yang YY, He HW, Long Y, et al. Bedside electrical impedance tomography in early diagnosis of pneumothorax in mechanically ventilated ICU patients - a single-center retrospective cohort study[J]. J Clin Monit Comput, 2023, 37(2): 629-637. DOI:10.1007/s10877-022-00935-w |
| [24] | Hochhegger B, Ley-Zaporozhan J, Marchiori E, et al. Magnetic resonance imaging findings in acute pulmonary embolism[J]. Br J Radiol, 2011, 84(999): 282-287. DOI:10.1259/bjr/26121475 |
| [25] | Frerichs I, Pulletz S, Elke G, et al. Assessment of changes in distribution of lung perfusion by electrical impedance tomography[J]. Respiration, 2009, 77(3): 282-291. DOI:10.1159/000193994 |
| [26] | Wang XC, Zhao H, Cui N. The role of electrical impedance tomography for management of high-risk pulmonary embolism in a postoperative patient[J]. Front Med (Lausanne), 2021, 8: 773471. DOI:10.3389/fmed.2021.773471 |
| [27] | Kuk WJ, Wright NR. Bedside diagnosis of pulmonary embolism using electrical impedance tomography: a case report[J]. A A Pract, 2022, 16(7): e01606. DOI:10.1213/XAA.0000000000001606 |
| [28] | Prins SA, Weller D, Labout JAM, et al. Electrical impedance tomography As a bedside diagnostic tool for pulmonary embolism[J]. Crit Care Explor, 2023, 5(1): e0843. DOI:10.1097/CCE.0000000000000843 |
| [29] | Proen?a M, Braun F, Lemay M, et al. Non-invasive pulmonary artery pressure estimation by electrical impedance tomography in a controlled hypoxemia study in healthy subjects[J]. Sci Rep, 2020, 10(1): 21462. DOI:10.1038/s41598-020-78535-4 |
| [30] | 何怀武, 隆云, 池熠, 等. 床旁高渗盐水造影肺灌注电阻抗断层成像的技术规范与临床应用[J]. 中华医学杂志, 2021, 101(15): 1097-1101. DOI:10.3760/cma.j.cn112137-20200926-02723 |
| [31] | Shenson JA, Marcott S, Dewan K, et al. Utility of videolaryngoscopy for diagnostic and therapeutic interventions in head and neck surgery[J]. Am J Otolaryngol, 2020, 41(4): 102284. DOI:10.1016/j.amjoto.2019.102284 |
| [32] | Jiang H, Han YJ, He GJ, et al. Evaluating bronchial anastomotic stenosis dynamically by electrical impedance tomography in a lung transplant recipient: a case report[J]. Ann Transl Med, 2023, 11(5): 222. DOI:10.21037/atm-22-4659 |
| [33] | 赵伦, 阿德力江·买买提明, 余雪渊, 等. 电阻抗断层成像用于围手术期呼吸管理的研究进展[J]. 基础医学与临床, 2024, 44(11): 1482-1486. DOI:10.16352/j.issn.1001-6325.2024.11.1482 |
| [34] | Pereira SM, Tucci MR, Morais CCA, et al. Individual positive end-expiratory pressure settings optimize intraoperative mechanical ventilation and reduce postoperative atelectasis[J]. Anesthesiology, 2018, 129(6): 1070-1081. DOI:10.1097/ALN.0000000000002435 |
| [35] | Nestler C, Simon P, Petroff D, et al. Individualized positive end-expiratory pressure in obese patients during general anaesthesia: a randomized controlled clinical trial using electrical impedance tomography[J]. Br J Anaesth, 2017, 119(6): 1194-1205. DOI:10.1093/bja/aex192 |
| [36] | Vellanki H, Antunes M, Locke RG, et al. Decreased incidence of pneumothorax in VLBW infants after increased monitoring of tidal volumes[J]. Pediatrics, 2012, 130(5): e1352-8. DOI:10.1542/peds.2011-2611 |
| [37] | Frerichs I, Becher T. Chest electrical impedance tomography measures in neonatology and paediatrics-a survey on clinical usefulness[J]. Physiol Meas, 2019, 40(5): 054001. DOI:10.1088/1361-6579/ab1946 |
| [38] | Sophocleous L, Frerichs I, Miedema M, et al. Clinical performance of a novel textile interface for neonatal chest electrical impedance tomography[J]. Physiol Meas, 2018, 39(4): 044004. DOI:10.1088/1361-6579/aab513 |
| [39] | Becher TH, Miedema M, Kallio M, et al. Prolonged continuous monitoring of regional lung function in infants with respiratory failure[J]. Ann Am Thorac Soc, 2022, 19(6): 991-999. DOI:10.1513/AnnalsATS.202005-562OC |
| [40] | Ke XY, Hou W, Huang Q, et al. Advances in electrical impedance tomography-based brain imaging[J]. Mil Med Res, 2022, 9(1): 10. DOI:10.1186/s40779-022-00370-7 |
| [41] | Yuan JL, He SN, Sang L, et al. Clinical applications of thoracic electrical impedance tomography in China: an updated review on recent 5 years[J]. Physiol Meas, 2025, 46(7). DOI:10.1088/1361-6579/adf16e |
| [42] | He HW, Chi Y, Long Y, et al. Bedside evaluation of pulmonary embolism by saline contrast electrical impedance tomography method: a prospective observational study[J]. Am J Respir Crit Care Med, 2020, 202(10): 1464-1468. DOI:10.1164/rccm.202005-1780LE |
| [43] | Yuan SY, Gao YL, Zhang K, et al. Bedside assessment of lung ventilation, recruitability and optimal PEEP by 3D-EIT and 2D-EIT in ARDS patients: a prospective study[J]. Intensive Care Med, 2025, 51(6): 1185-1188. DOI:10.1007/s00134-025-07960-8 |
| [44] | Cappellini I, Campagnola L, Consales G. Electrical impedance tomography, artificial intelligence, and variable ventilation: transforming respiratory monitoring and treatment in critical care[J]. J Pers Med, 2024, 14(7): 677. DOI:10.3390/jpm14070677 |
 2025, Vol. 34
2025, Vol. 34