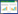2. 达州市中心医院急诊科,达州 635000
急危重症患者极易合并多器官功能障碍,如急性肾损伤(acute kidney injury, AKI)以及呼吸衰竭,其中约15%~20%的患者需进行持续性肾脏替代治疗(continuous renal replacement therapy, CRRT),部分患者往往合并凝血功能障碍[1]。尤其是当机体受到严重创伤、药物过量等因素影响,过度激活凝血系统,导致抗凝血剂不足、纤溶抑制等引起微循环中广泛的纤维蛋白沉积,或内外凝血因子缺乏等导致凝血功能障碍[2-3]。在CRRT治疗期间,血液与体外回路接触,激活了凝血和血小板的内在途径和外在途径,治疗期间极易发生体外循环凝血,而抗凝是保证CRRT正常运行的重要因素。临床常使用肝素作为抗凝剂,但肝素易导致出血、血小板减少、骨质疏松症、高脂血症、醛固酮抑制及过敏反应等并发症[3, 4],目前相关的专家共识及指南建议,凝血功能障碍的患者应首选枸盐酸钠作为局部抗凝剂,但枸盐酸钠容易导致代谢性酸中毒、代谢性碱中毒、低钙血症等并发症[5],且在肝硬化、肝衰竭等患者中枸橼酸盐常常作为禁用药物,因此,需要积极寻找更为安全有效的体外抗凝药物。
据文献报道,日本危重症患者血液净化时,84.3%患者使用甲磺酸萘莫司他(Nafamostat, NM)作为抗凝剂,远高于肝素的11.5%[6],NM是一种合成的丝氨酸蛋白酶抑制剂,具有多靶位抗凝、多通道代谢、半衰期短等多重优势[7]。然而,对于NM在危重患者血液净化过程中的有效性、安全性及不良并发症,目前鲜有系统的评价。仅有一篇关于NM在CRRT中的作用的Meta分析[8]发现,NM给药可以延长接受血液净化治疗的危重患者的过滤生存时间,改善生存结果,而不会增加显著出血事件[8],但本文仅纳入英文文献。本研究排除了年限较远的研究,纳入了更多近期文献以及中文文献。不仅比较了NM与常规治疗(conventional therapy, CT)[如普通肝素(unfractionated heparin, UFH)、低分子肝素(low molecular weight heparin, LMWH)、柠檬酸盐(sodium citrate, SC)和无抗凝剂(non-anticoagulant, NA)]之间的出血风险、过滤器寿命和住院病死率,同时进一步关注了NM组与CT组之间的ICU住院时长、输血率及总的CRRT持续时间。
1 资料与方法 1.1 方案与注册采用Cochrane评价方法,按照系统评价和Meta分析首选报告项目(PRISMA)指南(附表S1)进行[9]。本系统评价的方案已在INPLASY上注册,注册号(202470052)。
1.2 检索方法对Web of Science、PubMed、EMBASE、知网和谷歌进行全面的文献检索,以确定从成立到2024年6月20日符合纳入标准的研究。采用医学主题词(MeSH)进行检索:英文关键词包括“nafamstat” “fut 175” “ronastat” “nafamstat mesilate” “nafamostat dihydrochloride” “renal replacement therapy” “kidney replacement therapy” “renal therapy” “renal replacement” “replacement therapy” “kidney replacement” “therapies kidney replacement”;中文关键词包括:“甲磺酸萘莫司他”“FUT-175”“萘莫司他”“持续性肾脏替代治疗”。查询的搜索策略和细节在(附表S2)中给出。此外,进一步人工筛查检索到的研究和综述文章的参考文献表,以寻找其他出版物,没有使用语言限制。两位研究人员独立地对所有文章类型、标题和摘要进行了初步合格筛选。
1.3 纳入和排除标准纳入标准:(1)随机对照试验或队列研究;(2)评估含有NM治疗对病死率、出血并发症发生率、滤器时长及住院时长等的临床疗效的研究;(3)以任何途径或频率给药的NM。
排除标准:(1)综述、重复文献报道,或动物研究;(2)涉及孕妇或哺乳期患者的研究;(3)年限过于久远(2000年以前)的研究。
1.4 数据提取两名研究人员独立地从纳入文章中提取数据;如果两名研究人员的意见在此过程中发生冲突,则由另一名研究人员独立评估研究;通过小组讨论最终确定结果。提取数据包括第一作者姓名、发表年份、人口信息、干预和对照组(剂量和持续时间)、住院病死率、出血并发症发生率、滤器时长以及患者住院时长。
1.5 研究质量评价两名评审员独立进行质量评估。使用Cochrane协作组织的随机对照试验工具[10]评估随机研究的质量。工具中每个条目的满意表现、不清楚表现和不满意表现分别用绿色、黄色和红色表示。纽卡斯尔-渥太华量表(NOS)用于队列研究质量评价[11]。根据队列研究人群的选择质量、可比性和结果,NOS最多分配9分。研究质量被定义为差(0~3分)、一般(4~6分)或好(7~9分)。
1.6 研究结局主要结局为住院期间病死率、出血并发症发生率及滤器时长;次要结局为ICU住院时长、输血率及CRRT总时长。
1.7 统计学方法分析使用Review Manager (RevMan) 5.4和StatMP-6版软件进行。参考Cochrane系统评价手册,住院病死率和出血并发症表示为具有95%CI的相对危险度(RR)。使用Mantel-Haenszel方法计算加权合并RR[12]。连续变量(滤器时长)表示为95%CI的平均差异(MD)。多篇文章结局指标记录为中位数和四分位间距,本研究根据样本量计算器[13]计算其平均值和标准差。使用I2检验来衡量统计异质性[14]。当I2=0时,不存在异质性;当I2 < 50%时,认为研究异质性较小,采用固定效应模型进行分析[15];当I2 > 50%时,认为研究异质性相对较大,采用随机效应模型。同时进行敏感度分析证明结果的稳定性。使用Egger's检验对发表偏倚进行定量评估[16]。所有结果采用双侧检验,以P < 0.05为差异有统计学意义。
2 结果 2.1 文献检索结果和质量评价初检总计726篇文献,通过阅读标题和摘要初步筛选54篇文献,阅读全文剔除年代久远[17]、质量低下及无数据文献,最终纳入18篇文献,其中11篇为回顾性队列研究[18-28],7篇为随机对照研究[29-35]。纳入过程见图 1,纳入文献基本情况见表 1。
|
| 图 1 纳入文献基本信息 |
|
|
| 文献 | 国家 | 类型 | 干预措施 | 性别 | APACHE Ⅱ | PLT(×109/L) | APTT(s) | HB(g/dL) |
| Kameda, 2024[23] | 日本 | 回顾队列 | NM / UFH | 女/男 214/72 | NM 28 (7) | 153.3 (98.6) | NR | 9.7 (2.2) |
| UFH 27 (7) | 153.3(79.6) | 10.1(1.9) | ||||||
| Lee YK, 2014 [32] | 韩国 | 随机对照 | NM / NA | 女/男 44/29 | 26.72±5.26 | 57.44±40.05 | NR | 8.49±1.55 |
| 26.84±6.00 | 90.92±97.39 | 9.07±1.86 | ||||||
| Choi, 2015[30] | 韩国 | 随机对照 | NM / NA | 女/男 30/25 | 23.5+6.2 | 115.5±75.9 | 52.5±39.3 | 94±2.1 |
| 25.9±8.4 | 77.7±65.6 | 46.3±28.2 | 8.8±1.8 | |||||
| Baek, 2012[19] | 韩国 | 回顾队列 | NM / NA | 女/男 153/91 | NR | NR | NR | NR |
| Hwang, 2012[18] | 韩国 | 回顾队列 | UFH /NM / NA | 女/男 123/99 | 25.6±7.1 | 136.9±108.4 | 54.9±25.3 | NR |
| 24.3±5.8 | 180.0±93.1 | 41.3±13.4 | ||||||
| 24.9±6.1 | 164.6±139.1 | 50.7±21.2 | ||||||
| Yue, 2023[24] | 中国 | 回顾队列 | UFH / NM /SC | 女/男 57/5 | NR | NR | 43.05 (35.33, 51.85) | NR |
| Makino, 2016[21] | 日本 | 回顾队列 | UFH / NM | 女/男 71/30 | 18(14, 21) | 178(65, 205) | 38(30, 48) | NR |
| 20(17, 22) | 95(62, 148) | 31(28, 38) | ||||||
| Kamijo, 2020[22] | 日本 | 回顾队列 | NM / UFH | 女/男 750/466 | 27(21, 32) | 100(53, 165) | NR | 10.4 (8.7, 12.2) |
| 22(17, 28) | 111(59, 178) | 10.3 (8.7, 12.2) | ||||||
| Lee ST, 2014[20] | 韩国 | 回顾队列 | NA / NM / UFH | 女/男 25/15 | NR | 43.2±21.6 | 50.8±23.5 | NR |
| 328.0±185.3 | 45.2±11.2 | |||||||
| 36.7±21.6 | 73.9±74.7 | |||||||
| Uchino, 2007[31] | 日本 | 随机对照 | NM / UFH | NR | NR | NR | NR | NR |
| Park, 2009[29] | 韩国 | 随机对照 | NM / NA | 女/男 12/11 | 17.35±5.13 | 152.25±117.99 | 58.19±32.95 | NR |
| 15.52±3.96 | 158.83±98.81 | 50.59±26.05 | ||||||
| Kim, 2011[35] | 韩国 | 随机对照 | NM / NA | 女/男 17/18 | NR | 224.4±136.2 | 30.1±5.7 | NR |
| 187.3±66.2 | 30.0±4.8 | |||||||
| 张艳, 2022[25] | 中国 | 回顾队列 | NM/NA | 男/女 23/10 | 18.50±6.87 | 106.79±68.64 | NR | NR |
| 15.89±5.28 | 111.16±68.32 | |||||||
| 朱倩莹, 2024[33] | 中国 | 随机对照 | NM/UFH | 男/女 87/31 | 18.2±3.6 | 48.5(35.3, 76.8) | 55.2±19.7 | 76.0 (73.0, 97.3) |
| 16.9±4.5 | 40.0(16.3, 88.5) | 56.8±18.5 | 82.5 (71.3, 95.8) | |||||
| 张乔娜, 2024[28] | 中国 | 回顾队列 | NM/SC | 男/女 86/39 | 14.0(10.0, 16.0) | 155.64±87.73 | 33.10±12.88 | 87.08±20.26 |
| 13.0(13.0, 17.0) | 176.44±102.22 | 31.75±5.48 | 82.58±20.21 | |||||
| 朱倩莹, 2023[27] | 中国 | 回顾队列 | NM/UFH | 男/女 42/21 | 15.9±3.3 | 62.5±10.8 | 66.3±10.7 | 89.1±9.9 |
| 16.4±3.0 | 68.4±11.8 | 66.3±10.7 | 91.7±8.2 | |||||
| 周炜, 2022[34] | 中国 | 随机对照 | NM/NA | 男/女 13/14 | NR | NR | NR | NR |
Cochrane偏倚风险图显示所有纳入的文献均未对患者和实施者实施盲法,但并未产生显著的偏倚;本研究认为所有7项随机对照试验在一个或多个标准上存在高偏倚风险并将其评为“整体质量差”。队列研究NOS质量评估评分范围为5~8分;入组研究中存在的常见的方法学局限性是缺乏结果评估者的盲法、样本量证明以及与结果相关的不同暴露水平。见附图S1、附图S2、附表S1。纳入文献的结局数据见附表S2。
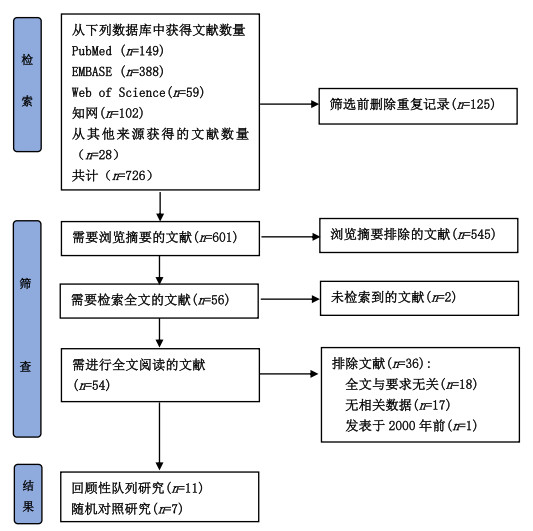
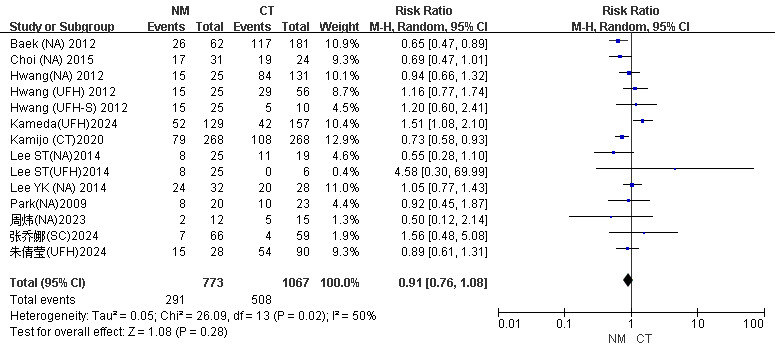
2.2 Meta分析结果 2.2.1 病死率11项研究报告了住院病死率[18-20, 22, 23, 28-30, 32-34],具有高异质性(I2=50%,P=0.02)。随机效应模型的Meta分析表明,NM组与CT组在医院病死率上差异无统计学意义(RR=0.91, 95%CI: 0.76~1.08, P=0.28)(图 2)。根据CT组抗凝血药物类型进行亚组分析,NA组住院死亡风险明显高于NM组(RR=0.76, 95%CI: 0.65~0.90, P=0.001);与UFH相比,NM增加了患者病死率(RR=1.26, 95%CI: 1.03~1.56, P=0.03);SC组和NM组之间病死率差异无统计学意义(P=0.46)(图 3)。根据文献不同年份进行亚组分析。结果显示NM组与CT组在医院病死率上均差异无统计学意义(附图S3)。
|
| 图 2 CRRT患者NM组与CT组病死率Meta分析森林图 |
|
|
|
| 注:NA为无抗凝,UFH为普通肝素,UFH-S为全身肝素,SC为柠檬酸盐 图 3 CRRT患者NM组与CT组病死率不同抗凝血药物亚组分析Meta分析森林图 |
|
|
本研究将出血并发症分为主要出血和次要出血。主要出血定义为致命性出血、发生在关键部位或器官的症状性出血(如颅内出血),以及需要外科手术或介入治疗才能控制的出血。次要出血则指所有不符合主要出血标准的临床显性出血,例如穿刺点渗血、血肿、鼻出血或血尿等[31, 36]。共有12篇文献报告了出血并发症[19, 21, 22, 26-28, 30-35],CT组出血并发症发生风险高于NM组(RR=0.80, 95%CI: 0.65~0.98, P=0.03),见图 4。
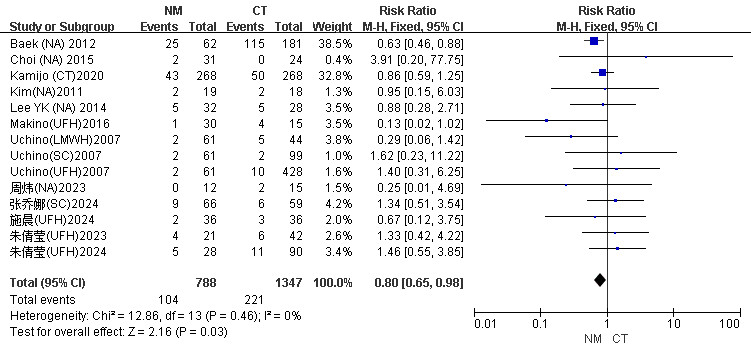
|
| 图 4 CRRT患者NM组与CT组出血率Meta分析森林图 |
|
|
血液过滤器的使用寿命记录为更换新过滤器之前的时间,共纳入8项研究[18, 20, 24, 25, 29, 30, 32, 34]。结果提示NM组滤器时长较CT组延长,具有高异质性(I2=90%,P=0.03),见图 5。根据常规治疗组抗凝剂使用情况分为三个亚组(NA、UFH、SC)进行分析。如图 6所示,选用随机效应模型。结果显示,与NA组相比,NM组滤器寿命较长(MD=7.74, 95%CI: 4.08~11.39, P < 0.001),具有高异质性(I2=79%)。UFH组与NM组之间差异无统计学意义,(MD=2.90, 95%CI: -0.10~5.91, P=0.06),异质性低(I2=4%,P=0.06)。进一步根据文献年份情况分为两个亚组(2005—2015年、2016—2024年)进行分析。选用随机效应模型。结果显示,在2005—2015年亚组中,NM组滤器寿命较CT组显著延长(MD=10.85, 95%CI: 6.33~15.37, P < 0.001, I2=42%)。见附图S4。
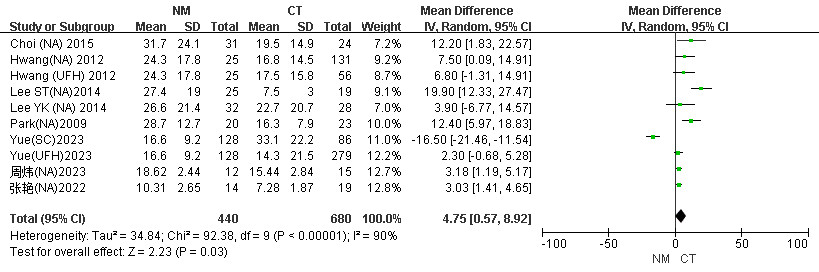
|
| 图 5 CRRT患者NM组与CT组滤器时长Meta分析森林图 |
|
|
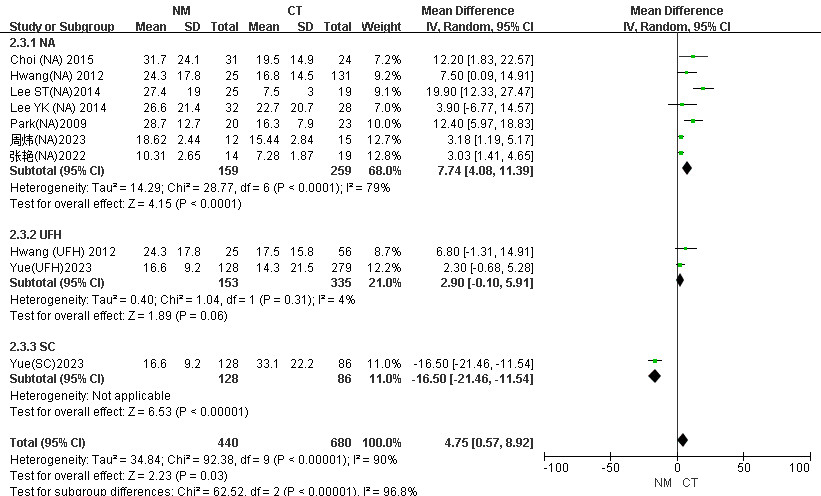
|
| 图 6 CRRT患者NM组与CT组滤器时长不同抗凝血药物亚组分析Meta分析森林图 |
|
|
CRRT时长记录为患者入从开始到结束的总时间,共纳入3项研究[20, 29-30],数据显示,与CT组相比,使用NM作为抗凝剂的患者CRRT时长显著延长(MD=15.95, 95%CI: 6.99~24.92, P < 0.001, I2=0%)。见图 7。
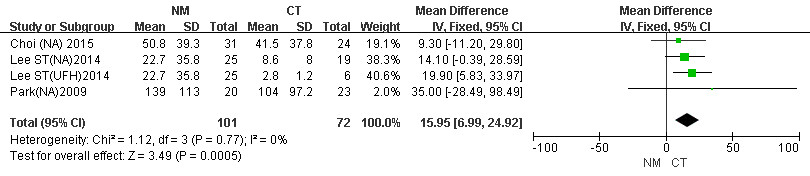
|
| 图 7 CRRT患者NM组与CT组CRRT总时长Meta分析森林图 |
|
|
有5项研究报告了输血[19, 23, 28, 30, 32],因输血剂量单位不同,最终选取3项研究进行输血率对比[19, 28, 30],两组输血率差异无统计学意义(RR=1.07, 95%CI: 0.88~1.29, P=0.51)。共有2篇文献纳入了ICU住院时长[23, 29],两组ICU住院时长差异无统计学意义(MD=2.67, 95%CI: -1.39~6.72, P=0.20)。见附图S5、附图S6。
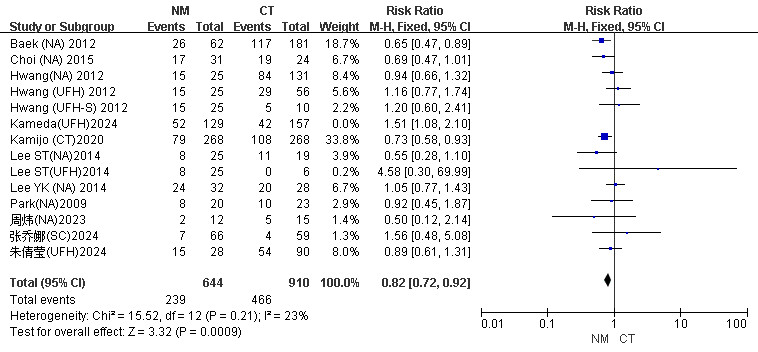
2.3 敏感度及发表偏倚对高异质性的结局进行敏感度分析进一步查明异质性来源(附图S7、附图S8)。在患者病死率森林图中,逐一对偏离中线较大的文献进行剔除,在剔除Kameda(UFH)2024后异质性明显降低(I2=23% vs. I2=50%),固定效应模型下NM组病死率较CT组降低(RR=0.82, 95%CI: 0.72~0.92, P=0.0009, I2=23%),因此判定该文章可能是异质性的来源。见图 8。
|
| 图 8 CRRT患者NM组与CT组剔除Kameda(UFH)2024后病死率Meta分析森林图 |
|
|
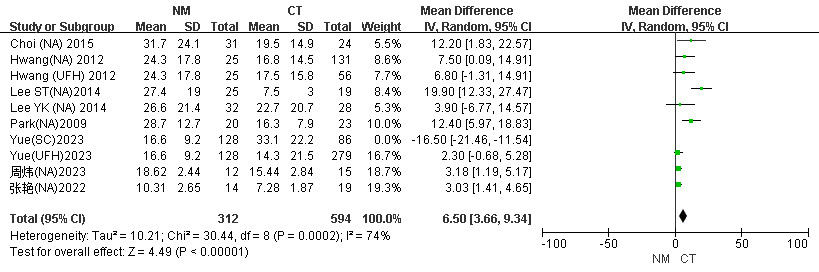
患者滤器时长森林图中,在剔除Yue(SC)2023文献后异质性稍有降低(I2=90% vs. I2=74%),随机效应模型下NM组滤器寿命优于CT组(MD=6.50, 95%CI: 3.66~9.34, P < 0.001),I2=74%,判定该文章可能是异质性的来源。见图 9。
|
| 图 9 CRRT患者NM组与CT组剔除Yue(SC)2023后滤器时长Meta分析森林图 |
|
|
对滤器时长结局进行Meta回归以探讨异质性来源,通过对研究类型、调查地区、样本量、人群性别、文献质量进行回归,其中样本量和男女比P < 0.05,可能是异质性来源,见表 2。
| 因素 | Coefficient | S.D. | Z | P |
| 研究类型(RCT vs. 非RCT) | 0.36 | 0.50 | 0.72 | 0.47 |
| 地区(中国vs. 其他) | 0.39 | 0.49 | 0.80 | 0.42 |
| 样本量(≥100例vs. < 100例) | -0.95 | 0.39 | -2.44 | 0.01 |
| 性别(男vs. 女) | -0.12 | 0.04 | -2.96 | < 0.01 |
| 文献质量(低质量vs. 中高质量) | 0.68 | 0.47 | 1.45 | 0.15 |
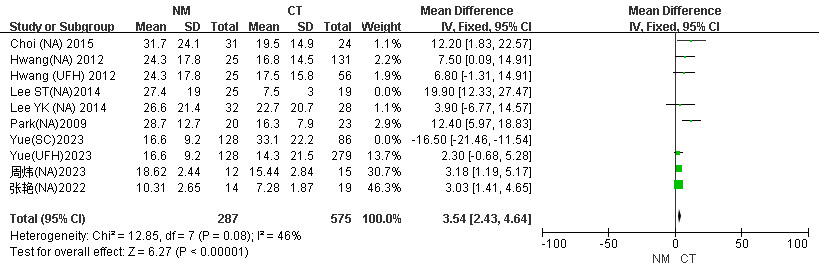
进一步剔除样本量和男女比差异大的研究,在剔除Lee ST(NA)2014文献后异质性明显降低(I2=46% vs. I2=74%),固定效应模型下(MD=3.54, 95%CI: 2.43~4.65, P < 0.001)。见图 10。
|
| 图 10 CRRT患者NM组与CT组剔除Yue(SC)2023以及Lee ST(NA)2014后滤器时长Meta分析森林图 |
|
|
采用Egger检验评估发表偏倚,分别对病死率和出血率进行了检验,P值分别为0.567和0.500,均不存在发表偏倚。见附图S9、附图S10。
3 讨论危急重症患者因急性肝、肾功能衰竭,经常需要进行CRRT、人工肝或毒物清除等治疗,CRRT不仅可清除体内有害物质及代谢产物,保持机体酸碱度及电解质平衡,从而维持机体内环境稳定,利于危重患者病情恢复[37],还可以通过减轻前后负荷降低心脏负担,降低老年患者心力衰竭的发生率,进一步降低住院期间病死率[38]。但因为凝血因子存在,血液在无抗凝因子存在的滤器中极易发生血栓,导致治疗费用增加,工作强度增大,频繁更换管路影响治疗效果。此时就需合适的抗凝剂以延长滤器使用寿命,尽可能降低治疗期间出血事件等并发症的发生[39]。NM已在日本和韩国使用,可以用于弥散性血管内凝血,并有效抑制MERS-CoVS蛋白介导的膜融合[40-41]。然而,NM在国内重症患者的治疗的系统研究是有限的。本研究纳入了几乎所有已发表的比较药物与NM用于危重患者CRRT的研究,并与Lin等[8]发表的第一篇比较NM与其他抗凝剂的Meta研究进行比较。首先,本研究发现病死率和出血风险研究结果与Lin等[8]相同,但本研究2个结果的异质性低,这可能与本研究排除2000年以前的文献并纳入更新更全面的研究有关;本研究2个主要结果不存在发表偏倚。而Lin等[8]未对病死率进行发表偏倚的评估。其次,本研究发现,与NA相比,NM组滤器寿命较长(MD=7.74, 95%CI: 4.08~11.39, P < 0.001),与Lin等[8]结果一致。进一步进行亚组分析发现,在2005—2015年研究亚组中,NM滤器寿命较CT组显著延长。本研究是首篇对ICU住院时长、输血率和CRRT总时间进行了Meta分析的文章。结果显示,NM作为抗凝剂的患者CRRT时长显著延长(MD=15.95, 95%CI: 6.99~24.92, P < 0.001),但需结合其他因素进一步分析[42]。
UFH作为传统的抗凝剂,其抗凝效果确切,但全身性应用时出血风险较高,且可能引起肝素诱导的血小板减少症等严重并发症。本Meta分析显示,NM组与UFH组在滤器时长方面差异无统计学意义。既往研究发现,NM在出血并发症风险方面低于UFH,安全性更好[21-22, 43-45]。本研究的Meta分析发现,NM组在血并发症风险方面优于UFH等CT组。NM作为一种丝氨酸蛋白酶抑制剂,其抗凝机制不同于肝素,不依赖于抗凝血酶Ⅲ,因此对于存在抗凝血酶Ⅲ缺乏的患者,NM可能是一个更合适的选择。此外,NM的短半衰期使其在需要紧急停止抗凝时能够迅速逆转,这对于围手术期或出血风险极高的患者尤为重要[40-41]。亚组分析发现NM住院死亡风险略高于UFH,然而,需要注意的是,NM主要用于高出血风险或凝血功能障碍的患者,这些患者本身的死亡风险较高,可能影响治疗效果的评估[46]。此外,本研究还发现,在剔除高异质性文章后,NM组的病死率较CT组降低。这表明,在特定患者群体中,NM可能具有更好的生存结局。需要进一步的研究来验证这些发现,并评估NM在不同患者群体中的疗效和安全性。
2012年肾脏疾病改善全球预后临床实践指南推荐对有出血倾向的AKI患者局部应用SC治疗[47]。与UFH相比,局部使用SC具有优异的过滤寿命和安全性能,在欧美被推荐为首选,即使是出血风险较低的患者也不例外[48-49]。在出血高风险的AKI患者中,与无抗凝剂相比,局部SC抗凝是安全有效的,可延长滤过器寿命,减少失血量,但需要进一步的研究来评价[50]。局部SC抗凝对手术后出血患者行CRRT是一种安全有效,体外循环良好,酸碱状态控制合理,无临床相关不良事件[51]。然而,SC并非没有缺点,它可能导致代谢性碱中毒、低钙血症,并在肝功能不全或休克患者中存在柠檬酸盐蓄积的风险[51-56]。本研究的Meta分析中,关于NM和SC的比较研究数量较少,仅有三项研究提供相关数据,其中Yue等[24]提示SC较NM延长滤器寿命,张乔娜和李露[28]因数据格式不同,为保证结果的稳定性,并未纳入数据进行分析。尽管如此,一些研究表明NM在某些方面与SC具有可比性甚至优势。例如,Liu等[57]的一项回顾性研究发现,NM在出血高风险患者中作为CRRT抗凝剂的疗效和安全性不劣于SC[57]。Peng等[58]比较了NM和SC在儿童高出血风险血浆置换中的应用。结果显示,两组滤器寿命和出血风险无明显差异,NM组的总不良反应发生率(23.8% vs. 64.4%)和代谢性碱中毒发生率(4.8% vs. 48.9%)显著低于SC组(P < 0.05)[58]。张乔娜等[28]的研究比较了NM和SC抗凝的疗效与安全性。结果显示,NM组滤器寿命显著低于SC组(8 h vs. 12 h),SC组代谢性碱中毒发生率略高于NM组(5.08% vs. 4.55%,P=0.042)。NM的优势在于其半衰期短(约8 min),通过血浆酯酶快速代谢,不易在体内蓄积,因此在肝功能不全的患者中可能更安全,且无需频繁监测凝血指标。这使得NM在临床实践中具有更高的灵活性和便利性。
已有研究表明,NM能够显著延长滤器寿命,一项包含639例高出血风险患者的Meta分析发现[59],NM组的滤器寿命平均延长了9.65 h,且出血并发症的发生率与对照组差异差异无统计学意义。He等[60]研究发现,NM组的滤器寿命长于UFH组(43.0 h vs. 37.0 h),同时显著降低了滤器凝血风险,提示NM组在延长滤器寿命方面更具优势[60]。其次,关于出血风险,UFH组新发临床出血事件的发生率显著高于NM组(36.8% vs. 5.9%),表明NM组在减少出血事件发生方面优于UFH组。在本研究中,总研究结果以及在2005—2015年亚组中,NM滤器寿命均较CT组延长。进一步对CRRT总时间进行Meta分析,结果显示,NM作为抗凝剂的患者CRRT时长延长,进一步印证了NM在降低可延长滤过器寿命的结论。NM对血小板聚集有直接抑制作用,抑制了激活的糖蛋白Ⅱ b/Ⅲ a表达,从而减少了血小板与纤维蛋白原的结合,降低了血栓形成的风险。
本研究的Meta分析结果显示,NM组与CT组之间ICU住院时长和输血率差异均无统计学意义。这可能由于纳入相关研究数量较少,导致统计效能不足以检测出潜在的差异。此外,ICU住院时长和输血率受多种复杂因素影响,包括患者基础疾病、并发症、治疗方案、医院管理策略等[61-62]。NM作为一种抗凝剂,其主要作用在于影响凝血功能和滤器寿命,对ICU住院时长和输血率的直接影响可能较小,或者其影响被其他更强的临床因素所掩盖。例如,即使NM能减少出血事件,但如果患者存在严重感染、多器官功能衰竭等情况,其ICU住院时长仍可能延长,输血需求也可能增加[63]。未来需要更多高质量、大样本的RCT研究,并进行亚组分析,以探讨NM在特定患者群体中对这些次要结局的潜在影响。
本研究结果具有一定的参考价值,但所纳入的文献存在一定的异质性。滤器时长的异质性达到了90%,即使在剔除部分文献后,异质性仍然较高(74%)。本研究进一步进行了Meta回归分析,结果显示,样本量和男女比可能是异质性来源,研究表明,样本量较小的研究可能由于随机误差导致效应量估计的不稳定,从而增加异质性。此外,较小的样本量可能导致效应量的估计偏倚,进而影响总体效应的准确性[64-65]。性别分布可能在不同研究中存在差异,从而影响效应量的估计。例如,男性和女性在生理、药物代谢等方面可能存在差异,这可能导致NM在不同性别中的效果不同[66-67]。在剔除样本量和男女比差异大的研究后异质性明显降低。未来应持续更新数据库,纳入更多相关文献,并在文献量充足的基础上,进一步细化亚组,探讨异质性产生的原因。
本研究存在以下局限性:(1)纳入研究数量偏少,质量欠佳,未完全遵循盲法和分配隐藏,部分研究样本量小,也未说明是否有研究对象中途退出,以及对结果采用意向性分析,均可能造成实施或测量偏倚;(2)虽进行亚组分析,但SC与NM对比的文章较少,需要更多更高质量的RCT研究进一步证实;(3)所纳入的文献存在一定的异质性,未来应在文献量充足的基础上,进一步细化亚组,探讨异质性产生的原因。
综上所述,排除高异质性文献后Meta分析显示,NM组住院死亡风险明显低于CT组,NM组出血并发症风险低于CT组。与CT相比,使用NM作为抗凝剂的患者CRRT时长延长。亚组分析显示,NA组住院死亡风险明显高于NM组。与NM相比,NA滤器寿命显著降低。UFH组与NM组之间差异无统计学意义。本研究证明了NM在CRRT质量中是一种有效且相对安全的抗凝剂。
利益冲突 所有作者声明无利益冲突
本文附表请登陆中华急诊网(www.cem.org.cn)浏览(Html格式全文)
| [1] | Kellum JA, Prowle JR. Paradigms of acute kidney injury in the intensive care setting[J]. Nat Rev Nephrol, 2018, 14(4): 217-230. DOI:10.1038/nrneph.2017.184 |
| [2] | Aitken C, Kreitman N. Henry Matthew's contribution[J]. J R Coll Physicians Edinb, 2010, 40(1): 92. DOI:10.4997/JRCPE.2010.119 |
| [3] | Cronin RE, Reilly RF. Unfractionated heparin for hemodialysis: still the best option[J]. Semin Dial, 2010, 23(5): 510-515. DOI:10.1111/j.1525-139X.2010.00770.x |
| [4] | Hematology 2001. American society of hematology education program book[M]. Orlando, Florida, USA. December 7-11, 2001. proceedings[J]. Hematology Am Soc Hematol Educ Program, 2001: 1-552. |
| [5] | Shankaranarayanan D, Muthukumar T, Barbar T, et al. Anticoagulation strategies and filter life in COVID-19 patients receiving continuous renal replacement therapy: a single-center experience[J]. Clin J Am Soc Nephrol, 2020, 16(1): 124-126. DOI:10.2215/CJN.08430520 |
| [6] | Arimura T, Abe M, Shiga H, et al. Clinical study of blood purification therapy in critical care in Japan: results from the survey research of the Japan Society for Blood Purification in Critical Care in 2013[J]. J Artif Organs, 2017, 20(3): 244-251. DOI:10.1007/s10047-017-0968-3 |
| [7] | Oh HS, Kim T, Gu DH, et al. Pharmacokinetics of nafamostat, a potent serine protease inhibitor, by a novel LC-MS/MS analysis[J]. Molecules, 2022, 27(6): 1881. DOI:10.3390/molecules27061881 |
| [8] | Lin Y, Shao YM, Liu YC, et al. Efficacy and safety of nafamostat mesilate anticoagulation in blood purification treatment of critically ill patients: a systematic review and meta-analysis[J]. Ren Fail, 2022, 44(1): 1263-1279. DOI:10.1080/0886022X.2022.2105233 |
| [9] | Liberati A, Altman DG, Tetzlaff J, et al. The PRISMA statement for reporting systematic reviews and meta-analyses of studies that evaluate health care interventions: explanation and elaboration[J]. PLoS Med, 2009, 6(7): e1000100. DOI:10.1371/journal.pmed.1000100 |
| [10] | Cumpston M, Li TJ, Page MJ, et al. Updated guidance for trusted systematic reviews: a new edition of the Cochrane Handbook for Systematic Reviews of Interventions[J]. Cochrane Database Syst Rev, 2019, 10(10): ED000142. DOI:10.1002/14651858.ED000142 |
| [11] | Stang A. Critical evaluation of the Newcastle-Ottawa scale for the assessment of the quality of nonrandomized studies in meta-analyses[J]. Eur J Epidemiol, 2010, 25(9): 603-605. DOI:10.1007/s10654-010-9491-z |
| [12] | Riggioni C, Ricci C, Moya B, et al. Systematic review and meta-analyses on the accuracy of diagnostic tests for IgE-mediated food allergy[J]. Allergy, 2024, 79(2): 324-352. DOI:10.1111/all.15939 |
| [13] | 吴凡, 周天晗, 陆凯宁, 等. 甲状腺髓样癌患者颈外侧淋巴结转移危险因素分析[J]. 浙江大学学报(医学版), 2021, 50(6): 730-740. DOI:10.3724/zdxbyxb-2021-0210 |
| [14] | Chen B, Benedetti A. Quantifying heterogeneity in individual participant data meta-analysis with binary outcomes[J]. Syst Rev, 2017, 6(1): 243. DOI:10.1186/s13643-017-0630-4 |
| [15] | Higgins JPT, Thompson SG, Deeks JJ, et al. Measuring inconsistency in meta-analyses[J]. BMJ, 2003, 327(7414): 557-560. DOI:10.1136/bmj.327.7414.557 |
| [16] | Seagroatt V, Stratton I. Bias in meta-analysis detected by a simple, graphical test. Test had 10% false positive rate[J]. BMJ, 1998, 316(7129): 470;authorreply470-470;authorreply471. |
| [17] | Ohtake Y, Hirasawa H, Sugai T, et al. Nafamostat mesylate as anticoagulant in continuous hemofiltration and continuous hemodiafiltration[J]. Contrib Nephrol, 1991, 93: 215-217. DOI:10.1159/000420222 |
| [18] | Hwang SD, Hyun YK, Moon SJ, et al. Nafamostat mesilate for anticoagulation in continuous renal replacement therapy[J]. Int J Artif Organs, 2013, 36(3): 208-216. DOI:10.5301/IJAO.5000191 |
| [19] | Baek NN, Jang HR, Huh W, et al. The role of nafamostat mesylate in continuous renal replacement therapy among patients at high risk of bleeding[J]. Ren Fail, 2012, 34(3): 279-285. DOI:10.3109/0886022X.2011.647293 |
| [20] | Lee ST, Cho H. The use of nafamostat mesilate as an anticoagulant during continuous renal replacement therapy for children with a high risk of bleeding[J]. J Korean Soc Pediatr Nephrol, 2014, 18(2): 98. DOI:10.3339/jkspn.2014.18.2.98 |
| [21] | Makino S, Egi M, Kita H, et al. Comparison of nafamostat mesilate and unfractionated heparin as anticoagulants during continuous renal replacement therapy[J]. Int J Artif Organs, 2016, 39(1): 16-21. DOI:10.5301/ijao.5000465 |
| [22] | Kamijo H, Mochizuki K, Nakamura Y, et al. Nafamostat mesylate improved survival outcomes of sepsis patients who underwent blood purification: a nationwide registry study in Japan[J]. J Clin Med, 2020, 9(8): 2629. DOI:10.3390/jcm9082629 |
| [23] | Kameda S, Fujii T, Ikeda J, et al. Unfractionated heparin versus nafamostat mesylate for anticoagulation during continuous kidney replacement therapy: an observational study[J]. BMC Nephrol, 2023, 24(1): 12. DOI:10.1186/s12882-023-03060-1 |
| [24] | Yue Q, Wu H, Xi MM, et al. Filter lifespan, treatment effect, and influencing factors of continuous renal replacement therapy for severe burn patients[J]. J Burn Care Res, 2024, 45(3): 764-770. DOI:10.1093/jbcr/irad196 |
| [25] | 张艳, 殷娜, 丁皓姝. 甲磺酸萘莫司他抗凝对外科重症监护病房患者连续性肾脏替代治疗有效性及安全性回顾性研究[J]. 世界临床药物, 2022, 43(9): 1148-1153. DOI:10.13683/j.wph.2022.09.012 |
| [26] | 施晨, 熊万鹏, 谭莹莹, 等. 新型抗凝剂甲磺酸萘莫司他在急诊连续性肾脏替代治疗中的临床应用研究[J]. 临床和实验医学杂志, 2024, 23(9): 934-937. DOI:10.3969/j.issn.1671-4695.2024.09.010 |
| [27] | 朱倩莹, 程立新, 黄兰, 等. 甲磺酸萘莫司他体外抗凝在脓毒症合并急性肾损伤患者连续性肾脏替代治疗中的应用评价[J]. 华西医学, 2023, 38(5): 718-723. DOI:10.7507/1002-0179.202206024 |
| [28] | 张乔娜, 李露. 甲磺酸萘莫司他与枸橼酸抗凝在慢性肾衰竭伴高危出血患者连续性肾替代治疗中的疗效评估[J]. 中国体外循环杂志, 2024, 22(3): 197-203. DOI:10.13498/j.cnki.chin.j.ecc.2024.03.07 |
| [29] | Park II, Choi M, Yoon J, et al. Saline versus nafamostat mesilate anticoagulation for continuous veno-venous hemofiltration (CVVH) in patients at high risk of bleeding: a prospective study[J]. Kidney Res Clin Pract, 2009, 28: 205-210. |
| [30] | Choi JY, Kang YJ, Jang HM, et al. Nafamostat mesilate as an anticoagulant during continuous renal replacement therapy in patients with high bleeding risk: a randomized clinical trial[J]. Medicine (Baltimore), 2015, 94(52): e2392. DOI:10.1097/MD.0000000000002392 |
| [31] | Uchino S, Bellomo R, Morimatsu H, et al. Continuous renal replacement therapy: a worldwide practice survey. The beginning and ending supportive therapy for the kidney (B.E.S.T. kidney) investigators[J]. Intensive Care Med, 2007, 33(9): 1563-1570. DOI:10.1007/s00134-007-0754-4 |
| [32] | Lee YK, Lee HW, Choi KH, et al. Ability of nafamostat mesilate to prolong filter patency during continuous renal replacement therapy in patients at high risk of bleeding: a randomized controlled study[J]. PLoS One, 2014, 9(10): e108737. DOI:10.1371/journal.pone.0108737 |
| [33] | 朱倩莹, 张凌, 杨莹莹, 等. 甲磺酸萘莫司他在脓毒症相关急性肾损伤oXiris滤器连续性肾脏替代治疗中的抗凝效果评价[J]. 华西医学, 2024, 39(7): 1082-1087. DOI:10.7507/1002-0179.202307003 |
| [34] | 周炜, 陶芸, 韩林, 等. 甲磺酸萘莫司他抗凝在心血管外科术后高危出血风险患者连续性肾脏替代治疗中应用[J]. 世界临床药物, 2022, 43(9): 1143-1147. DOI:10.13683/j.wph.2022.09.011 |
| [35] | Kim EY, Lee YK, Lee SM, et al. Low-dose nafamostat mesilate in hemodialysis patients at high bleeding risk[J]. Korean J Nephrol, 2011, 30(1): 61-66. |
| [36] | Schulman S, Kearon C. Definition of major bleeding in clinical investigations of antihemostatic medicinal products in non‐surgical patients[J]. J Thromb Haemost, 2005, 3(4): 692-694. DOI:10.1111/j.1538-7836.2005.01204.x |
| [37] | Tandukar S, Palevsky PM. Continuous renal replacement therapy: who, when, why, and how[J]. Chest, 2019, 155(3): 626-638. DOI:10.1016/j.chest.2018.09.004 |
| [38] | Ronco C, Reis T. Continuous renal replacement therapy and extended indications[J]. Semin Dial, 2021, 34(6): 550-560. DOI:10.1111/sdi.12963 |
| [39] | Levi M, Scully M. How I treat disseminated intravascular coagulation[J]. Blood, 2018, 131(8): 845-854. DOI:10.1182/blood-2017-10-804096 |
| [40] | Yamamoto M, Kiso M, Sakai-Tagawa Y, et al. The anticoagulant nafamostat potently inhibits SARS-CoV-2 S protein-mediated fusion in a cell fusion assay system and viral infection in vitro in a cell-type-dependent manner[J]. Viruses, 2020, 12(6): 629. DOI:10.3390/v12060629 |
| [41] | Hoffmann M, Schroeder S, Kleine-Weber H, et al. Nafamostat mesylate blocks activation of SARS-CoV-2: new treatment option for COVID-19[J]. Antimicrob Agents Chemother, 2020, 64(6): e00754-20. DOI:10.1128/AAC.00754-20 |
| [42] | Kumwilaisak K, Kyokong O, Indrambarya T. Factors influencing length of stay in neurosurgical intensive care unit[J]. J Med Assoc Thai, 2008, 91(6): 875-881. |
| [43] | Muto S, Imai M, Asano Y. Mechanisms of hyperkalemia caused by nafamostat mesilate[J]. Gen Pharmacol, 1995, 26(8): 1627-1632. DOI:10.1016/0306-3623(95)00072-0 |
| [44] | Okada H, Moriwaki K, Nakamoto H, et al. Positive skin reaction test in haemodialysis patients allergic to nafamostat mesilate[J]. Nephrol Dial Transplant, 1998, 13(8): 2166-2167. DOI:10.1093/oxfordjournals.ndt.a027907 |
| [45] | Maruyama H, Miyakawa Y, Gejyo F, et al. Anaphylactoid reaction induced by nafamostat mesilate in a hemodialysis patient[J]. Nephron, 1996, 74(2): 468-469. DOI:10.1159/000189371 |
| [46] | Gautam SC, Lim J, Jaar BG. Complications associated with continuous RRT[J]. Kidney360, 2022, 3(11): 1980-1990. DOI:10.34067/KID.0000792022 |
| [47] | Khwaja A. KDIGO clinical practice guidelines for acute kidney injury[J]. Nephron Clin Pract, 2012, 120(4): c179-c184. DOI:10.1159/000339789 |
| [48] | Liu C, Mao Z, Kang HJ, et al. Regional citrate versus heparin anticoagulation for continuous renal replacement therapy in critically ill patients: a meta-analysis with trial sequential analysis of randomized controlled trials[J]. Crit Care, 2016, 20(1): 144. DOI:10.1186/s13054-016-1299-0 |
| [49] | Stucker F, Ponte B, Tataw J, et al. Efficacy and safety of citrate-based anticoagulation compared to heparin in patients with acute kidney injury requiring continuous renal replacement therapy: a randomized controlled trial[J]. Crit Care, 2015, 19(1): 91. DOI:10.1186/s13054-015-0822-z |
| [50] | Gao JP, Wang F, Wang YG, et al. A mode of CVVH with regional citrate anticoagulation compared to no anticoagulation for acute kidney injury patients at high risk of bleeding[J]. Sci Rep, 2019, 9(1): 6607. DOI:10.1038/s41598-019-42916-1 |
| [51] | Kalb R, Kram R, Morgera S, et al. Regional citrate anticoagulation for high volume continuous venovenous hemodialysis in surgical patients with high bleeding risk[J]. Ther Apher Dial, 2013, 17(2): 202-212. DOI:10.1111/j.1744-9987.2012.01101.x |
| [52] | Bai M, Zhou ML, He LJ, et al. Citrate versus heparin anticoagulation for continuous renal replacement therapy: an updated meta-analysis of RCTs[J]. Intensive Care Med, 2015, 41(12): 2098-2110. DOI:10.1007/s00134-015-4099-0 |
| [53] | Wu MY, Hsu YH, Bai CH, et al. Regional citrate versus heparin anticoagulation for continuous renal replacement therapy: a meta-analysis of randomized controlled trials[J]. Am J Kidney Dis, 2012, 59(6): 810-818. DOI:10.1053/j.ajkd.2011.11.030 |
| [54] | Kramer L, Bauer E, Joukhadar C, et al. Citrate pharmacokinetics and metabolism in cirrhotic and noncirrhotic critically ill patients[J]. Crit Care Med, 2003, 31(10): 2450-2455. DOI:10.1097/01.CCM.0000084871.76568.E6 |
| [55] | Gong DH, Ji DX, Xu B, et al. Regional citrate anticoagulation in critically ill patients during continuous blood purification[J]. Chin Med J (Engl), 2003, 116(3): 360-363. |
| [56] | Tan JN, Haroon SWP, Mukhopadhyay A, et al. Hyperlactatemia predicts citrate intolerance with regional citrate anticoagulation during continuous renal replacement therapy[J]. J Intensive Care Med, 2019, 34(5): 418-425. DOI:10.1177/0885066617701068 |
| [57] | Liu D, Zhao J, Xia H, et al. Nafamostat mesylate versus regional citrate anticoagulation for continuous renal replacement therapy in patients at high risk of bleeding: a retrospective single-center study[J]. Eur J Med Res, 2024, 29(1): 72. DOI:10.1186/s40001-024-01660-7 |
| [58] | Peng D, Cai ZL, He J, et al. Comparison of regional citrate anticoagulation and nafamostat mesylate anticoagulation during plasma exchange for children at high bleeding risk: a retrospective study[J]. Ital J Pediatr, 2025, 51(1): 114. DOI:10.1186/s13052-025-01954-4 |
| [59] | Zhang Y, Chen XP, Lao YW, et al. Using nafamostat mesilate anticoagulation for continuous renal replacement therapy in high bleeding risk patients: a systematic review and meta-analysis[J/OL]. (2023-03-15). https://www.researchsquare.com/article/rs-2611340/v1. DOI: 10.21203/rs.3.rs-2611340/v1. |
| [60] | He J, Zhang XP. Comparison of different anticoagulation methods in continuous renal replacement therapy for pediatric acute liver failure patients: a retrospective observational study[J]. Front Pediatr, 2025, 13: 1667760. DOI:10.3389/fped.2025.1667760 |
| [61] | Böhmer AB, Just KS, Lefering R, et al. Factors influencing lengths of stay in the intensive care unit for surviving trauma patients: a retrospective analysis of 30, 157 cases[J]. Crit Care, 2014, 18(4): R143. DOI:10.1186/cc13976 |
| [62] | Toptas M, Sengul Samanci N, Akkoc İ, et al. Factors affecting the length of stay in the intensive care unit: our clinical experience[J]. Biomed Res Int, 2018, 2018: 9438046. DOI:10.1155/2018/9438046 |
| [63] | Asim M, Amin F, El-Menyar A. Multiple organ dysfunction syndrome: Contemporary insights on the clinicopathological spectrum[J]. Qatar Med J, 2020, 2020(1): 22. DOI:10.5339/qmj.2020.22 |
| [64] | IntHout J, Ioannidis JPA, Borm GF, et al. Small studies are more heterogeneous than large ones: a meta-meta-analysis[J]. J Clin Epidemiol, 2015, 68(8): 860-869. DOI:10.1016/j.jclinepi.2015.03.017 |
| [65] | Ioannidis JPA. Interpretation of tests of heterogeneity and bias in meta-analysis[J]. J Eval Clin Pract, 2008, 14(5): 951-957. DOI:10.1111/j.1365-2753.2008.00986.x |
| [66] | Anderson GD. Gender differences in pharmacological response[J]. Int Rev Neurobiol, 2008, 83: 1-10. DOI:10.1016/S0074-7742(08)00001-9 |
| [67] | Younes S. The relationship between gender and pharmacology[J]. Curr Res Pharmacol Drug Discov, 2024, 7: 100192. DOI:10.1016/j.crphar.2024.100192 |
 2025, Vol. 34
2025, Vol. 34