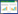2. 徐州医科大学附属医院重症医学科,徐州 221000
脓毒性休克是由感染引起的全身炎症反应综合征,是脓毒症的严重表现形式,其特征为持续的低血压、组织灌注不足和多器官功能障碍[1]。尽管现代医学在病因学和治疗手段方面取得了显著进展,脓毒性休克的病死率仍高达40%~60%,严重威胁患者生命[2]。因此,寻找有效的治疗手段一直是临床研究的重要方向。近年来,越来越多的研究表明,肠道菌群失调在脓毒性休克的发生和发展中发挥了重要作用[3]。肠道作为机体最大的免疫器官和微生态系统,其菌群平衡对维持全身免疫稳态具有重要意义。在脓毒性休克状态下,肠道屏障功能受损,肠道菌群多样性降低,致病菌增殖,进一步加剧了炎症反应和多器官功能障碍[4]。因此,调节肠道菌群平衡已成为治疗脓毒性休克的重要研究方向之一。参附注射液是一种传统中药制剂,广泛应用于治疗脓毒性休克等危重症,在改善循环衰竭、促进组织灌注以及调节免疫功能方面表现出显著的临床疗效[5]。然而,参附注射液对肠道菌群的具体影响及其与脓毒性休克治疗的关系尚不清楚。因此,本研究旨在通过分析参附注射液对脓毒性休克患者肠道菌群多样性及组成的影响,为临床应用提供科学依据和新的研究思路。
1 资料与方法 1.1 研究对象本研究为单中心随机对照临床试验,选取2022年3月至2023年3月于徐州医科大学附属医院重症医学科住院治疗的脓毒性休克患者为研究对象。纳入标准:(1) 年龄18~80岁;(2)符合脓毒性休克的诊断标准(根据2021年国际脓毒症与脓毒性休克定义专家共识)[6];(3)经过初步复苏后仍需血管活性药物维持血压。排除标准:(1) 既往患有慢性肠道疾病;(2) 近1个月内使用过益生菌或其他肠道调节剂;(3) 合并恶性肿瘤或终末期疾病;(4)妊娠期或哺乳期妇女;(5)对参附注射液过敏。
本研究方案已通过徐州医科大学附属医院医学伦理委员会审批(伦理审批号:XYFY2021-KL173-01),符合医学伦理学相关规定。所有治疗措施均获得患者或其家属的知情同意。
1.2 研究方法本研究通过随机数字表法将患者随机分为参附组和对照组。所有患者均按照2021版《拯救脓毒症运动》指南接受规范化治疗,包括初始液体复苏、抗感染治疗、血管活性药物的合理使用、维持内环境稳定以及尽早实施肠内营养支持等措施。参附组在常规治疗的基础上,加用参附注射液(四川雅安三九药业有限公司,规格10 mL/支),具体用法为:参附注射液100 mL加入5%葡萄糖注射液250 mL中,静脉滴注,每日1次,连续7 d。
1.3 观察指标 1.3.1 一般资料收集两组患者的基本信息,包括性别、年龄以及感染部位(如呼吸系统感染和血行感染)。
1.3.2 观察指标在治疗前(第0天)和治疗后(第7天),通过无菌采样方法采集患者的新鲜粪便样本,置于无菌冷冻管中,迅速保存于-80℃冰箱中待测。使用粪便DNA提取试剂盒(TianGen)进行DNA提取。利用1%琼脂糖凝胶电泳检测DNA的纯度和浓度,通过PCR扩增菌群基因的V3-V4高变区,以构建扩增子测序文库。所有PCR混合液加入15 μL Phusion® High-Fidelity PCR Master Mix(New England Biolabs)、0.2 μmol/L引物和10 ng基因组DNA模板。热循环程序为:在98℃下进行1 min的第一次变性,然后在98℃(10 s)、50℃(30 s)和72℃(30 s)下进行30次循环,最后在72℃下保持5 min。PCR产物使用2%浓度的琼脂糖凝胶进行电泳检测,并进行文库构建。构建好的文库经过Qubit和Q-PCR定量,文库合格后,使用NovaSeq 6000进行PE 250上机测序。通过16S rDNA高通量测序技术分析肠道菌群的多样性和组成结构。
1.4 统计学方法采用SPSS 26.0软件进行统计学分析。通过QIIME软件(版本1.9.1)计算Chao1指数、Ace指数和Shannon指数,以评估菌群多样性。采用LEfSe分析方法识别组间差异显著的代表菌群。连续数据应用均数±标准差(x±s)表示,组间比较采用两独立样本t检验;计数资料采用Fisher确切概率法检验。以P < 0.05为差异有统计学意义。
2 结果 2.1 两组患者一般资料统计本研究共纳入30例脓毒性休克患者,其中参附组15例,对照组15例。两组患者性别、年龄、感染部位以及入院时Chao1指数,Ace指数和Shannon指数等比较,差异无统计学意义(均P > 0.05),组间具有可比性。见表 1。
| 指标 | 参附组(n=15) | 对照组(n=15) | 统计值 | P值 |
| 年龄(岁)a | 65.07±8.34 | 64.27±8.95 | 0.253 | 0.802 |
| 性别b | 0.715 | |||
| 男 | 7(46.7) | 9(60.0)) | ||
| 女 | 8(53.3) | 6(40.0) | ||
| 感染部位b | 0.710 | |||
| 呼吸系统 | 8(53.3) | 10(66.7) | ||
| 血行感染 | 7(46.7) | 5(33.3) | ||
| Chao1指数a | 387.26±75.45 | 367.93±98.09 | 0.605 | 0.550 |
| ACE指数a | 445.05±90.60 | 437.65±101.99 | 0.210 | 0.835 |
| Shannon指数a | 1.97±0.78 | 2.11±0.98 | -0.411 | 0.684 |
| 注:a为x±s,b为例(%) | ||||
治疗第7天,参附组Chao1指数,Ace指数和Shannon指数高于对照组[(516.75±126.48) vs. (391.74±128.25), t=2.69;(591.30±132.34) vs. (459.70±194.66), t=2.17;(3.17±0.78) vs. (2.45±0.76), t=2.55],差异均有统计学意义(均P < 0.05)。见图 1。
|
| A:两组Chao1指数比较;B:两组Ace指数比较;C:两组Shannon指数比较;两组间比较,aP < 0.05 图 1 两组患者Chao1指数,Ace指数和Shannon指数的比较 |
|
|
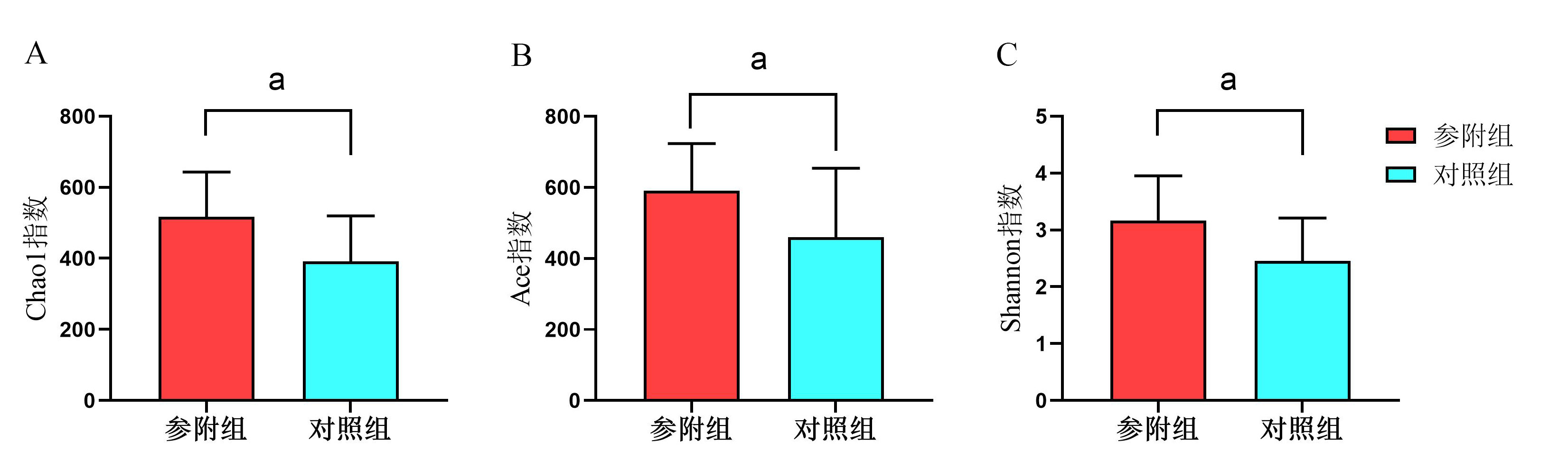
在门水平上,参附组中丰度最高的菌依次为厚壁菌门(54.47%)、拟杆菌门(16.87%)和变形菌门(14.93%);而对照组中丰度最高的依次是厚壁菌门(48.34%)、变形菌门(33.46%)和拟杆菌门(9.05%)。
在科水平上,参附组中丰度最高的菌依次为瘤胃球菌科(18.38%)、肠球菌科(15.53%)和乳酸杆菌科(12.44%);而对照组中丰度最高的依次是肠杆菌科(25.11%)、肠球菌科(22.49%)和瘤胃球菌科(11.98%)。
在属水平上,参附组中丰度最高的菌依次为肠球菌属(15.53%)、拟杆菌属(10.43%)和阿克曼氏菌属(8.29%);而对照组中丰度最高的依次是肠球菌属(22.49%)、肠杆菌属(12.32%)和大肠杆菌-志贺氏菌属(11.52%)。见图 2。
|
| A:两组在门水平比较;B:两组在科水平比较;C:两组在属水平比较 图 2 两组患者肠道菌群组成比较 |
|
|
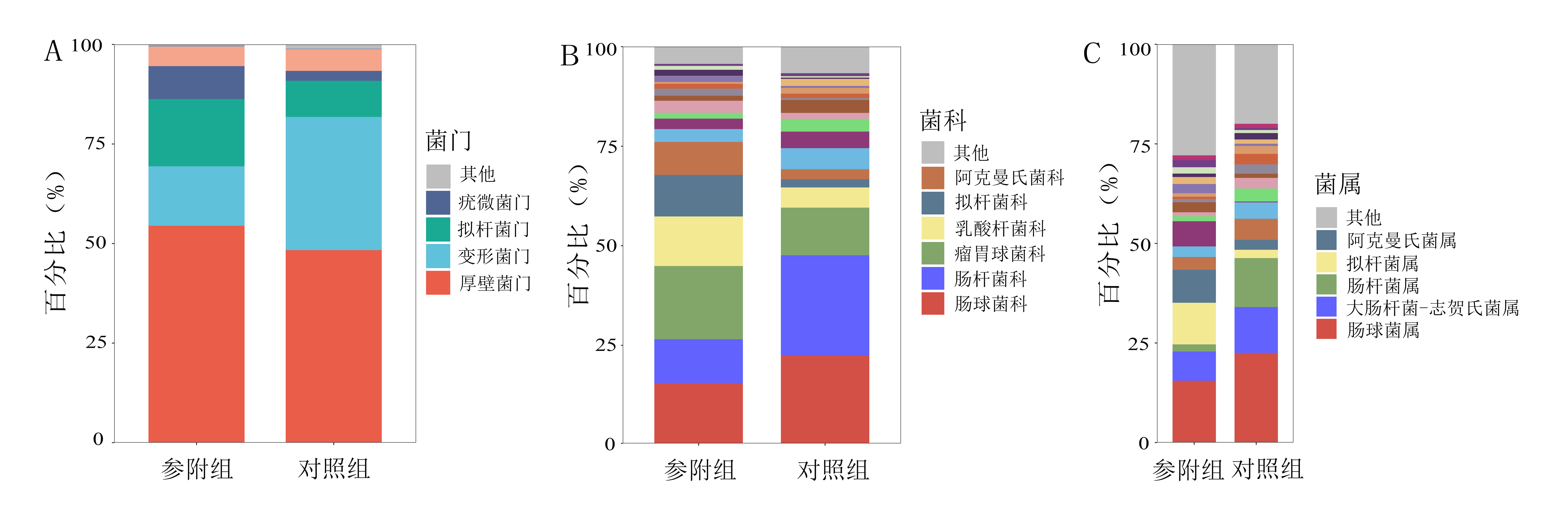
用LEfSe分析法分析各组间物种差异,参附组与对照组在肠道菌群组成上的显著差异菌群主要为拟杆菌科、乳酸杆菌科和瘤胃球菌科。见图 3。
|
| 图 3 LEfSe分析识别有差异性的菌群 |
|
|
脓毒性休克是全球范围内威胁患者生命的严重危重症,其病理生理机制复杂,涉及多器官功能障碍和全身炎症反应综合征[6]。近年来,研究表明肠道作为重要的免疫器官和菌群储存库,在脓毒性休克的发生和进展中发挥了至关重要的作用[7]。肠道菌群的失调不仅破坏了肠屏障的完整性,还通过细菌移位和内毒素释放加剧了全身炎症反应,这成为疾病恶化的重要因素。因此,如何有效调节肠道微生态,为脓毒性休克患者提供新的治疗策略,已成为当前研究的热点。本研究发现,参附注射液能够显著改善脓毒性休克患者的肠道菌群多样性。治疗后,参附组患者的Chao1指数、Ace指数和Shannon指数显著高于对照组,这表明参附注射液可能通过增加菌群种类和丰度,有效提高肠道微生态系统的稳健性。肠道菌群的多样性恢复不仅对维护肠道屏障功能至关重要,还与患者更好的临床预后密切相关,这与近期文献报道的结果一致[8]。
参附注射液的主要成分为人参和附子,其药理作用可能是改善肠道微生态的关键。人参皂苷具有显著的抗炎、抗氧化及免疫调节作用,可通过调节细胞因子释放、抑制炎症通路等机制间接影响肠道菌群[9]。附子所含的乌头生物碱则被认为能够增强微循环、改善肠道屏障功能,这对于肠道菌群的恢复至关重要[10]。在门水平上,本研究发现参附注射液提高了拟杆菌门的丰度,同时降低了变形菌门的比例。拟杆菌门被认为是重要的抗炎菌群,其增加通常与炎症缓解和肠道屏障修复相关[11]。Han等[12]研究发现,拟杆菌门的丰度增加与炎症标志物如IL-1、IL-2和IL-6的下降呈负相关。另一方面,变形菌门(如肠杆菌科)的比例升高通常与肠道通透性增加和炎症加剧相关,参附注射液对其的抑制作用可能是改善肠道微生态环境的重要途径。在属水平上,参附注射液增加了拟杆菌属和阿克曼氏菌属的丰度。拟杆菌属能代谢膳食纤维并产生短链脂肪酸,这些代谢产物不仅为肠道上皮细胞提供能量,还具有抗炎和免疫调节作用[13]。阿克曼氏菌属则以增强肠道黏液层更新和屏障功能著称,其丰度增加与炎症减轻及代谢改善密切相关[14]。由此可见,参附注射液通过促进这些有益菌的增殖和调节肠道微生态,为患者提供了重要的治疗支持。
此外,LEfSe分析进一步揭示了参附注射液对肠道菌群结构的调节作用。本研究发现,参附组拟杆菌科、乳酸杆菌科和瘤胃球菌科的丰度显著高于对照组。这些菌群的变化对改善脓毒性休克患者的肠道微生态环境和整体预后具有重要意义。拟杆菌科、乳酸杆菌科和瘤胃球菌科均是健康肠道菌群的重要组成部分,在维持肠道酸碱平衡、抑制病原菌生长以及增强免疫功能方面具有重要作用。近年的研究表明,脓毒性休克患者中拟杆菌科的丰度通常下降,这可能导致肠屏障功能减弱,内毒素易于跨壁转运,从而加剧炎症反应[15]。瘤胃球菌科作为纤维分解菌群,其主要功能包括降解复杂的植物多糖和产生短链脂肪酸[16]。乳酸杆菌科是典型的益生菌群,研究发现,乳酸杆菌科可以调节T细胞分化、抑制促炎因子表达以及增强抗炎因子如IL-10的分泌[17]。已有研究表明,乳酸杆菌科的丰度与脓毒严重程度密切相关,并且补充乳酸杆菌可逆脓毒症引起的肠道菌群失调[18-19]。乳酸杆菌科和瘤胃球菌科的显著增加以及拟杆菌科的恢复,表明参附注射液可能通过促进益生菌群的增殖和抑制致病菌群的扩张,改善肠道菌群结构。
综上所述,参附注射液能够显著改善患者的肠道菌群多样性,提升益生菌群如拟杆菌科、乳酸杆菌科和瘤胃球菌科的丰度,同时抑制部分致病菌群的过度生长。本研究为参附注射液在重症感染性疾病治疗中的应用提供了新的微生态调节依据,未来可结合多中心大样本研究进一步验证其疗效,并探讨其具体分子机制,为微生态治疗的发展提供理论支持。
利益冲突 所有作者声明无利益冲突
作者贡献声明 张苏明、王博、晁亚丽:数据收集、论文撰写;董庆云、鲍文韬:数据整理、统计学分析;刘艳存、柴艳芬:研究设计、论文修改
| [1] | Zhao JO, Patel BK, Krishack P, et al. Identification of clinically significant cytokine signature clusters in patients with septic shock[J]. Crit Care Med, 2023, 51(12): e253-e263. DOI:10.1097/CCM.0000000000006032 |
| [2] | Park C, Ku NS, Park DW, et al. Early management of adult sepsis and septic shock: Korean clinical practice guidelines[J]. Acute Crit Care, 2024, 39(4): 445-472. DOI:10.4266/acc.2024.00920 |
| [3] | Magnan C, Lancry T, Salipante F, et al. Role of gut microbiota and bacterial translocation in acute intestinal injury and mortality in patients admitted in ICU for septic shock[J]. Front Cell Infect Microbiol, 2023, 13: 1330900. DOI:10.3389/fcimb.2023.1330900 |
| [4] | Chen Y, Zhang F, Ye X, et al. Association between gut dysbiosis and sepsis-induced myocardial dysfunction in patients with sepsis or septic shock[J]. Front Cell Infect Microbiol, 2022, 12: 857035. DOI:10.3389/fcimb.2022.857035 |
| [5] | Liao JJ, Qin CY, Wang ZY, et al. Effect of Shenfu injection in patients with septic shock: a systemic review and meta-analysis for randomized clinical trials[J]. J Ethnopharmacol, 2024, 320: 117431. DOI:10.1016/j.jep.2023.117431 |
| [6] | Evans L, Rhodes A, Alhazzani W, et al. Surviving sepsis campaign: international guidelines for management of sepsis and septic shock 2021[J]. Intensive Care Med, 2021, 47(11): 1181-1247. DOI:10.1007/s00134-021-06506-y |
| [7] | 杨小娟, 杨晓军, 刘丹, 等. 脓毒症患者肠道菌群与肠屏障功能紊乱的相关性研究[J]. 中华急诊医学杂志, 2022, 31(2): 210-216. DOI:10.3760/cma.j.issn.1671-0282.2022.02.013 |
| [8] | Luan FY, Zhou Y, Ma XH, et al. Gut microbiota composition and changes in patients with sepsis: potential markers for predicting survival[J]. BMC Microbiol, 2024, 24(1): 45. DOI:10.1186/s12866-024-03188-6 |
| [9] | 南富耀, 马林沁, 吴彩军, 等. 参附注射液治疗脓毒性休克与心脏骤停后综合征的基础与临床[J]. 中华急诊医学杂志, 2021, 30(8): 920-923. DOI:10.3760/cma.j.issn.1671-0282.2021.08.002 |
| [10] | Huang P, Guo YH, Hu X, et al. Mechanism of Shenfu injection in suppressing inflammation and preventing sepsis-induced apoptosis in murine cardiomyocytes based on network pharmacology and experimental validation[J]. J Ethnopharmacol, 2024, 322: 117599. DOI:10.1016/j.jep.2023.117599 |
| [11] | Sankar J, Thakral V, Bharadwaj K, et al. The microbiome and metabolome of the gut of children with sepsis and septic shock[J]. J Intensive Care Med, 2024, 39(6): 514-524. DOI:10.1177/08850666231216361 |
| [12] | Han YJ, Kim S, Shin H, et al. Protective effect of gut microbiota restored by fecal microbiota transplantation in a sepsis model in juvenile mice[J]. Front Immunol, 2024, 15: 1451356. DOI:10.3389/fimmu.2024.1451356 |
| [13] | Zheng Q, Xu D, Wang Q, et al. Huang-Lian-Jie-Du decoction ameliorates sepsis through dynamic regulation of immune response and gut microbiota-metabolite axis[J]. Microb Pathog, 2025, 199: 107246. DOI:10.1016/j.micpath.2024.107246 |
| [14] | Panzetta ME, Valdivia RH. Akkermansia in the gastrointestinal tract as a modifier of human health[J]. Gut Microbes, 2024, 16(1): 2406379. DOI:10.1080/19490976.2024.2406379 |
| [15] | Chen JT, Song Y, Zeng WQ, et al. Research progress on the role of gut microbiota and its metabolites in the occurrence and development of septic-associated liver injury[J]. Shock, 2025, 63(1): 4-10. DOI:10.1097/SHK.0000000000002441 |
| [16] | Liu YL, Guo YN, Hu S, et al. Analysis of the dynamic changes in gut microbiota in patients with different severity in sepsis[J]. BMC Infect Dis, 2023, 23(1): 614. DOI:10.1186/s12879-023-08608-y |
| [17] | Haak BW, Prescott HC, Joost Wiersinga W. Therapeutic potential of the gut microbiota in the prevention and treatment of sepsis[J]. Front Immunol, 2018, 9: 2042. DOI:10.3389/fimmu.2018.02042 |
| [18] | Peng YH, Wei JL, Jia XN, et al. Changes in the microbiota in different intestinal segments of mice with sepsis[J]. Front Cell Infect Microbiol, 2023, 12: 954347. DOI:10.3389/fcimb.2022.954347 |
| [19] | Chen LF, Li HY, Li JY, et al. Lactobacillus rhamnosus GG treatment improves intestinal permeability and modulates microbiota dysbiosis in an experimental model of sepsis[J]. Int J Mol Med, 2019, 43(3): 1139-1148. DOI:10.3892/ijmm.2019.4050 |
 2025, Vol. 34
2025, Vol. 34