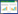脓毒症是由感染引起的机体失调反应综合征,是ICU中常见且严重威胁患者生命健康的疾病[1-2]。急性肾损伤(acute kidney injury, AKI)是脓毒症常见的严重并发症之一,导致患者肾功能急剧恶化,增加肾脏替代治疗的需求,严重者甚至进一步增加患者的死亡风险[3]。内环境中酸碱失衡、代谢紊乱是脓毒症患者病情进展的重要因素[4],阴离子间隙(anion gap, AG)是临床上评估酸碱平衡和代谢紊乱的重要指标之一,反映了未测定阴离子与未测定阳离子的差值[5]。传统的AG计算容易受到未测定阴离子浓度的影响,可能会导致对酸碱平衡状态的误判。白蛋白是血浆中含量最丰富的阴离子,其水平的变化会对AG产生显著影响。当患者存在低白蛋白血症时,未结合的负电荷减少,导致传统AG计算值偏低,从而掩盖了潜在的代谢性酸中毒[6]。因此为了更准确地评估患者的酸碱平衡状态,引入了基于白蛋白校正的阴离子间隙(albumin-corrected anion gap, ACAG)[7]。既往研究证实[8],危重症患者ACAG水平升高与AKI发生风险存在密切关联,但其对于脓毒症患者并发AKI的预测价值尚未见相关文献报道,此外建立有效的预测模型是实现疾病早期精准预测的关键,通过多因素分析筛选出与脓毒症患者并发AKI密切相关的危险因素,并将其纳入预测模型中,可以提高模型的预测准确性。本研究主要基于ACAG以及其他临床相关指标,建立预测脓毒症患者并发AKI的模型,并对模型进行验证,以期为临床早期识别脓毒症患者并发AKI的高危人群提供一种有效的工具,为及时采取针对性的防治措施、改善患者预后提供理论依据和参考。
1 资料与方法 1.1 研究对象回顾性选取2020年9月至2025年1月期间赣州市人民医院收治的脓毒症患者为研究对象,纳入标准:①符合Sepsis-3标准[9],确诊为脓毒症或脓毒症休克;②年龄≥18岁;③临床资料完整。排除标准:①入院时间 < 48 h;②合并恶性肿瘤、免疫性疾病;③处于妊娠期或哺乳期妇女;④入院后48 h内死亡或放弃治疗者;⑤合并肾功能障碍或终末期肾病者;⑥病例资料不全者。研究已取得赣州市人民医院临床科研伦理委员会批准,伦理审批号为:PJB2025-125-01。
1.2 方法 1.2.1 资料收集通过电子病历收集患者的资料,①基本信息:年龄、性别、体质量指数(body mass index, BMI)、吸烟史、饮酒史;②疾病治疗资料:原发感染部位、糖尿病史、高血压史、冠心病史、入院首次序贯器官衰竭(sequential organ failure assessment, SOFA)评分、急性生理与慢性健康(acute physiology and chronic health evaluation Ⅱ, APACHE Ⅱ)评分、机械通气情况;③实验室资料:入院24 h内首次血常规、血生化指标、凝血功能、炎症指标、血气指标。AG(mmol/L)=[Na+(mmol/L)+K+(mmol/L)]-[Cl-(mmol/L)+HCO3-(mmol/L)],参照Hatherill等[10]报道,ACAG(mmol/L)=AG+[44-白蛋白(g/L)]×0.25。
1.2.2 AKI评估参考改善全球肾脏病预后(Kidney Disease: Improving Global Outcomes, KDIGO)组织在2012年提出的AKI诊断标准[11],若血清肌酐(serum creatinine, Scr)在48 h内升高幅度达到或超过0.3 mg/dL(即26.5 μmol/L),或者在7 d内Scr水平升高至基线值的1.5倍,又或者尿量小于0.5 mL/(kg·h)且这种情况持续6 h及以上,则符合相应诊断条件。
1.3 模型构建首先对纳入的全部数据进行随机抽样,按照7∶3的比例将其划分为两部分,70%的数据作为训练集,用于构建预测模型,30%的数据作为验证集,用于对所构建模型的性能进行验证。基于多因素logistic回归分析结果建立列线图预测模型,列线图通常包含各个预测变量的得分标尺、总得分标尺以及结局事件发生概率标尺,顶端分值线0~100分,依据模型的系数,将各个预测变量转化为得分,各预测因素对应垂直的分值,分值之和为总分。
1.4 统计学方法本研究使用IBM SPSS 27.0分析和处理数据。首先Shapiro-Wilk检验对数据进行正态性评估。计量资料符合正态分布,以均数±标准差(x±s)的形式呈现,组间比较采用独立样本t检验;计量资料不符合正态分布,则用中位数(四分位数)[M(Q1, Q3)]来表示,组间比较运用Mann-Whitney U检验。计数资料用n(%)表示,两组间的比较采用卡方检验。采用多因素Logistic回归分析AKI危险因素。使用R软件(版本4.3.1),依据多因素分析的结果构建列线图模型,绘制受试者工作特征(receiver operating characteristic, ROC)曲线,并计算曲线下面积(areas under curve, AUC)。AUC的数值处于0至1的区间,AUC值越大,意味着预测模型在区分AKI是否发生上的能力越出色。对于模型校准度的评估,使用Hosmer-Lemeshow检验并绘制校准曲线。采用决策曲线分析(decision curve analysis, DCA)来衡量模型的临床实用性。以P < 0.05为差异具有统计学意义。
2 结果 2.1 训练集和验证集临床资料比较本研究最终纳入382例脓毒症患者,按照7∶3比例分为训练集(n=267)和验证集(n=115)。382例患者住院期间发生AKI 124例,占比32.46%(124/382),其中训练集发生AKI 85例,占比31.84%(85/267),验证集发生AKI 39例,占比33.91%(39/115)。训练集和验证集患者临床比较均差异无统计学意义(P > 0.05),见表 1。
| 因素 | 训练集(n=267) | 验证集(n=115) | χ2/t/Z值 | P值 |
| 年龄(岁)a | 59.18±12.33 | 58.64±13.15 | 0.385 | 0.701 |
| 性别b | 0.096 | 0.757 | ||
| 男 | 144(53.93) | 64(55.65) | ||
| 女 | 123(46.07) | 51(44.35) | ||
| BMI(kg/m2)a | 23.95±1.89 | 23.72±1.97 | 1.077 | 0.282 |
| 吸烟史b | 44(16.50) | 17(14.78) | 0.173 | 0.678 |
| 饮酒史b | 37(13.86) | 14(12.17) | 0.197 | 0.657 |
| 原发感染部位b | 0.302 | 0.960 | ||
| 肺部 | 155(58.05) | 65(56.52) | ||
| 腹腔 | 79(29.21) | 37(32.17) | ||
| 泌尿系 | 26(9.74) | 10(8.70) | ||
| 其他 | 7(2.62) | 3(2.61) | ||
| 糖尿病史b | 90(33.71) | 39(33.91) | 0.002 | 0.969 |
| 高血压史b | 87(32.58) | 37(32.17) | 0.006 | 0.937 |
| 冠心病史b | 39(14.61) | 18(15.65) | 0.069 | 0.793 |
| SOFA评分(分)c | 6(4, 11) | 6(3, 10) | 1.056 | 0.311 |
| APACHE Ⅱ评分(分)a | 24.12±4.15 | 23.89±4.88 | 0.471 | 0.638 |
| 机械通气b | 160(59.93) | 66(57.39) | 0.214 | 0.644 |
| WBC(×109/L)a | 12.95±2.56 | 12.71±2.78 | 0.819 | 0.413 |
| PLT(×109/L)a | 131.25±26.88 | 129.54±29.45 | 0.554 | 0.580 |
| ALB(g/L)a | 29.56±3.65 | 28.91±4.12 | 1.535 | 0.126 |
| Lac(mmol/L)c | 2.2(1.65, 3.10) | 2.1(1.80, 3.25) | 1.256 | 0.662 |
| Scr(μmol/L)a | 128.33±19.54 | 125.47±26.31 | 1.177 | 0.240 |
| BUN(mmol/L)c | 10.62(5.85, 13.80) | 10.50(5.15, 13.75) | 1.339 | 0.381 |
| 尿酸(μmol/L) | 302.34±56.55 | 297.63±59.81 | 0.734 | 0.464 |
| PT(s)a | 13.56±2.15 | 13.19±2.77 | 1.410 | 0.159 |
| CRP(mg/L)a | 112.57±29.54 | 110.49±32.36 | 0.613 | 0.540 |
| PaCO2(mmHg)a | 32.88±8.45 | 32.49±8.59 | 0.412 | 0.681 |
| PaO2(mmHg)a | 86.54±11.62 | 84.12±12.39 | 1.830 | 0.068 |
| 氧合指数c | 251(162, 302) | 245(153, 319) | 1.203 | 0.417 |
| ACAG(mmol/L)a | 21.12±2.98 | 20.88±3.65 | 0.673 | 0.501 |
| 注:BMI为体质量指数,SOFA为序贯器官衰竭评分,APACHE Ⅱ为急性生理与慢性健康Ⅱ评分,WBC为白细胞计数,PLT为血小板计数,ALB为白蛋白,Lac为血清乳酸,Scr为血肌酐,BUN为血尿素氮,PT为凝血酶原时间,CRP为C反应蛋白,PaCO2为动脉血二氧化碳分压,PaO2为动脉血氧分压;a为x±s,b为n(%),c为M(Q1, Q3);1 mmHg=0.133 kPa | ||||
训练集单因素分析结果显示,与非AKI组相比较,AKI组年龄更高,WBC、Lac、Scr、BUN、尿酸、CRP、ACAG水平更高(P < 0.05),见表 2。
| 因素 | AKI组(n=85) | 非AKI组(n=182) | χ2/t/Z值 | P值 |
| 年龄(岁) | 62.33±10.95 | 57.12±12.98 | 3.205 | 0.002 |
| 性别 | 0.049 | 0.824 | ||
| 男 | 43(50.59) | 99(54.40) | ||
| 女 | 42(49.41) | 83(45.60) | ||
| BMI(kg/m2) | 23.57±1.75 | 23.89±1.94 | 1.294 | 0.197 |
| 吸烟史 | 13(15.29) | 31(17.03) | 0.127 | 0.721 |
| 饮酒史 | 12(14.12) | 25(13.74) | 0.007 | 0.933 |
| 原发感染部位 | 1.062 | 0.786 | ||
| 肺部 | 50(58.82) | 105(57.69) | ||
| 腹腔 | 26(30.59) | 53(29.12) | ||
| 泌尿系 | 8(9.41) | 18(9.89) | ||
| 其他 | 1(1.18) | 6(3.30) | ||
| 糖尿病史 | 29(34.12) | 61(33.52) | 0.009 | 0.923 |
| 高血压史 | 28(32.94) | 59(32.42) | 0.007 | 0.932 |
| 冠心病史 | 12(14.12) | 27(14.84) | 0.024 | 0.877 |
| SOFA评分(分) | 6(4, 10) | 5(4, 11) | 1.734 | 0.154 |
| APACHE Ⅱ评分(分) | 24.59±4.78 | 24.08±4.92 | 0.796 | 0.427 |
| 机械通气 | 52(61.18) | 108(59.34) | 0.081 | 0.776 |
| WBC(×109/L) | 15.23±2.88 | 11.09±2.95 | 10.763 | 0.000 |
| PLT(×109/L) | 128.45±25.62 | 131.37±31.88 | 0.740 | 0.460 |
| ALB(g/L) | 28.92±4.15 | 29.23±3.66 | 0.617 | 0.538 |
| Lac(mmol/L) | 2.6(2.0, 5.0) | 2.0(1.55, 3.15) | 2.847 | 0.006 |
| Scr(μmol/L) | 188.64±39.84 | 91.26±25.65 | 24.018 | < 0.001 |
| BUN(mmol/L) | 15.85(10.12, 22.38) | 8.95(5.85, 12.90) | 4.128 | < 0.001 |
| 尿酸(μmol/L) | 398.52±51.28 | 202.31±56.39 | 27.243 | < 0.001 |
| PT(s) | 13.81±2.88 | 13.25±2.96 | 1.452 | 0.148 |
| CRP(mg/L) | 131.29±31.89 | 90.25±21.26 | 12.435 | 0.000 |
| PaCO2(mmHg) | 31.75±8.27 | 32.19±8.79 | 0.388 | 0.698 |
| PaO2(mmHg) | 85.69±11.89 | 86.33±12.35 | 0.399 | 0.690 |
| 氧合指数 | 248(177, 301) | 252(169, 310) | 0.451 | 0.588 |
| ACAG(mmol/L) | 23.85±2.62 | 19.62±2.78 | 11.793 | < 0.001 |
| 注:BMI为体质量指数,SOFA为序贯器官衰竭评分,APACHE Ⅱ为急性生理与慢性健康Ⅱ评分,WBC为白细胞计数,PLT为血小板计数,ALB为白蛋白,Lac为血清乳酸,Scr为血肌酐,BUN为血尿素氮,PT为凝血酶原时间,CRP为C反应蛋白,PaCO2为动脉血二氧化碳分压,PaO2为动脉血氧分压,ACAG为白蛋白校正阴离子间隙 | ||||
以年龄、WBC、Lac、Scr、BUN、尿酸、CRP、ACAG为自变量,以训练集中脓毒症患者是否发生AKI因变量,进行多因素Logistic回归分析,校正混杂因素后,结果显示:年龄、WBC、Lac、Scr、BUN、尿酸、CRP、ACAG是训练集中脓毒症患者发生AKI的危险因素(P < 0.05),见表 3。
| 因素 | β | SE | Wald χ2 | OR | 95%CI | P值 |
| 年龄 | 1.035 | 0.388 | 7.115 | 2.815 | 1.316~6.022 | 0.009 |
| WBC | 0.655 | 0.189 | 12.027 | 1.926 | 1.330~2.790 | < 0.001 |
| Lac | 0.783 | 0.266 | 8.675 | 2.189 | 1.300~3.687 | 0.006 |
| Scr | 1.149 | 0.315 | 13.312 | 3.156 | 1.702~5.852 | 0.020 |
| BUN | 1.082 | 0.296 | 13.366 | 2.951 | 1.652~5.271 | < 0.001 |
| 尿酸 | 1.138 | 0.345 | 10.889 | 3.122 | 1.588~6.139 | < 0.001 |
| CRP | 1.046 | 0.368 | 8.083 | 2.847 | 1.384~5.856 | 0.007 |
| ACAG | 1.083 | 0.291 | 13.846 | 2.953 | 1.669~5.224 | < 0.001 |
根据多因素Logistic回归分析结果,建立列线图模型结果,见图 1。根据各变量对应的分值,分值之和即为总分,总分所对应风险轴的值为脓毒症患者发生AKI的概率,总分越高,脓毒症患者发生AKI的概率越高。
|
| 图 1 脓毒症患者发生AKI风险的列线图模型 Fig 1 Nomogram model of AKI risk in patients with sepsis |
|
|
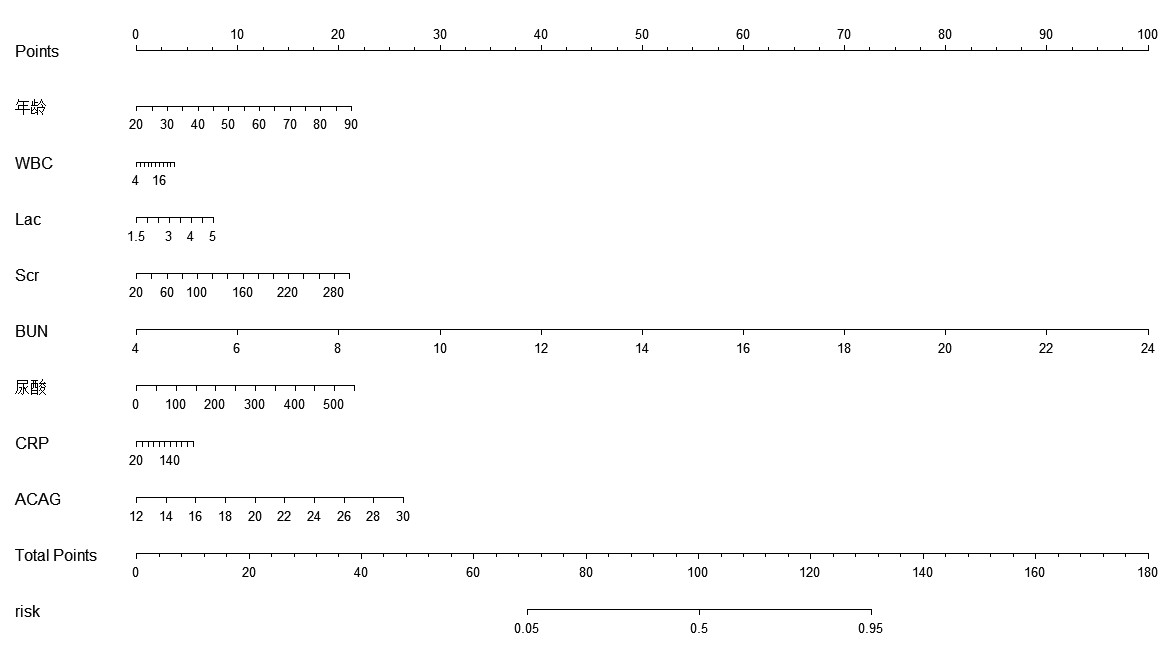
ROC分析结果显示,基于多因素分析结果构建的列线图模型预测训练集和验证集脓毒症患者术后发生AKI的AUC分别为0.95(95%CI: 0.90~0.98)、0.92(95%CI: 0.89~0.97),表明模型的区分度良好,见图 2。
|
| 图 2 列线图预测模型在训练集和验证集中的ROC曲线 Fig 2 ROC curve of nomogram prediction model in training set and validation set |
|
|
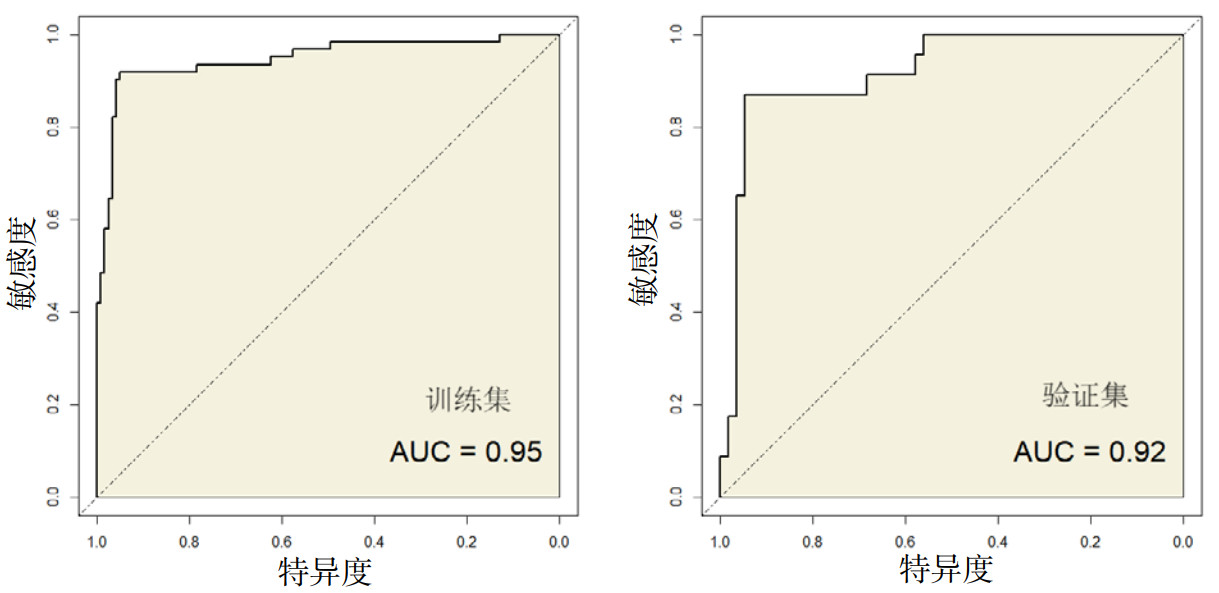
校准曲线分析结果显示,基于多因素分析结果构建的列线图模型预测训练集和验证集脓毒症患者术后发生AKI与实际发生具有较好的一致性,经过Hosmer-Lemeshow拟合优度检验后的统计值分别为0.295、0.264(P=0.563、0.488),表明模型的校准度良好,见图 3。
|
| 图 3 列线图预测模型在训练集和验证集中的校准曲线 Fig 3 Calibration curves of nomogram prediction model in training set and validation set |
|
|
DCA曲线结果显示,基于多因素分析结果构建的列线图模型预测概率在0.01~0.95时,临床实际应用效果较好,临床获益良好,见图 4。
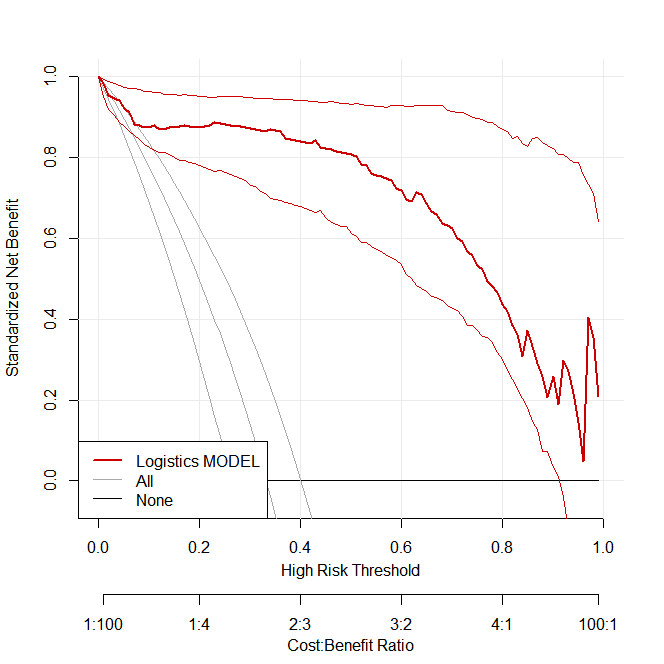
|
| 图 4 列线图预测模型的DCA曲线 Fig 4 DCA curve of nomogram prediction model |
|
|
本研究中脓毒症患者AKI的总体发生率为46.44%,与Fang等[12]报道结果相近。AKI是脓毒症患者住院期间严重且常见的并发症之一,也是导致患者住院时间延长以及死亡风险增加的重要原因[13],因此及早预测AKI对改善脓毒症患者预后至关重要。既往临床多采用Scr、BUN等指标对AKI进行预测,但上述指标在肾脏已经发生一定程度损伤后才会出现明显变化,缺乏早期预测价值,且单一指标难以全面反映脓毒症患者复杂的病理生理状态[14-15],因此构建脓毒症患者发生AKI的风险预测模型对提高预测准确性具有重要意义。
本研究结果显示,年龄、WBC、Lac、Scr、BUN、尿酸、CRP、ACAG是脓毒症患者发生AKI的危险因素。Gao等[16]研究证实年龄越大,患者肾脏的结构和功能越容易出现生理性衰退,肾血流量减少,肾小球滤过率下降,肾脏对缺血、缺氧等损伤因素的耐受性降低,在脓毒症状态下,老年人的肾脏更容易受到炎症介质、感染毒素等的攻击,从而增加了AKI的发生风险。高WBC水平反映了机体强烈的炎症反,既往研究指出[17],过多的白细胞在肾脏内聚集、活化,释放大量的炎症介质和氧自由基,导致肾脏血管内皮细胞损伤、肾小管上皮细胞凋亡,进而影响肾脏的正常功能,增加AKI的发生风险。Wu和Qin[18]研究发现,Lac是重症患者并发AKI的独立危险因素,由于感染导致组织灌注不足、细胞缺氧,无氧酵解增加,Lac水平升高;同时Lac升高可能反映了肾脏组织的缺血缺氧状态,持续的缺血缺氧会导致肾脏细胞损伤和功能障碍,最终引发AKI。Scr、BUN、尿酸均是临床常用的反映肾功能的指标,Scr、BUN主要通过肾小球滤过排出体外,当肾脏功能受损时,其排泄减少,血中水平升高[19];尿酸是嘌呤代谢的终产物,肾脏是尿酸排泄的主要器官,肾功能损害会导致尿酸排泄障碍,血尿酸水平升高,这些指标的异常升高反映了肾脏功能已经受到一定程度的损害,是AKI发生的重要信号[20]。Sheng等[21]研究证实,CRP是脓毒症患者发生AKI的危险因素,在脓毒症过程中,CRP水平的升高反映了机体的炎症反应程度,过度的炎症反应会对肾脏造成损伤,破坏肾脏的正常结构和功能,增加AKI的发生风险。ACAG是评估酸碱平衡和代谢紊乱的重要指标。赵明明等[22]文献报道指出,ACAG在预测多器官功能障碍综合征患者早期预后不良中具有良好的应用价值。Hu等[23]研究也发现,ACAG水平与ICU脓毒症患者死亡有关,其预测性能明显高于白蛋白和AG。在脓毒症患者中,ACAG可能反映了体内有机酸的蓄积、代谢紊乱以及组织灌注不足等情况[24]。本研究发现ACAG是AKI的危险因素,提示ACAG的异常可能与肾脏的损伤机制相关。体内代谢紊乱和酸碱失衡会影响肾脏细胞的正常代谢和功能,导致肾脏损伤。
本研究通过对筛选出的AKI影响因素进行单因素和多因素logistic回归分析后,将年龄、WBC、Lac、Scr、BUN、尿酸、CRP、ACAG作为预测因子,构建列线图风险预测模型。采用ROC曲线、Hosmer-Lemeshow拟合优度检验、校准曲线和DCA评估该模型的性能。ROC曲线分析结果显示,该预测模型在训练集中的AUC为0.95,在验证集中的AUC为0.92,提示该模型在内部验证和外部验证中的效能良好,预测能力较好。风险预测模型校准度是指患者AKI实际发生情况与模型预测AKI发生风险的一致性。模型校准度好表示模型预测AKI风险的准确性概率高,而模型校准度差则意味着预测准确性概率低,临床通常使用Hosmer-Lemeshow检验来评估模型的表现。当检验的P值大于0.05时,表示模型的预测与实际发生的情况无明显差异,模型校准度高,接近理想模型,本研究中预测模型经过Hosmer-Lemeshow检验所得的P值分别为0.563、0.488,提示该模型在训练集和验证集中的拟合度较好,与实际情况无明显差异。通过绘制校准曲线,结果显示:预测AKI发生概率与实际发生概率的曲线走势基本一致,说明该模型预测AKI发生风险与实际发生具有较好的一致性。此外,本研究通过采用DCA分析该预测模型的临床实用性,结果显示模型临床实际应用效果较好,临床获益良好。
本研究存在一定的局限性,研究为单中心研究,样本可能存在一定的偏倚,其结果的推广性可能受到限制。未来需要进行多中心、大样本的研究,以进一步验证本研究的结果。其次,尽管模型中包含Scr、BUN等指标,但未能纳入更全面反映休克严重程度与血流动力学状态的指标,如血管活性药物的使用种类与剂量,低血压导致的肾脏低灌注是AKI的核心驱动因素,而血管活性药物的剂量是量化此因素的客观标准。这些关键变量的缺失,可能导致模型未能完全捕捉到与休克严重度相关的AKI风险,从而限制了其解释的全面性,后续研究可以扩大指标范围,寻找更多的危险因素。此外,本研究未将AKI的严重程度进行分期,未能评估模型在预测患者预后不良中的应用价值,今后将进一步延长随访时间,以对AKI患者进行准确的严重程度分期,分析不同分期患者的各项临床指标变化,从而更深入地评估模型在不同分期患者中的性能。另一方面,长期随访能够明确患者的最终预后结局,如是否死亡、是否发生慢性肾脏病等,进而评估模型在预测患者预后不良方面的应用价值。
综上所述,年龄、WBC、Lac、Scr、BUN、尿酸、CRP以及ACAG这些因素,均与脓毒症患者发生AKI存在关联,基于这些风险因素,构建出用于预测脓毒症患者发生AKI风险的列线图模型,该模型具备良好的区分能力、校准能力以及临床实用价值,有助于临床医师早期识别AKI的高危患者,进而采取积极有效的预防和治疗措施,以改善患者的预后。
利益冲突 所有作者声明无利益冲突
作者贡献声明 曾令泉:研究设计、数据收集、数据分析、论文撰写;郭树平:研究设计、数据收集、数据分析、论文审阅、指导
| [1] | Yang ZY, Cui XJ, Song Z. Predicting sepsis onset in ICU using machine learning models: a systematic review and meta-analysis[J]. BMC Infect Dis, 2023, 23(1): 635. DOI:10.1186/s12879-023-08614-0 |
| [2] | Weng L, Xu Y, Yin P, et al. National incidence and mortality of hospitalized sepsis in China[J]. Crit Care, 2023, 27(1): 84. DOI:10.1186/s13054-023-04385-x |
| [3] | Manrique-Caballero CL, Del Rio-Pertuz G, Gomez H. Sepsis-associated acute kidney injury[J]. Crit Care Clin, 2021, 37(2): 279-301. DOI:10.1016/j.ccc.2020.11.010 |
| [4] | White KC, Serpa-Neto A, Hurford R, et al. Sepsis-associated acute kidney injury in the intensive care unit: incidence, patient characteristics, timing, trajectory, treatment, and associated outcomes. A multicenter, observational study[J]. Intensive Care Med, 2023, 49(9): 1079-1089. DOI:10.1007/s00134-023-07138-0 |
| [5] | Bhandari R, Ekladious A, Javaid MM. Demystifying normal-anion-gap metabolic acidosis: pathophysiology, aetiology, evaluation and diagnosis[J]. Intern Med J, 2024, 54(7): 1056-1065. DOI:10.1111/imj.16418 |
| [6] | Aydın SŞ, Aksakal E. Relationship between albumin-corrected anion gap and mortality in hospitalized heart failure patients[J]. Cureus, 2023, 15(9): e45967. DOI:10.7759/cureus.45967 |
| [7] | Gao PH, Min J, Zhong L, et al. Association between albumin corrected anion gap and all-cause mortality in critically ill patients with acute kidney injury: a retrospective study based on MIMIC-Ⅳ database[J]. Ren Fail, 2023, 45(2): 2282708. DOI:10.1080/0886022X.2023.2282708 |
| [8] | Guo HX, Wang J. Association between albumin-corrected anion gap and in-hospital mortality and sepsis-associated acute kidney injury[J]. Med Sci Monit, 2024, 30: e943012. DOI:10.12659/MSM.943012 |
| [9] | Singer M, Deutschman CS, Seymour CW, et al. The third international consensus definitions for sepsis and septic shock (sepsis-3)[J]. JAMA, 2016, 315(8): 801-810. DOI:10.1001/jama.2016.0287 |
| [10] | Hatherill M, Waggie Z, Purves L, et al. Correction of the anion gap for albumin in order to detect occult tissue anions in shock[J]. Arch Dis Child, 2002, 87(6): 526-529. DOI:10.1136/adc.87.6.526 |
| [11] | Ostermann M, Bellomo R, Burdmann EA, et al. Controversies in acute kidney injury: conclusions from a Kidney Disease: Improving Global Outcomes (KDIGO) Conference[J]. Kidney Int, 2020, 98(2): 294-309. DOI:10.1016/j.kint.2020.04.020 |
| [12] | Fang YJ, Xiong B, Shang X, et al. Triglyceride-glucose index predicts sepsis-associated acute kidney injury and length of stay in sepsis: a MIMIC-Ⅳ cohort study[J]. Heliyon, 2024, 10(7): e29257. DOI:10.1016/j.heliyon.2024.e29257 |
| [13] | Wang QF, Liu F, Tao WQ, et al. Timing of renal replacement therapy in patients with sepsis-associated acute kidney injury: a systematic review and meta-analysis[J]. Aust Crit Care, 2024, 37(2): 369-379. DOI:10.1016/j.aucc.2023.06.011 |
| [14] | Fan ZY, Jiang JM, Xiao C, et al. Construction and validation of prognostic models in critically Ill patients with sepsis-associated acute kidney injury: interpretable machine learning approach[J]. J Transl Med, 2023, 21(1): 406. DOI:10.1186/s12967-023-04205-4 |
| [15] | Chang YM, Chou YT, Kan WC, et al. Sepsis and acute kidney injury: a review focusing on the bidirectional interplay[J]. Int J Mol Sci, 2022, 23(16): 9159. DOI:10.3390/ijms23169159 |
| [16] | Gao TY, Nong ZQ, Luo YZ, et al. Machine learning-based prediction of in-hospital mortality for critically ill patients with sepsis-associated acute kidney injury[J]. Ren Fail, 2024, 46(1): 2316267. DOI:10.1080/0886022X.2024.2316267 |
| [17] | Xin Q, Xie TH, Chen R, et al. A predictive model based on inflammatory and coagulation indicators for sepsis-induced acute kidney injury[J]. J Inflamm Res, 2022, 15: 4561-4571. DOI:10.2147/JIR.S372246 |
| [18] | Wu D, Qin HD. Diagnostic and prognostic values of immunocyte ratios in patients with sepsis in the intensive care unit[J]. J Infect Dev Ctries, 2023, 17(10): 1362-1372. DOI:10.3855/jidc.17907 |
| [19] | Hu HB, Li LL, Zhang Y, et al. A prediction model for assessing prognosis in critically ill patients with sepsis-associated acute kidney injury[J]. Shock, 2021, 56(4): 564-572. DOI:10.1097/SHK.0000000000001768 |
| [20] | Li Y, Huang QS, Fang MX, et al. Prognostic value of serum levels of multiple adhesion factors in patients with sepsis-induced acute kidney injury[J]. Int Urol Nephrol, 2023, 55(5): 1229-1237. DOI:10.1007/s11255-022-03394-z |
| [21] | Sheng S, Zhang YH, Ma HK, et al. Albumin levels predict mortality in sepsis patients with acute kidney injury undergoing continuous renal replacement therapy: a secondary analysis based on a retrospective cohort study[J]. BMC Nephrol, 2022, 23(1): 52. DOI:10.1186/s12882-021-02629-y |
| [22] | 赵明明, 魏芝薇, 李小石, 等. 白蛋白校正的阴离子间隙、碱剩余变化值和乳酸清除率对多器官功能障碍综合征患者预后早期评估的临床价值[J]. 临床内科杂志, 2022, 39(2): 120-122. DOI:10.3969/j.issn.1001-9057.2022.02.015 |
| [23] | Hu TY, Zhang ZW, Jiang YF. Albumin corrected anion gap for predicting in-hospital mortality among intensive care patients with sepsis: a retrospective propensity score matching analysis[J]. Clin Chim Acta, 2021, 521: 272-277. DOI:10.1016/j.cca.2021.07.021 |
| [24] | Wang YB, Zhong L, Min J, et al. Albumin corrected anion gap and clinical outcomes in elderly patients with acute kidney injury caused or accompanied by sepsis: a MIMIC-Ⅳ retrospective study[J]. Eur J Med Res, 2025, 30(1): 11. DOI:10.1186/s40001-024-02238-z |
 2025, Vol. 34
2025, Vol. 34