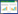2. 北京大学人民医院重症医学科/创伤救治中心, 北京 100044;
3. 北京大学人民医院创伤医学中心/中国国家创伤医学中心/教育部创伤与神经再生重点实验室(北京大学)
2. Peking University Second Clinical Medical School, Beijing 100044, China;
3. Trauma Medicine Center, Peking University People’s Hospital; National Center for Trauma Medicine of China; Key Laboratory of Trauma and Neural Regeneration (Peking University) of Ministry of Education; Beijing 100044, China
创伤出血性休克预后不良、病死率高, 占创伤后死亡的30%~40%[1], 多器官功能障碍综合征(multiple organ dysfunction syndrome, MODS)是严重创伤患者不良预后的决定性因素, 也是严重创伤患者ICU住院期间死亡的重要因素[2]。呼吸功能衰竭在创伤后MODS中最为常见, 其次是心血管功能障碍、中枢神经系统功能障碍和血液系统功能障碍, 肾脏功能障碍和肝功能障碍发生率较低, 而肝功能障碍和中枢神经系统功能障碍病死率最高[3]。创伤出血性休克合并MODS预后更差、花费更多、疾病负担更重, 并发MODS的患者ICU住院时间及呼吸机使用天数显著高于非MODS患者[4], 所以创伤出血性休克合并MODS的危险因素研究很重要。近年来随着治疗方法的更新, 有必要重新探讨创伤出血性休克合并MODS患者院内死亡的危险因素, 从而探索早期防治创伤出血性休克合并MODS, 并降低院内死亡的策略。本研究旨在探讨创伤出血性休克合并MODS患者发生院内死亡的危险因素。
1 资料与方法 1.1 研究对象本研究回顾性分析2013年1月至2023年5月在北京大学人民医院就诊的创伤出血性休克患者共417例, 整体院内病死率9.4%(39/417);其中合并MODS患者234例, MODS发病率56.0%, 创伤出血性休克合并MODS院内病死率12.4%(29/234), 非MODS患者院内病死率5.5%(10/183)。选取创伤合并MODS患者并依据院内生存情况将患者分为生存组(205例)和死亡组(29例)。本研究获得北京大学人民医院伦理审查委员会批准(批准号2020PHB258-01)。
纳入标准: 创伤出血性休克导致的MODS患者, 年龄大于18岁, 创伤出血性休克的定义参考本团队之前发表的研究[5]; MODS的定义为创伤出血性休克一周内出现两个或两个以上器官功能障碍, 序贯器官衰竭评估(sequential organ failure assessment, SOFA)评分≥4分[6]。
排除标准: 感染等其他原因导致的MODS的患者; 其他原因导致休克的患者; 致命性创伤导致的濒死患者, 预计入院24 h内死亡的患者; 创伤直接导致的肺损伤、心脏损伤、肝损伤和肾损伤; 处于妊娠期的患者; 数据不全患者。
1.2 观察指标收集数据包括(1)一般情况: 性别、年龄、病史(高血压、脑卒中、冠心病、慢性肺病、糖尿病、慢性肾功能不全、恶性肿瘤); (2)伤情评估: 主要出血部位(胸部、骨盆、四肢、腹部、其他)、受伤到入院时间、入院即刻体温、心率、平均动脉压(2/3舒张压+1/3收缩压); (3)入院即刻实验室指标: 白细胞计数、中性粒细胞计数、淋巴细胞计数、血红蛋白、血小板计数、凝血酶原时间、活化部分凝血活酶时间、纤维蛋白原、D-二聚体、总胆红素、白蛋白、血肌酐、估算肾小球滤过率、尿酸、肌酸激酶、心脏肌钙蛋白I、B型脑钠肽、C反应蛋白、降钙素原、碱剩余、氧合指数(PaO2/FiO2)、乳酸与白蛋白比值、葡萄糖与白蛋白比值、C反应蛋白与白蛋白比值、白蛋白与纤维蛋白原比值; (4)入院1周内发生的急性呼吸窘迫综合征、急性肾损伤、急性心肌损伤、创伤性凝血病、急性肝功能不全; (5)创伤严重程度评分(injury severity score, ISS)、急性生理与慢性健康评分(acute physiology and chronic health evaluation, APACHE Ⅱ)、序贯器官衰竭评分(sequential organ failure assessment, SOFA)。
急性呼吸窘迫综合征的定义为1周之内出现的已知临床诱因或新发或原有呼吸系统症状加重的、无法用心功能衰竭或液体负荷过重解释的呼吸衰竭, 影像学观察到不能完全用胸腔积液、肺不张或结节来解释的双肺透光度下降, PEEP/CPAP ≥ 5 cmH2O且氧合指数(PaO2/FiO2)≤300 mmHg[7](1 cmH2O=0.098 kPa, 1 mmHg=0.133 kPa)。急性肾损伤的定义为已知或推测在过去7 d内血肌酐升高≥基线值的1.5倍或48 h内血肌酐升高绝对值≥26.5 μmol/L(0.3 mg/dL), 或持续6 h以上尿量减少[尿量 < 0.5 mL/(kg·h)][8]。心肌损伤的定义为心肌肌钙蛋白I高于正常参考值上限第99百分位数, 若心肌肌钙蛋白值有上升和(或)下降, 则考虑为急性心肌损伤[9], 心脏肌钙蛋白Ⅰ通过DXI 800全自动化学发光免疫分析仪(Beckman Coulter, Brea, CA, USA)测定, 第99百分位数为0.034 ng/mL。创伤性凝血病是指在创伤后由于大量出血及组织损伤后激活凝血、纤溶、抗凝途径, 在早期出现的急性凝血功能紊乱, 定义为凝血酶原时间(prothrombin time, PT) > 18 s或活化部分凝血酶原时间(activated partial thromboplastin time, APTT) > 60 s或国际标准化比值(international normalized ratio, INR) > 1.5[10]。急性肝功能不全的定义为创伤出血性休克后Child-Turcotte-Pugh评分≥5分[11]。
1.3 统计学方法使用SPSS 26.0统计软件进行数据分析。符合正态分布的计量资料以平均值±标准差(x±s)表示, 两组间比较采用独立样本t检验; 非正态分布的计量资料结果以中位数(四分位数)[M(Q1, Q3)]表示, 采用非参数Mann-Whitney U检验。计数资料组间比较采用χ2检验或Fisher精确概率法。将差异有统计学意义的指标利用Wilks’s Lambda逐步判别分析建立创伤出血性休克合并MODS患者院内死亡的判别模型, 绘制受试者工作特征曲线(receiver operating characteristic curve, ROC)并计算曲线下面积(area under the curve, AUC), 采用交互验证方法评估所建模型预测结果的准确性。以P < 0.05为差异有统计学意义。
2 结果 2.1 临床资料的比较生存组和死亡组之间主要出血部位(四肢)、受伤到入院时间、体温、血小板计数、凝血酶原时间、活化部分凝血活酶时间、纤维蛋白原、D-二聚体、白蛋白、血肌酐、估算肾小球滤过率、尿酸、肌钙蛋白、降钙素原、碱剩余、乳酸与白蛋白比值、葡萄糖与白蛋白比值、急性呼吸窘迫综合征、急性肾损伤、急性心肌损伤、创伤性凝血病、ISS、APACHE Ⅱ和SOFA的比较, 差异有统计学意义(均P < 0.05), 其他指标比较差异均无统计学意义(均P > 0.05), 见表 1。
| 变量 | 生存组n=205 | 死亡组n=29 | 统计值 | P值 |
| 性别(n, %) | ||||
| 男 | 75 (36.6) | 23 (79.3) | 2.836 | 0.100 |
| 女 | 130 (63.4) | 6 (20.7) | ||
| 年龄(岁)a | 58.03±18.36 | 60.00±19.63 | 0.535 | 0.576 |
| 病史(n, %) | ||||
| 高血压 | 49 (23.9) | 10 (34.5) | 1.508 | 0.254 |
| 脑卒中 | 8 (4.0) | 1 (3.4) | 0.014 | 1.000 |
| 冠心病 | 13 (6.3) | 2 (6.9) | 0.013 | 1.000 |
| 慢性肺病 | 6 (2.9) | 2 (6.9) | 1.213 | 0.259 |
| 糖尿病 | 20 (9.8) | 3 (10.3) | 0.010 | 1.000 |
| 慢性肾功能不全 | 3 (1.5) | 1 (3.4) | 0.596 | 0.413 |
| 恶性肿瘤 | 11 (5.4) | 0 (0.0) | 1.641 | 0.368 |
| 主要出血部位(n, %) | ||||
| 胸部 | 43 (21.0) | 8 (27.6) | 0.651 | 0.471 |
| 骨盆 | 36 (17.6) | 7 (24.1) | 0.733 | 0.344 |
| 四肢 | 62 (30.2) | 3 (10.3) | 5.015 | 0.026 |
| 腹部 | 39 (19.0) | 4 (13.8) | 0.464 | 0.615 |
| 其他 | 25 (12.2) | 7 (24.1) | 2.752 | 0.148 |
| 受伤到入院时间(h)b | 5.0 (2.8, 9.0) | 2.0 (0.8, 16.5) | 2.992 | 0.003 |
| 体温(℃)b | 37.0 (36.6, 38.3) | 36.8 (35.0, 38.3) | 2.044 | 0.041 |
| 心率(次/min)a | 112.3±21.0 | 119.8±31.2 | 1.645 | 0.119 |
| 平均动脉压(mmHg)b | 69.5 (57.8, 98.5) | 54.0 (38.5, 125.5) | 1.505 | 0.132 |
| 白细胞计数(×109/L)b | 13.8 (9.4, 20.5) | 14.1 (9.8, 18.8) | 0.650 | 0.516 |
| 中性粒细胞计数(×109/L)a | 11.5±5.9 | 10.7±7.2 | 0.582 | 0.081 |
| 淋巴细胞计数b(×109/L) | 0.7 (0.5, 1.0) | 0.5 (0.4, 8.3) | 1.209 | 0.227 |
| 血红蛋白(g/L)a | 90.2±22.1 | 80.8±34.6 | 1.948 | 0.003 |
| 血小板计数(×109/L)b | 74.0 (56.8, 103.8) | 22.0 (13.5, 78.0) | 2.472 | 0.013 |
| 凝血酶原时间(s)b | 14.5 (13.4, 15.8) | 18.6 (15.6, 26.2) | 3.553 | < 0.001 |
| 活化部分凝血活酶时间b(s) | 29.4 (27.5, 34.4) | 66.8 (39.1, 139.8) | 3.339 | 0.001 |
| 纤维蛋白原(mg/dL)b | 159.0 (128.8, 191.5) | 121.0 (52.0, 149.5) | 3.011 | 0.003 |
| D-二聚体(mg/L)b | 10.5 (3.3, 29.6) | 60.0 (33.7, 70.9) | 3.508 | < 0.001 |
| 总胆红素(μmol/L)b | 23.1 (15.1, 38.9) | 32.6 (22.5, 69.9) | 0.334 | 0.739 |
| 白蛋白(g/dL)a | 2.7±0.6 | 2.1±0.7 | 0.535 | < 0.001 |
| 血肌酐(μmol/L)b | 82.5 (60.8, 132.0) | 195.0 (123.5, 208.5) | 3.524 | < 0.001 |
| 估算肾小球滤过率[mL/(min·1.73 m2)]b | 85.3 (53.8, 101.7) | 32.0 (25.7, 54.9) | 3.951 | < 0.001 |
| 尿酸(mmol/L)b | 368.0 (278.5, 458.5) | 461.0 (391.0, 559.5) | 2.666 | 0.008 |
| 肌酸激酶(U/L)b | 1 345.5 (636.3, 3 064.3) | 1 182.0 (649.0, 20 714.5) | 0.617 | 0.537 |
| 心脏肌钙蛋白I (ng/mL)b | 0.100 (0.024, 0.359) | 1.376 (0.819, 13.509) | 3.050 | 0.002 |
| B型脑钠肽M (pg/mL)b | 117.5 (32.0, 254.8) | 729.0 (411.0, 1 091.0) | 1.922 | 0.055 |
| C反应蛋白(mg/L)b | 49.4 (16.9, 83.9) | 37.6 (16.8, 60.0) | 1.868 | 0.062 |
| 降钙素原(ng/ml)b | 2.3 (0.7, 7.9) | 37.2 (16.1, 59.3) | 2.217 | 0.027 |
| 碱剩余(mmol/L)a | -3.9±4.7 | -7.7±4.1 | 3.64 | < 0.001 |
| 氧合指数(mmHg)b | 276.5 (206.0, 356.9) | 247.0 (84.0, 383.5) | 0.820 | 0.412 |
| 乳酸与白蛋白比值(×10-3)a | 1.2±1.2 | 5.0±5.1 | -9.694 | < 0.001 |
| 葡萄糖与白蛋白比值(mmol/g)a | 0.3±0.2 | 0.5±0.4 | -3.777 | < 0.001 |
| C反应蛋白与白蛋白比值(×10-3)a | 2.2±2.1 | 1.5±1.4 | 1.313 | 0.347 |
| 白蛋白与纤维蛋白原比值(×10-3)b | 1.6 (1.1, 1.8) | 1.6 (0.8, 2.2) | 1.287 | 0.198 |
| 急性呼吸窘迫综合征(n, %) | 64 (31.2) | 15 (51.7) | 4.777 | 0.036 |
| 急性肾损伤(n, %) | 63 (30.7) | 21 (72.4) | 19.182 | < 0.001 |
| 急性心肌损伤(n, %) | 118 (57.6) | 27 (93.1) | 13.618 | < 0.001 |
| 创伤性凝血病(n, %) | 65 (31.7) | 19 (65.5) | 12.621 | 0.001 |
| 急性肝功能不全(n, %) | 81 (39.5) | 14 (48.3) | 0.809 | 0.421 |
| ISSb | 25.0 (19.0, 29.0) | 34.0 (26.5, 42.0) | 3.159 | 0.002 |
| APACHEⅡb | 18.0 (14.8, 21.8) | 25.0 (23.0, 34.0) | 6.251 | < 0.001 |
| SOFAb | 5.0 (4.0, 8.3) | 12.0 (7.0, 14.0) | 3.418 | 0.001 |
| 注: a为x±s, b为[M(Q1, Q3)]; MODS为多器官功能障碍综合征, ISS为创伤严重程度评分, APACHEⅡ为急性生理与慢性健康评分Ⅱ, SOFA为序贯器官衰竭评分 | ||||
| 变量 | 生存组分类函数系数 | 死亡组分类函数系数 | 典则判别函数 |
| 凝血酶原时间 | 2.324 | 2.838 | 0.165 |
| ISS | 0.552 | 0.809 | 0.083 |
| 估算肾小球滤过率 | 0.075 | 0.034 | -0.013 |
| 乳酸与白蛋白比值 | -0.802 | -0.120 | 0.219 |
| 常量 | -27.083 | -43.862 | -4.084 |
| 截断值 | 2.052 | ||
| 注: ISS为创伤严重程度评分 | |||
将以上有统计学意义的指标采用逐步判别分析方法建立判别模型, 最终凝血酶原时间、ISS、估算肾小球滤过率、乳酸与白蛋白比值进入判别模型, 所得判别函数为: 判别生存和死亡的函数Y=0.165×凝血酶原时间(s)+0.083×ISS-0.013×估算肾小球滤过率+0.219×乳酸与白蛋白比值-4.084。
2.3 模型判别效果评价将样本相关指标数据代入方程, 若Y值> 2.052, 则判断患者死亡风险高, 应重点关注此类患者; 若Y值< 2.052, 则判断患者死亡风险低。将预测结果与实际结果进行对比, 预测创伤出血性休克合并MODS患者死亡风险的ROC曲线分析显示, AUC=0.791, 9%CI=0.671~0.911, 见图 1。

|
| 图 1 判别模型预测创伤出血性休克合并MODS患者死亡风险的ROC曲线 Fig 1 ROC curve of discriminative model for predicting the risk of death in patients with traumatic hemorrhagic shock combined with MODS |
|
|
本研究中创伤出血性休克患者MODS发病率56.0%, 病死率12.4%, 非MODS病死率5.5%。德国的一项研究[12]报道2002年到2011年间创伤患者MODS发病率32.7%, 所有患者的病死率从2002年的18.1%下降到2011年的15.3%, MODS患者的病死率由42.6%下降至2011年的33.3%。英国2019年调查[13]发现MODS发病率55%, MODS患者病死率22%, 非MODS患者病死率0.5%。2007年祝伟等[14]研究发现多发伤患者MODS发病率60.7%, MODS病死率55.38%, 非MODS病死率4.76%。本研究中创伤出血性休克患者MODS发病率相比德国较高, 与英国的数据相近, 与我国16年前的研究相比下降7.7%, 与德国创伤患者MODS发病率的差异可能与统计纳入标准有关, 本研究纳入创伤出血性休克患者比德国纳入的创伤患者筛选标准更严格。本研究中MODS患者病死率比英国、德国明显要低, 相比于我国2007年研究明显下降, 这表明目前大型综合医院创伤救治水平尤其是对MODS患者的治疗及ICU管理有着明显发展, 已经处于国际领先水平。
凝血酶原时间反映创伤患者入院时的凝血功能障碍情况, 而凝血功能障碍正是创伤相关疾病及其并发症发展的危险因素, 发生凝血功能障碍的患者更容易出现多器官功能衰竭和死亡[15]。创伤出血性休克患者由于血容量不足、微循环供氧缺乏, 引起代谢性酸中毒[16], 实验表明酸中毒可降低凝血因子活性、抑制血小板聚集[17]、增加纤维蛋白原的消耗[18], 进而影响凝血功能。机体创伤会激活凝血系统, 促进凝血酶和纤维蛋白产生, 引发血栓形成[19], 可能导致多器官功能衰竭; 随着凝血状态的持续, 凝血因子耗竭, 组织出血风险增加, 可能导致患者死亡[20]。Raum等[21]研究发现凝血酶原时间反映的凝血功能障碍程度与ISS损伤严重程度之间存在很强的相关性, 并确定凝血酶原时间可以独立预测重大创伤后的生存情况, 这与本研究结果得出的凝血酶原时间可以预测创伤出血性休克后MODS的死亡风险相符。Mica等[22]在瑞士的研究发现, ISS > 17分的多发创伤患者中, 依据凝血酶原活动度(%)=(正常人凝血酶原时间-8.7)/(患者凝血酶原时间-8.7)×100%进行换算, 入院当日死亡患者、入院1~3 d内死亡患者、入院3 d后死亡患者、入院所有死亡患者的凝血酶原时间(s)均值分别为21.29、17.70、15.28、15.89, 李蕙伊等[23]研究发现创伤死亡患者凝血酶原时间为17.4(14.9, 24.2)s, 本研究发现创伤出血性休克合并MODS死亡患者的凝血酶原时间(s)为18.6(15.6, 26.2)。本研究的结果与瑞士及我国其他地区的研究相近, 可进一步表明用凝血酶原时间来预测创伤出血性休克合并MODS的死亡风险具有很好的应用前景。
ISS是常用的损伤评估量表, 对身体上三个受伤最严重的区域进行损伤量化, 其结果表示解剖损伤的严重程度, 可用以评估患者损伤情况并预测患者预后[24], 本研究表明ISS具有良好的针对创伤出血性休克合并MODS患者的死亡预测能力。Tamim等[25]在贝鲁特美国大学医学中心对891例创伤患者进行研究, 发现死亡组ISS为25(9, 42)分, 本研究发现创伤出血性休克合并MODS死亡患者ISS的为34.0(26.5, 42.0)分。本研究结果同Tamim等的研究结果相比ISS评分较高, 可能与统计纳入患者的创伤程度有关, 这仍可以说明ISS评分在我国具有良好的创伤出血性休克合并MODS患者的死亡预测能力。
估算肾小球滤过率是常用的肾功能评估指标, 肾功能受损患者死亡风险升高[26]。本研究发现估算肾小球滤过率的降低与创伤出血性休克合并MODS病死率呈正相关。Shan等[27]发现当患者估算肾小球滤过率低于90 mL/(min·1.73 m2)时, 死亡风险随着估算肾小球滤过率的降低呈指数增长, 尤其与心血管病死率相关, 这在创伤出血性休克合并MODS中可能与失血过多造成心血管损伤相关, 具体机制有待进一步探索。
乳酸是组织缺氧导致无氧呼吸的产物[28], 可作为休克的预后标志物[29], 能反映炎症严重程度的血清白蛋白也被列为休克的预后标志物[30], 然而仅基于一项指标的预测可能有局限性, 近期一些研究认为乳酸与白蛋白比值和MODS及死亡率相关, 被认为是一项可以预测死亡风险的标志物[31]。Ray等[32]在美国开展的对PICU患者的研究中发现, 相对于单纯的乳酸指标, 乳酸与白蛋白比值对死亡风险有更好的预测能力, 且在MODS与非MODS两组间差异无统计学意义。Gharipour等[33]的研究结果支持将乳酸与白蛋白比值作为危重症患者早期预后标志物, 本研究也表明乳酸与白蛋白比值具有良好的针对创伤出血性休克合并MODS患者的死亡预测能力。
创伤出血性休克合并MODS的影响因素众多, 但由于诸多因素的限制, 本研究只检测了其中部分指标, 只能推测出凝血酶原时间、ISS、估算肾小球滤过率、乳酸与白蛋白比值与创伤出血性休克合并MODS患者的死亡有着显著的相关性, 并能一定程度上进行预测。但是本研究样本量较小, 因此, 所筛选出的影响因素及据此所建立的预测模型的代表性、准确性有待于在今后工作中进一步完善和提高。
本研究所建立的模型预测创伤出血性休克合并MODS患者院内死亡风险的准确度较高, 具有实际应用价值。由于创伤救治的医疗水平越来越高, 有更多的患者在严重创伤中幸存下来, 这部分所受创伤较严重的患者有更大的可能发展为MODS, 因而创伤后MODS的发病率不断升高, 这给重症监护带来了更大的挑战。凝血酶原时间、ISS、估算肾小球滤过率、乳酸等因素在重症监护室有着良好的死亡风险预测前景, 其预测可以更好地指导创伤患者的治疗方案比如一些预防性的保护措施, 可以改善预后、降低严重创伤患者的病死率。本研究将为创伤救治工作者明确防治重点人群、为患者制订诊疗方案提供决策支持。
利益冲突 所有作者声明无利益冲突
作者贡献声明 姜东鑫: 研究设计、统计学分析、论文撰写和修改; 赵秀娟、朱凤雪、王天兵: 研究设计、论文修改; 姜东鑫、黄伟: 负责数据收集及整理
| [1] | Kauvar DS, Lefering R, Wade CE. Impact of hemorrhage on trauma outcome: an overview of epidemiology, clinical presentations, and therapeutic considerations[J]. J Trauma, 2006, 60(6 Suppl): S3-11. DOI:10.1097/01.ta.0000199961.02677.19 |
| [2] | Marshall JC, Cook DJ, Christou NV, et al. Multiple organ dysfunction score: a reliable descriptor of a complex clinical outcome[J]. Crit Care Med, 1995, 23(10): 1638-1652. DOI:10.1097/00003246-199510000-00007 |
| [3] | 任成山, 刘素刚, 毛宝龄. 创伤后多器官功能衰竭的临床特征[C]. 中华医学会急诊医学学会. 中华医学会全国第五次急诊医学学术会议论文集, 1994, 2: 40-41. |
| [4] | Durham RM, Moran JJ, Mazuski JE, et al. Multiple organ failure in trauma patients[J]. J Trauma Inj Infect Crit Care, 55(4): 608-616. DOI:10.1097/01.ta.0000092378.10660.d1 |
| [5] | 赵秀娟, 王储, 黄伟, 等. 创伤出血性休克患者院内死亡风险的判别分析[J]. 中华普通外科杂志, 2021, 36(8): 608-611. DOI:10.3760/cma.j.cn113855-20210309-00143 |
| [6] | Fröhlich M, Wafaisade A, Mansuri A, et al. Which score should be used for posttraumatic multiple organ failure? - Comparison of the MODS, Denver- and SOFA- Scores[J]. Scand J Trauma Resusc Emerg Med, 2016, 24(1): 130. DOI:10.1186/s13049-016-0321-5 |
| [7] | Gorman EA, O'Kane CM, McAuley DF. Acute respiratory distress syndrome in adults: diagnosis, outcomes, long-term sequelae, and management[J]. Lancet, 2022, 400(10358): 1157-1170. DOI:10.1016/S0140-6736(22)01439-8 |
| [8] | Khwaja A. KDIGO clinical practice guidelines for acute kidney injury[J]. Nephron Clin Pract, 2012, 120(4): c179-c184. DOI:10.1159/000339789 |
| [9] | Thygesen K, Alpert JS, Jaffe AS, et al. Fourth universal definition of myocardial infarction (2018)[J]. J Am Coll Cardiol, 2018, 72(18): 2231-2264. DOI:10.1016/j.jacc.2018.08.1038 |
| [10] | Brohi K, Cohen MJ, Davenport RA. Acute coagulopathy of trauma: mechanism, identification and effect[J]. Curr Opin Crit Care, 2007, 13(6): 680-685. DOI:10.1097/MCC.0b013e3282f1e78f |
| [11] | 朱珠, 曹运莉, 孙钢, 等. 肝功能不全分级方法概述[J]. 中国药师, 2012, 15(3): 418-421. DOI:10.3969/j.issn.1008-049X.2012.03.053 |
| [12] | Fröhlich M, Lefering R, Probst C, et al. Epidemiology and risk factors of multiple-organ failure after multiple trauma: an analysis of 31, 154 patients from the TraumaRegister DGU[J]. J Trauma Acute Care Surg, 2014, 76(4): 921-927. DOI:10.1097/TA.0000000000000199 |
| [13] | Cole E, Gillespie S, Vulliamy P, et al. Multiple organ dysfunction after trauma[J]. Br J Surg, 2020, 107(4): 402-412. DOI:10.1002/bjs.11361 |
| [14] | 祝伟, 陈华文, 汤睿, 等. 多发伤合并多器官功能障碍综合征的危险因素分析[J]. 中华急诊医学杂志, 2007, 16(12): 1248-1250. DOI:10.3760/j.issn.1671-0282.2007.12.004 |
| [15] | Spahn DR, Bouillon B, Cerny V, et al. The European guideline on management of major bleeding and coagulopathy following trauma: fifth edition[J]. Crit Care, 2019, 23(1): 98. DOI:10.1186/s13054-019-2347-3 |
| [16] | Moore EE, Moore HB, Kornblith LZ, et al. Trauma-induced coagulopathy[J]. Nat Rev Dis Primers, 2021, 7(1): 30. DOI:10.1038/s41572-021-00264-3 |
| [17] | Marumo M, Suehiro A, Kakishita E, et al. Extracellular pH affects platelet aggregation associated with modulation of store-operated Ca(2+) entry[J]. Thromb Res, 2001, 104(5): 353-360. DOI:10.1016/s0049-3848(01)00374-7 |
| [18] | Martini WZ, Holcomb JB. Acidosis and coagulopathy: the differential effects on fibrinogen synthesis and breakdown in pigs[J]. Ann Surg, 2007, 246(5): 831-835. DOI:10.1097/SLA.0b013e3180cc2e94 |
| [19] | Gando S. Tissue factor in trauma and organ dysfunction[J]. Semin Thromb Hemost, 2006, 32(1): 48-53. DOI:10.1055/s-2006-933340 |
| [20] | Brohi K, Singh J, Heron M, et al. Acute traumatic coagulopathy[J]. J Trauma, 2003, 54(6): 1127-1130. DOI:10.1097/01.TA.0000069184.82147.06 |
| [21] | Raum MR, Bouillon B, Rixen D, et al. The prognostic value of prothrombin time in predicting survival after major trauma: a prospective analysis of 1, 351 patients from the German trauma registry[J]. Eur J Trauma, 2001, 27(3): 110-116. DOI:10.1007/s00068-001-1106-7 |
| [22] | Mica L, Rufibach K, Keel M, et al. The risk of early mortality of polytrauma patients associated to ISS, NISS, APACHE Ⅱ values and prothrombin time[J]. J Trauma Manag Outcomes, 2013, 7: 6. DOI:10.1186/1752-2897-7-6 |
| [23] | 李蕙伊, 刘畅, 赵洋子, 等. 急诊科成人创伤患者院内死亡危险因素分析[J]. 中国医科大学学报, 2018, 47(2): 128-131. DOI:10.12007/j.issn.02584646.2018.02.008 |
| [24] | Deng QY, Tang BH, Xue C, et al. Comparison of the ability to predict mortality between the injury severity score and the new injury severity score: a meta-analysis[J]. Int J Environ Res Public Health, 2016, 13(8): 825. DOI:10.3390/ijerph13080825 |
| [25] | Tamim H, Al Hazzouri AZ, Mahfoud Z, et al. The injury severity score or the new injury severity score for predicting mortality, intensive care unit admission and length of hospital stay: experience from a university hospital in a developing country[J]. Injury, 2008, 39(1): 115-120. DOI:10.1016/j.injury.2007.06.007 |
| [26] | Kelly DM, Li LX, Rothwell PM, et al. Etiological subtypes of transient ischemic attack and ischemic stroke in chronic kidney disease: population-based study[J]. Stroke, 2020, 51(9): 2786-2794. DOI:10.1161/STROKEAHA.120.030045 |
| [27] | Shan Y, Zhang JW, Lu YQ, et al. Kidney function measures and mortality: a mendelian randomization study[J]. Am J Kidney Dis, 2024, 83(6): 772-783. DOI:10.1053/j.ajkd.2023.10.014 |
| [28] | Gibot S. On the origins of lactate during sepsis[J]. Crit Care, 2012, 16(5): 151. DOI:10.1186/cc11472 |
| [29] | Mikkelsen ME, Miltiades AN, Gaieski DF, et al. Serum lactate is associated with mortality in severe sepsis independent of organ failure and shock[J]. Crit Care Med, 2009, 37(5): 1670-1677. DOI:10.1097/CCM.0b013e31819fcf68 |
| [30] | Yin M, Si L, Qin WD, et al. Predictive value of serum albumin level for the prognosis of severe sepsis without exogenous human albumin administration: a prospective cohort study[J]. J Intensive Care Med, 2018, 33(12): 687-694. DOI:10.1177/0885066616685300 |
| [31] | Wang B, Chen G, Cao YF, et al. Correlation of lactate/albumin ratio level to organ failure and mortality in severe sepsis and septic shock[J]. J Crit Care, 2015, 30(2): 271-275. DOI:10.1016/j.jcrc.2014.10.030 |
| [32] | Ray CC, Pollack MM, Gai JX, et al. The association of the lactate-albumin ratio with mortality and multiple organ dysfunction in PICU patients[J]. Pediatr Crit Care Med, 2023, 24(9): 760-766. DOI:10.1097/PCC.0000000000003272 |
| [33] | Gharipour A, Razavi R, Gharipour M, et al. Lactate/albumin ratio: an early prognostic marker in critically ill patients[J]. Am J Emerg Med, 2020, 38(10): 2088-2095. DOI:10.1016/j.ajem.2020.06.067 |
 2025, Vol. 34
2025, Vol. 34