2. 陆军军医大学第一附属医院急诊医学科, 重庆 400038
2. Department of Emergency Medicine, The First Affiliated Hospital of Army Medical University, Chongqing 400038, China
随着社会快速发展, 创伤事件的发生率与死亡率持续攀升[1], 已成为一个世界性的严峻公共卫生问题[2]。严重创伤具有伤情复杂、进展迅速、致残率及致死率高等特点[3], 其救治的关键在于早期快速评估与精准化复苏。创伤严重评分是评估患者伤情与预后的重要工具[4], 但目前种类繁多, 既包括以创伤严重度评分(injury severity score, ISS)为代表的解剖学评分, 也包括急性生理学与慢性健康状况评分系统Ⅱ(acute physiology and chronic health evaluation Ⅱ, APACHE Ⅱ)、序贯器官衰竭评分(sequential organ failure assessment, SOFA)等生理学评分, 以及院前分类指数(prehospital index, PHI)、修正创伤评分(revised trauma score, RTS)和循环呼吸腹部运动语言评分(Circulation, Respiration, Abdomen, Motor, Speech, CRAMS)等院前评分, 尚缺乏统一的应用标准。
我国西南地区地理环境复杂、经济发展相对滞后, 部分偏远地区医疗资源匮乏, 基层急救能力与东部发达地区相比存在一定差距。因此, 探索适用于该地区的创伤评估方案, 对改善患者预后具有重要意义。然而, 针对西南地区特定医疗环境下的多种评分系统效能比较研究相对有限, 其预测效能仍需进一步验证。本研究系统比较上述六种评分对西南地区严重创伤患者预后的预测价值, 旨在为临床优化评估策略提供本地化的循证依据。
1 资料与方法 1.1 研究对象本研究采用回顾性队列设计。研究对象为2018年1月至2023年10月陆军军医大学第一附属医院收治的479例严重创伤患者。纳入标准: ①年龄≥ 16岁; ②损伤严重程度评分(ISS)≥ 16分; ③伤后24 h内入院。排除标准为: ①合并严重基础慢性疾病; ②烧伤或电击伤; ③临床资料不全。根据患者入院后28 d转归分为存活组(n=424)和死亡组(n=55), 所有患者入院后均遵循严重创伤救治原则进行积极复苏与损伤控制性治疗。本研究经陆军军医大学第一附属医院伦理委员会批准, 伦理批号: KY2025049。
1.2 研究方法相关研究数据由两名经标准化培训的研究人员提取, 如出现分歧则由第三位资深急诊专家仲裁。记录所有患者入院时的PHI、RTS、CRAMS评分, 以及入院24 h内最差生理参数(用于计算APACHE Ⅱ、SOFA评分)。ISS评分基于入院24 h内所有可获得的影像学及手术探查结果确定[5]。APACHE Ⅱ与SOFA评分采用最差生理参数计算, 该取值方法是APACHE Ⅱ评分系统定义的标准方法[6], 其有效性及在预后研究中的实用性已得到广泛认可[7]。SOFA评分采用相同取值方法以准确量化器官功能障碍程度, 该方法在危重患者研究中普遍应用[8]。
1.3 统计学方法符合正态分布的数据以均数±标准差(x±s)描述, 两组间比较采用独立样本t检验; 非正态分布数据以中位数(四分位数)[M(Q1, Q3)]表示, 采用Mann-Whitney U检验比较组间评分差异。通过受试者工作特征曲线(ROC)计算曲线下面积(AUC), 并采用DeLong检验进行两两比较; 采用决策曲线分析(decision curve analysis, DCA)评估临床净获益。以P < 0.05为差异有统计学意义。
2 结果 2.1 两组患者的资料比较研究共纳入患者479例(主要来自云贵川渝等西南地区), 存活组424例(占88.52%), 死亡组55例(11.48%); 其中男性365例(占76.20%), 女性114例(占23.80%); 致伤因素中车祸伤200例(占41.75%)、高处坠落伤175例(占36.54%)、其他损伤(重物砸伤、摔伤、击打伤等)104例(占21.71%); 年龄52(40, 62)岁。严重创伤患者死亡的单因素分析结果显示, 两组患者的年龄、体温、呼吸、收缩压、血钠等差异有统计学意义(P < 0.05)。见表 1。
| 指标 | 存活组(n=424) | 死亡组(n=55) | 统计值 | P值 |
| 年龄(岁) a | 51.00 (39.00, 58.00) | 69.00 (54.00, 78.00) | -6.123 | < 0.001 |
| 体温(℃) a | 36.70 (36.50, 37.00) | 36.60 (36.20, 37.00) | 2.232 | 0.026 |
| 呼吸(次) a | 20.00 (20.00, 20.00) | 20.00 (16.00, 20.00) | -3.922 | 0.000 |
| 收缩压(mmHg) a | 125.00 (111.00, 139.00) | 136.00 (110.00, 160.00) | -2.238 | 0.025 |
| 血钠(mmol/L) a | 139.00 (137.00, 141.00) | 140.80 (139.00, 147.00) | -3.424 | 0.001 |
| 血肌酐(μmol/L) a | 61.61 (51.42, 74.30) | 71.82 (59.70, 85.75) | -4.020 | < 0.001 |
| FDP (mg/L) a | 29.50 (15.10, 70.20) | 70.10 (35.50, 155.70) | -5.399 | < 0.001 |
| APTT (s) b | 26.44±4.33 | 30.06±22.31 | -2.951 | < 0.001 |
| PT (s) a | 11.20 (10.50, 11.90) | 11.60 (10.80, 12.40) | -2.032 | < 0.001 |
| Fib (g/L) b | 2.44±0.88 | 2.32±1.16 | 8.006 | 0.005 |
| D-二聚体(mg/L) a | 14.94 (5.97, 26.31) | 20.55 (11.59, 41.26) | -2.685 | 0.007 |
| 乳酸(mmol/L) a | 1.40 (0.90, 2.40) | 2.80 (1.50, 5.70) | -5.267 | < 0.001 |
| 血糖(mmol/L) a | 7.80 (6.60, 9.50) | 9.70 (8.40, 13.40) | -5.896 | < 0.001 |
| 氧合指数(mmHg) a | 359.00 (284.00, 435.00) | 250.00 (189.00, 378.00) | 4.874 | < 0.001 |
| Tbil (μmol/L) b | 14.08±7.17 | 16.39±10.62 | -2.118 | < 0.001 |
| 白蛋白(g/L) b | 37.47±6.02 | 37.62±7.81 | -0.163 | 0.043 |
| HCO3- (mmol/L) b | 21.46±3.13 | 20.90±4.10 | 1.188 | 0.017 |
| PaO2 (mmHg) b | 103.26±33.17 | 110.60±78.41 | -1.253 | < 0.001 |
| 合并其他疾病 c | < 0.001 | |||
| 无 | 337 (70.35) | 27 (5.64) | ||
| 有 | 87 (18.16) | 28 (5.85) | ||
| 受伤机制 c | 0.015 | |||
| 交通伤 | 179 (37.37) | 21 (4.38) | ||
| 高坠伤 | 161 (33.61) | 14 (2.92) | ||
| 其他 | 84 (17.54) | 20 (4.18) | ||
| 气管插管 c | < 0.001 | |||
| 未插管 | 378 (78.91) | 31 (6.47) | ||
| 插管 | 46 (9.60) | 24 (5.02) | ||
| 血管活性药物 c | 0.002 | |||
| 未使用 | 396 (82.67) | 44 (9.19) | ||
| 使用 | 28 (5.85) | 11 (2.29) | ||
| 注: a为M(Q1, Q3), b为x±s, c为例数(%); FDP为纤维蛋白原降解产物, APTT为活化部分凝血活酶时间, PT为凝血酶原时间; Fib为纤维蛋白原, Tbil为血清总胆红素, HCO3-为碳酸氢根离子, PaO2为氧分压 | ||||
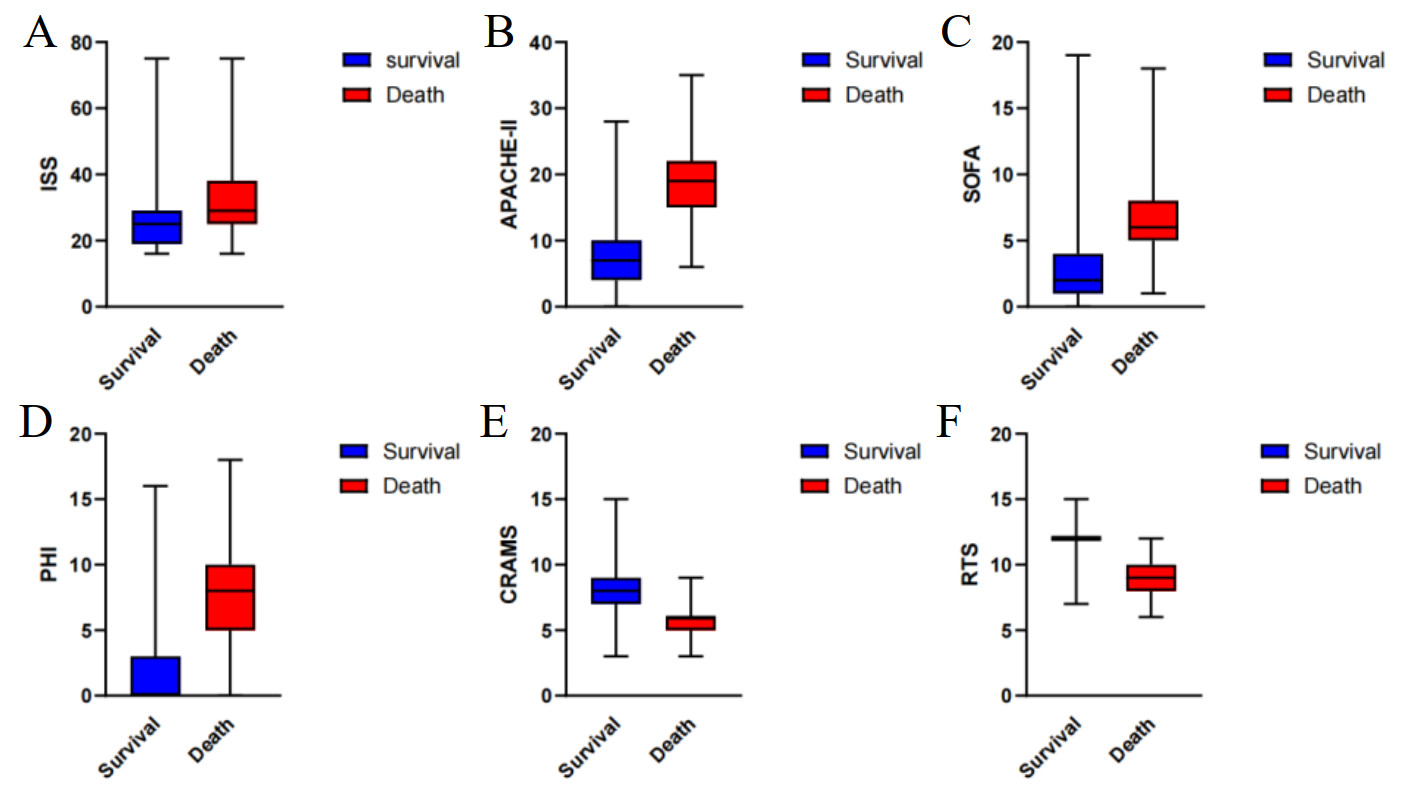
六种评分在两组间的比较结果见表 2与图 1。存活组的RTS与CRAMS评分显著高于死亡组, 而ISS、APACHE Ⅱ、SOFA及PHI评分显著低于死亡组, 差异均具有统计学意义(均P < 0.05)。
| 评分 | 存活组(n=424) | 死亡组(n=55) | 统计值 | P值 |
| ISS评分 | 25.00 (19.00, 29.00) | 29.00 (25.00, 38.00) | -5.044 | < 0.001 |
| APACHE-Ⅱ评分 | 7.00 (4.00, 10.00) | 19.00 (15.00, 22.00) | -10.092 | < 0.001 |
| SOFA评分 | 2.00 (1.00, 4.00) | 6.00 (5.00, 8.00) | -9.109 | < 0.001 |
| PHI评分 | 0.00 (0.00, 3.00) | 6.00 (5.00, 10.00) | -9.011 | < 0.001 |
| RTS评分 | 12.00 (12.00, 12.00) | 9.00 (8.00, 10.00) | 11.589 | < 0.001 |
| CRAMS评分 | 8.00 (7.00, 9.00) | 6.00 (5.00, 6.00) | 8.143 | < 0.001 |
|
| 注: 图 1A: ISS评分在存活组与死亡组中的分布; 图 1B: APACHE-Ⅱ评分在存活组与死亡组中的分布; 图 1C: SOFA评分在存活组与死亡组中的分布; 图 1D: PHI评分在存活组与死亡组中的分布: 图 1E: CRAMS评分在存活组与死亡组中的分布; 图 1F: RTS评分在存活组与死亡组中的分布 图 1 各评分在存活组与死亡组中的分布 Fig 1 Distribution of each score in the survival and death groups |
|
|
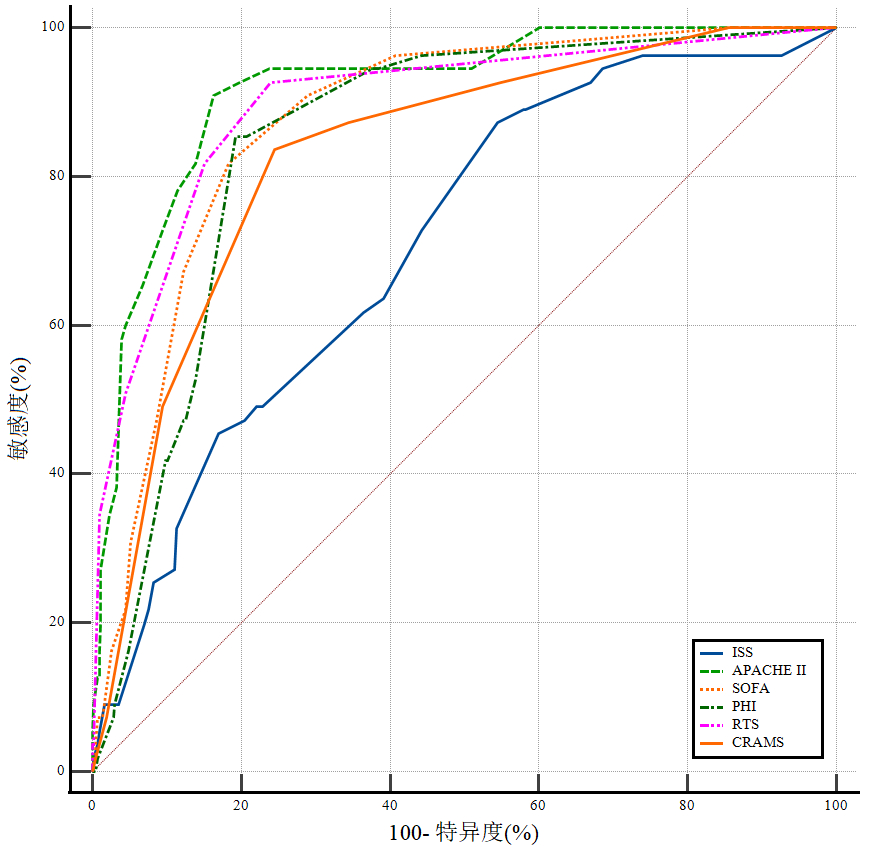
ISS、APACHE Ⅱ、SOFA、PHI评分均与严重创伤患者死亡结局呈正相关, RTS、CRAMS评分与严重创伤患者死亡结局呈负相关。六种评分系统预测28 d死亡风险的效能各不相同(如表 3, 图 2所示)。其中, APACHE Ⅱ评分的预测准确性最高(AUC=0.917), 其次为RTS评分(AUC=0.897), 之后依次是SOFA(0.873)、PHI(0.848)、CRAMS(0.831)和ISS评分(0.708)。进一步的两两比较显示, APACHE Ⅱ与RTS评分的AUC差异无统计学意义(P=0.325), 而它们与其他评分的差异大多具有统计学意义(如表 4所示)。
| 评分类型 | AUC | 敏感度(%) | 特异度(%) | 约登指数 | 阳性似然比 | 阴性似然比 | 截断值 | 95%CI |
| ISS评分 | 0.708 | 87.3 | 45.5 | 0.328 | 1.60 | 0.28 | 24.5 | 0.640~0.777 |
| APACHE-Ⅱ评分 | 0.917 | 90.9 | 83.7 | 0.746 | 5.58 | 0.11 | 12.5 | 0.881~0.954 |
| SOFA评分 | 0.873 | 81.8 | 81.6 | 0.634 | 4.45 | 0.22 | 4.5 | 0.832~0.914 |
| PHI评分 | 0.848 | 85.5 | 80.7 | 0.662 | 4.43 | 0.18 | 4.5 | 0.813~0.879 |
| RTS评分 | 0.897 | 92.7 | 75.9 | 0.686 | 3.85 | 0.10 | 11.5 | 0.850~0.944 |
| CRAMS评分 | 0.831 | 83.6 | 75.5 | 0.591 | 3.45 | 0.22 | 6.5 | 0.777~0.884 |
|
| 图 2 ISS、APACHE-Ⅱ、SOFA、PHI、RTS、CRAMS评分对严重创伤患者预后评估的ROC曲线 Fig 2 ROC curves of ISS, APACHE-Ⅱ, SOFA, PHI, RTS, and CRAMS scores for prognostic evaluation of patients with severe trauma |
|
|
| 评分类型 | ΔAUC | 95%CI | Z值 | P值 | Standard Errora |
| ISS与APACHE-Ⅱ | 0.209 | 0.139~0.279 | 5.872 | < 0.001 | 0.0356 |
| ISS与SOFA | 0.165 | 0.097~0.233 | 4.727 | < 0.001 | 0.0349 |
| ISS与PHI | 0.140 | 0.073~0.207 | 4.107 | < 0.001 | 0.0341 |
| ISS与RTS | 0.189 | 0.119~0.258 | 5.324 | < 0.001 | 0.0355 |
| ISS与CRAMS | 0.123 | 0.0461~0.199 | 3.144 | 0.002 | 0.0390 |
| APACHE-Ⅱ与SOFA | 0.044 | 0.003~0.085 | 2.109 | 0.035 | 0.0209 |
| APACHE-Ⅱ与PHI | 0.069 | 0.026~0.112 | 3.125 | 0.002 | 0.0220 |
| APACHE-Ⅱ与RTS | 0.020 | -0.020~0.060 | 0.985 | 0.325 | 0.0204 |
| APACHE-Ⅱ与CRAMS | 0.086 | 0.032~0.140 | 3.134 | 0.002 | 0.0276 |
| SOFA与PHI | 0.025 | -0.019~0.068 | 1.116 | 0.264 | 0.0247 |
| SOFA与RTS | 0.024 | -0.020~0.068 | 1.058 | 0.290 | 0.0226 |
| SOFA与CRAMS | 0.042 | -0.011~0.096 | 1.544 | 0.123 | 0.0275 |
| PHI与RTS | 0.049 | 0.008~0.089 | 2.378 | 0.017 | 0.0205 |
| PHI与CRAMS | 0.018 | -0.031~0.066 | 0.711 | 0.477 | 0.0249 |
| RTS与CRAMS | 0.066 | 0.013~0.120 | 2.444 | 0.014 | 0.0271 |
| 注: aDeLong et al., 1988;ΔAUC为曲线下面积间差异 | |||||
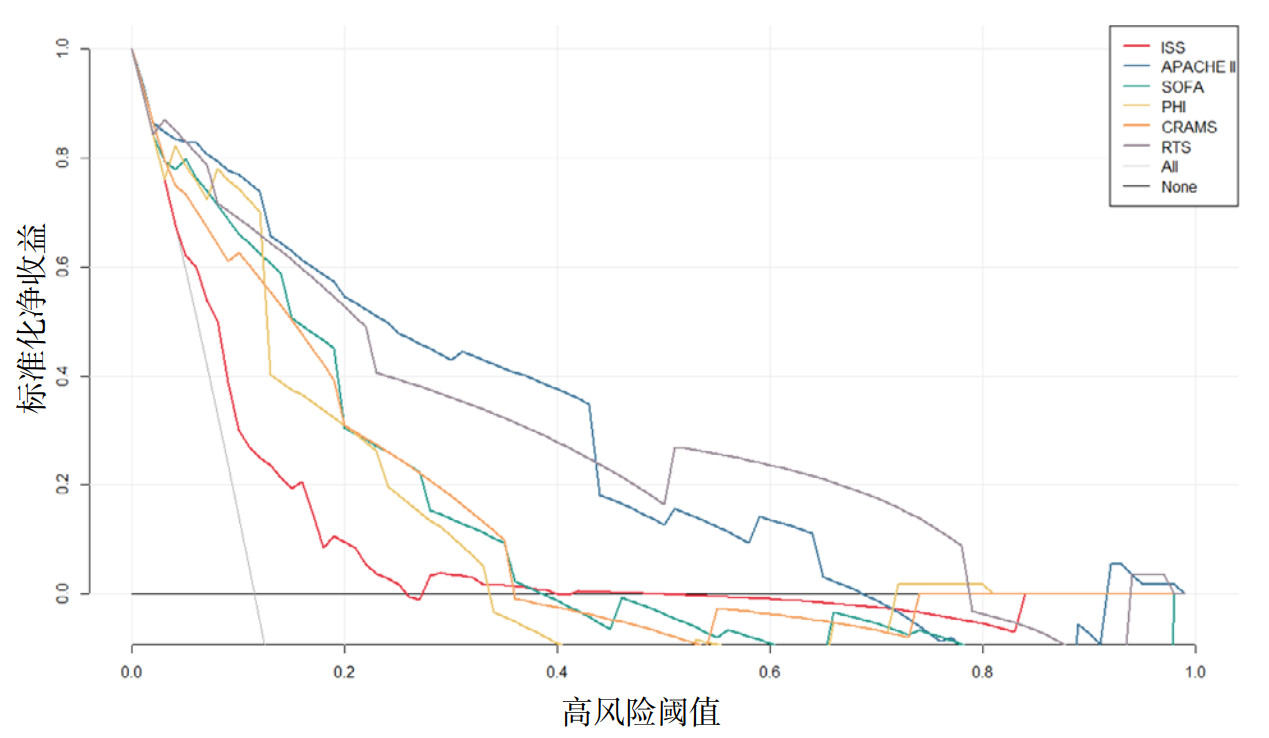
为评估六种评分系统在临床决策中的净获益, 本研究进一步进行了DCA(如图 3所示), 横坐标为高风险阈值概率, 纵坐标为标准化净获益率。
|
| 注: 决策曲线分析了应用各评分模型相对于“全干预”(All)和“全不干预”(None)策略的净获益率; 如图所示, 在广泛的阈值概率范围内(约0.01 ~ 0.99), APACHE-Ⅱ评分和RTS评分的净获益曲线位置最高, 表明其临床实用性最优。SOFA、PHI、CRAMS评分虽能提供正向净获益, 但其效能介于APACHE-Ⅱ/RTS和ISS之间; ISS评分的净获益与“全不干预”策略最为接近 图 3 六种评分系统预测严重创伤患者28 d死亡风险的决策曲线分析(DCA) Fig 3 Decision curve analysis (DCA) of the six scoring systems for predicting 28-day mortality risk in patients with severe trauma |
|
|
DCA曲线显示, 在绝大多数高风险阈值范围内(约0.01 ~ 0.99), APACHE Ⅱ评分和RTS评分模型的曲线位置最高, 表明应用这两种评分制定临床干预策略所能带来的净获益, 始终高于“全部干预”与“全部不干预”的极端策略, 在整个阈值范围内均优于其他四种评分。ISS评分的净获益曲线在整个阈值范围内均与“全部不干预”策略最为接近, 表明其临床实用性有限。SOFA、PHI和CRAMS评分虽能提供正向净获益, 但其效能介于APACHE Ⅱ/RTS和ISS之间。
该结果表明, 从临床决策的角度出发, APACHE Ⅱ和RTS评分不仅能准确预测死亡风险(如ROC曲线所示), 更能为医生提供有效的决策依据, 临床应用能带来更大的实际效益。
3 讨论本研究的主要发现是, 在六种创伤评分中, APACHE Ⅱ与RTS评分对西南地区严重创伤患者28 d死亡风险的预测效能最为优异(AUC分别为0.917和0.897), 且两者差异无统计学意义。DCA进一步证实, 两者在绝大多数临床决策阈值下能提供最高的净获益。这一结果提示, 基于APACHE Ⅱ与RTS评分构建的分阶段评估策略, 可能是适应西南地区医疗资源分布不均现状的优化方案。
本研究结果引申出一个核心问题:为何生理学评分(APACHE Ⅱ、RTS、SOFA)普遍优于传统的解剖学评分(ISS)?其根本原因可能在于, 创伤后的死亡风险并非仅由解剖损伤的严重程度决定, 更取决于机体对损伤的生理应激与代偿能力。ISS评分作为“金标准”[5], 主要反映损伤的静态解剖结构, 却无法捕捉到休克、炎症风暴、器官功能不全等动态病理生理过程, 而这些正是驱动患者走向死亡的关键机制[9-10]。这解释了为何在本研究中, ISS预测效能最低(AUC=0.708)。相比之下, APACHE Ⅱ与RTS评分通过监测血压、呼吸、意识、代谢等关键生理参数, 直接评估了机体的失代偿状态, 因而具有更高的预测价值。这一发现也与损伤控制性复苏(damage control resuscitation, DCR)强调早期纠正生理紊乱的理念相契合[11]。
3.1 APACHE Ⅱ与RTS评分优势分析及其互补性本研究结果显示, APACHE Ⅱ评分对西南地区严重创伤患者28 d死亡风险的预测准确性最高(AUC=0.917)。其优势可能源于该评分涵盖年龄、急性生理参数和慢性健康状况等多项指标, 能够较全面反映创伤后机体病理生理紊乱及代偿衰竭的动态演变过程[12-13]。该评分通过整合多项生理参数及其变化, 构建了一套可用于评估全身炎症反应综合征-代偿性抗炎反应综合征-多器官功能障碍综合征(SIRS-CARS-MODS)动态变化的量化工具, 尤其适用于评估创伤后炎症风暴、休克及器官功能不全的发生与发展[14-15]。但该评分也存在一定局限, 如参数较多、计算复杂、依赖实验室检查结果, 限制了其在院前和急诊早期快速评估中的应用[16-17]。
本研究发现RTS评分的预测效能(AUC=0.897)与APACHE Ⅱ差异无统计学意义(P=0.325), DCA也提示二者临床效用接近。这一结果具有重要的临床意义。RTS仅包括格拉斯哥昏迷评分(GCS)、收缩压和呼吸频率三项参数, 操作简便、易于获取, 可在数分钟内完成评定[18]。此外, RTS也有利于院前急救人员与接收医院之间进行清晰、标准化的沟通, 提前启动创伤团队, 为挽救生命赢得宝贵时间。Galvagno等[19]报道也表明, RTS作为一种基于生理学的评估标准, 在严重创伤患者死亡预测中具有良好的敏感度和特异度, 与本研究的结论一致。DCA显示, 在高风险阈值(> 50%)时, RTS评分展现出微弱的净获益优势。RTS的设计初衷即是快速识别急需紧急处置的极端高危患者。因此, 当临床医生面临高风险阈值时, RTS显得更具决策价值。
DCA结果的深层含义在于, 它超越了传统的区分度(AUC)比较, 从临床决策净获益的角度证实了APACHE Ⅱ与RTS的实用性。当医生的决策阈值概率处于5%~40%这一常见区间时, 依据这两个评分来制定干预策略, 其净获益远高于“全部治疗”或“全部不治疗”的简单策略。这表明, APACHE Ⅱ与RTS评分不仅能够预测死亡风险, 更能精准地指导临床干预的最佳时机, 从而避免医疗资源浪费并降低不必要的治疗风险, 展现出显著的卫生经济学价值。
结合本研究结果及西南地区地形复杂、转运时间长、医疗资源分布不均等特点[20], 上述两种评分的互补性为构建分阶段评估策略提供了关键依据。笔者推荐采用“院前RTS快速分诊+ 院内APACHE Ⅱ动态监测”的模式。具体而言, 建议院前急救人员将RTS ≤ 11.5分的患者, 直接标识为极高危, 启动创伤团队预警, 并优先转运至区域性创伤中心。患者入院后, 应立即计算基线APACHE Ⅱ评分, 若评分 > 12.5分, 则提示死亡风险显著增高, 需收入ICU进行高级生命支持与动态监测(并定期重新评估), 评分持续升高应作为病情恶化的预警信号, 触发多学科会诊。该策略有效结合了RTS的快捷简便和APACHE Ⅱ的全面动态, 实现了优势互补, 尤其适合于医疗资源配置不均的西南地区创伤救治体系。
3.2 其他评分的角色与局限性本研究也对其余评分进行了评估。如前述, ISS评分主要反映静态解剖损伤, 难以准确捕捉生理代偿动态变化, 加之依赖于影像或手术探查结果, 时效性较低, 不适合早期临床决策[9-10]。尽管后续开发了NISS等改良版本以期提升预测能力[21], 但其基于解剖损伤的静态评估本质仍未发生根本改变。Wu等[4]的研究也表明, 单纯依赖解剖评分预测创伤预后存在一定局限。然而, 这并非完全否定ISS的价值。在创伤流行病学研究、伤情标准化描述及长期功能预后评估中, 其作为通用标准的价值依然不可替代。未来研究可探索将其与生理评分结合, 构建复合模型。
SOFA评分专注于器官功能衰竭程度评估, 虽具有一定预测价值(AUC=0.873), 但仍属于院内评分, 在创伤早期、尤其非感染因素为主的背景下, 其针对性不如APACHE Ⅱ[22]。Hwang等[13]研究显示, SOFA评分在创伤预后预测中具有一定效用, 但仍与APACHE Ⅱ存在差距。SOFA的优势在于简洁且专注于器官功能, 但其设计初衷是针对脓毒症, 在创伤早期, 其敏感度可能不足以捕捉尚未发展为明显器官衰竭的生理紊乱。
PHI和CRAMS作为院前评分工具, 其预测效能(AUC分别为0.848和0.831)在本研究中低于RTS。Kim等[23]指出, 不同院前评分工具的表现可能因医疗环境差异而有所不同, 实际应用中需结合具体情境加以选择。本研究结果与Höke等[24]及Yolcu等[25]的报告部分吻合, 后者也提示RTS等生理学评分在创伤患者的评估中具有一定优势。相比之下, PHI与CRAMS评分中的部分项目(如PHI的“意识状态”、CRAMS的“腹部”和“运动”)属于综合性临床判断, 其标准化和可量化程度不如RTS所选取的纯生理参数(GCS、血压、呼吸), 因此在院前紧急环境下, 更易受评估者经验影响, 导致评估者间一致性可能降低。
3.3 研究的临床意义与局限性本研究首次立足于西南地区特定医疗环境, 综合运用ROC和DCA方法, 较系统评价了APACHE Ⅱ与RTS评分的预测效能与临床效用, 并据此提出符合区域特点的分阶段创伤评估策略, 对完善区域创伤救治体系具有参考价值。与中国全国性创伤统计数据相比[20], 西南地区的创伤救治体系仍存在明显差异, 进一步凸显了本研究区域化策略的必要性。本研究的结果挑战了“越复杂的评分表现越好”的简单假设, 证明了一个设计精良的简单评分(RTS)在特定场景下可与复杂评分(APACHE Ⅱ)相媲美, 这为在资源有限的基层单位推广实用评估工具提供了信心。
但本研究仍存在若干局限: 首先, 这是一项回顾性单中心研究, 可能存在数据收集时间跨度大、治疗方案变更等所致的偏倚; 其次, 样本量有限(总样本479例, 死亡55例), 可能影响统计效能; 第三, 研究对象主要来自西南地区, 结论的外推需谨慎, 今后需通过多中心、大样本研究本结论的普适性; 最后, 本研究仅关注了解剖学和生理学评分, 未来可探索开发结合两类指标的新型复合评分, 以更好应对真实世界中复杂创伤患者的评估需求。后续研究可聚焦于解剖评分(如ISS)与生理评分(如RTS/APACHE Ⅱ)的融合模型, 以期进一步提升预测准确性。此外, 本研究未纳入乳酸、凝血功能等新兴生物标志物, 未来可将这些动态变化的实验室指标与传统评分结合, 有望构建出预测精度更高、时效性更强的预后模型。
综上所述, 本研究通过系统比较六种评分系统, 认为APACHE Ⅱ评分显示出最佳的预测准确性(AUC=0.917), 其次是RTS评分(AUC=0.897)。决策曲线分析(DCA)证实, 在临床相关决策阈值(5%~40%)内, 应用APACHE Ⅱ或RTS评分指导干预策略, 能提供显著且稳定的临床净获益。基于上述结果及西南地区医疗资源分布不均、转运时间长等特点, 笔者推荐采用“院前RTS快速分诊+院内APACHE Ⅱ动态监测”的分阶段评估策略。该策略兼顾了RTS的简便性、高敏感度(92.7%)与APACHE Ⅱ的全面性, 适用于该地区的创伤救治体系; 创伤评分是辅助临床决策的重要工具, 但实践中仍需结合动态评估、医师经验及实时生命体征变化进行综合研判。
利益冲突 所有作者声明无利益冲突
作者贡献声明 李科: 研究设计、论文修改; 王蕾: 论文撰写; 朱浩然: 数据提取及整理; 肖伟: 数据提取, 分析、统计学分析; 向强: 指导、仲裁、最终审阅
| [1] | Costantini TW, Coimbra R, Holcomb JB, et al. Current management of hemorrhage from severe pelvic fractures: Results of an American Association for the Surgery of Trauma multi-institutional trial[J]. J Trauma Acute Care Surg, 2016, 80(5) 717-723; discussion 723-725. DOI:10.1097/TA.0000000000001034 |
| [2] | James SL, Castle CD, Dingels ZV, et al. Global injury morbidity and mortality from 1990 to 2017: results from the global burden of disease study 2017[J]. Inj Prev, 2020, 26(Supp 1): i96-i114. DOI:10.1136/injuryprev-2019-043494 |
| [3] | Zhou J, Wang TB, Belenkiy I, et al. Management of severe trauma worldwide: implementation of trauma systems in emerging countries: China, Russia and South Africa[J]. Crit Care, 2021, 25(1): 286. DOI:10.1186/s13054-021-03681-8 |
| [4] | Wu SC, Chou SG, Liu HT, et al. Performance of prognostic scoring systems in trauma patients in the intensive care unit of a trauma center[J]. Int J Environ Res Public Health, 2020, 17(19): 7226. DOI:10.3390/ijerph17197226 |
| [5] | Baker SP, O'Neill B, Haddon W Jr, et al. The injury severity score: a method for describing patients with multiple injuries and evaluating emergency care[J]. J Trauma, 1974, 14(3): 187-196. DOI:10.1097/00005373-197403000-00001 |
| [6] | Knaus WA, Draper EA, Wagner DP, et al. APACHE Ⅱ: a severity of disease classification system[J]. Crit Care Med, 1985, 13(10): 818-829. DOI:10.1097/00003246-198510000-00009 |
| [7] | Wong DT, Knaus WA. Predicting outcome in critical care: the current status of the APACHE prognostic scoring system[J]. Can J Anaesth, 1991, 38(3): 374-383. DOI:10.1007/BF03007629 |
| [8] | Jones AE, Trzeciak S, Kline JA. The Sequential Organ Failure Assessment score for predicting outcome in patients with severe sepsis and evidence of hypoperfusion at the time of emergency department presentation[J]. Crit Care Med, 2009, 37(5): 1649-1654. DOI:10.1097/CCM.0b013e31819def97 |
| [9] | Serviá L, Badia M, Montserrat N, et al. Severity scores in trauma patients admitted to ICU. Physiological and anatomic models[J]. Med Intensiva (Engl Ed), 2019, 43(1): 26-34. DOI:10.1016/j.medin.2017.11.008 |
| [10] | 吴彦坤, 王联群, 温志超, 等. 重症创伤评分系统的研究进展[J]. 中国急救医学, 2022, 42(11): 1008-1012. DOI:10.3969/j.issn.1002-1949.2022.11.015 |
| [11] | Holcomb JB, Jenkins D, Rhee P, et al. Damage control resuscitation: directly addressing the early coagulopathy of trauma[J]. J Trauma, 2007, 62(2): 307-310. DOI:10.1097/TA.0b013e3180324124 |
| [12] | Polita JR, Gomez J, Friedman G, et al. Comparison of APACHE Ⅱ and three abbreviated APACHE Ⅱ scores for predicting outcome among emergency trauma patients[J]. Rev Assoc Med Bras (1992), 2014, 60(4): 381-386. DOI:10.1590/1806-9282.60.04.018 |
| [13] | Hwang SY, Lee JH, Lee YH, et al. Comparison of the Sequential Organ Failure Assessment, Acute Physiology and Chronic Health Evaluation Ⅱ scoring system, and Trauma and Injury Severity Score method for predicting the outcomes of intensive care unit trauma patients[J]. Am J Emerg Med, 2012, 30(5): 749-753. DOI:10.1016/j.ajem.2011.05.022 |
| [14] | Kądziołka I, Świstek R, Borowska K, et al. Validation of Apache ii and saps ii scales at the intensive care unit along with assessment of sofa scale at the admission as an isolated risk of death predictor[J]. Anaesthesiol Intensive Ther, 2019, 51(2): 107-111. DOI:10.5114/ait.2019.86275 |
| [15] | 谢铎文, 潘景业. 急性生理学与慢性健康状况评分系统: 1978-2010[J]. 中国中西医结合急救杂志, 2010, 17(6): 378-381. DOI:10.3969/j.issn.1008-9691.2010.06.025 |
| [16] | McAnena OJ, Moore FA, Moore EE, et al. Invalidation of the Apache ii scoring system for patients with acute trauma[J]. J Trauma Inj Infect Crit Care, 33(4): 504-507. DOI:10.1097/00005373-199210000-00003 |
| [17] | Serviá L, Llompart-Pou JA, Chico-Fernández M, et al. Development of a new score for early mortality prediction in trauma ICU patients: RETRASCORE[J]. Crit Care, 2021, 25(1): 420. DOI:10.1186/s13054-021-03845-6 |
| [18] | Şentürk GÖ, Ünlüer EE, Vandenberk N, et al. The prognostic value of cystatin C compared with trauma scores in multiple blunt trauma: a prospective cohort study[J]. J Emerg Med, 2013, 44(6): 1070-1076. DOI:10.1016/j.jemermed.2012.11.037 |
| [19] | Galvagno SM Jr, Massey M, Bouzat P, et al. Correlation between the revised trauma score and injury severity score: implications for prehospital trauma triage[J]. Prehosp Emerg Care, 2019, 23(2): 263-270. DOI:10.1080/10903127.2018.1489019 |
| [20] | Wang YH, Wang C, Hu P, et al. China trauma treatment statistics 2019: a national retrospective study based on hospitalized cases[J]. Front Public Health, 2023, 11: 1116828. DOI:10.3389/fpubh.2023.1116828 |
| [21] | Osler T, Baker SP, Long W. A modification of the injury severity score that both improves accuracy and simplifies scoring[J]. J Trauma, 1997, 43(6) 922-925;discussion 925-926. DOI:10.1097/00005373-199712000-00009 |
| [22] | Vincent JL, Moreno R, Takala J, et al. The SOFA (Sepsis-related Organ Failure Assessment) score to describe organ dysfunction/failure. On behalf of the Working Group on Sepsis-Related Problems of the European Society of Intensive Care Medicine[J]. Intensive Care Med, 1996, 22(7): 707-710. DOI:10.1007/BF01709751 |
| [23] | Kim YJ. Injury severity scoring systems: a review of application to practice[J]. Nurs Crit Care, 2012, 17(3): 138-150. DOI:10.1111/j.1478-5153.2012.00498.x |
| [24] | Höke MH, Usul E, Özkan S. Comparison of trauma severity scores (ISS, NISS, RTS, BIG score, and TRISS) in multiple trauma patients[J]. J Trauma Nurs, 2021, 28(2): 100-106. DOI:10.1097/JTN.0000000000000567 |
| [25] | Yolcu S, Sener K, Tapsiz H, et al. Revised Trauma Score and CRAMS better predicted mortality in high-energy-trauma patients than Early-Warning Score[J]. Ir J Med Sci, 2023, 192(4): 1855-1860. DOI:10.1007/s11845-022-03208-2 |
 2025, Vol. 34
2025, Vol. 34