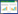急性心肌梗死(acute myocardial infarction, AMI)是引起心脏骤停(cardiac arrest, CA)最常见的病因[1]。体外心肺复苏(extracorporeal cardiopulmonary resuscitation, ECPR)对院外心脏骤停(out of-hospital cardiac arrest, OHCA)的疗效缺乏足够的证据支持, 而改善院内心脏骤停(in-of- hospital cardiac arrest, IHCA)患者生存率和神经系统结局的效果明确[2]。尽管ECPR患者的结局受多种混杂因素的影响, 显示出异质性生存结局[3], 且接受静脉-动脉体外膜肺氧合(venoarterial extracorporeal membrane oxygenation, V-A ECMO)治疗的危重AMI患者并没有显著的生存获益[4], 但对于AMI导致的难治性CA, ECPR无论是作为再灌注治疗的桥梁还是维持循环的生存手段, 都是唯一的救治方式。
本文排除OHCA和既往接受经皮冠状动脉介入(percutaneous coronary intervention, PCI)治疗混杂因素影响, 回顾性分析南京医科大学第一附属医院体外生命支持中心2017年1月至2024年12月的70例AMI-IHCA-ECPR患者, 总结AMI-IHCA-ECPR的临床应用经验和效果, 探讨冠状动脉病变分布类型及严重程度对生存结局的影响, 为ECPR的临床实践提供一定的证据支持。
1 资料与方法 1.1 研究对象收治于本中心的实施ECPR患者。启动指征: ①可逆性病因; ②年龄 < 80岁; ③有目击的CA; ④CA到启动ECPR的时间 < 30 min; ⑤基础疾病非终末状态[5]。2017年1月至2024年12月共有连续112例AMI导致CA的患者接受ECPR, 排除30例OHCA和12例既往接受PCI治疗的ECPR患者, 共纳入70例AMI-IHCA-ECPR患者为研究对象。所有患者均遵照成人ECPR实践路径系统化管理[6], 出现临床左心室扩张(left ventricular distention, LVD)的患者, 联合主动脉内球囊反搏(intra-aortic balloon pump, IABP)以左心减负[7]。本研究已获得南京医科大学第一附属医院伦理委员会批准(伦审号: 2019-NT-12)。患者纳入分组流程见图 1。
|
| 图 1 本研究设计分组流程图 Fig 1 Flow chart of the study |
|
|
收集AMI-IHCA-ECPR患者的年龄、性别、基础疾病(以查尔森合并症指数评价)、初始心律、无血流时间(CA至开始胸外按压的时间)、CA-Pump On时间(CA至ECMO开始转流的时间)、ECPR上机前或上机即刻pH和乳酸值、冠状动脉造影结果、ECMO治疗时间、ECMO撤离成功率和90 d存活率等信息。患者第一个记录在案的节律为心室颤动或无脉性室性心动过速作为初始可电击心律。以冠状动脉血管狭窄程度在75%以上界定为严重病变血管[8]。神经功能预后评价采用格拉斯哥-匹兹堡脑功能表现分级(cerebral performance category, CPC)评分, CPC评分1~2级为神经功能预后良好[9]。部分患者放弃治疗或在脱离ECMO后因综合因素死亡, 均视为病死率。
1.2 冠状动脉病变严重程度Gensini评分根据冠状动脉造影结果对每支冠脉血管病变程度进行定量评定: 以狭窄程度最严重处为标准, 狭窄直径 < 25%计1分, ≥25%~ < 50%计2分, ≥50%~ < 75%计4分, ≥75%~ < 90%计8分, ≥90%~ < 99%计16分, ≥99%计32分。根据不同冠脉分支将以上得分乘以相应系数, 左主干(left main coronary artery, LMA)病变: 得分×5;左前降支(left anterior descending, LAD)病变: 近端×2.5, 中段×1.5;对角支病变: D1×1, D2×0.5;左回旋支(left circumflex branch, LCX)病变: 近端×2.5, 远端×1;后降支×1;后侧支×0.5;右冠状动脉(right coronary artery, RCA)病变: 近、中、远和后降支均×1。各病变支得分总和即为患者的冠状动脉病变狭窄程度总积分[10]。
1.3 统计学方法应用SPSS 20.0统计学软件进行数据处理。计量资料符合正态分布以平均值±标准误(mean±SE)表示, 组间比较采用t检验; 不符合正态分布的以中位数(四分位数)[M(Q1, Q3)]表示, 组间比较采用Kruskal-Wallis秩和检验。计数资料以例数(百分比)[n (%)]表示, 组间比较采用卡方检验。以P < 0.05为差异有统计学意义。
2 结果 2.1 AMI-IHCA-ECPR患者的基本信息70例AMI-IHCA-ECPR患者纳入分析, 其中男性61例, 女性9例, 年龄为(56.1±1.5)岁, 查尔森合并症指数为(0.9±0.1), 初始可电击心律44例(62.9%), ECPR初始血气pH值7.25 (7.04, 7.36), 乳酸值(10.49±0.78)mmol/L, 无血流时间1 (1, 1) min, CA-Pump On时间55 (40, 96) min, Gensini评分86(60, 121), 联合IABP治疗23例(32.9%), ECMO治疗时间5 (2, 8) d。ECMO成功撤离29例(41.4%), 90 d存活22例(31.4%), 有19例(86.4%)神经功能预后良好, 其中1例接受冠状动脉搭桥(coronary artery bypass graft, CABG)、另1例植入左心辅助装置(left ventricular assisted device, LVAD)长久存活。见表 1。
| 基本信息 | 数值 |
| 年龄(岁)a | 56.1±1.5 |
| 性别(男/女, 例) | 61/9 |
| 查尔森合并症指数a | 0.9±0.1 |
| 初始可电击心律c | 44 (62.9%) |
| pH值b | 7.25 (7.04, 7.36) |
| 乳酸值(mmol/L)a | 10.49±0.78 |
| 无血流时间(min)b | 1 (1, 1) |
| CA-Pump On时间(min)b | 55 (40, 96) |
| Gensini评分b | 86 (60, 121) |
| 联合IABP治疗c | 23 (32.9%) |
| IABP治疗时间(d)b | 5 (3, 8) |
| ECMO治疗时间(d)b | 5 (2, 8) |
| ECMO成功撤离c | 29 (41.4%) |
| 90 d存活c | 22 (31.4%) |
| CPC1~2级c | 19 (86.4%) |
| 90 d死亡c | 48 (68.6%) |
| 死亡时间(d)b | 4 (1, 9) |
| 注: IABP为主动脉内球囊反搏; a为mean±SE, b为M(Q1, Q3), c为例(%) | |
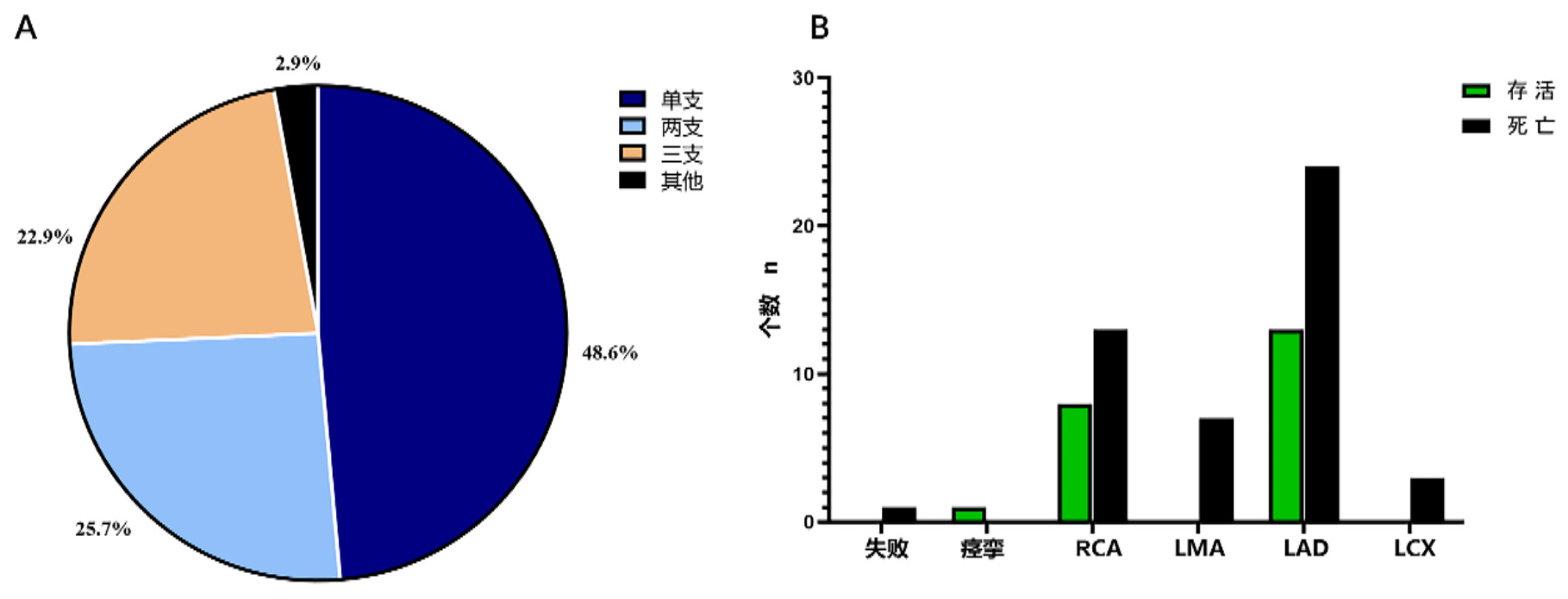
在70例AMI-IHCA-ECPR患者中, 1例因心脏破裂而造影失败, 1例确诊为冠状动脉痉挛, 34例(48.6%)为单支冠状动脉的严重病变, 18例(25.7%)为两支冠状动脉的严重病变, 16例(22.9%)为三支冠状动脉的严重病变。有3例不能行PCI治疗的严重三支病变患者接受CABG治疗, 存活1例, 其余患者均接受了积极的罪犯血管再通治疗。以“一元论”罪犯血管进行分类: RCA为罪犯血管有21例, 存活8例(38.1%); LAD为罪犯血管有37例, 存活13例(35.1%); LMA和LCX为罪犯血管分别有7例和3例, 全部死亡。不同血管病变的AMI-IHCA-ECPR患者生存情况差异无统计学意义。见图 2。
|
| 图 2 AMI-IHCA-ECPR患者的冠状动脉病变特征(A)和罪犯血管分布(B)(n=70) Fig 2 Characteristics of coronary artery lesions (A) and distribution of offender blood vessels (B) in AMI-IHCA-ECPR patients (n=70) |
|
|
70例AMI-IHCA-ECPR患者中, ECMO联合IABP治疗23例(32.9%), 90 d存活4例(17.4%), IABP治疗时间5(3, 8)d。IABP组与无IABP组之间年龄、性别、基础疾病、初始可电击心律、ECPR初始血气pH值、乳酸值、无灌流时间、CA-Pump On时间、Gensini评分、90 d存活率均差异无统计学意义。与无IABP组比较, IABP组的ECMO治疗时间长[7(4, 9)d vs. 4(1, 8)d], ECMO撤离成功率低(21.7% vs. 51.1%), 差异有统计学意义(P < 0.05)。见表 2。
| 指标 | IABP组(n=23) | 无IABP组(n=47) | 检验值 | P值 |
| 年龄(岁)a | 57.5± 2.8 | 55.5± 1.7 | 0.70 | 0.51 |
| 性别(男/女, 例) | 19/4 | 42/5 | 0.63 | 0.43 |
| 查尔森合并症指数a | 1.0± 0.2 | 0.9± 0.2 | 0.73 | 0.47 |
| 初始可电击心律c | 15 (65.2) | 29 (61.7) | 0.08 | 0.78 |
| pH值b | 7.25 (7.16, 7.36) | 7.23 (7.00, 7.36) | 1.29 | 0.20 |
| 乳酸值(mmol/L)a | 11.00± 1.39 | 10.24± 0.95 | 0.46 | 0.65 |
| 无血流时间(min)b | 1 (1, 1) | 1 (1, 1) | 1.12 | 0.27 |
| CA-Pump On时间(min)b | 62 (42, 120) | 55 (40, 80) | 1.08 | 0.29 |
| Gensini评分b | 90 (84, 122) | 82 (52, 119) | 0.97 | 0.34 |
| 联合IABP治疗c | 7 (4, 9) | 4 (1, 8) | 2.49 | 0.02 |
| ECMO成功撤离c | 5 (21.7) | 24 (51.1) | 5.47 | 0.02 |
| 90 d存活c | 4 (17.4) | 18 (38.3) | 3.13 | 0.08 |
| CPC1-2级(n) | 4 | 15 | ||
| 注: a为mean±SE, b为M(Q1, Q3), c为例(%) | ||||
70例AMI-IHCA-ECPR患者中, 90 d死亡48例(68.6%), 死亡时间4(1, 9)d。90 d存活组与死亡组之间, 年龄、性别、基础疾病、初始可电击心律、无血流时间、CA-Pump On时间、ECMO治疗时间、IABP应用情况均差异无统计学意义。与90 d死亡组比较, 存活组ECPR初始血气pH值高[7.35(7.10, 7.41)vs. 7.17(7.01, 7.30)]、乳酸值低[(6.16±1.23)mmol/L vs. (12.61±0.82)mmol/L], 且Gensini评分低[80(52, 88)vs. 92(80, 132)], 差异存在统计学意义(P < 0.05)。见表 3。
| 指标 | 90 d存活组(n=22) | 90 d死亡组(n=48) | 检验值 | P值 |
| 年龄(岁)a | 57.6± 2.4 | 55.5± 1.8 | 0.66 | 0.51 |
| 性别(男/女, 例) | 19/3 | 42/6 | 0.02 | 0.90 |
| 查尔森合并症指数a | 0.6± 0.1 | 1.0± 0.2 | 1.54 | 0.13 |
| 初始可电击心律c | 16 (72.7) | 28 (58.3) | 1.34 | 0.25 |
| pH值b | 7.35 (7.10, 7.41) | 7.17 (7.01, 7.30) | 2.08 | 0.04 |
| 乳酸值(mmol/L)a | 6.16± 1.23 | 12.61± 0.82 | 4.45 | 0.00 |
| 无血流时间(min)b | 1 (1, 1) | 1 (1, 1) | 0.53 | 0.60 |
| CA-Pump On时间(min)b | 52 (40, 117) | 60 (41, 93) | 0.05 | 0.96 |
| Gensini评分b | 80 (52, 88) | 92 (80, 132) | 2.74 | 0.01 |
| 联合IABP治疗c | 4 (18.2) | 19 (39.6) | 3.56 | 0.06 |
| ECMO治疗时间(d)b | 6 (5, 8) | 4 (1, 8) | 0.23 | 0.82 |
| 注: a为mean±SE, b为M(Q1, Q3), c为例(%) | ||||
尽管近年来快速发展的ECMO技术被寄予厚望, 但ECMO治疗危重AMI患者的临床获益证据仍然不足, 多项随机对照研究均显示ECMO不降低病死率、反而增加并发症发生率[4]。可能仅有不足5%的危重AMI患者从ECMO治疗中获益, 及时处理AMI的罪犯血管是唯一被证明能有效降低病死率的治疗方法[11]。AMI是CA最常见的原因, AMI合并CA的患者病死率高, ECPR的关键意义在于提供临时的循环辅助, 并以此作为桥梁完成血管再通治疗, 桥接到心脏功能恢复、桥接到下一步决策、桥接到LVAD治疗或心脏移植[12]。
按照冠状动脉与心脏的供血关系, 左主干和前降支近端血管病变所致的AMI常出现前壁、下壁大面积的心肌缺血坏死, 影响左心室射血, 容易导致心源性休克, 预后差[13]。研究显示约5~10%的AMI患者合并心源性休克, 以LMA、LAD、LCX和RCA为罪犯血管的病死率分别为77.7%、58.2%、55.1%和45.0%[14]。本研究排除存活组与死亡组间患者年龄、性别、基础疾病、初始心律、ECPR启动流程(无血流时间和CA-Pump On时间)及IABP应用多种混杂因素的影响, 发现不同罪犯血管病变以及单支或多支血管病变的AMI-IHCA-ECPR患者的生存结局差异无统计学意义, 而存活组的Gensini评分显著低于死亡组[80 (52, 88) vs. 92 (80, 132), P < 0.05], 表明通过Gensini评分量化的冠状动脉病变的严重程度是患者死亡的独立危险因素。Gensini评分是评估AMI患者预后的有效指标[15], 同样适用于评估AMI-IHCA-ECPR患者的预后, 结局始终与原发疾病的严重程度直接相关。
尽管IABP产生的搏动血流比V-A ECMO的逆向平流更具生理性意义, 且增加冠状动脉血流灌注, 同时降低V-A ECMO的左心室负荷, 但现有关于IABP对V-A ECMO患者生存率影响的研究结果不尽相同, V-A ECMO联用IABP的临床获益尚不明确[16, 17]。目前IABP联合ECPR的疗效尚未得到充分研究, 最新Meta分析结果表明, 联合IABP可以提高ECPR患者的即刻生存率, 但纳入的多项研究存在固有的特征偏倚, 如ECPR的病因、IABP介入时机, 且混杂有OHCA, 需要进一步亚组分析, 并通过随机对照试验验证[18]。因此, 本研究排除既往接受PCI治疗和OHCA患者, 限定AMI-IHCA的ECPR患者为研究对象, 当出现临床LVD时联用IABP以左心减负[7], 发现是否联用IABP对90 d存活率无显著影响。反而IABP组的ECMO撤离成功率低(21.7% vs. 51.1%), 可能与临床LVD显著降低左心收缩功能和增加恶性心律失常有关[19-20]。显然, IABP有其临床应用的治疗价值, 但并非所有的AMI-ECPR患者均需联用IABP, 获益患者的筛选和合适的干预时机具有挑战性, 联用IABP所能发挥的治疗效果仍需要更多的临床实践以及相关研究来证明[21]。
综上所述, ECPR有效提高IHCA患者的生存率, 鉴于ECPR难以进行有效的随机对照试验, 本文首次报道国内AMI-IHCA-ECPR患者的临床数据, 为ECPR的临床实践提供一定的证据支持。有限的单中心数据结果显示: AMI-IHCA-ECPR联合IABP治疗未见显著生存获益, 约50%的患者为多支冠状动脉的严重病变, 以单一罪犯血管难以评价预后, 推荐通过Gensini评分量化冠状动脉病变的严重程度评估患者结局。
利益冲突 所有作者声明无利益冲突
作者贡献声明 张华忠、张忠满: 研究设计、数据收集; 胡德亮、孙峰、李伟、张刚: 数据整理、统计学分析; 梅勇、吕金如: 体外膜肺氧合专业指导、基金支持; 张华忠、陈旭锋: 论文撰写、论文修改
| [1] | Panchal AR, Berg KM, Hirsch KG, et al. 2019 American heart association focused update on advanced cardiovascular life support: use of advanced airways, vasopressors, and extracorporeal cardiopulmonary resuscitation during cardiac arrest: an update to the American heart association guidelines for cardiopulmonary resuscitation and emergency cardiovascular care[J]. Circulation, 2019, 140(24): e881-e894. DOI:10.1161/CIR.0000000000000732 |
| [2] | Low CJW, Ramanathan K, Ling RR, et al. Extracorporeal cardiopulmonary resuscitation versus conventional cardiopulmonary resuscitation in adults with cardiac arrest: a comparative meta-analysis and trial sequential analysis[J]. Lancet Respir Med, 2023, 11(10): 883-893. DOI:10.1016/S2213-2600(23)00137-6 |
| [3] | Karve S, Lahood D, Diehl A, et al. The impact of selection criteria and study design on reported survival outcomes in extracorporeal oxygenation cardiopulmonary resuscitation (ECPR): a systematic review and meta-analysis[J]. Scand J Trauma Resusc Emerg Med, 2021, 29(1): 142. DOI:10.1186/s13049-021-00956-5 |
| [4] | Zeymer U, Freund A, Hochadel M, et al. Venoarterial extracorporeal membrane oxygenation in patients with infarct-related cardiogenic shock: an individual patient data meta-analysis of randomised trials[J]. Lancet, 2023, 402(10410): 1338-1346. DOI:10.1016/S0140-6736(23)01607-0 |
| [5] | Michels G, Wengenmayer T, Hagl C, et al. Recommendations for extracorporeal cardiopulmonary resuscitation (eCPR): consensus statement of DGIIN, DGK, DGTHG, DGfK, DGNI, DGAI, DIVI and GRC[J]. Clin Res Cardiol, 2019, 108(5): 455-464. DOI:10.1007/s00392-018-1366-4 |
| [6] | 中国老年医学学会急诊医学分会, 中国老年医学学会急诊医学分会ECMO工作委员会. 成人体外膜肺氧合辅助心肺复苏(ECPR)实践路径[J]. 中华急诊医学杂志, 2019, 28(10): 1197-1203. DOI:10.3760/cma.j.issn.1671-0282.2019.10.005 |
| [7] | Truby LK, Takeda K, Mauro C, et al. Incidence and implications of left ventricular distention during venoarterial extracorporeal membrane oxygenation support[J]. ASAIO J, 2017, 63(3): 257-265. DOI:10.1097/MAT.0000000000000553 |
| [8] | Thygesen K, Alpert JS, Jaffe AS, et al. Fourth universal definition of myocardial infarction (2018)[J]. J Am Coll Cardiol, 2018, 72(18): 2231-2264. DOI:10.1016/j.jacc.2018.08.1038 |
| [9] | Sandroni C, Cariou A, Cavallaro F, et al. Prognostication in comatose survivors of cardiac arrest: an advisory statement from the European Resuscitation Council and the European Society of Intensive Care Medicine[J]. Resuscitation, 2014, 85(12): 1779-1789. DOI:10.1016/j.resuscitation.2014.08.011 |
| [10] | Aksu F, Ahmed SA. Gensini score's severity and its relationship with risk factors for coronary artery disease among patients who underwent angiography in Somalia's largest PCI centre[J]. Int J Gen Med, 2024, 17: 187-192. DOI:10.2147/IJGM.S384626 |
| [11] | Thiele H, Desch S, Freund A, et al. Why VA-ECMO should not be used routinely in AMI-cardiogenic shock[J]. J Heart Lung Transplant, 2024, 43(5): 695-699. DOI:10.1016/j.healun.2024.01.006 |
| [12] | Lorusso R, Shekar K, MacLaren G, et al. ELSO interim guidelines for venoarterial extracorporeal membrane oxygenation in adult cardiac patients[J]. ASAIO J, 2021, 67(8): 827-844. DOI:10.1097/MAT.0000000000001510 |
| [13] | Taniguchi Y, Sakakura K, Adachi Y, et al. In-hospital outcomes of acute myocardial infarction with cardiogenic shock caused by right coronary artery occlusion vs. left coronary artery occlusion[J]. Cardiovasc Interv Ther, 2018, 33(4): 338-344. DOI:10.1007/s12928-017-0490-9 |
| [14] | Trzeciak P, Gierlotka M, Gąsior M, et al. Mortality of patients with ST-segment elevation myocardial infarction and cardiogenic shock treated by PCI is correlated to the infarct-related artery: Results from the PL-ACS Registry[J]. Int J Cardiol, 2013, 166(1): 193-197. DOI:10.1016/j.ijcard.2011.10.100 |
| [15] | Ye Q, Zhang J, Ma LK. Predictors of all-cause 1-year mortality in myocardial infarction patients[J]. Medicine (Baltimore), 2020, 99(29): e21288. DOI:10.1097/MD.0000000000021288 |
| [16] | Wang DB, Chao V, Yap KH, et al. Does concurrent use of intra-aortic balloon pumps improve survival in patients with cardiogenic shock requiring venoarterial extracorporeal membrane oxygenation?[J]. Interact Cardiovasc Thorac Surg, 2020, 30(2): 312-315. DOI:10.1093/icvts/ivz256 |
| [17] | Nishi T, Ishii M, Tsujita K, et al. Outcomes of venoarterial extracorporeal membrane oxygenation plus intra-aortic balloon pumping for treatment of acute myocardial infarction complicated by cardiogenic shock[J]. J Am Heart Assoc, 2022, 11(7): e023713. DOI:10.1161/JAHA.121.023713 |
| [18] | Marabotti A, Cianchi G, Bertini P, et al. The effect of intra-aortic balloon pump on survival and neurological outcome in patients treated with extracorporeal cardiopulmonary resuscitation: a meta-analysis and systematic review[J]. Int J Cardiol, 2025, 419: 132690. DOI:10.1016/j.ijcard.2024.132690 |
| [19] | Aleong RG, Mulvahill MJ, Halder I, et al. Left ventricular dilatation increases the risk of ventricular arrhythmias in patients with reduced systolic function[J]. J Am Heart Assoc, 2015, 4(8): e001566. DOI:10.1161/JAHA.114.001566 |
| [20] | Kasa G, Teis A, Juncà G, et al. Clinical and prognostic implications of left ventricular dilatation in heart failure[J]. Eur Heart J Cardiovasc Imaging, 2024, 25(6): 849-856. DOI:10.1093/ehjci/jeae025 |
| [21] | Ezad SM, Ryan M, Donker DW, et al. Unloading the left ventricle in venoarterial ECMO: in whom, when, and how?[J]. Circulation, 2023, 147(16): 1237-1250. DOI:10.1161/CIRCULATIONAHA.122.062371 |
 2025, Vol. 34
2025, Vol. 34