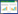2. 扬州大学附属苏北人民医院, 扬州 225001;
3. 中国医学科学院北京协和医院急诊医学科, 北京 100730
2. Northern Jiangsu People's Hospital Affiliated to Yangzhou University, Yangzhou 225001, China;
3. Peking Union Medical College Hospital, Chinese Academy of Medical Sciences, Emergency department, Beijing 100730, China
心脏骤停是全球关注的公共卫生问题。我国心脏骤停总体发病率为97.1/10万, 呈上升趋势, 但十余年来救治效果改善不明显, 院外心脏骤停患者生存率仅为1.3%, 院内心脏骤停患者生存率为9.1%, 显著低于发达国家水平[1-2]。正压通气是心肺复苏(cardiopulmonary resuscitation, CPR)重要组成, 尤其在延迟开始的CPR、延长CPR及非心源性心脏骤停等情况下, 通气是必不可少的。人工通气如简易呼吸器操作时易发生通气频率过快诱发过度通气, 从而影响复苏效果[3]。机械通气具有控制呼吸频率和通气量的特点, 理论上具有避免过度通气的优势。国内CPR时使用呼吸机进行通气较为普遍, 尤其是院内CPR, 但普通机械通气模式常存在误触发致通气过度或气道高压报警致通气不足等情况[4]。心肺复苏通气模式(cardiopulmonary resuscitation ventilation mode, CPRV)是我国自主研发的专用于CPR的机械通气模式, 具有一键启动、自动设置相关参数(呼气末正压为0、吸氧浓度100%、呼吸频率为10次/min、气道高压报警阈值60 cmH2O, 1 cmH2O=0.098 kPa)、嵌入阻抗阀(impedance threshold device, ITD)原理在胸外按压回弹阶段增加胸内负压促使静脉血液回流、自动潮气量补偿等特点。目前观察CPRV效果的临床和实验研究报道罕见, 本研究通过建立猪心室颤动(ventricular fibrillation, VF)模型, 观察CPRV对CPR复苏效果的影响, 探讨CPRV用于CPR通气的潜在优势和应用前景。
1 材料与方法 1.1 研究对象及分组清洁级健康小型长白猪30只(3~4月龄, 雌雄不拘), 由北京协和医院动物实验中心在实验1周前采购及适应性喂养。实验动物许可证号: SCXK(京)2017-0005, 并经苏北人民医院动物实验伦理委员会批准(K17-034)。将30只小型长白猪[体重(31.7±4.5) kg]按随机数字表法分为3组: CPRV组、间歇正压通气组(intermittent positive pressure ventilation, IPPV组)及ITD组, 每组10只。
1.2 实验准备所有动物于实验前夜禁食, 使用3%戊巴比妥钠30 mg/kg、地西泮30 mg/kg及阿托品0.02 mg/kg肌肉注射进行麻醉诱导。诱导满意后将其仰卧位置于特制的U型固定架上。耳缘静脉建立静脉通道, 静脉持续泵入异丙酚2~3 mg/(kg·h)以维持麻醉, 尾部备皮并连接血氧探头, 胸腹部备皮后连接心电电极, 使用T8监护仪(迈瑞生物医疗电子股份有限公司, 深圳)监护。使用6.5 F导管经口气管插管后接SV300呼吸机(迈瑞生物医疗电子股份有限公司, 深圳)进行通气, 使用容量控制模式, 吸入氧浓度21%, 潮气量10 mL/kg, 调节呼吸频率以维持呼气末二氧化碳(end tidal carbon dioxide, ETCO2)在35~40 mmHg(1 mmHg=0.133 kPa)及血氧饱和度 > 95%。使用加温毯控制动物的体温在36~38℃。
给予吗啡5 mg静注后, 双侧颈部皮肤切开, 逐层钝性分离, 暴露左颈总动脉, Seldinger法置入4 Fr的脉搏指示连续心输出量监测(pulse indicator continuous cardiac output, PiCCO)导管(PV2014L 16-A, PULSION Medical Systems SE, 德国)至降主动脉起始段, 监测主动脉血压; 暴露右侧颈总动脉, 使用中号超声血流探头(PSB, Transonic, 美国)包绕动脉, 监测颈动脉血流。暴露右侧颈内静脉并置入18 G中心静脉导管至右心房, 监测右心房压力; 暴露左侧颈外静脉并置入鞘管, 为诱颤电极通过提供通道。左上腹切约2 cm小切口, 在腹壁腹膜外谨慎向上分离至能见膈肌, 将16 G深静脉导管直视下置入胸腔以监测胸腔压力, 外科缝合腹壁。诱颤前给予生理盐水5 mL/(kg·h)静脉滴注维持右心房压力在3~5 mmHg。
1.3 研究方案动物模型制备完成后进行动静脉血血气分析, 确证通气和氧合基线状态。稳定30 min后, 通过左侧颈外静脉鞘管置入诱颤电极至右心室, 诱颤工装以24 V/50 Hz交流电放电约0.5 s, 以监护仪出现典型VF波形、动脉血压波形及脉搏指氧波形消失来确定诱颤成功。立即断开呼吸机, 停止输液和镇静药物泵入。经过3 min无处理VF后, 使用心肺复苏机(WISH-SL-FS-A型, 三龙科技公司, 武汉)进行持续胸外按压, 按压频率104次/min, 深度为猪胸廓前后径的30%。进行5 min单纯胸外按压后, 进入高级生命支持阶段(advanced cardiovascular life support, ACLS), 继续胸外按压并给予机械通气。IPPV组采用容量控制模式: 氧浓度100%, 潮气量7 mL/kg, 呼吸频率10次/min, 恒定吸气流速30 L/min, 呼气末正压为0, 吸呼比1∶2, 气道压力报警上限为60 cmH2O, 关闭触发。ITD组机械通气设置同IPPV组, 并将ITD(ResQPOD ITD 16, 卓尔医疗公司, 美国)连接在气管插管与呼吸机管路间。CPRV组采用CPRV模式, 基本通气设置与IPPV组相同, e-ITD极限设置为-20 cmH2O。
经过16 min按压和通气后, 给予100 J双向波电除颤, 记录除颤后心律。若自主循环恢复(return of spontaneous circulation, ROSC)则停止复苏, 若未ROSC给予肾上腺素0.015 mg/kg静脉注射, 继续进行2min CPR后再次除颤, 记录ROSC情况并停止复苏。ROSC定义为: 心电监护显示自主心律, 伴动脉收缩压≥80 mmHg维持5 min以上[5]。实验完毕予15%氯化钾注射液10 mL静脉注射处死动物。实验流程见图 1。
|
| 注: VF为心室颤动, ROSC为自主循环恢复 图 1 实验流程 Fig 1 Flow chart of experiment |
|
|
在基线状态、ACLS 8 min及16 min时采集气道压力、ETCO2及胸腔压力数据, 采用1 min的平均值。胸腔压力分为胸腔高压(基线状态为吸气期压力、CPR时为按压期压力)和胸腔低压(基线状态为呼气期压力、CPR时为按压放松期压力)。胸腔压力变异度通过胸腔高压减去胸腔低压计算而得。气道压力和ETCO2通过位于气管插管和呼吸机管路之间的采样管分别连接到生理多导仪和T8监护仪进行持续监测。胸腔压力由测压管连接到专用换能器由生理多导仪(MP-150, BIOPAC, 美国)实时记录。
1.4.2 动静脉血气分析在基线状态、ACLS 8 min及16 min时通过PiCCO和右颈内静脉导管采集动静脉血进行血气分析。观察动静脉pH、氧分压(partial pressure of oxygen, PO2)、二氧化碳分压(partial pressure of carbon dioxide, PCO2)及静脉血氧饱和度(venous oxygen saturation, SVO2)等指标。
1.4.3 血流动力学相关参数在基线状态、ACLS 8 min及16 min时采集主动脉血压、右心房压力及颈动脉血流, 采用1 min的平均值。记录平均主动脉血压, 公式为(收缩压+2×舒张压)/3。PiCCO和右颈内静脉导管通过三通同时连接T8监护仪和生理多导仪实时记录, 颈动脉血流亦由生理多导仪实时记录。冠脉灌注压通过主动脉血压和右心房压力计算而得(舒张期动脉压-同期右心房压力)。
1.4.4 各组ROSC情况记录第1次除颤后ROSC情况, 及未ROSC动物的心脏节律, 如VF、电机械分离及心脏停博。记录第2次除颤后ROSC情况, 及两次除颤总ROSC情况。
1.5 统计学方法使用SPSS 17.0软件进行数据分析, 因动物数量少采用非参数检验。连续变量除了动物体质量以均数±标准差(x±s)外, 均以中位数(四分位数)[M(Q1, Q3)]表示, 组间比较采用Friedman检验, P值进行Bonferroni校正。计数资料以频数和百分比表示, 采用χ2检验进行比较。以P < 0.05为差异有统计学意义。
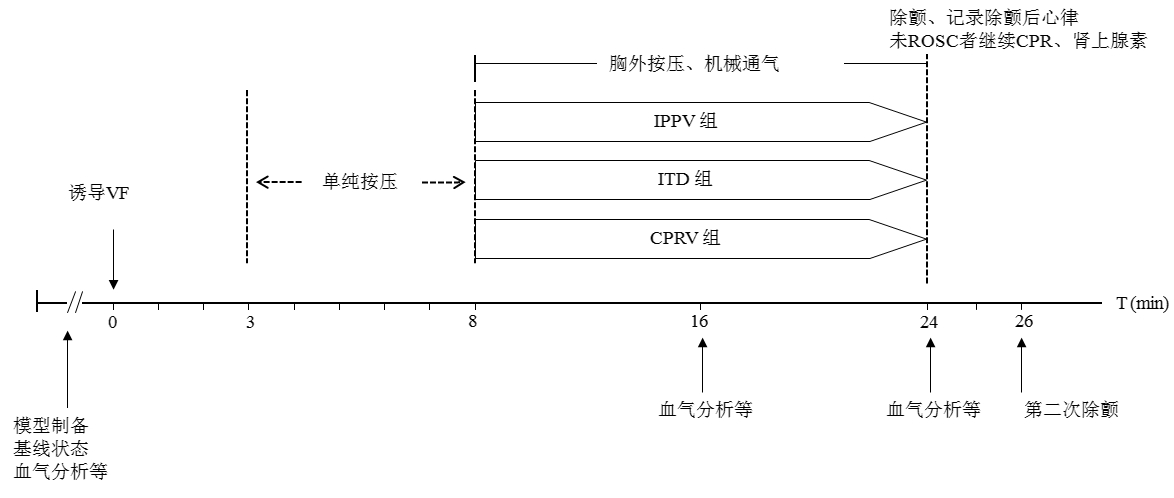
2 结果 2.1 各组呼吸参数分析在基线状态, CPRV组与IPPV组及ITD组比较各呼吸相关参数均差异无统计学意义。在ACLS 8 min及16 min, CPRV组平均气道压显著低于IPPV组, 而胸腔低压(绝对值)、胸腔高压及胸腔压力变异度显著高于IPPV组(均P < 0.01)。除了ACLS 8 min时平均气道压高于ITD组(P < 0.01), CPRV组与ITD组平均气道压和胸腔低压比较均差异无统计学意义, 而CPRV组复苏时胸腔高压及胸腔压力变异度显著高于ITD组(均P < 0.01)。CPRV组ETCO2在各时间点与IPPV组及ITD组比较均差异无统计学意义, 见表 1、图 2。
| 参数 | 时间点 | CPRV组(n=10) | IPPV组(n=10) | 检验值 | P值 | ITD组(n=10) | 检验值 | P值 |
| 平均气道压(cmH2O) | 基线状态 | 5.3 (4.4, 6.1) | 5.4 (4.8, 6.3) | 0.605 | 0.545 | 5.7 (4.7, 7.0) | 0.794 | 0.427 |
| ACLS 8 min | 3.8 (3.1, 5.6) | 6.7 (5.7, 9.0) | 3.065 | 0.002 | 2.0 (1.4, 2.9) | 2.725 | 0.006 | |
| ACLS 16 min | 5.1 (3.8, 6.4) | 8.8 (6.7, 10.7) | 3.138 | 0.002 | 3.7 (3.2, 4.6) | 0.541 | 0.677 | |
| 胸腔低压(cmH2O) | 基线状态 | -4.5 (-5.5, -3.3) | -5.2 (-6.0, -4.1) | 1.098 | 0.272 | -4.7 (-6.1, -3.4) | 0.379 | 0.704 |
| ACLS 8 min | -14.5 (-17.9, -11.2) | -8.1 (-10.7, -6.9) | 3.063 | 0.002 | -16.5 (-19.2, -12.4) | 0.832 | 0.406 | |
| ACLS 16 min | -13.9 (-16.1, -10.0) | -6.4 (-9.0, -4.6) | 3.441 | 0.001 | -16.0 (-18.8, -12.5) | 0.876 | 0.256 | |
| 胸腔高压(cmH2O) | 基线状态 | 4.2 (3.9, 5.6) | 5.2 (4.1, 7.0) | 1.022 | 0.307 | 5.9 (3.7, 7.1) | 0.871 | 0.384 |
| ACLS 8 min | 11.6 (8.6, 17.1) | 3.6 (2.1, 4.4) | 3.968 | < 0.001 | 1.5 (1.1, 2.2) | 3.781 | < 0.001 | |
| ACLS 16 min | 17.7 (14.0, 20.0) | 6.6 (4.4, 9.6) | 3.326 | 0.001 | 5.0 (3.3, 8.3) | 3.581 | < 0.001 | |
| 胸腔压力变异度(cmH2O) | 基线状态 | 10.3 (8.4, 12.9) | 8.8 (8.2, 10.4) | 1.286 | 0.198 | 9.5 (8.4, 11.8) | 1.022 | 0.307 |
| ACLS 8 min | 24.0 (21.3, 31.6) | 11.6 (10.3, 15.4) | 3.781 | < 0.001 | 18.9 (14.1, 20.4) | 2.646 | 0.008 | |
| ACLS 16 min | 30.3 (25.9, 31.9) | 13.7 (10.8, 16.7) | 3.704 | < 0.001 | 16.4 (15.7, 23.5) | 3.327 | 0.001 | |
| 呼气末二氧化碳(mmHg) | 基线状态 | 38.0 (36.0, 39.3) | 37.0 (35.8, 39.3) | 0.613 | 0.540 | 36.0 (35.0, 37.3) | 1.776 | 0.076 |
| ACLS 8 min | 25.5 (21.5, 29.5) | 29.0 (26.0, 35.8) | 1.366 | 0.172 | 29.5 (20.8, 33.0) | 0.530 | 0.596 | |
| ACLS 16 min | 27.0 (24.0, 30.0) | 29.0 (25.8, 31.5) | 0.987 | 0.324 | 29.5 (25.8, 34.0) | 1.052 | 0.211 | |
| 注: 1 cmH2O =0.098 kPa; 1 mmHg=0.133 kPa; P值为与CPRV组同时间点比较, 经过Bonferroni校正 | ||||||||
|
| 注: 左侧列为气道压力, 右侧列为胸腔压力; 上为CPRV组, 中为IPPV组, 下为ITD组 图 2 各组ACLS 8 min时气道压及胸腔压力 Fig 2 Airway pressure and intrathoracic pressure at 8 min of ACLS in each group |
|
|
在基线状态, CPRV组与IPPV组及ITD组比较动静脉血气均差异无统计学意义。动脉血气分析, CPRV组在ACLS 8 min及ACLS 16 min时动脉pH、PaO2均显著高于IPPV组及ITD组, 而PaCO2均显著低于IPPV组及ITD组(均P < 0.05)。静脉血气分析显示CPRV组SvO2在ACLS 8 min及ACLS 16 min时显著高于IPPV组(均P < 0.05), 余指标两组间无明显差别。CPRV组在ACLS 8 min及ACLS 16 min时静脉pH和SvO2显著高于ITD组, 而PvCO2均显著低于ITD组(均P < 0.05), 见表 2。
| 参数 | 时间点 | CPRV组(n=10) | IPPV组(n=10) | 检验值 | P值 | ITD组(n=10) | 检验值 | P值 |
| 动脉pH | 基线状态 | 7.44 (7.40, 7.45) | 7.44 (7.40, 7.45) | 0.228 | 0.673 | 7.42 (7.38, 7.47) | 0.228 | 0.673 |
| ACLS 8 min | 7.32 (7.29, 7.36) | 7.22 (7.20, 7.31) | 2.282 | 0.023 | 7.20 (7.14, 7.24) | 2.983 | 0.003 | |
| ACLS 16 min | 7.28 (7.24, 7.37) | 7.19 (7.14, 7.24) | 2.535 | 0.011 | 7.15 (7.09, 7.24) | 2.571 | 0.010 | |
| 动脉PO2 (mmHg) | 基线状态 | 98.5 (92.3, 106.3) | 107.0 (93.3, 116.0) | 1.211 | 0.226 | 103.0 (90.1, 112.5) | 0.719 | 0.472 |
| ACLS 8 min | 100.5 (97.5, 134.3) | 70.5 (66.8, 86.8) | 3.371 | 0.001 | 62.5 (59.0, 76.3) | 3.292 | 0.001 | |
| ACLS 16 min | 106.0 (88.5, 177.8) | 71.0 (66.3, 81.5) | 2.989 | 0.003 | 62.0 (56.8, 70.5) | 3.634 | < 0.001 | |
| 动脉PCO2 (mmHg) | 基线状态 | 40.5 (37.8, 42.5) | 42.0 (40.5, 44.3) | 1.481 | 0.138 | 37.0 (36.0, 41.3) | 1.449 | 0.147 |
| ACLS 8 min | 43.5 (37.8, 48.5) | 53 (48.5, 61.0) | 2.573 | 0.010 | 61.0 (48.3, 67.5) | 2.637 | 0.005 | |
| ACLS 16 min | 38.5 (34.8, 54.5) | 57.5 (53.3, 65.8) | 3.279 | 0.001 | 66.5 (59.3, 71.0) | 3.305 | 0.001 | |
| 静脉pH | 基线状态 | 7.44 (7.39, 7.45) | 7.40 (7.37, 7.41) | 1.671 | 0.095 | 7.41 (7.39, 7.45) | 0.571 | 0.568 |
| ACLS 8 min | 7.30 (7.20, 7.32) | 7.18 (7.14, 7.25) | 1.893 | 0.058 | 7.16 (7.12, 7.24) | 2.195 | 0.028 | |
| ACLS 16 min | 7.27 (7.19, 7.32) | 7.20 (7.13, 7.22) | 1.893 | 0.058 | 7.15 (7.12, 7.22) | 2.572 | 0.010 | |
| 静脉PO2 (mmHg) | 基线状态 | 40.5 (38.0, 46.3) | 45.0 (38.0, 48.3) | 1.061 | 0.289 | 42.0 (39.5, 49.0) | 1.104 | 0.270 |
| ACLS 8 min | 31 (27.5, 37.8) | 27.5 (24.0, 31.0) | 1.439 | 0.150 | 26.5 (20.8, 29.3) | 1.931 | 0.053 | |
| ACLS 16 min | 30.5 (25.0, 35.8) | 28.5 (23.8, 34.0) | 0.799 | 0.290 | 25.0 (23.0, 28.5) | 1.596 | 0.111 | |
| 静脉PCO2 (mmHg) | 基线状态 | 41.0 (40.0, 45.0) | 44.5 (43.0, 48.0) | 1.636 | 0.102 | 43.5 (41.5, 48.0) | 0.987 | 0.324 |
| ACLS 8 min | 57.5 (47.5, 63.0) | 61.0 (53.5, 71.5) | 1.590 | 0.112 | 66.0 (54.8, 76.3) | 2.044 | 0.041 | |
| ACLS 16 min | 59.5 (52.5, 62.8) | 64.5 (59.8, 65.5) | 1.789 | 0.074 | 69.5 (59.5, 75.0) | 2.198 | 0.028 | |
| SvO2 (%) | 基线状态 | 72.0 (68.3, 77.3) | 73.0 (67.8, 78.8) | 0.644 | 0.520 | 67.5 (64.8, 73.0) | 1.211 | 0.226 |
| ACLS 8 min | 52.5 (45.0, 58.3) | 39.5 (35.8, 43.5) | 2.310 | 0.021 | 36.5 (30.5, 43.0) | 2.537 | 0.011 | |
| ACLS 16 min | 46.5 (40.3, 54.0) | 37.5 (34.3, 43.3) | 2.083 | 0.037 | 36.0 (31.8, 41.8) | 2.424 | 0.015 | |
| 注: PO2为氧分压, PCO2为二氧化碳分压, SvO2为静脉血氧饱和度; 1 mmHg=0.133 kPa; P值为与CPRV组同时间点比较, 经过Bonferroni校正 | ||||||||
在基线状态, CPRV组与IPPV组及ITD组比较血流动力学各参数均差异无统计学意义。CPRV组在ACLS 8 min及ACLS 16 min时主动脉血压均高于IPPV组(均P < 0.05), 而与ITD组同时间点比较则差异无统计学意义。对于右心房压力, CPRV组在ACLS 8 min及ACLS 16 min时均显著低于IPPV组和ITD组同时间点(均P < 0.05)。CPRV组在ACLS 8 min及ACLS 16 min时冠脉灌注压均高于IPPV组(均P < 0.05)。与ITD组比较中, 两组冠脉灌注压在ACLS 8 min时无差异, 但在ACLS 16 min时CPRV组冠脉灌注压更高(P=0.049)。在颈动脉血流分析中, CPRV组在ACLS 8 min及ACLS 16 min时均高于IPPV组(均P < 0.05), 而与ITD组同时间点比较则差异无统计学意义, 见表 3。
| 参数 | 时间点 | CPRV组(n=10) | IPPV组(n=10) | 检验值 | P值 | ITD组(n=10) | 检验值 | P值 |
| 平均主动脉压(mmHg) | 基线状态 | 106.4 (107.0, 121.8) | 117.2 (107.0, 121.8) | 1.587 | 0.112 | 110.4 (105.5, 120.0) | 1.021 | 0.307 |
| ACLS 8 min | 52.4 (46.6, 59.4) | 44.0 (39.6, 48.6) | 1.966 | 0.049 | 50.8 (43.2, 59.0) | 0.454 | 0.650 | |
| ACLS 16 min | 51.4 (43.9, 55.2) | 43.1.5 (33.3, 49.6) | 2.043 | 0.041 | 49.7 (41.4, 52.4) | 0.643 | 0.520 | |
| 平均右心房压(mmHg) | 基线状态 | 4.0 (3.0, 5.0) | 3.0 (2.0, 4.0) | 1.527 | 0.127 | 4.0 (2.8, 5.0) | 1.089 | 0.276 |
| ACLS 8 min | 30.0 (25.3, 35.3) | 41.0 (30.8, 48.8) | 2.044 | 0.041 | 43.0 (30.8, 37.3) | 2.193 | 0.028 | |
| ACLS 16 min | 29.5 (24.3, 36.3) | 45.0 (37.5.3, 53.3) | 2.611 | 0.009 | 49.5 (40.8, 56.3) | 3.177 | 0.001 | |
| 冠脉灌注压(mmHg) | 基线状态 | 96.5 (87.0, 102.8) | 98.5 (91.8, 109.5) | 0.948 | 0.343 | 95.5 (91.8, 107.5) | 0.531 | 0.595 |
| ACLS 8 min | 41.3 (31.3, 46.4) | 30.3 (23.3, 32.3) | 2.485 | 0.021 | 36.1 (27.8, 41.6) | 1.059 | 0.290 | |
| ACLS 16 min | 38.5 (34.2, 46.4) | 27.4 (20.4, 31.6) | 2.948 | 0.003 | 31.0 (25.9, 39.3) | 1.965 | 0.049 | |
| 颈动脉血流(mL/min) | 基线状态 | 242.0 (209.0, 275.8) | 259.0 (221.8, 301.3) | 0.798 | 0.425 | 249.0 (236.8, 275.8) | 0.454 | 0.650 |
| ACLS 8 min | 56.6 (49.0, 76.8) | 44.9 (30.4, 56.2) | 2.231 | 0.026 | 50.8 (32.8, 73.8) | 1.058 | 0.290 | |
| ACLS 16 min | 54.1 (45.1, 70.7) | 44.0 (30.8, 51.7) | 2.117 | 0.034 | 45.0 (31.1, 64.3) | 1.209 | 0.226 | |
| 注: 1 mmHg=0.133 kPa; P值为与CPRV组同时间点比较, 经过Bonferroni校正 | ||||||||
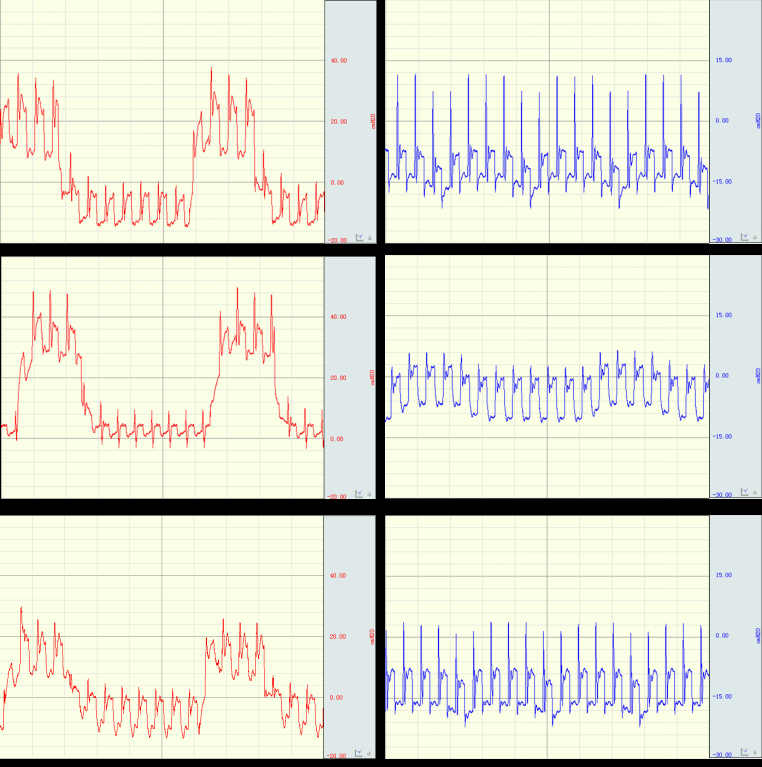
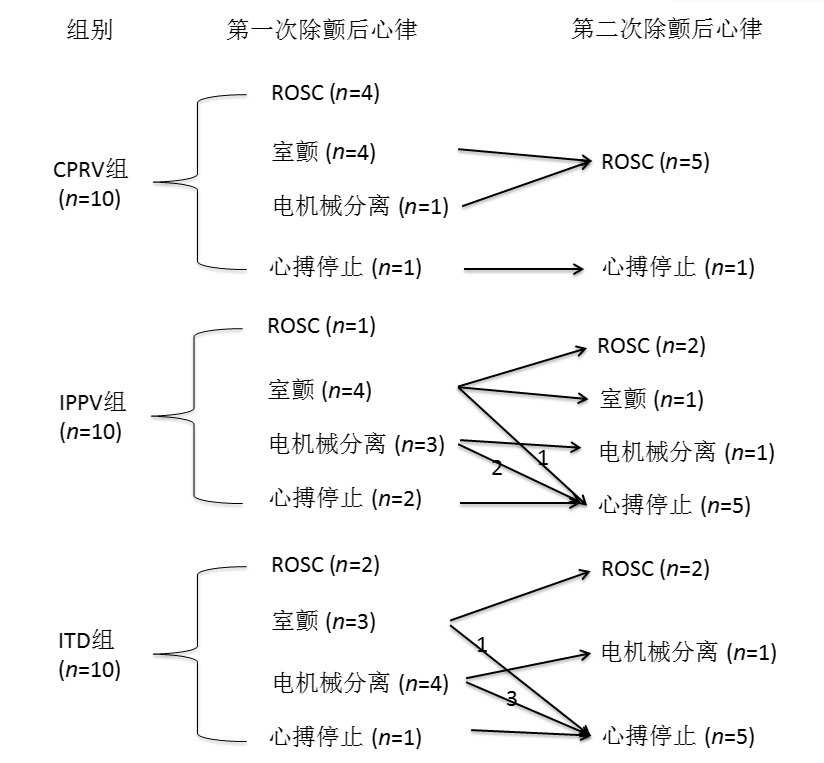
第一次除颤后CPRV组与IPPV组及ITD组分别有4只、1只和2只动物ROSC, 经过二次除颤三组总ROSC动物分别为9只、3只和4只, CPRV组总ROSC率(90%)显显著高于IPPV组(30%)及ITD组(40%)(均P < 0.05), 见图 3。
|
| 注: ROSC为自主循环恢复 图 3 各组除颤后心律及ROSC情况 Fig 3 Cardiac rhythm and ROSC after defibrillation in each group |
|
|
CPR时正压通气的主要目的是维持一定的氧合和清除二氧化碳, 显著的低氧血症和二氧化碳潴留是CPR预后不良的独立危险因素[6]。由于便捷、节约人力等优势, 院内普通呼吸机用于CPR时的通气是临床普遍现象。相关复苏指南对建立高级气道后通气频率明确推荐为10次/min, 但对于机械通气的模式和其他参数设置并无明确推荐[7]。笔者团队曾探索普通呼吸机应用于CPR时的模式及参数设置, 以减少误触发及气道高压报警导致的过度通气和潮气量过低[4]。CPRV是目前极少专门针对CPR的通气模式之一, 具有一键启动、关闭触发、调高气道高压报警、电子ITD及自动补充潮气量等特点。本研究发现在VF家猪模型中, CPRV较IPPV和ITD有更好的通气、氧合、血流动力学效果, 及更高的ROSC率, 值得临床进一步探索。
IPPV模式是完全指令通气, 呼吸频率和潮气量完全与设置相同, 且通气与胸外按压完全独立。按压放松期胸廓回弹产生的胸腔负压是CPR时静脉回流的主要决定因素。胸外按压放松时胸廓回弹, 一些气体被“吸入”肺部, 从而使胸腔内负压变小, 影响血液回流至心脏。为了避免这种现象, 促进静脉回流, Lurie等[8]设计了ITD装置。研究发现, 在正压通气时使用ITD来增强胸腔负压, 有潜在的血流动力学益处[9]。Cordioli等[10]发现即使按照指南推荐的通气策略(如本研究中的IPPV)进行CPR, 肺容积始终处于功能残气量以下, 心脏按压可导致肺容积下降335 mL左右, 停止按压后继续通气可见肺容积逐渐恢复。ITD设计特点可能决定了其肺容积丢失较IPPV更加明显。
CPRV除了具有类似ITD原理, 同时呼吸机实时计算呼出潮气量与设置潮气量之间的差值(肺容积丢失量), 下一次吸气时在设置潮气量基础上进行补充。此外CPRV每一次送气可与按压的开始点相同步, 这可进一步加大按压期的胸腔正压。这些可能是本研究中CPRV胸腔高压及压力变异度显著高于IPPV及ITD, 而胸腔低压(绝对值)显著大于IPPV的合理解释。虽然CPRV实际送气量大于ITD, 但复苏后期两组气道压却类似, 主要原因应是ITD组肺容积丢失明显导致肺顺应性下降, 从而导致气道压上升。理论上, CPRV实际通气肺容积大于IPPV和ITD, ETCO2应较低。然而, ETCO2同时受肺通气和血流的影响[11], CPRV组ETCO2无明显下降可能提示CPRV较IPPV和ITD有更好的体肺循环血流状态, 这在血流动力学部分也得到了验证。
肺容积下降、肺泡塌陷是CPR时缺氧和二氧化碳潴留的重要原因之一。胸廓回弹产生的胸腔负压及肺容积低于功能残气量, 均会导致小气道塌陷。研究发现气道正压有利于CPR时肺泡通气的恢复, 缓解小气道塌陷, 减少肺容积下降和死腔通气比例, 从而改善通气和氧合[12]。本研究中, CPRV组具有相对高的气道压, 对于缓解肺泡和小气道塌陷, 从而维持良好的通气和氧合可能有重要作用。与IPPV和ITD相比, CPRV具有较高的SvO2, 与各组ROSC情况一致。CPRV组有更高的动脉氧合, 而静脉氧分压各组无差别, 提示CPRV组更大的动静脉氧含量差和氧摄取率。这也提示CPR时相对高的SvO2主要源于相对高的氧输送, 可能对短期预后更有提示意义[13]。
本研究中, CPRV组主动脉血压、冠脉灌注压及颈动脉血流显著高于IPPV组。CPRV具有ITD原理, 从而增大按压放松期胸腔负压, 促进静脉回流, 这是较IPPV有血流动力学优势的理论基础。CPRV与ITD比较, 虽然主动脉血压及颈动脉血流比较差异无统计学意义, 但随着CPR时间延长, CPRV组的冠脉灌注压高于ITD。CPRV和ITD两组具有类似的胸腔负压, 因此两组间的血流动力学差别存在其他机制。Chalkias等[14]一项前瞻性观察性研究亦发现, 300例CPR患者采用相同的通气策略, ROSC者具有更高的平均气道压。研究者解释为高气道压能够增强胸泵的作用。本研究的结果亦支持该观点, CPRV更高的实际通气量及更高的气道正压使按压期胸腔正压升高, 而按压放松期仍维持负压水平, 导致更大的胸腔压力变异度, 从而增强了胸泵作用。
心泵在CPR初期可能起主要作用, 但随着CPR时间延长心肌顺应性下降明显, 胸泵的作用可能逐渐凸显[15-16]。国内外研究发现, 按压同步的正压通气模式(按压放松期则进入呼气期), 能产生更好的氧合和器官灌注, 且能保持按压效率不受影响, 避免过度通气[17-19]。其中的原理可能与本研究类似, 与按压同步的正压通气会显著增加气道压力, 从而可能会增强胸泵作用[20]。本研究中, CPRV补潮气量功能使得气道正压增加, 从而加强了胸泵的作用, 且这种作用随着复苏的时间延长而凸显出来, 这也许能解释CPRV与ITD比较血流动力学差异出现在ACLS 16 min。
本研究中无论是第一次除颤后ROSC率还是总ROSC率, CPRV均高于IPPV及ITD。分析其可能相关机制有: (1) CPRV能够较IPPV及ITD减少CPR时肺容积丢失, 减少肺泡塌陷, 改善通气和氧合, 纠正低氧和二氧化碳潴留; (2) CPRV产生的更大胸腔压力变异度使CPR的胸泵原理得到加强, 从而有更佳的血流动力学; (3) CPRV由于改善通气、氧合及血流动力学状态, 体内内环境酸碱平衡紊乱较轻, 从而增加血管活性药物及电除颤的效能, 使第二次除颤ROSC率亦较高。
本研究尚存在一些局限性。首先, 本研究只观察了CPR的短期预后ROSC, 对ROSC后血气分析、血流动力学及中长期预后如神经功能预后等并未观察, 可在后继研究中进一步探索。其次, 肺容积丢失量的补充只是基于理论推测, 理想的补充量在后继研究中可使用胸阻抗等方法进一步合理滴定。最后, 本研究为探索性动物研究, 仅建立了猪VF模型, 样本量较小, 研究结果能否推及其他心脏骤停模型和临床尚不确定, 需要进一步通过基础和临床研究来探索。总之, 本研究显示出CPRV在心肺复苏中一定的应用前景, 值得进一步研究和探索。
利益冲突 所有作者声明无利益冲突
作者贡献声明 乔昆朋、夏雨蝶: 研究设计、研究实施、统计学分析、论文撰写; 曹鹏、王兵侠、耿平: 数据收集与整理、统计学分析、论文撰写; 谈定玉: 研究设计、研究指导、数据整理、论文修改; 于学忠: 研究指导、论文修改
| [1] | 中国心脏骤停与心肺复苏报告编写组, 徐峰, 陈玉国. 中国心脏骤停与心肺复苏报告(2022年版)概要[J]. 中国循环杂志, 2023, 38(10): 1005-1017. |
| [2] | 宋维. 心肺复苏理论与实践之十项变革[J]. 中华急诊医学杂志, 2025, 34(1): 1-5. DOI:10.3760/cma.j.issn.1671-0282.2025.01.001 |
| [3] | van Eijk JA, Doeleman LC, Loer SA, et al. Ventilation during cardiopulmonary resuscitation: a narrative review[J]. Resuscitation, 2024, 203: 110366. DOI:10.1016/j.resuscitation.2024.110366 |
| [4] | Tan DY, Xu J, Shao SH, et al. Comparison of different inspiratory triggering settings in automated ventilators during cardiopulmonary resuscitation in a porcine model[J]. PLoS One, 2017, 12(2): e0171869. DOI:10.1371/journal.pone.0171869 |
| [5] | Idris AH, Becker LB, Fuerst RS, et al. Effect of ventilation on resuscitation in an animal model of cardiac arrest[J]. Circulation, 1994, 90(6): 3063-3069. DOI:10.1161/01.cir.90.6.3063 |
| [6] | Algahtani AI, Brady Scott J, Li J. Ventilation and oxygenation during and after adult cardiopulmonary resuscitation: changing paradigms[J]. Respir Care, 2024, 69(12): 1573-1586. DOI:10.4187/respcare.12427 |
| [7] | Perman SM, Elmer J, Maciel CB, et al. 2023 American heart association focused update on adult advanced cardiovascular life support: an update to the American heart association guidelines for cardiopulmonary resuscitation and emergency cardiovascular care[J]. Circulation, 2024, 149(5): e254-e273. DOI:10.1161/CIR.0000000000001194 |
| [8] | Lurie KG, Zielinski T, McKnite S, et al. Use of an inspiratory impedance valve improves neurologically intact survival in a porcine model of ventricular fibrillation[J]. Circulation, 2002, 105(1): 124-129. DOI:10.1161/hc0102.101391 |
| [9] | Moore JC, Segal N, Lick MC, et al. Head and Thorax elevation during active compression decompression cardiopulmonary resuscitation with an impedance threshold device improves cerebral perfusion in a swine model of prolonged cardiac arrest[J]. Resuscitation, 2017, 121: 195-200. DOI:10.1016/j.resuscitation.2017.07.033 |
| [10] | Cordioli RL, Lyazidi A, Rey N, et al. Impact of ventilation strategies during chest compression. An experimental study with clinical observations[J]. J Appl Physiol (1985), 2016, 120(2): 196-203. DOI:10.1152/japplphysiol.00632.2015 |
| [11] | Pantazopoulos C, Xanthos T, Pantazopoulos I, et al. A review of carbon dioxide monitoring during adult cardiopulmonary resuscitation[J]. Heart Lung Circ, 2015, 24(11): 1053-1061. DOI:10.1016/j.hlc.2015.05.013 |
| [12] | Markstaller K, Karmrodt J, Doebrich M, et al. Dynamic computed tomography: a novel technique to study lung aeration and atelectasis formation during experimental CPR[J]. Resuscitation, 2002, 53(3): 307-313. DOI:10.1016/s0300-9572(02)00031-x |
| [13] | Ryu SJ, Lee SJ, Park CH, et al. Arterial pressure, end-tidal carbon dioxide, and central venous oxygen saturation in reflecting compression depth[J]. Acta Anaesthesiol Scand, 2016, 60(7): 1012-1023. DOI:10.1111/aas.12728 |
| [14] | Chalkias A, Pavlopoulos F, Koutsovasilis A, et al. Airway pressure and outcome of out-of-hospital cardiac arrest: a prospective observational study[J]. Resuscitation, 2017, 110: 101-106. DOI:10.1016/j.resuscitation.2016.10.023 |
| [15] | Andreka P, Frenneaux MP. Haemodynamics of cardiac arrest and resuscitation[J]. Curr Opin Crit Care, 2006, 12(3): 198-203. DOI:10.1097/01.ccx.0000224861.70958.59 |
| [16] | Liu YC, Tian Z, Yu CH, et al. Transesophageal echocardiography to assess mitral valve movement and flow during long term cardiopulmonary resuscitation: How cardiac effects fade with time[J]. Int J Cardiol, 2016, 223: 693-698. DOI:10.1016/j.ijcard.2016.08.274 |
| [17] | Kill C, Galbas M, Neuhaus C, et al. Chest compression synchronized ventilation versus intermitted positive pressure ventilation during cardiopulmonary resuscitation in a pig model[J]. PLoS One, 2015, 10(5): e0127759. DOI:10.1371/journal.pone.0127759 |
| [18] | Speer T, Dersch W, Kleine B, et al. Mechanical ventilation during resuscitation: how manual chest compressions affect a ventilator's function[J]. Adv Ther, 2017, 34(10): 2333-2344. DOI:10.1007/s12325-017-0615-7 |
| [19] | 曹光立, 高贵锋, 徐杰丰, 等. 按压自主同步通气模式对猪心肺复苏效果影响的研究[J]. 中华急诊医学杂志, 2024, 33(9): 1257-1264. DOI:10.3760/cma.j.issn.1671-0282.2024.09.007 |
| [20] | Chalkias A, Xanthos T. Timing positive-pressure ventilation during chest compression: the key to improving the thoracic pump?[J]. Eur Heart J Acute Cardiovasc Care, 2015, 4(1): 24-27. DOI:10.1177/2048872613516923 |
 2025, Vol. 34
2025, Vol. 34